使用小肠和大肠单层界面的牛类器官技术的进步
摘要
本研究提出了一种从类器官生成牛肠道 2D 单层的方案,为研究宿主-病原体相互作用提供了更好的途径。它包括评估膜完整性和功能的方法,推进模拟牛胃肠道生理学的 体外 模型。这种方法有望带来显著的生物医学和农业效益,包括增强的治疗策略。
摘要
推进胃肠道生理学及其疾病的知识在很大程度上取决于忠实模拟体内肠道组织的精确、物种特异性体外模型的开发。这对于研究牛体内的宿主-病原体相互作用尤为重要,因为牛是构成严重公共卫生风险的病原体的重要宿主。传统的 3D 类器官对肠上皮顶端表面的访问有限,2D 单层培养物的出现克服了这一障碍。这些培养物来源于类器官细胞,为更容易进行的研究提供了暴露的管腔表面。在这项研究中,介绍了一种详细的方案,用于从牛小肠和大肠类器官的细胞中创建和维持 2D 单层培养物。该方法包括通过跨上皮电阻和细胞旁通透性以及免疫细胞化学染色技术评估膜完整性的方案。这些方案为建立和表征 2D 牛单层培养系统奠定了基础,推动了这些方法在具有公共卫生意义的生物医学和转化研究中应用的界限。采用这种创新方法可以开发生理相关的体外模型,以探索牛肠道生理学的正常和疾病状态。这对生物医学和农业进步的影响是深远的,为更有效治疗牛的肠道疾病铺平了道路,从而提高了动物福利和食品安全。
引言
在三维 (3D) 培养物(称为肠道类器官)中培养肠上皮干细胞标志着体外技术在研究肠道功能、营养和与病原体相互作用方面的重大进步 1,2。这些类器官通过自我复制和组织成包含各种肠道细胞谱系的 3D 结构来模拟体内肠上皮的复杂结构3。这一特点突出了它们在推动对肠道生物学的理解向前发展方面的巨大潜力。
将肠道类器官技术应用于农场动物的兴趣日益浓厚,这需要改进培养和维护技术 4,5。这项技术的相关性体现在它对研究农场动物肠道健康的潜在影响上,这在其生产力中起着关键作用,因此,通过影响动物福利和运营成本,对食用动物行业的经济性起着关键作用 6,7。具体来说,利用肠道类器官培养物来探索牛的肠道功能至关重要,因为它们是人畜共患肠道病原体(如沙门氏菌属和大肠杆菌 (E. coli) O157:H78)的储存库。这些病原体位于肠道的特定部分,因此必须按肠道部分区分肠道类器官培养方法,以提高研究的精确度9。
肠道类器官研究的一个重大障碍是进入上皮细胞顶端表面的机会受限10。在细胞外基质 (ECM) 中培养时,细胞自然定向,使基底表面朝外,顶端表面朝内10。为了应对这一挑战,提出了一些方法,包括将 3D 类器官解离成单个细胞,并将其接种到半透性细胞培养插入物中。这种设置在顶端表面和基底外侧隔室之间建立了一个界面。该方案表明,来源于牛肠道类器官的细胞可以形成连贯的 2D 单层,跨上皮电阻 (TEER) 测量和细胞旁通透性测定证明了这一点。此外,通过免疫荧光和电子显微镜证实了类器官衍生的 2D 单层细胞中具有刷状边界和紧密连接的细胞极性的发展,反映了 体内 肠道上皮的特性。
在这项研究中,回肠代表小肠道,直肠代表大肠道。这些选择基于相关的肠道病原体,例如沙 门氏菌 属,它可以易位回肠11,以及已知主要定植于牛直肠 9 的大 肠 杆菌O157 :H7。这些特定肠道片段的选择突出了为肠道区域定制肠道类器官培养方法以实现研究精度的必要性。这些方法详细介绍了从这些肠道段有效培养类器官衍生的 2D 单层界面的程序,为探索牛肠道健康、病原体感染以及肠道微生物组与宿主之间的相互作用提供了一个强大的模型。
研究方案
肠隐窝是从当地屠宰场采购的剩余肠道标本中获得的,供体信号见 补充表 1。类器官是使用在屠宰场被人道安乐死的动物的组织产生的,动物的采购不仅仅是为了这项研究;因此,本研究不受 IACUC 审查,道德声明不适用。
1. 用于类器官来源的 2D 单层培养的细胞培养小室上的 ECM 涂层
注意:所有程序均在生物安全柜中使用灭菌材料和无菌技术进行。除非另有说明,否则所有试剂在整个过程中都保存在冰上。
- 通过在微管中将基础培养基与 2% (v/v) 基于 ECM 的水凝胶彻底混合,制备 100 μL ECM,用于包被每个 0.33 cm2 细胞培养插入物。
- 用灭菌镊子从包装中取出单个细胞培养小室,并单独放入 24 孔透明平底细胞培养板的孔中。
- 将步骤 1.1 中制备的 100 μL ECM 涂层应用于步骤 1.2 中制备的每个细胞培养插入物的顶腔。
- 盖上盖子,将含有涂层细胞培养插入物的细胞培养板在 37 °C 和 5% CO2 的加湿培养箱中孵育 1 小时。
- 对于回肠类器官细胞,插入片段在孵育 1 小时后即可使用。对于直肠类器官细胞,孵育 1 小时后,用直肠单层培养基替换 ECM 涂层并孵育过夜(表 1)。如果要进行 TEER 测量,请为空白对照准备额外的细胞培养小室。
| 回肠 | 直肠 | |
| ECM 涂层孵育时间 | 1 小时 | 1 小时,然后 在单层培养基中过夜 |
| 补充 类器官培养基 | ||
| CHIR99021 | ||
| LY2157299 | LY2157299 | |
| 编号 Y-27632 | 编号 Y-27632 | |
| 胎牛血清 | 胎牛血清 | |
| 细胞接种密度(细胞/孔) | 5 x 105 | 3 x 105 |
表 1:用于创建源自成年牛回肠和直肠类器官的 2D 单分子层的优化方案总结。
2. 牛回肠和/或直肠类器官细胞接种和 2D 单层培养
注:本节中描述的方案使用牛回肠和直肠类器官,它们使用所描述的技术在 48 孔板上培养和维持5.为获得最佳结果,建议使用稳定维持的类器官,这些类器官在初始建立后已传代 3 次以上,并且在最近一次传代后培养时间超过 3 天。
- 在不干扰含有成熟类器官的基于 ECM 的水凝胶圆顶的情况下,使用连接到真空系统的一次性玻璃巴斯德吸管去除类器官培养基,并在每孔中加入 300 μL 冰冷的 ECM 解聚溶液。在 4 °C 下孵育至少 1 小时。
注:或者,在加入 ECM 解聚溶液后,机械破坏含有基于 ECM 的水凝胶圆顶的类器官,并在 4 °C 下孵育之前将悬浮液收集在 15 mL 锥形管中。 当不打算用于 2D 单层培养的类器官在同一板上同时培养时,建议使用此方法。类器官培养物的密度显著影响细胞培养插入物的最佳接种所需的类器官培养孔的数量。- 对于高密度类器官培养物(补充图 1A),直肠细胞培养插入物使用 1:1 至 1:2 范围内的接种比例,这意味着一个培养孔可以接种一到两个孔。对于回肠,将比率保持在 1:1。相比之下,低密度培养物(补充图 1B)需要更多的培养孔;1 个直肠细胞培养小室使用 3-4 个直肠类器官培养孔(3-4:1 比例),1 个回肠细胞培养小室使用 4-5 个回肠类器官培养孔(4-5:1 比例)。
- 目视检查基于 ECM 的水凝胶是否完全溶解,并将类器官悬浮液收集到 15 mL 锥形管中。
- 通过在 200 x g 和 4 °C 下离心 5 分钟沉淀类器官。弃去上清液。将沉淀重悬于 1 mL 补充有 10 μM Y-27632 的重组细胞解离酶溶液中。
- 将类器官悬浮液在 37 °C 水浴中孵育 10 分钟,间歇性摇动 3-5 秒,每 2-3 分钟漩涡,以促进有效的类器官解离。
- 酶消化后,加入 5 mL 基础培养基,并用 P1000 微量移液器积极移液,以进一步破坏单细胞的类器官。检查悬浮液是否有类器官团块,如果视觉上仍然明显,则重复移液以增强单细胞解离。
- 制备带有 70 μm 细胞过滤器的 50 mL 锥形管。通过应用 1-2 mL 基础培养基预润湿过滤器。
- 通过过滤器过滤细胞悬液,以去除残留的基于 ECM 的水凝胶碎片和大细胞团块。用额外的 10 mL 基础培养基冲洗原来的 15 mL 试管和 70 μm 细胞过滤器。
注:如果细胞悬液不容易通过过滤器,则可能表明类器官解离不完全。可以尝试将收集的细胞悬液重新通过相同的 70 μm 细胞过滤器。可能需要额外的酶或机械破坏。 - 通过在 200 x g 和 4 °C 下离心 5 分钟来沉淀单细胞悬液。去除上清液,用适当体积的基础培养基重悬细胞以进行细胞计数。
- 台盼蓝染色后,用血细胞计数器计数活细胞,以计算收集的细胞总数。
- 通过在 200 x g 和 4 °C 下离心 5 分钟来沉淀单细胞悬液。去除上清液,并在相应的单层培养基中将细胞重悬至适当的接种密度(表 1)。
- 对于回肠类器官细胞,在 200 μL 回肠单层培养基中,将细胞重悬至 2.5 x 106 个细胞/mL 的浓度,以达到每个细胞培养插入物 5 x 105 个细胞的接种密度,该培养基是补充有 500 nM LY2157299、10 μM Y-27632 和 20% 胎牛血清 (FBS) 的类器官培养基。
- 对于直肠类器官细胞,在 200 μL 直肠单层培养基中,将细胞重悬至 1.5 x 106 个细胞/mL 的浓度,以达到每个细胞培养插入物 3 x 105 个细胞的接种密度,该培养基是补充有 100 nM CHIR99021、500 nM LY2157299、10 μM Y-27632 的类器官培养基。 和 20% FBS。
- 取回带有 ECM 包被细胞培养小室的 24 孔细胞培养板,并小心地真空抽吸清空细胞培养小室的顶腔,以免破坏涂层。
- 将步骤 2.10 中制备的 200 μL 单细胞悬液轻轻涂抹到细胞培养小室的顶端腔中。对于空白对照,在顶腔中加入 200 μL 不含细胞的培养基。对于空白对照,在顶腔中加入 200 μL 不含细胞的培养基。
- 将 500 μL 适当补充的单层培养基(取决于回肠细胞与直肠细胞)涂抹到每个孔的基底外侧腔中。
- 在 37 °C 和 5% CO2 的加湿培养箱中孵育,以促进细胞粘附和生长,从而在细胞培养小室上形成汇合的 2D 单层。
- 从细胞接种后 48 小时开始,每隔一天更换顶端和基底外侧腔的培养基。确保空白对照和含有细胞的插入片段的孵育时间相等。
3. TEER 测量
注意:此处描述的方法使用市售的手动 TEER 测量系统,称为上皮伏安表,带有一对 Ag/AgCl 电极(图 1A)。测定 2D 单层的 TEER 需要测量空白孔。确保以与样品相同的方式获取空白读数。
- 从培养箱中检索含有细胞培养小室和类器官衍生的 2D 单层和空白的板。让板达到室温约 10 分钟。
- 用 70% 乙醇对电极进行消毒,并让它们完全干燥。
- 小心地将短端引入顶端腔,长端引入基底外侧腔(图 1A)。
注意:需要格外小心,以免破坏细胞单层。 - 让读数平衡,并在稳定时以欧姆为单位记录值。
注意: 伏安表的灵敏度是这样的,在进行电阻测量时会出现欧姆值的波动。当测量值稳定并始终徘徊在平台值附近时,将获得可靠的读数。 - 使用以下公式确定 2D 单层的 TEER:
TEER (Ω x cm2) = 细胞培养小室的表面积 (cm2) x 净电阻
其中,净电阻等于电池单层插件的测量电阻减去空白插件的测量电阻。用于 24 孔板的细胞培养小室的表面积为 0.33 cm2。
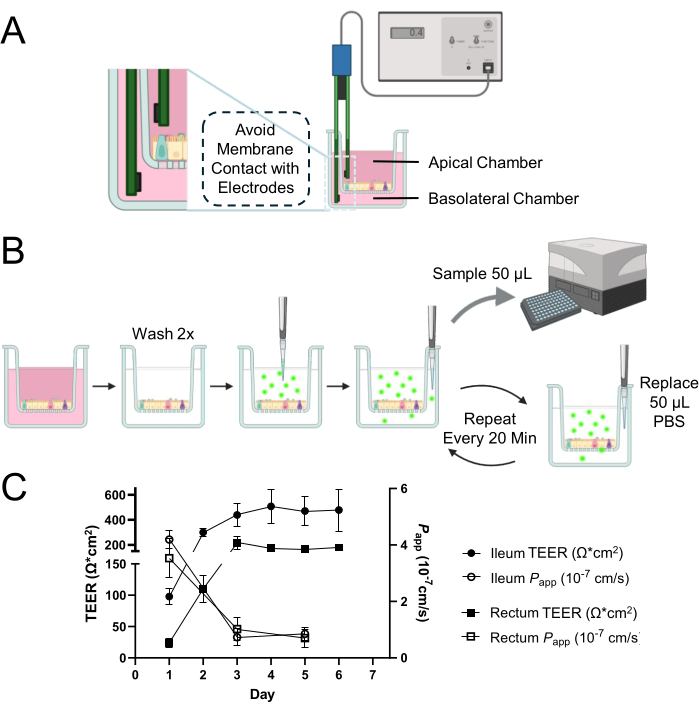
图 1:牛肠道类器官衍生的 2D 单层的上皮屏障完整性评估。 (A) 用于 TEER 测量的细胞培养插入物的顶端和基底外侧腔内电极的适当定位示意图。将短电极插入根尖腔,将长电极小心放置在基底外侧腔中,以避免与膜接触。(B) 渗透性测定过程的示意图。用温热的PBS洗涤细胞培养室2次,并将溶于PBS的0.5mg / mL 4kDa FITC-葡聚糖示踪剂施加到顶端室。从基底外侧腔室中重复取样 50 μL 等分试样,更换等体积的 PBS,以在整个孵育期间保持基底外侧腔中的总体积。使用酶标仪测量等分试样的荧光强度,以量化 4 kDa FITC-葡聚糖示踪剂在细胞单层中的扩散。(C) 使用 TEER 测量(由回肠的闭合圆圈和直肠的闭合方块表示)和通透性测定(由回肠的空心圆圈和直肠的空方块表示)和 4 kDa FITC-葡聚糖示踪剂评估回肠和直肠单层内屏障完整性随时间推移的动态发展。到培养的第 3 天,两种类型的单层都表现出稳定和功能性上皮屏障的建立,它们各自的 TEER 和通透性曲线证明了这一点。结果是至少两个独立实验和两个技术重复的平均值。误差线表示测量的 SEM。 请单击此处查看此图的较大版本。
4. 细胞旁通透性测定
注意:该测定涉及测定异硫氰酸荧光素 (FITC) - 葡聚糖在 120 分钟内跨 2D 单层从顶端腔扩散到基底外侧腔产生的荧光强度(图 1B)。为获得最佳结果,建议在检测过程中尽量减少光照,并在每次采样后立即在酶标仪中进行测量,以防止荧光减弱或淬灭。每个孔只能使用一次,不能在后续分析中重复使用。准备至少 2 个孔作为每次测定的技术重复。例如,总共需要 6 个孔才能获得 图 1C 中所示的结果,其中检测在 3 个不同的时间点(培养的第 1 天、第 3 天和第 5 天)一式两份进行。
- 在磷酸盐缓冲盐水 (PBS) 中用 4 kDa FITC-葡聚糖制备标准曲线稀释系列。对于每次稀释,将 50 μL 移液到 96 孔板中,一式三份。
注:建议制备一系列 5-7 倍稀释液,范围为 0 至 0.5 mg/mL。 - 在预校准的酶标仪中,在 495 nm 的激发波长和 535 nm 的发射波长下测定标准品的荧光强度。
- 使用荧光强度结果计算线性回归以创建标准曲线。
- 从培养箱中检索含有细胞培养插入物的板,这些插入物具有类器官衍生的 2D 单层。从细胞培养插入物的顶端和基底外侧腔室中取出单层培养基,该插入物含有要评估的类器官衍生的 2D 单层。
- 分别用 200 μL(顶腔)和 500 μL(基底外侧腔)预热的 PBS 轻轻洗涤每个腔室 2 次。
- 从顶端腔中取出洗涤液,将 200 μL 0.5 mg/mL 4 kDa FITC-葡聚糖示踪剂的 PBS 溶液涂到细胞培养小室的顶端腔中。
- 在 37 °C 和 5% CO2 的加湿培养箱中孵育 20 分钟。
- 从孵育的 24 孔板的基底外侧腔室中取样 50 μL,然后转移到与酶标仪兼容的 96 孔板中。
- 在采样孔的基底外侧腔室中更换 50 μL 新鲜 PBS。
- 立即在预先校准的酶标仪中以 495 nm 的激发波长和 535 nm 的发射波长进行荧光强度测量。
- 每 20 分钟重复步骤 4.6-4.10,直到 120 分钟。在测定结束时,如果需要保留 2D 单层,请用新鲜的 PBS 2x 冲洗顶端和基底外侧腔,更换为新鲜的单层培养基,然后孵育。
注意:可以对 2D 单层进行进一步评估,即 TEER 测量、免疫荧光染色等;但是,不建议这样做,因为残留的荧光示踪剂可能会有影响分析。 - 使用以下公式确定表观磁导率系数 (Papp):
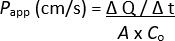
ΔQ / Δt = 在特定持续时间内通过单层进入细胞培养小室基底外侧腔室的荧光示踪剂浓度,通过荧光强度测量,并通过标准曲线外推至 μg/mL
A = 细胞培养小室的表面积
Co = 添加到细胞培养小室顶室的荧光示踪剂浓度,单位为 μg/mL
5. 类器官来源的 2D 单层的免疫荧光染色
- 用真空抽吸从细胞培养插件中取出单层培养基,并加入 200 μL 4% 多聚甲醛 (PFA)。在室温下孵育 15-30 分钟以进行细胞固定。
- 用真空抽吸去除 PFA,并用 100 μL PBS 2x 洗涤。
- 通过在室温下孵育 10 分钟,用 100 μL 0.3% Triton X-100 在 2% 牛血清白蛋白 (BSA) 的 PBS 溶液中透化细胞。
- 用真空抽吸去除上清液,并用 100 μL PBS 2x 洗涤。
- 去除上清液,用 PBS 中的 2% BSA 替换,并在室温下孵育 1 小时以封闭。
- 去除上清液,加入 100 μL 用 2% BSA 的 PBS 溶液稀释的一抗,并在室温下孵育 1 小时,或在 4 °C 下过夜。
注:所用一抗的浓度见 材料表。除非另有说明,否则请遵循制造商的建议。 - 去除上清液并用 100 μL PBS 3x 洗涤。
- 应用 100 μL 用 2% BSA 的 PBS 溶液稀释的二抗,并在室温下孵育 1 小时,或在 4 °C 下过夜。
注:如果使用的一抗与荧光探针偶联,则可以跳过此步骤。所用二抗的浓度见 材料表。除非另有说明,否则请遵循制造商的建议。 - 去除上清液并用 100 μL PBS 3x 洗涤。
- 可选:对于 F-肌动蛋白和细胞核 (DAPI) 的复染,通过在 PBS 中以适当稀释度(根据制造商的建议)混合两个探针来制备,应用 100 μL,并在室温下孵育 30 分钟。去除上清液并用 100 μL PBS 3x 洗涤。
- 用手术刀刀片小心地切出细胞培养插入膜,并用安装溶液安装在载玻片上。放置盖玻片并观察。
代表性结果
该方案可靠地从小肠道和大肠道中产生强大的牛肠类器官衍生的 2D 单层,模拟 体内 肠上皮的复杂性。该方法利用从健康牛的肠隐窝标本中开发的成熟类器官,这些标本是在优化条件下培养的。有趣的是,类器官衍生的 2D 单层的成功和可重复的条件对于肠道部分来说是独一无二的(表 1)。这加强了为感兴趣的肠道片段优化培养技术的重要性。
在将解离的成熟类器官接种到细胞培养插入物上后 1 天,似乎形成了 2D 单层(图 2A)。然而,尽管最初出现这种外观,但在这个阶段回肠和直肠单层的 TEER 测量值仍然很低(图 1C)。此外,细胞旁通透性测定显示,单层培养仅 1 天后,就允许 4 kDa FITC-葡聚糖示踪剂穿过细胞层(图 1C)。到培养的第 3 天,两种类型的类器官衍生的 2D 单层都显示出显着的成熟,TEER 值增加和对 4 kDa FITC-葡聚糖示踪剂的抗性证明了这一点,这种趋势一直持续到培养的第 5 天。
特别值得注意的是种间变异性,尽管在相似条件下,相对于人类和犬类的 2D 单层培养物,牛类器官衍生的 2D 单层培养物的 TEER 值较低 12,13,14,15,但膜的完整性仍然完好无损。这一结论是从单层在渗透性测定中的适当反应中得出的,表明牛样品中的低 TEER 值并不一定反映缺乏屏障功能。这种完整性对于功能性上皮屏障至关重要,并通过仔细解释通透性测定结果和 TEER 测量来有效证明。
用扫描电子显微镜可视化 2D 单层顶端表面的细胞划分和发达的微绒毛,显示专门的微观解剖结构,进一步加强了回肠和直肠类器官衍生的 2D 单层的成熟(图 2B)。此外,2D 单层的免疫荧光染色证实了回肠(图 3A)和直肠(图 3B)类器官衍生的 2D 单层中存在顶刷边界、基底外侧粘附连接和产生粘液的杯状细胞。这些结果强化了开发的 2D 单层在组成和形成上很复杂,不仅表达完整肠上皮的关键特征,而且由多系细胞群组成。
成功的 2D 单层开发依赖于细胞对 ECM 的粘附和生长对汇合,以产生完整的上皮层。值得注意的是,在细胞培养小室上孵育期间,不均匀的 ECM 分布或不理想的条件会导致细胞层部分脱离,沿其边缘尤其明显(图 4Ai)。如果细胞以高于最佳密度接种或接种细胞在培养表面上分布不均匀,则此问题会进一步复杂化,这种情况通常源于类器官不完全解离成单细胞悬液。这种不均匀的分布会导致在单层内形成间隙和/或细胞培养插入物上的 3D 形态发生(图 4Aii)。相比之下,细胞接种不足也可能导致单层发育在预期的培养期内不成功或延迟,这会无意中影响使用 2D 单层系统的后续研究的效率(图 4Aiii)。此外,培养系统的污染也会导致在单层内形成间隙,从而在培养的后期破坏曾经形成的汇合单层(图 4Aiv)。持续的 TEER 值和细胞旁通透性反应可能会受到激进洗涤或处理技术对细胞层干扰的影响,即使在这些测定之前没有遇到上述潜在的失败原因(图 4B)。因此,通过有效应用故障排除策略,仔细处理细胞和评估单层形成或破坏对于成功开发类器官衍生的 2D 单层至关重要。
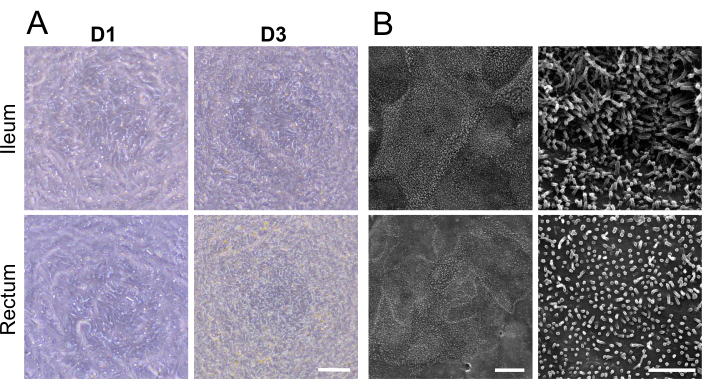
图 2:牛回肠和直肠类器官衍生的 2D 单层的显微表征。 (A) 细胞培养插入物上培养第 1 天和第 3 天(D1 和 D3)的 2D 单层的代表性相差显微镜图像。比例尺 = 100 μm。(B) 具有较低(左)和较高(右)放大倍率的 2D 单层的代表性扫描电子显微镜图像。详细的细胞表面结构,包括微绒毛,可以在回肠(顶部)和直肠(底部)单层中欣赏。左刻度尺 = 10 μm,右刻度尺 = 2 μm。 请点击此处查看此图的较大版本。
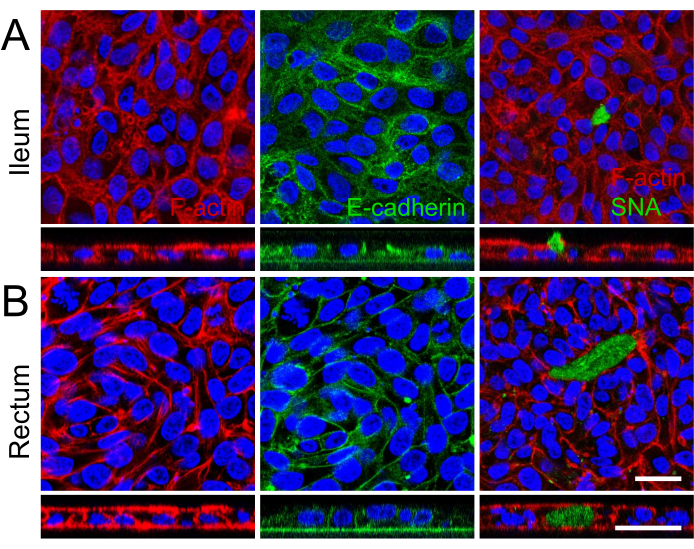
图 3:来源于回肠和直肠类器官的 2D 单层的免疫荧光表征。 (一、二)面板 (A) 显示回肠,面板 (B) 显示直肠类器官。在左侧,F-肌动蛋白纤维用鬼笔环肽(红色)突出显示,说明了细胞骨架结构和顶端刷状缘的形成。中间图像捕捉了粘附连接的基底外侧定位,用 E-钙粘蛋白(绿色)标记,表示细胞间粘附和单层完整性。在右侧,通过 SNA(绿色)识别产生粘蛋白的杯状细胞的存在,z 堆栈图像描绘了回肠单层中粘蛋白的顶端分泌。所有图像的细胞核均用 DAPI (蓝色) 复染。此外,所有图像的 z 堆栈成像进一步证明了培养插入物内形成单个细胞层。比例尺 = 25 μm。 请点击此处查看此图的较大版本。
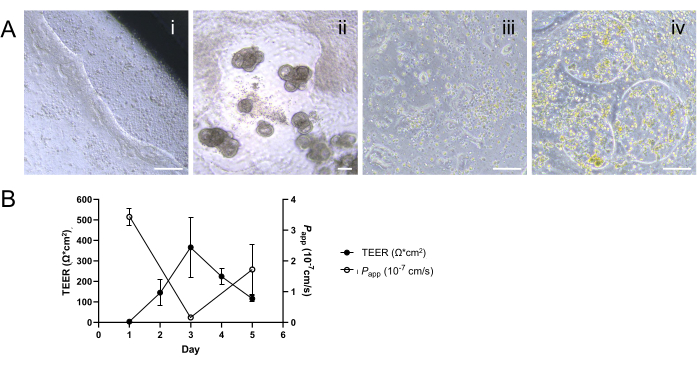
图 4:次优 2D 单层形成的表征。 (A) 代表性的相差图像表明 (i) 单层沿细胞培养插入片段边缘的部分分离;(ii) 3D 生长的发展和单层内间隙的形成;(iii) 由于接种密度低于最佳接种密度而导致单层形成不完全或延迟,表现为细胞斑片状粘附;(iv) 在后期在曾经形成的 2D 单层内形成间隙,这可能是由可疑污染引起的。比例尺 = 100 μm。(B) TEER 测量值下降加上第 3 天后通透性曲线上升表明未能建立稳定和功能性的上皮屏障。结果表示为平均值±平均值的标准误差 (SEM),来自具有两个技术重复的单个实验。 请单击此处查看此图的较大版本。
补充图 1:基于 ECM 的水凝胶中牛肠道类器官培养物的密度变化。 在基于 ECM 的水凝胶中培养的牛肠道类器官;(A) 高密度和 (B) 低密度。比例尺 = 100 μm。 请点击此处下载此文件。
补充表 1:总结的组织供体信号。请点击此处下载此文件。
讨论
肠道健康对牛的生产力和整体健康都至关重要16.利用类器官衍生的 2D 单层技术,科学家现在可以在 体外 环境中更准确地模拟牛肠道上皮的复杂结构5。这种创新方法不仅再现了肠道内壁的多样化细胞组成,包括其多细胞谱系,而且还捕获了关键功能特征,例如粘液分泌和微绒毛的存在,这对于理解肠道生理学和病理学至关重要3。为回肠和直肠节段开发的定制培养方案催生了一个先进的平台,该平台显着增强了研究牛肠道健康的能力。这种复杂的方法可以详细研究人畜共患病原体与牛肠道环境之间的相互作用。在 体外 密切复制和研究牛肠道生态系统独特方面的能力是朝着制定改善牲畜健康和减轻人畜共患疾病传播的针对性策略迈出的重要一步。
然而,为了确保使用牛肠道类器官成功开发 2D 单层细胞,保持类器官及其解离的单细胞的健康和活力至关重要。小心处理和最小化压力对于保持细胞完整性和功能至关重要,这对于类器官的有效生长和随后功能性单层的创建至关重要。此外,实现均匀的单层依赖于类器官成功解离为单个细胞而不形成大团块。这种团块会破坏细胞分布并破坏单层的结构。因此,采用精确的技术进行平滑解离至关重要,从而获得一致的单细胞悬液。此外,最大限度地减少细胞粘附期间和洗去多余的非贴壁细胞时的干扰变得有益。这种方法对于解决 3D 形态发生的潜在问题尤为重要,从而提高单层的整体质量。
生物来源的基于 ECM 的水凝胶的一个显着挑战是成分的批次间变化17。虽然使用所描述的方案和材料未观察到这一点,但 ECM 组成的批次间变化可能会对成功的单层开发构成挑战。如果 ECM 产品、品牌或批号发生变化时影响了单层细胞的形成,则可能需要优化步骤来确定包被细胞培养小室所需的适当 ECM 浓度。
此外,在进行任何更改之前将培养基调整到室温是一个关键步骤,有助于减轻热冲击、保护细胞健康并保持类器官和单层培养物的质量。温和的清洗方法对于在单层形成和后续分析过程中保持单层的完整性也至关重要,避免中断可以防止结果不准确。当单层脱离在重复洗涤或长时间暴露于 PBS 期间成为问题时,例如在细胞旁通透性测定中,用 Hank 平衡盐溶液 (HBSS) 替代 PBS 似乎有助于最大限度地减少单层脱离。最后,定制培养基以满足来自肠道不同段(如回肠和直肠)的细胞的特定需求,对于准确复制 体内 条件至关重要。这种特异性确保了最佳的细胞健康和功能,有助于对牛肠道生理学和与病原体的相互作用进行精确建模,从而突出类器官研究中的这些关键步骤。
除了采用温和的细胞处理实践外,建立与细胞计数和 TEER 测量相关的良好技术能力对于成功开发功能性 2D 单层至关重要。由于细胞计数过低或计数不足分别导致过低和过高的接种密度都可能导致单层生长受损。鼓励仔细检查细胞计数,并在怀疑接种密度不准确的情况下确保适当的接种密度。此外,TEER 测量技术不足会导致电极意外划伤而破坏单层。小心地将电极引入顶腔,并特别注意保持它们相对于膜表面的垂直方向,有助于降低单层意外损坏的风险。
此处描述的细胞旁通透性测定方法改编自先前的方案18。对报告的方案进行了修改,包括在 120 分钟内多次采样并用等量的 PBS 替换采样等分试样,以提高结果的准确性和可靠性。保持腔室内的总体积至关重要,原因如下:它可以保持渗透平衡,确保细胞完整性,保持准确渗透性评估所必需的浓度梯度,并防止可能影响运输速率的静水压力变化。这种用相当于含荧光示踪剂的 PBS 采样体积的新鲜 PBS 补充基底外侧腔的做法对于保持这些条件至关重要,从而能够准确和有意义地评估单层通透性。细胞旁通透性测定通过直接评估示踪分子通过单层的运动来作为 TEER 测量的补充。此外,比较不同实验室的 TEER 值可能无法获得相关的见解,因为这些值可能受到许多变量的影响,例如温度和细胞培养的具体条件,包括细胞类型、传代次数和培养基的组成19。细胞旁通透性测定提供了上皮屏障内粘附和紧密连接有效表达的功能 体外 评估20。
虽然从 3D 类器官开发 2D 单层代表了培养技术的重大进步,但重要的是要承认与 2D 单层相关的局限性。一个主要缺点是这仍然是一个静态培养系统,缺乏 体内环境中发现 的动态刺激。此外,由于其开放式设置涉及带盖的培养板,因此修改培养系统内的氧含量存在挑战,使其不太适合与厌氧菌长期共培养。这些限制可能通过采用更动态的培养平台来解决,例如微流体系统21,它提供了一个更加受控和生理相关的环境。此外,重要的是要认识到,虽然目前的培养条件富含有利于维持干细胞生长的营养物质,但它们可能不是诱导上皮细胞生理分化的最佳选择。这种差异突出了未来研究需要进行优化,以密切模拟 体内 条件并支持分化过程。通过解决这些限制并改进这些方法,类器官培养技术的实用性和适用性得到增强,更接近于在 体外复制胃肠道的复杂动力学和相互作用。
从牛回肠和直肠组织生成 2D 单层的方案为研究人员提供了小肠上皮和大肠上皮管腔界面的有价值的体外模型。该模型为基础动物营养研究开辟了巨大应用的可能性,特别是在研究营养物质在各种条件下如何被吸收。一个值得注意的感兴趣领域是对肠漏综合征的研究,其特征是胃肠道通透性异常增加,通常由饮食变化和极端环境温度触发22,23。此外,该模型是探索肠道微生物组与其宿主之间复杂相互作用的重要工具。它允许研究共生微生物如何影响宿主生物体的健康,解决了兽医和医学科学的一个关键方面 1,24。此外,人类食源性病原体经常作为共生体存在于牛肠道的不同部分 8,9,25,该协议能够详细研究允许这些人畜共患病原体在其各自生态位中茁壮成长的特定条件。
在整个研究中,观察到直肠和回肠类器官衍生的单层需要不同的条件才能成功发育。具体来说,当直肠类器官衍生的单层最初接种到用 2% 基于 ECM 的水凝胶在基础培养基中制备的细胞培养插入物上 1 小时时,注意到大孔和细胞脱落。通过改用专门的直肠单层培养基并将孵育期延长至接种前过夜,解决了这个问题,而回肠类器官衍生的单层细胞是使用较短的制备方案成功开发的。此外,向培养基中添加 CHIR99021 始终改善了直肠单层26 的建立,但对于回肠单层27 不是必需的。此外,与直肠类器官相比,回肠单层细胞需要更高的细胞密度才能成功发育27。这些优化的条件 (表 1) 反复开发了保持抗性屏障完整性的单层,强调了为特定肠道段定制培养条件的重要性。
获得准确反映 体内 肠道多细胞谱系复杂性的模型对于这些研究至关重要。它使研究人员能够密切模拟肠道环境的自然条件,为实验提供更可靠的基础。通过该协议,研究人员配备了一个强大的模型,可以提高他们的研究能力,从而有可能在他们的研究领域取得突破性的发现。这种方法不仅有助于了解肠道健康和疾病,还有助于制定改善牲畜管理和食品安全的策略。
披露声明
作者没有任何需要声明的利益冲突。
致谢
这项研究得到了美国国立卫生研究院主任办公室(K01OD030515 和 YMA R21OD031903)和 WSU VCS 住院医师和研究生研究资助(GDD)的部分支持。作者要感谢参与的屠宰场提供供体牛。
材料
| Name | Company | Catalog Number | Comments |
| Basal Medium | |||
| Advanced DMEM/F12 (1X) | Gibco | 12634-010 | n/a |
| GlutaMAX-I (100X) | Gibco | 35050-061 | 2 mM |
| HEPES (1M) | Gibco | 15630-080 | 10 mM |
| Pen Strep Glutamine (100X) | Gibco | 10378-016 | 1X |
| Organoid Culture Medium (Supplements to Basal Medium) | |||
| A-83-01 | Sigma-Aldrich | SML0788-5MG | 500 nM |
| B27 Supplement (50X) | Gibco | 17504-001 | 1X |
| [Leu15]-Gastrin I human | Sigma-Aldrich | G9145-.5MG | 10 nM |
| Murine EGF | PeproTech | 315-09-500UG | 50 ng/mL |
| Murine Wnt-3a | PeproTech | 315-20-10UG | 100 ng/mL |
| N-Acetyl-L-cysteine | MP Biomedicals | 194603 | 1 mM |
| N-2 MAX Media Supplement (100X) | R&D Systems | AR009 | 1X |
| Nicotinamide | Sigma-Aldrich | N0636-100G | 10 mM |
| Noggin Conditioned Medium | n/a | n/a | 10 vol/vol % |
| Primocin | InvivoGen | ant-pm-2 | 100 µg/mL |
| R-Spondin-1 Conditioned Medium | n/a | n/a | 20 vol/vol % |
| SB202190 | Sigma-Aldrich | S7067-25MG | 10 µM |
| Monolayer Culture Medium (Supplements to Organoid Culture Medium) | |||
| CHIR99021 | Sigma-Aldrich | SML1046-5MG | 2.5 µM |
| HI FBS | Gibco | 10438-034 | 20 vol/vol % |
| LY2157299 | Sigma-Aldrich | SML2851-5MG | 500 nM |
| Y-27632 | StemCellTechnologies | 72308 | 10 µM |
| Reagents | |||
| Alexa Fluor 488 Mouse anti-E-cadherin | BD Biosciences | 560061 | 1:200 dilution |
| Alexa Fluor 647 Phalloidin | Invitrogen | A22287 | 1:400 dilution |
| BSA | Cytiva | SH30574.02 | 2 w/vol % |
| Cell Recovery Solution | Corning | 354253 | n/a |
| DAPI Solution (1 mg/mL) | Thermo Scientific | 62248 | 1:1000 dilution |
| DPBS (1X) | Gibco | 14190-144 | n/a |
| Fluorescein Isothiocyanate–Dextran | Sigma-Aldrich | FD4-100MG | 0.5 mg/mL |
| Matrigel Matrix | Corning | 354234 | n/a |
| Paraformaldehyde Solution (4%) | Thermo Scientific | J19943K2 | n/a |
| ProLong Gold antifade reagent | Invitrogen | P36930 | n/a |
| SNA, EBL, Fluorescein | Vector Laboratories | FL-1301 | 1:100 dilution |
| Triton X-100 | Thermo Scientific | A16046.AE | 0.3 vol/vol % |
| TrypLE Express | Gibco | 12605-028 | n/a |
| Trypan Blue Solution, 0.4% | VWR Life Science | K940-100ML | n/a |
| Materials and Equipment | |||
| 0.4 µm Cell Culture Insert | Falcon | 353095 | |
| 24-well Cell Culture Plate | Corning | 3524 | |
| 48-well Cell Culture Plate | Thermo Scientific | 150687 | |
| 70 µm Sterile Cell Strainer | Fisher Scientific | 22-363-548 | |
| 96-well Cell Culture Plate | Greiner Bio-One | 655086 | |
| Centrifuge | Eppendorf | 5910Ri | |
| CO2 Incubator | Thermo Scientific | 370 | |
| Epithelial Volt-Ohm Meter | Millipore | Millicell ERS-2 | |
| Hemocytometer | LW Scientific | CTL-HEMM-GLDR | |
| Inverted Confocal Microscope | Leica Microsystems | SP8-X | |
| Inverted Phase-Contrast Microscope | Leica Microsystems | DMi1 | |
| Microscope Cover Glass | Fisher Scientific | 12-540-B | |
| Microplate Reader | Molecular Devices | SpecrtraMax i3x | |
| Microscope Slides | Fisher Scientific | 22-034-486 | |
| Pasteur Pipets | Fisher Scientific | 13-678-20C | |
| Scalpel Blade | iMed Scientific | - | #11 carbon steel |
| Vortex Mixer | Scientific Industries | SI-0236 | |
| Software | |||
| LAS X imaging software | Leica Microsystems | LAS X 3.7.6.25997 | |
| Microplate Reader software | Molecular Devces | SoftMax Pro 7.1.2 |
参考文献
- Min, S., Kim, S., Cho, S. W. Gastrointestinal tract modeling using organoids engineered with cellular and microbiota niches. Exp Mol Med. 52 (2), 227-237 (2020).
- Fitzgerald, S. F., et al. Shiga toxin sub-type 2a increases the efficiency of Escherichia coli O157 transmission between animals and restricts epithelial regeneration in bovine enteroids. PLoS Pathogens. 15 (10), e1008003 (2019).
- Dutta, D., Heo, I., Clevers, H. Disease modeling in stem cell-derived 3D organoid systems. Trend Mol Med. 23 (5), 393-410 (2017).
- Beaumont, M., et al. Intestinal organoids in farm animals. Vet Res. 52 (1), 33 (2021).
- Kawasaki, M., Dykstra, G. D., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Adult bovine-derived small and large intestinal organoids: In vitro development and maintenance. J Tissue Eng Regene Med. 2023, e3095002 (2023).
- Kvidera, S. K., et al. Intentionally induced intestinal barrier dysfunction causes inflammation, affects metabolism, and reduces productivity in lactating Holstein cows. J Dairy Sci. 100 (5), 4113-4127 (2017).
- Crawford, C. K., et al. Inflammatory cytokines directly disrupt the bovine intestinal epithelial barrier. Sci Rep. 12 (1), 14578 (2022).
- Heredia, N., García, S. Animals as sources of food-borne pathogens: A review. Animal Nutri. 4 (3), 250-255 (2018).
- Naylor, S. W., et al. Lymphoid follicle-dense mucosa at the terminal rectum is the principal site of colonization of enterohemorrhagic Escherichia coli O157:H7 in the bovine host. Infect Immun. 71 (3), 1505-1512 (2003).
- Co, J. Y., et al. Controlling epithelial polarity: A human enteroid model for host-pathogen interactions. Cell Rep. 26 (9), 2509-2520.e4 (2019).
- Pullinger, G. D., et al. Systemic translocation of Salmonella enterica Serovar Dublin in cattle occurs predominantly via efferent lymphatics in a cell-free niche and requires type III secretion system 1 (T3SS-1) but not T3SS-2. Infect Immun. 75 (11), 5191-5199 (2007).
- Nickerson, K. P., et al. A versatile human intestinal organoid-derived epithelial monolayer model for the study of enteric pathogens. Microbiol Spectr. 9 (1), e0000321 (2021).
- Varani, J., McClintock, S. D., Aslam, M. N. Cell-matrix interactions contribute to barrier function in human colon organoids. Front Med. 9, 838975 (2022).
- Freire, R., et al. Human gut derived-organoids provide model to study gluten response and effects of microbiota-derived molecules in celiac disease. Sci Rep. 9, 7029 (2019).
- Ambrosini, Y. M., et al. Recapitulation of the accessible interface of biopsy-derived canine intestinal organoids to study epithelial-luminal interactions. PLoS ONE. 15 (4), e0231423 (2020).
- Kogut, M. H., Arsenault, R. J. Editorial: Gut health: The new paradigm in food animal production. Front Vet Sci. 3, 71 (2016).
- Lingard, E., et al. Optimising a self-assembling peptide hydrogel as a Matrigel alternative for 3-dimensional mammary epithelial cell culture. Biomater Adv. 160, 213847 (2024).
- Turksen, K. . Permeability Barrier: Methods and Protocols. , (2011).
- Srinivasan, B., et al. TEER measurement techniques for in vitro barrier model systems. J Lab Autom. 20 (2), 107-126 (2015).
- Frost, T. S., Jiang, L., Lynch, R. M., Zohar, Y. Permeability of epithelial/endothelial barriers in Transwells and microfluidic bilayer devices. Micromachines. 10 (8), 533 (2019).
- Bein, A., et al. Microfluidic organ-on-a-chip models of human intestine. Cell Mol Gastroenterol Hepatol. 5 (4), 659 (2018).
- Sanz-Fernandez, M. V., et al. Targeting the hindgut to improve health and performance in cattle. Animals. 10 (10), 1817 (2020).
- Gressley, T. F., Hall, M. B., Armentano, L. E. Ruminant nutrition symposium: Productivity, digestion, and health responses to hindgut acidosis in ruminants. J Anim Sci. 89 (4), 1120-1130 (2011).
- O'Hara, E., Neves, A. L. A., Song, Y., Guan, L. L. The role of the gut microbiome in cattle production and health: Driver or passenger. Ann Rev Animal Biosci. 8 (2020), 199-220 (2020).
- Beach, J. C., Murano, E. A., Acuff, G. R. Prevalence of Salmonella and Campylobacter in beef cattle from transport to slaughter. J Food Protect. 65 (11), 1687-1693 (2002).
- Kawasaki, M., Ambrosini, Y. M. Accessible luminal interface of bovine rectal organoids generated from cryopreserved biopsy tissues. PLoS One. 19 (3), e0301079 (2024).
- Kawasaki, M., McConnel, C. S., Burbick, C. R., Ambrosini, Y. M. Pathogen-epithelium interactions and inflammatory responses in Salmonella Dublin infections using ileal monolayer models derived from adult bovine organoids. Scientific Reports. 14 (1), 11479 (2024).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
关于 JoVE
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。