Method Article
基于针引导不对称双侧颈总动脉狭窄的血管性认知障碍和痴呆小鼠模型
摘要
提出了不对称双侧颈总动脉狭窄的穿刺方法,以创建血管性认知障碍和痴呆的小鼠模型。与先前建立的模型相比,它会产生更长期的结果,并且与实时 MRI 兼容。演示手术的视觉表示为掌握手术提供了指导。
摘要
血管性脑损伤和痴呆 (VCID) 由血管性脑损伤引起。鉴于 VCID 的高发病率,预计随着人口老龄化,VCID 的发病率将继续上升,因此为该疾病建立一个强大的动物模型至关重要。本文提出了一种基于不对称双侧颈总动脉狭窄创建 VCID 小鼠模型的新方法,该方法模拟了由颈动脉粥样硬化引起的人类慢性脑灌注不足。
简而言之,使用 7-0 丝缝线将颈总动脉 (CCA) 结扎到不同规格的针头(右侧 CCA 为 32 G,左侧 CCA 为 34 G),然后立即拔针。剩余的缝合环会导致持续的血流减少和与白质损伤、微梗死和反应性胶质增生相关的长期认知障碍,因此与 VCID 的发病机制非常相似。重要的是,在这个针模型中,临床表征不会随着时间的推移而恢复,从而提供可靠的长期认知障碍。此外,术后 24 周的生存率为 81.6%,与其他已建立的血流减少水平相似的 VCID 模型相比更高。
其他优点包括材料成本低,并且由于没有植入金属,因此与 MRI 兼容,可监测活体动物的脑损伤。采用 VCID 针头模型的主要挑战是需要发展高级手术技能,因为小鼠 CCA 的直径小于 0.6 毫米并且非常脆弱。因此,手术的高质量视觉表示将帮助研究人员掌握这项技术并促进我们对 VCID 的理解,从而有可能开发新的治疗方式,以减少与 VCID 相关的毁灭性认知能力下降。
引言
血管性认知障碍和痴呆 (VCID) 是认知能力下降的第二大原因。尽管在了解 VCID 发病机制及其风险因素方面取得了不可否认的进展,但神经血管功能障碍如何导致认知能力下降的机制仍然模糊。已经建立了许多不同复杂性的啮齿动物模型来诱导脑缺血,以模拟人类 VCID1 的临床表现。其中一些模型基于创建短暂性脑灌注不足;然而,它们中的大多数是通过诱导慢性脑灌注不足产生的,这是导致人类患者 VCID 的主要机制2。
慢性脑灌注不足可使用双侧颈动脉闭塞 (BCAO) 或双侧颈动脉狭窄 (BCAS) 引入,这会导致严重但通常是致命的结果。BCAS 通常使用以下两种方法之一进行:在两个 CCA 周围放置相同的微线圈,导致对称性狭窄3;或通过分别在左右 CCA 周围植入 ameroid 收缩器和微线圈,导致左右 CCA 逐渐闭塞和 ~50% 血流减少,相应地4.两种方法的缺点是,如果狭窄太严重或 CCA 闭塞,死亡率高,并且由于体内存在金属而与活体动物 MRI 扫描不相容。还建立了一些遗传小鼠模型 1,5,6,7,8。其他选择包括伴有皮质下梗死的常染色体显性遗传性动脉病和白质脑病小鼠模型 9,10。然而,所提出的模型都没有模拟人类患者出现的所有缺血性损伤,因此继续寻找更新的 VCID 模型。
本文提出了一种在小鼠中诱导不对称双侧颈总动脉狭窄 (ABCS) 的新型手术方法,其中 CCA 狭窄是使用丝缝线进行的,并通过将 CCA 连接到各种直径的针头上,然后立即拔针来控制11。因此,精确直径的缝合环永久留在 CCA 上,以确保慢性狭窄。与对称方法相比,使用 ABCS 的好处是右侧中度低灌注可确保更好的生存率,而左侧更明显的低灌注可确保长期的神经和病理表现。与传统的 BCAS 模型11 相比,这种针头模型具有几个优点,例如结果持久、死亡率更低、成本超低、灵活性以及使用特殊分析方法的可能性。
为了详细说明这些优势,三个结扎导致 CCA 狭窄片段而不是局灶狭窄,导致 ~90% 的小鼠持续灌注不足、白质损伤和认知能力下降。针鼠的死亡率为 ~17%,低于 Hattori 的 ameroid restrictor/microcoil model4,根据我们的经验,该模型在 16 周内的死亡率为 ~30%。由于昂贵的微线圈或 ameroid 限制器,每个 BCAS 型号的成本通常在 100 美元左右,而针型号每只鼠标的成本仅为 1 美元左右。此外,可以根据对两侧血流限制的研究特定要求来修改针头的规格。在当前论文中提出的变化中,针头模型模拟了严重颈动脉狭窄的病理生理学,由无闭塞的单侧永久性狭窄引起,这是临床上最常见的疾病表现11。此外,传统 BCAS 模型中使用的 ameroid 限制器和微线圈由金属制成,如果进行 体内 MRI,这可能会导致严重的伪影,即使金属不是植入大脑而是植入胸部。可能很难预测金属的存在将如何影响成像。
通常,微线圈植入后进行的 体内 MRI 通常是简单的解剖成像,不适合多发性损伤的定量分析,这对于 VCID 研究来说是非常可取的。相比之下,这里介绍的针头模型仅使用丝线缝合线,并且与任何类型的 体内 MRI 完全兼容。这很重要,原因有两个:(1) MRI 对小脑病变、微出血或浅表铁质沉着症12 极为敏感,因此优于其他分析方法,例如 CT 扫描 (2) 体内 MRI 应优于 离体 MRI,因为 VCID 研究无疑可以从跟踪病变进展/愈合的动力学中受益, 特别是对拟议的新型治疗方法的响应。此外,可以在针状模型中进行功能 (fMRI),以提供对响应脑低灌注的神经血管耦合完整性的关键见解。因此,使用 体内 MRI 的可能性为深入分析病灶的大小和位置与认知功能之间的复杂相关性以及神经血管耦合开辟了一条途径,尤其是在药效学研究中。
研究方案
所有动物规程均已获得匹兹堡大学机构动物护理和使用委员会的批准,并按照美国国立卫生研究院实验动物护理和使用指南执行。所有存活手术都必须保持无菌技术。本实验使用体重 25-30 g 的 12 周龄雄性 C57BL/6J 小鼠。
1. 准备材料和工作空间
- 准备针头片段(~4 mm 长;右侧 CCA 为 32 G,左侧 CCA 为 34 G)。小心地将针的尖头敲击在坚硬的表面上,使针的尖头略微变钝,并使用持针器小心地将针与塑料片分开。将 7-0 根真丝缝合线预剪成 1-2 厘米长的块。
- 通过高压灭菌或任何其他适当的方法对手术器械、针头碎片和缝合线进行消毒。
2. 进行手术
- 称量小鼠,并将小鼠置于用 3% 异氟醚在 25% O2 和 72% N2O 的混合物中通风的腔室中 2-3 分钟来诱导麻醉。
- 将鼠标(腹侧朝上)放在用无菌手术片覆盖的加热垫上,以保持恒定的体温 (37 °C),并用 1% 异氟醚在 25% O2 和 74% N2O 的混合物中固定面罩以进行通风。用胶带固定小鼠的四肢。
- 用电动剃须刀剃掉脖子上的毛皮。用胶带或键盘真空吸尘器清洁细毛。
- 用 Betadine 溶液(10% 碘)对手术部位进行消毒。用 70% 乙醇对皮肤脱碘。重复 dinsinfection 3 次。通过对用力的脚趾捏合(踏板反射)缺乏反应,确保麻醉水平足够。
- 覆盖手术区域。然后,沿着气管做一个垂直的中线切口,用微型镊子分离双侧甲状腺。用无菌的小皮肤牵开器将皮肤和组织拉开。
- 在显微镜下,使用斜镊小心地暴露和钝化迷走神经和鞘中解剖其中一个 CCA。如果 CCA 倾向于粘在镊子上,请使用无菌水或磷酸盐缓冲盐水 (PBS) 润湿切口部位。如果需要,在脖子下方放置一个小塑料注射器以支持姿势。
注意: 请格外小心,不要使 CCA 破裂。 - 使用斜镊在 CCA(相距 7 毫米)下穿入三个预切的丝缝合片段(尺寸 0-1)。
- 在其中一个缝合片段的 CCA 周围打一个非常松散的双结。
注意:用无菌水或 PBS 润湿手术部位和缝合线可能有助于打结。 - 将一根针头(右 CCA 为 32 G,左 CCA 为 34 G)平行于 CCA,在松散的结内(图 1A)。小心地收紧针头和 CCA 周围的初级结,直到没有观察到血流,然后用次级结固定。立即拔出针头以恢复部分血流并修剪缝合线的末端。
注意:打结完成后,外科医生必须非常小心地修剪缝合线末端。剪得离结太近可能会导致结松动。此外,在拔针后观察 CCA 以确保结下游的血流仍然有效也很重要。如果拔针后 CCA 看起来非常苍白,则表示 CCA 过度压缩。 - 对同一 CCA 上的第 2 和第 3 缝 合线重复步骤 2.8-2.9,彼此相距约 1 毫米(图 1B)。
- 使用 32 G 针片段,用相反的 CCA 重复步骤 2.6-2.10。
- 仔细检查两个 CCA 是否都有效结扎:确认所有三个缝合带都牢固地打结到位,但不要太紧以至于完全阻塞血流(检查 CCA 在打结的下游是否苍白)。检查每个 CCA 上的三个缝合带是否彼此相距约 1 毫米。
- 使用无菌单丝缝合线闭合皮肤。
- 手术后立即腹膜内注射 100-150 μL 酮洛芬(1 mg/mL 原液;5 mg/kg 体重)以缓解术后疼痛。手术后 24 小时和 48 小时重复此注射。
- 将小鼠放在 37 °C 的恒温毯上连续监测 2 小时,然后将动物送回动物设施。
注意:对于假手术,应省略步骤 2.7-2.12。
3. 模型验证
注意:用 体内 MRI 分析脑损伤,并通过 Luxol 固蓝 (LFB) 染色和行为测试进一步验证。
- 脑血灌注成像。
- 使用 1-1.5% 异氟醚麻醉小鼠。用 Betadine 溶液(10% 碘)对手术部位进行消毒。然后,用 70% 乙醇对皮肤进行脱碘。
- 将动物的头骨固定在立体定向框架中。在头皮上从额骨到枕骨做一个中线下垂切口,露出颅骨,并用无菌盐水清洁颅骨表面。
- 使用二维激光散斑系统将带电耦合器件相机放置在颅骨上方 10 厘米处。将探针支架放在开颅手术部位并牢固固定。
- 在手术前 5 分钟和放针后立即或手术后 7、14、21、28、35 和 42 天拍摄血液灌注图像。
- 使用无菌单丝缝合线闭合皮肤。腹膜内注射 100-150 μL 酮洛芬(1 mg/mL 原液;5 mg/kg 体重)以缓解术后疼痛。重复此注射 24 小时和 48 小时。
- 体内 核磁共振成像
- 使用 1-1.5% 异氟醚麻醉小鼠,在图像采集过程中连续监测呼吸并将温度保持在 37 °C,并用暖空气。
- 使用 9.4T 扫描仪、86 毫米 Tx 线圈和 4 通道小鼠脑接收器阵列,运行相关软件进行 体内 MRI。在定位和导频扫描之后,使用弛豫增强快速采集 (RARE) 序列获取 T2 加权图像 (T2WI),参数如下:回波时间/重复时间 (TE/TR) = 40/4,000 毫秒,平均值 = 8,256 × 256 个矩阵,16 个切片厚度为 0.5 毫米,稀有因子 = 4,视场 (FOV) 为 20 x 20 毫米。
- 使用回波平面成像 (EPI)-DTI 成像序列收集扩散张量成像 (DTI) 数据,使用与 T2WI 相同的几何形状和参数,但以下情况除外: TR/TE = 2,300/22 ms,采集矩阵 = 128 x 128,2 个分段,5 个 A0 图像和 30 个非线性扩散图像,Δ/δ = 10/3 ms,b 值 = 1,000 s/mm2。
- 使用 DSI Studio 软件 (http://dsistudio.labsolver.org/) 分析 DTI 数据,寻找扩散标量参数(分数各向异性 (FA)、平均扩散率 (MD)、轴向扩散率 (AD) 和径向扩散率 (RD))的差异。从两个半球绘制胼胝体 (CC)、外囊 (EC)、内囊 (IC)、菌毛、前连合 (AC)、扣带 (Cing)、海马 (hippo)、皮层 (C) 和纹状体 (Str) 的感兴趣区域 (ROI)。
- Luxol 固蓝 (LFB) 染色
- 准备脑切片:用 4% PFA 固定大脑 24 小时,然后将大脑浸入 30% 蔗糖中直至大脑下沉。将大脑嵌入干冰上的 OCT 化合物中。在滑动切片机上切下 20 μm 厚的冠状脑切片。将脑切片储存在储存溶液(PBS 中的 30% 甘油/30% 乙二醇)中。
- 将脑切片浸入 LFB(0.1% 酒精溶液)中,在 56 °C 下保持过夜,并用蒸馏水洗涤。
- 在 0.05% 碳酸锂中孵育脑切片,并通过分级醇脱水。
- 用 0.5% 甲酚紫对切片染色 5 分钟,用 70% 乙醇区分。
- 用封固剂封固染色的脑切片。
- 使用改良的 Morris 水迷宫测试进行认知功能评估
- 将圆形水箱装满水(25 oC,深 33 厘米),然后将一个方形 ~10 x 10 cm2 有机玻璃平台浸入水位以下 1.2 厘米处,距离池的北、东、南或西边缘 31 厘米。
注意:在整个测试期间,该平台应保持在同一位置。 - 打开安装在天花板上的摄像机。将鼠标放入水箱中(不要在水位上放飞),面向墙壁,从东北、东南、西南或西北开始。让鼠标最多游动 90 秒以找到一个水下平台。
- 如果找到平台,请让鼠标在水下平台上停留 30 秒。如果未找到平台,请将鼠标放置 30 秒。
- 让鼠标休息 5 分钟,然后重复游泳试验(步骤 3.4.2 - 3.4.3)2 次。
- 用一块布擦干鼠标,然后将其放回加热灯泡下的笼子中。
- 每天重复 3 次游泳试验,连续 5 天。
- 使用视频片段计算逃逸延迟(在每次试验中找到平台需要多长时间)。
- 在测试的最后一天,删除平台并记录鼠标在平台之前所在的象限中花费的时间。
- 将圆形水箱装满水(25 oC,深 33 厘米),然后将一个方形 ~10 x 10 cm2 有机玻璃平台浸入水位以下 1.2 厘米处,距离池的北、东、南或西边缘 31 厘米。
结果
长期不对称性脑灌注不足
如前所述,在最后一次(第三次)连接之前和之后立即测量 CCA 血流量11。左侧 CCA 的血流量减少了 ~70%,右侧 CCA 的血流量减少了 ~50%。使用二维激光散斑动态监测脑血灌注。手术导致两个半球的脑灌注不足,左半球受到的影响更严重(图2)。手术后脑灌注不足维持至少 24 周11。
降低死亡率
雄性小鼠 6 周以上的存活率为 81.6%(图 3);小鼠在手术后第一周更容易死亡。
脑 损伤的体内 MRI 检测
T2 加权图像显示接受 ABCS 手术的小鼠海马体 (Hippo)、外囊 (EC)、内囊 (IC)、胼胝体 (CC) 和纹状体 (Str) 的低信号或高信号区域,表明脑损伤(图 4A)。与假小鼠相比,在 ABCS 小鼠 DTI 的方向编码彩色 (DEC) 图中观察到结构损伤(图 4B)。
定量分析显示,与假小鼠相比,ABCS 小鼠在左侧 Hippo、IC、前连合 (AC)、扣带回 (Cg) 和菌丝 (Fi) 中的各向异性分数 (FA) 显着降低 (P < 0.05 与假相比),表明左半球白质微观结构受损(左上图, 图 4C)。ABCS 小鼠右侧 Cg 和 Fi 的 FA 也降低 (P < 0.05 vs sham)。在 ABCS 小鼠中,左侧 IC 和 Fi 中的 FA 显著低于右侧 (P < 0.05,左 vs 右)。
同样,与假手术相比,ABCS 小鼠左侧 EC、IC、Str 和 Fi 的轴向扩散率 (AD) 显着降低,表明轴突损伤(右上图, 图 4C (P < 0.05 与假手术相比))。与假小鼠相比,只有左侧 Str 显示 ABCS 小鼠的平均扩散率 (MD) 降低(左下图, 图 4C)。在 ABCS 小鼠的左侧 CC 、 Str 和 Fi 中观察到径向扩散率 (RD) 差异(右下图, 图 4C),表明这些区域存在炎症和细胞结构增加13。
两个半球的不对称脑损伤和左半球白质区域的损伤
使用前面描述的程序14 通过 LFB 染色额外分析脑损伤(图 5)。低倍图像显示 EC 和 Str 中较浅的蓝色染色,表明这些区域有脱髓鞘。高清图像显示,假小鼠在 EC 中表现出组织良好且有髓的轴突和线性导向的少突胶质细胞;然而,轴突消失,并且在 ABCS 小鼠的 EC 中观察到普遍的蓝色染色细胞。假小鼠在 Str 中表现出深蓝色染色和组织良好的纤维束结构。然而,纤维束染色得更轻、更小,并且它们的完整性受到了损害;一些纤维束在 ABCS 小鼠中空泡化。在 ABCS 小鼠的 AC 中,纤维束扭曲,束间基质显著增厚。总之,ABCS 手术会导致轴突脱髓鞘和损伤;白质损伤主要发生在左半球。
学习和记忆功能障碍
针刺 ABCS 手术导致严重的学习障碍,如在 Morris 水迷宫测试期间寻找水下平台的时间增加(逃生潜伏期)所示(图 6)。这种残疾在手术后至少持续了 24 周。内存也受到了显著影响,如在平台被移除后在目标象限中花费的时间减少所表明的那样。
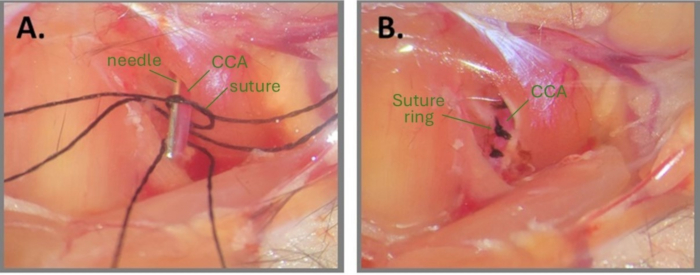
图 1:创建 ABCS 的针刺手术步骤。 (A) 暴露出左侧 CCA,在 CCA 下穿入三根丝线。在其中一个缝合线碎片上打一个松散的结,针头平行于 CCA 定位。(B) 三个缝合环相距约 1 毫米。缩写: ABCS = 不对称性双侧颈总动脉狭窄;CCA = 颈总动脉。 请单击此处查看此图的较大版本。

图 2:针 ABCS 模型中持续不对称的脑灌注不足。 手术后脑血流的动态监测。在两个半球都可以观察到持续的脑灌注不足,在左侧更为严重。黑色星号表示灌注不足区域。缩写:ABCS = 不对称双侧颈总动脉狭窄。 请单击此处查看此图的较大版本。

图 3:针刺 ABCS 手术后的存活率。 手术 6 周生存率为 81.6%;死亡主要发生在术后第一周。缩写:ABCS = 不对称双侧颈总动脉狭窄。 请单击此处查看此图的较大版本。
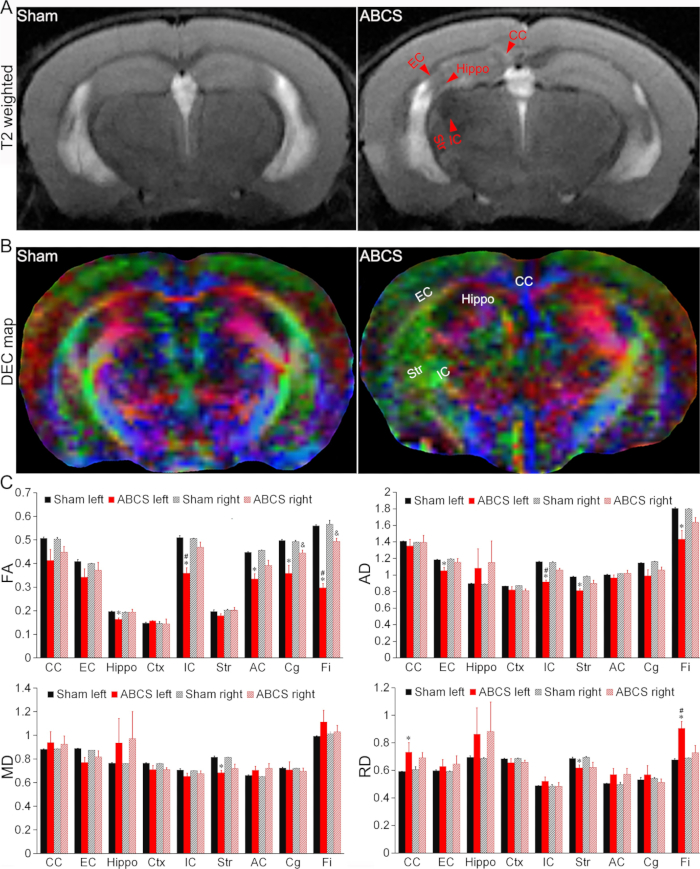
图 4: 针头 ABCS 模型中脑损伤的体内 MRI 检测。(A) 来自假小鼠和 ABCS 小鼠的代表性 T2 加权图像。红色箭头表示低信号或高信号区域。(B) 针刺 ABCS 手术后 2 周体内 DTI 的代表性 DEC 图。颜色表示扩散主轴的方向性(红色 = 左/右,绿色 = 背侧/腹侧,蓝色 = 喙侧/尾侧)。(C) 假小鼠和 ABCS 小鼠的定量分析(单因素方差分析)。* 表示 p < 0.05 ABCS 与假手术(左半球)。# 表示 P < 0.05 左与右。&代表p < 0.05 ABCS与假手术(右半球)的对比。数据以 SEM ±平均值表示;假小鼠 n = 4,ABCS 小鼠 n = 4。缩写: ABCS = 不对称性双侧颈总动脉狭窄;Hippo = 海马体;EC = 外囊;IC = 内囊;CC = 胼胝体;Str = 纹状体;DEC = 方向编码的颜色;DTI = 弥散张量成像;FA = 分数各向异性;MD = 平均扩散率;AD = 轴向扩散率;RD = 径向扩散率。请单击此处查看此图的较大版本。
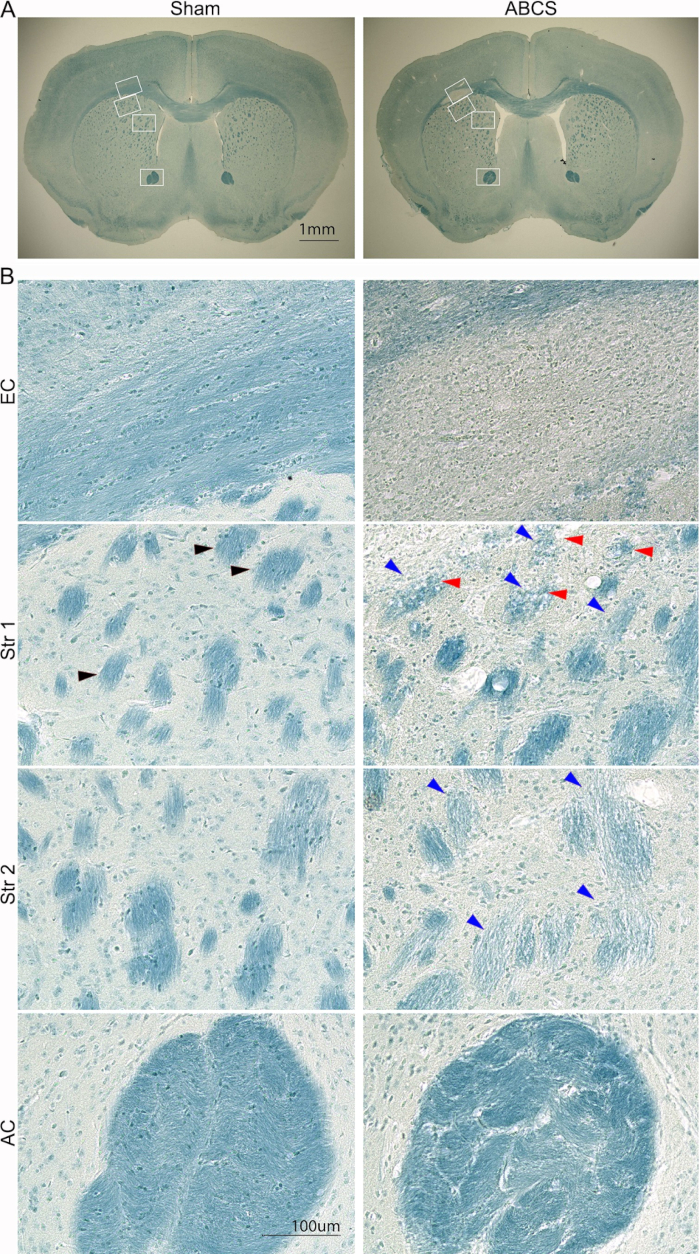
图 5:穿刺 ABCS 手术后 6 周脑切片的代表性 LFB 染色。(A) 假小鼠和 ABCS 小鼠 LFB 染色的低倍图像。白色框表示 B 中与更高分辨率图像对应的位置。(B) 来自 EC(上面板)和 Str 位置 1 和 2(中面板)和 AC(下面板)的高清图像 (200x)。黑色箭头显示正常的纤维束。蓝色箭头指向损坏的光纤束。红色箭头表示空泡纤维。比例尺 = 1 毫米 (A),100 微米 (B)。缩写: ABCS = 不对称性双侧颈总动脉狭窄;LFB = Luxol 固蓝;EC = 外囊;Str = 纹状体;AC = 前连合。 请单击此处查看此图的较大版本。
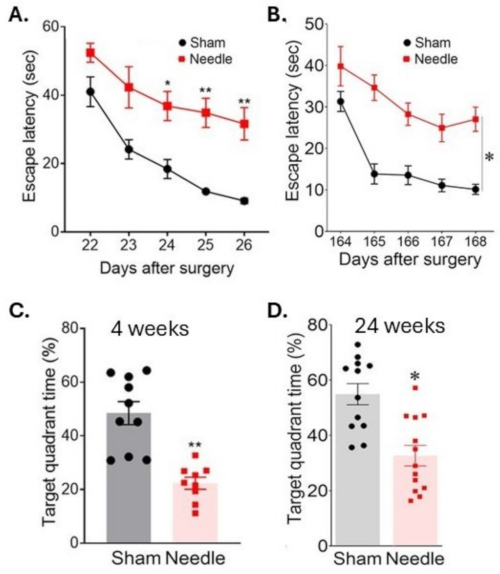
图 6:水迷宫测试中的空间学习和记忆评估。 在手术后 (A) 3 周和 (B) 24 周通过测量连续几天定位平台的时间来评估空间学习。通过测量平台移除后在目标象限花费的时间,在手术后 (C) 4 周和 (D) 24 周评估记忆力。手术导致认知功能的长期破坏。数据表示为 SEM ±平均值,*p < 0.05 针与假针;**P < 0.01 与 SHAM 相比;双向方差分析和 Neuman-Keuls 事后。假针组 n = 10,针组 n = 10。该图已从 Weng 等人 11 修改而来。 请单击此处查看此图的较大版本。
讨论
已经描述了几种使用不对称 CCA 狭窄诱导 VCID 的方法,它们都有一个重要且关键的手术步骤,即将 CCA 与迷走神经和 CCA 的鞘分离并暴露,使其可用于狭窄。虽然我们为结扎前 CCA 的手术暴露提供了高质量的视觉指导,但我们也想指导研究人员观看有关 CCA 分离的其他视频,这些视频可在其他小鼠和大鼠手术的背景下在线获得 15,16,17,18。应格外小心不要压迫或破裂 CCA,因为它是为大脑提供含氧血液的主要动脉。
手术中需要掌握的另一个关键步骤是拉出一个松散的结,然后用针头进一步收紧 CCA 周围,然后取出针头。我们强烈建议在尝试在麻醉的小鼠中执行此步骤之前,仅用针头练习此步骤。这将允许掌握微妙的镊子动作并完善缝合线的作,而不会有伤害鼠标的风险。打结需要固定好,在拔针过程中不会散开,足够紧以固定针头,但又足够松,以便使用镊子将针头从打结的缝合线上滑开。
重要的是,我们发现每个 CCA 的单次连接不足以可靠地减少血流量和维持长期脑低灌注11。一种可能的解释可能是单次结扎会导致点狭窄,这可能会导致局部压力增加,导致血流速度增加以补偿血流减少。我们建议进行三次结扎,彼此相距 ~1 mm,以产生狭窄片段。使用三个结扎的另一个好处是,这些结可以作为醒发机制,以防其中一个结在额外的针头移除过程中松动。事实上,由同一 CCA 的三个单独结扎引起的狭窄片段增加了模型的一致性,导致约 90% 的小鼠持续脑低灌注。此外,与病灶狭窄相比,碎片狭窄更精确地模拟了人类患者动脉粥样硬化引起的 CCA 狭窄,从而提高了针头模型的临床相关性。
我们强烈建议在完成第一次结扎后立即拔出针头,以确保 CCA 血流部分恢复,然后依次进行第二次和第三次结扎。不建议在所有三个结内用针头完成所有三个结扎,因为这会显着增加血流完全阻塞的时间。通常,我们不建议在取出针头之前超过 1 分钟的完全 CCA 闭塞。该建议基于报告,即小鼠在两个 CCA 闭塞 3 次 60 秒后没有表现出任何功能障碍的迹象19。在我们的模型中,外科医生一次处理一个 CCA,这比同时闭塞两个 CCA 更宽容,但我们仍然建议遵循此时间表,以排除由长期闭塞而不是两侧慢性低灌注引起的任何伪影。
虽然这种针头模型允许通过使用各种直径的针头(根据体重或血流限制的具体要求)来调整打结缝合线的直径,但根据我们的经验,当右半球灌注不足时,小鼠的存活率更高是中度而不是重度。另一方面,左半球持续严重的低灌注产生了长期的病理和神经系统结果。因此,我们建议使用较粗的针头结扎右侧 CCA(导致右半球中度灌注不足),并使用较细的针头结扎左侧 CCA(导致左半球严重低灌注),进行不对称结扎。
最后,研究人员应该意识到,不同的小鼠品系可能会产生与缺血性或创伤性损伤不同的结果,这主要是由于脑血管解剖结构的差异20,21。由于现在许多研究都需要产生新的转基因小鼠,因此如果在实验设计的任何阶段需要 BCAO 手术,则必须仔细考虑背景菌株。例如,C57BL/6 和 SV129 菌株都是为中风研究生成转基因动物的常见背景选择21。然而,有充分的证据表明,与测试的其他菌株(包括 SV129 小鼠20,21)相比,C57BL/6 小鼠对缺血更敏感。事实上,有证据表明,小鼠菌株的效果可能比用于诱导 VCID21 的技术的效果更重要。因此,在所有涉及诱导啮齿动物缺血性脑损伤的实验中保持小鼠背景一致变得至关重要。重要的是,研究人员可以使用神经学评分系统22 评估活体动物手术结果的效率,评分为 0.5 作为纳入标准。可以使用 Iba1 免疫染色进一步确认脑损伤,即使在轻微的局灶性损伤后,Iba1 免疫染色也对脑损伤非常敏感。
总之,重要的是要记住 VCI 是一个复杂的术语,它将许多临床表现和原因统一在同一保护伞下。因此,研究人员应始终牢记应该根据他们想要研究的 VCI 方面选择哪种模型。永远不可能有一个适用于所有 VCI 表现的单一通用模型。CCA 狭窄模型严重限制了来自大动脉的血流,因此类似于动脉硬化性狭窄患者。在 C57BL/6J 小鼠中创建不对称 BCAS 的新型针头方法是模拟 VCID 的可靠方法,与以前报道的方法相比,它具有多项优势(特别是高灵活性、低死亡率、长期结果、最低成本和实时 MRI 监测)。由于它优于其他模型,它可用于进一步推进我们对 VCID 进展的了解,并作为筛选潜在治疗剂以治愈或减缓 VCID 进展的基础。与其他报道的 BCAS 方法类似,针头模型需要先进的手术技能,这些技能可以随着时间的推移而掌握,以此视觉演示为指导。
披露声明
作者没有需要披露的利益冲突。
致谢
该项目得到了美国国立卫生研究院/NINDS 赠款 RF1NS117509 (G. Cao) 和 VA Merit Review 赠款 BX003923 和 BX006454 (G. Cao) 的支持。
材料
| Name | Company | Catalog Number | Comments |
| 1 mL syringe | BD | 309659 | IP injection of ketoprofen |
| 2.5 mm blunt retractor tips | Kent Scientific Corporation | SURGI-5016-2 | 2 needed |
| Andis Ion T-Blade Pet Trimmer | Andis | BTF3 | To shave fur |
| Betadine Solution | Avrio Health L.P. | NDC 67618-150-17 | |
| Braided silk suture, 5-0 | Teleflex Medical | 106-S | For suturing skin |
| Braided silk suture, 7-0 | Teleflex Medical | 103-S | For ligating CCAs |
| Camera | Med Associates, Inc | VID-CAM-MONO-7 | For model validation |
| cover glass | Fisherbrand | 12-541-012 | For model validation |
| cresyl violet | Thermo Scientific | C581-25 | For model validation |
| Dispensing Tip, Needle, Flex, 34 Gauge, 1/4" OAL | Jensen Global | JG34-0.25HPX | For the left CCA |
| DSIStudio | https://dsi-studio.labsolver.org; for DTI data analysis | ||
| Dumont Tweezers; Pattern #1 | Roboz Surgical Instrument Co | RS-4960 | 2 needed |
| Dumont Tweezers; Pattern #5, 45 Degree Angle | Roboz Surgical Instrument Co | RS-5058 | 2 needed |
| Ethanol | Fisher Scientific | 64-17-5 | Dilute to 70% |
| ethylene glycol | Thermo Scientific | E178-4 | For model validation |
| Eye Needle, Size #4; 3/8 Circle, Cutting Edge, 11 mm Chord Length | Roboz Surgical Instrument Co | RS-7981-4 | For suturing skin |
| E-Z Anesthesia Classic System | E-Z systems | EZ-7000 | |
| glycerol | Thermo Scientific | AAA16205AP | For model validation |
| Homeothermic Monitoring System | Harvard Bioscience | K 022258 | |
| Imaging system EVOS FL Auto | Life Technologies | AMAFD2000 | For model validation |
| Isoflurane | Covetrus | 11695-6777-2 | |
| Ketoprofen | Zoetis | 5487 | |
| Leica M320 F12 clinic and surgery microscope | Leica | M320 F12 | |
| Lidocaine and Prilocaine Cream, USP 2.5%/2.5% | Padagis | NDC 0574-2042-30 | Generic to EMLA cream |
| lithium carbonate | Thermo Scientific | L119-500 | For model validation |
| Luxol fast blue | Thermo Scientific | AC212170250 | For model validation |
| microscope slides | Fisherbrand | 12-550-403 | For model validation |
| Microtome | Leica | SM2010R | For model validation |
| Morris Water Maze with the hidden platform | Maze Engineers | https://maze.conductscience.com/portfolio/morris-water-maze/ | |
| M-Prove Portable Balance | Sartorius | AY711 | Scales for weiging the mouse |
| MRI with ParaVision 6.0.1 | Bruker | AV3HD 9.4T | For model validation |
| Multi gas flow meter | Aalborg Instruments | GMR2-010334 | for low flow rate gas blending (N2O and O2) |
| Nano Ultra Fine Pen Needles - 32G 4mm | BD | 58320883 | For the right CCA |
| O.C.T. | Thermo Scientific | 23-730-571 | For model validation |
| Paraformaldehyde, 4% | Thermo Scientific | J61899.AK | For model validation |
| PBS | Thermo Scientific | BP399500 | For model validation |
| PeriCam PSI System with Aperiflux probe holder | Perimed Inc | PeriCam PSI HR | For model validation |
| permount | Thermo Scientific | SP15-100 | For model validation |
| Round Handle Forceps; Micro Suturing With Tying Platform; Curved | Roboz Surgical Instrument Co | RS-5264 | To help with cutting and suturing the skin |
| Small Animal Heat Lamp, 75 Watt | Morganville Scientific | HL0100 | For model validation |
| Small cotton-tipped applicators | Fisher Scientific | 23-400-118 | |
| Spring Scissors - 8mm Cutting Edge | Fine Science tools | 15024-10 | |
| Student Halsey Needle Holder | Fine Science tools | 91201-13 | 3 needed: 2 for holding skin retractors and 1 for suturing the skin |
| Sucrose | Thermo Scientific | A15583.36 | For model validation |
| Universal Camera Ceiling Mount | Med Associates, Inc | ENV-598 | For model validation |
| water bath | VWR | 89032-226 | For model validation |
参考文献
- Tuo, Q. Z., Zou, J. J., Lei, P. Rodent models of vascular cognitive impairment. J Mol Neurosci. 71 (5), 1-12 (2021).
- Zhou, Z., et al. Deeper cerebral hypoperfusion leads to spatial cognitive impairment in mice. Stroke Vasc Neurol. 7 (6), 527-533 (2022).
- Shibata, M., Ohtani, R., Ihara, M., Tomimoto, H. White matter lesions and glial activation in a novel mouse model of chronic cerebral hypoperfusion. Stroke. 35 (11), 2598-2603 (2004).
- Hattori, Y., et al. A novel mouse model of subcortical infarcts with dementia. J Neurosci. 35 (9), 3915-3928 (2015).
- Janson, J., et al. Increased risk of type 2 diabetes in Alzheimer disease. Diabetes. 53 (2), 474-481 (2004).
- Herzig, M. C., et al. Abeta is targeted to the vasculature in a mouse model of hereditary cerebral hemorrhage with amyloidosis. Nat Neurosci. 7 (9), 954-960 (2004).
- Miao, J., et al. Cerebral microvascular amyloid beta protein deposition induces vascular degeneration and neuroinflammation in transgenic mice expressing human vasculotropic mutant amyloid beta precursor protein. Am J Pathol. 167 (2), 505-515 (2005).
- Moechars, D., et al. Early phenotypic changes in transgenic mice that overexpress different mutants of amyloid precursor protein in brain. J Biol Chem. 274 (10), 6483-6492 (1999).
- Wallays, G., et al. Notch3 Arg170Cys knock-in mice display pathologic and clinical features of the neurovascular disorder cerebral autosomal dominant arteriopathy with subcortical infarcts and leukoencephalopathy. Arterioscler Thromb Vasc Biol. 31 (12), 2881-2888 (2011).
- Cognat, E., Cleophax, S., Domenga-Denier, V., Joutel, A. Early white matter changes in CADASIL: evidence of segmental intramyelinic oedema in a pre-clinical mouse model. Acta Neuropathol Commun. 2, 49 (2014).
- Weng, Z., et al. A novel needle mouse model of vascular cognitive impairment and dementia. J Neurosci. 43 (44), 7351-7360 (2023).
- Biesbroek, J. M., Biessels, G. J. Diagnosing vascular cognitive impairment: Current challenges and future perspectives. Int J Stroke. 18 (1), 36-43 (2023).
- Winklewski, P. J., et al. Understanding the physiopathology behind axial and radial diffusivity changes-what do we know. Front Neurol. 9, 92 (2018).
- Jing, Z., et al. Neuronal NAMPT is released after cerebral ischemia and protects against white matter injury. J Cereb Blood Flow Metab. 34 (10), 1613-1621 (2014).
- Yang, S. T., et al. Adult mouse venous hypertension model: common carotid artery to external jugular vein anastomosis. J Vis Exp. (95), e50472 (2015).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Lee, D., et al. A murine model of ischemic retinal injury induced by transient bilateral common carotid artery occlusion. J Vis Exp. (165), (2020).
- Schleimer, K., et al. Training a sophisticated microsurgical technique: interposition of external jugular vein graft in the common carotid artery in rats. J Vis Exp. (69), e4124 (2012).
- Speetzen, L. J., Endres, M., Kunz, A. Bilateral common carotid artery occlusion as an adequate preconditioning stimulus to induce early ischemic tolerance to focal cerebral ischemia. J Vis Exp. (75), e4387 (2013).
- Barone, F. C., Knudsen, D. J., Nelson, A. H., Feuerstein, G. Z., Willette, R. N. Mouse strain differences in susceptibility to cerebral ischemia are related to cerebral vascular anatomy. J Cereb Blood Flow Metab. 13 (4), 683-692 (1993).
- Wellons, J. C., et al. A comparison of strain-related susceptibility in two murine recovery models of global cerebral ischemia. Brain Res. 868 (1), 14-21 (2000).
- Cao, G., et al. In Vivo delivery of a Bcl-xL fusion protein containing the TAT protein transduction domain protects against ischemic brain injury and neuronal apoptosis. J Neurosci. 22 (13), 5423-5431 (2002).
转载和许可
请求许可使用此 JoVE 文章的文本或图形
请求许可探索更多文章
This article has been published
Video Coming Soon
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。