血液采集 I
Overview
来源: 凯斯图尔特, RVT, RLATG, CMAR;瓦莱丽. 施罗德, RVT, RLATG。圣母大学
血液收集是一个共同的要求, 研究研究, 涉及老鼠和老鼠。小鼠和大鼠的血液提取方法取决于所需的血液体积、取样的频率、被放血的动物的健康状况以及技术员的技术水平。1所讨论的所有方法--向后眶窦出血、初始尾剪出血和心内出血--需要使用全身麻醉。
Principles
在出血过程之前, 必须确定所需样品的类型。实验程序可能需要全血、血浆或血清。对于全血, 必须在样品中加入抗凝剂。血浆, 其中含有纤维蛋白原和其他凝血因子, 当与红细胞分离, 可以从一个抗凝样本提取。血清是通过血液采集而获得的, 没有抗凝血。一旦血块形成, 血清就会从样品的离心中产生。由于样品已凝结, 血清不会含有纤维蛋白原或其他凝血因子。血浆和血清都是通过使用离心机运行在 2200-2500 RPM 至少15分钟。
对于必须产生全血或血浆的样品, 必须使用适当的抗凝剂。实验室动物常用的抗凝剂是肝素、柠檬酸钠和乙二胺乙酸酸 (EDTA);选择的依据是研究的需要。封存--EDTA、肝素和枸橼酸钠的液体形式--可以直接装入注射器以涂上表面。这就可以直接接触抗凝血的血液被绘制, 协助预防凝血。由于鼠血凝块比大多数哺乳动物的血液凝结得快, 因此必须将抗凝血的正确比例用于血液采集。
针的选择依据的是动物的大小和穿刺部位。一般而言, 针头的孔径越大, 样品收集起来就越迅速。对更大的针头来说, 减少对血液细胞的伤害是另一个好处。然而, 大口径针头的主要缺点是对容器的潜在损害。对小鼠和大鼠, 大小的选择范围从20-29 口径针, 是 0.5-1.5 英寸的长度。如果针头太长, 不仅使用起来很笨拙, 而且在针头上有多余的空间会导致凝固。"过程" 部分中的每个方法都列出了适当的针大小。
所需样本的大小也必须预先确定。由于小老鼠或老鼠的大小, 血液收集的最大数量必须计算为生存出血。每只体重25克的小鼠总血容量为1.8 毫升;平均体重250克的鼠总血容量为16毫升。对于没有液体置换的小鼠或大鼠的单个血液样本, 可以安全去除的最大血容量是总血量的 10%, 或 7.7-8 µl/克。 因而为一个平均老鼠, 10% 它的血液容量是193-200 µl。对于250克的平均鼠来说, 这相当于 1.9-2.0 毫升. 研究表明, 去除超过15% 的血容量会引起休克休克。12然而, 随着体液置换, 多达15% 的总血容量-或12µl/克-可以删除。对于25克鼠标, 这相当于300µl;对于一个250克大鼠, 它相当于3毫升。对于流体置换, 液体应加热, 并给予皮下注射。
如果有必要采取多样本, 血液体积绘制减少。每周可抽取的最大血量不超过总血量的 7.5%, 或6µl/克。 对于一个25克鼠标, 这相当于每星期145-150 µl。对于一个250克大鼠, 这相当于 1.45-1. 50 毫升每星期。 如果取样将每2周发生一次, 则可抽取10% 的总血容量 (8 µl/克)。这相当于200µl 每2周的平均鼠标, 和2.00 毫升每2周为250克鼠。一项对平均重量为250克的大鼠进行的一项研究显示, 当血液的15-20% 被移除时, 血液水平的正常化需要超过29天的时间。12对于重复的血液收集, 液体替换不允许更大的血液容量或更频繁的血液汇集, 因为它只替换容量。这只动物需要时间补充血液细胞。
使用回溯式眶丛是过去常见的做法。然而, 对这一程序的仁爱的许多关注已经出现。在手术过程中, 红细胞压积管的过度运动一旦放置在眼睛的内侧眼角, 就会对周围组织造成损伤, 导致眼睑和/或结膜膜肿胀。肿胀的组织可导致眼球凸出足够远, 使眼睑闭合受阻, 可能导致角膜干燥和损伤。肿胀的疼痛会引起抓挠和自残, 导致眼球摘除。不正确放置红细胞压积管在一个复古眶出血可以切断视神经, 导致失明。如果红细胞压积管是在一个不适当的角度推进, 眼睛可以被迫离开轨道, 让眼睑落在眼球后面。如果出现这种情况, 则很难将眼睛正确地替换到插槽中。其他可能出现的问题包括: 对脆弱的轨道骨骼的破裂, 眼球球体的穿透, 导致玻璃体液的丧失, 或者眼睛后面的血肿形成, 由于眼睛和周围的压力, 会导致极度疼痛。结构.尽管所有这些问题, 如果一个熟练的技术员执行的程序和动物完全麻醉与一般麻醉, 如异氟醚吸入麻醉, 复古眼眶出血已证明是一种有效的方法的血液收集啮齿目动物。
在小鼠和老鼠之间, 眶区的解剖结构是不同的。老鼠有一个复古的眼窝窦-一个收集的血管, 创造了一个鼻窦在轨道区域。在鼠眼的眼眶里, 有一丛血管在那眼后面流动;然而, 它们并不像老鼠那样形成一个窦。因此, 对小鼠进行这一过程比较容易。对于重复采样收集通过回溯轨道丛, 至少10天之间的出血是需要的, 使该地区的组织愈合。虽然一般麻醉建议, 该程序可以执行的小鼠没有全身麻醉, 如果一个局部眼科麻醉, 如丙或丁卡因, 是在程序之前应用。由于大鼠没有逆行眶窦, 而且由于其周围的薄膜的轨道更强, 因此必须麻醉它们。
使用尾夹法可以获得小体积的串口样品。尾巴的最初截肢必须限制在尾巴尖端, 大约 0.5-1.0 毫米长的小鼠和2.0 毫米的大鼠。1通过将原始切口的痂或血块阻断到尾部的尾部, 可以进行血液采集的尾剪程序。一般情况下, 附加的尾端截肢是不必要的。收集的血量范围从20-100 µL 的小鼠和75-150 µL 的大鼠。收集到的数量在动物之间是可变的, 并且可以受年龄、健康状况和体重的影响。
从尾部切片收集的样本可以同时包含动脉和静脉血, 以及组织产品的污染。如果尾巴被抚摸或 "挤奶" 以获得更多的血液, 样品质量就会降低。为了增加血液流量, 可以用热敷、加热灯或在温水中浸泡尾部来加热。应将压力应用于尾部止血, 每5-10 分钟检查一次动物, 以确保止血效果。止血常因反复取样而延迟。止血粉可用于止血。对于最初的截肢, 建议麻醉 (一般或局部)。随后的出血不应要求麻醉, 特别是当动物习惯于程序。麻醉会导致血压下降, 使血液收集与此技术困难。
尾巴剪的另一种选择是尾巴船尼克。这一过程很容易在老鼠和小鼠身上进行。然而, 与尾巴剪, 样品可能被污染与组织产品, 特别是在老鼠。对于大鼠, 皮下注射针头插入血管, 血液从针的中心收集。一项研究显示, 在穿刺部位上方放置止血带, 以帮助血液收集。3注射器不用于抽取血管中的血液, 因为注射器产生的压力会使血管坍塌。这种方法也可以用于连续取样, 因为血块可以被移除, 从而导致站点再次出血。与尾部剪, 这是当务之急, 以确保止血的应用压力, 对现场和复核的动物每5-10 分钟。
通常, 研究需要一个 nonsurvival, 大的血液样本, 通过失血通过心腔出血或尾静脉静脉收集。4心脏穿刺可以从老鼠或大鼠身上采集到总血量的大约一半。这相当于40µl/克或大约1毫升的平均25克鼠标。250克老鼠会产生大约10毫升的血液。动物必须被麻醉为失血。吸入麻醉或 CO2麻醉可由熟练技师使用;注射麻醉也可以使用。然而, 血压和血液循环可能减少, 这可能会减少血液的采集量。
尾腔静脉法要求对动物进行深度麻醉, 以手术暴露血管。CO2麻醉是不够的, 因为心脏必须跳动和动物呼吸在血液撤退。在手术过程中, 抽血速度过快会导致血管塌陷, 咬合, 防止血液收集。此外, 船只的墙壁是薄的, 因此, 必须避免手和针的运动, 以防止从针进入现场的血液破裂或泄漏。由于针不是通过皮肤, 这种方法导致收集一个无菌样品。必须采用辅助安乐死的方法, 以确保动物不会从麻醉中恢复。这种方法通常是心脏或主动脉灌注后。
心腔方法可在被麻醉 (闭合方法) 的动物中进行人工约束, 或者根据骶管静脉采血方法 (open 方法) 的规定, 对心脏进行手术暴露。对于封闭的方法, 针放置的标志是在剑过程中的肋骨笼形成的凹槽, 在动物的左侧。
Procedure
1. 复古眶出血
- 设备
- 准备一个钟罐, 或麻醉诱导室, 以管理麻醉气体, 如异氟醚。使用铃罐时, 液体麻醉剂必须与动物接触, 避免通过皮肤吸收。可以使用具有小孔的平台。
- Microhematocrit 管, 持有50-75 升是首选。聚酯薄膜缠绕管不太可能打破的手指之间的运营商, 并应考虑作为一个安全措施。
- 在工作表面放置一些纸巾厚度或其他绝缘材料, 以保持动物的体温在过程中。
- 动物的准备和定位
- 该动物用吸入麻醉剂, 如异氟醚, 在钟罐或气体麻醉感应室中麻醉, 效果。
- 一旦该动物完全麻醉, 它被删除, 并放置在侧卧床。
- 眼睛是突出的, 把手指放在头顶上, 沿着下颌, 并拉动皮肤的背部和向下。
- 避免对气管施加压力, 因为这可能会使气道塌陷或咬合窒息导致死亡。
- 血液撤退
- microhematocrit 被放置在眼睛的内侧眼角, 并从鼻子的平面30-45°的角度引导尾。
- 在轻轻旋转红细胞压积管时施加压力。这将切割通过结膜膜和破裂的眼丛。
- 血液会通过毛细管作用流入红细胞压积管。
- 避免推得太深, 以至于你在眼球的后部打到了骨头。
- 一旦血液开始流动, 保持压力保持眼睛凸出。
- 要收集多管的血液, 就不必把下一根管子放到眼丛中, 因为血液会继续流动, 并且可以从内侧眼角流出来采集。
- 停止流血, 释放皮肤, 让眼睛回到正常的位置。将压力施加到轨道上以确保止血。
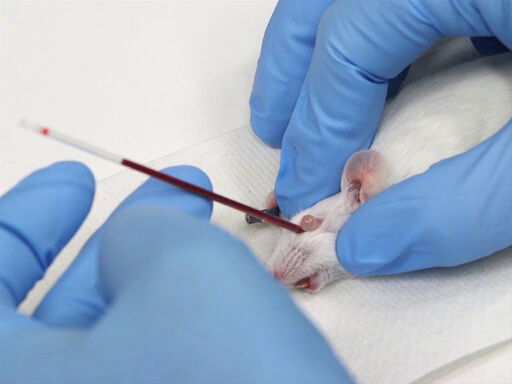
图1。小鼠眶内退血。
2. 尾部出血程序: 尾剪和尾尼克
- 设备
- 一个无菌手术刀刀片, 最好是一个数字11刀片或一个单面刀片, 是用来做初步截肢的尾巴剪法。剪刀不应使用, 因为剪刀的切割是粉碎, 从而促进凝结和减少血液流动。对于尾部尼克程序, 一个数字11或15手术刀刀片是用来做切割。
- 一个限制管, 允许进入鼠标的尾巴准备。
- 吸水纸巾或纱布用作执行尾剪的基板。
- 收集管或红细胞压积管也需要。
- 止血粉应可用于止血。
- 克制
- 动物被放进管子里, 这样尾巴就可以进入。对于布鲁姆型位, 动物先将臀部拉入试管。对于其他管子, 动物先放头。
- 动物被固定在管子里, 这样它们就不能掉头或撤回尾巴。
- 一些老鼠会允许尾巴剪和血液收集, 如果允许它们抓取粗糙的表面, 那么它们将会受到最小的人工约束。
- 一些老鼠会需要吸入麻醉这种方法的血液收集。
- 血液撤退
- 用温水擦拭尾巴, 去除碎片, 造成轻微的血管舒张。不要使用热水。
- 为尾巴剪, 尾巴是延长的, 并且尾巴的非常末端 (0.5-1 毫米为老鼠和至多2毫米为老鼠) 用手术刀刀片切开。
- 为尾巴尼克, 尾巴是延长的, 并且切口用手术刀刀片大约2/3 距离从臀部, 直接地在侧向尾巴静脉。
- 尾巴可以从臀部到鼻尖, 以鼓励血液流动;然而, 这将降低样品的质量。
- 血液是从尖端或尼克收集的, 使用红细胞压积管或允许滴入收集瓶。
3. 心血采集
- 设备
- 对于鼠标, 3 毫升注射器与22-25 口径 x 1 "针是首选。较小的注射器没有相同的背压, 可以使血液退出更困难。小于25的针头限制了血液的流动, 导致血细胞的凝结和损伤增加。针短于 1 "可能不会达到心脏的水平时, 从隔膜接近。
- 对于大鼠, 10-12 毫升注射器与18口径 x 1.5 "针是首选。根据大鼠的大小, 一个较小的注射器可能无法容纳整个血容量被收集, 因此注射器将不得不改变过程中。小于20口径的针头限制血液的流动, 导致血栓的增加。针短于 1.5 "可能不会达到心脏的水平时, 从隔膜接近。
- 一个足够大小的采血管用来收集血液。
- 克制
- 适当的克制对这种方法的成功至关重要。动物是由颈背持有, 身体垂直悬挂。重要的是, 身体是直的, 以防止心脏的偏转或扭曲的胸部。
- 一个替代的位置是背部卧床时, 放置在动物的左侧肋骨之间的针。这是特别有用的大鼠或当多个动物将流血。
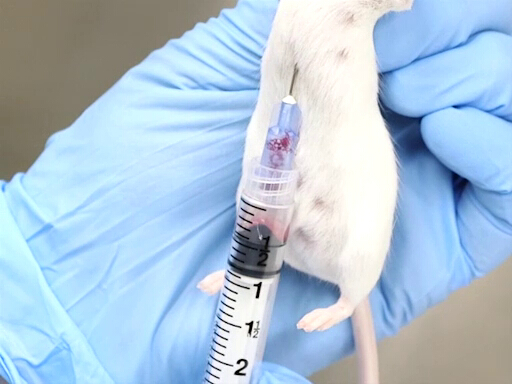
图2。用小鼠垂直保持心脏血退。
- 血液撤退
- 从后部的方法, 穿刺膈更容易完成时, 鼠标或大鼠是垂直举行的颈背。
- 针是先进的凹槽刚刚在动物的剑的左侧。
- 针应该平行于脊柱, 放在肋骨下面。
- 心脏近似地位于手肘的水平。
- 把针放在胸前, 刺穿心脏。
- 使用注射器轻微的背压。如果针在心脏, 血液将流入注射器。
- 等待, 直到血液填补了注射器之前增加额外的背部压力注射器。
- 从动物左侧的侧方方法需要将动物定位在背卧床。
- 入口点是根据胸壁上肘的点来测量的。心脏近似地位于手肘的水平。
- 针插入垂直于表的平面在一个点上, 在胸壁上作为测量 dorsoventrally。
- 把针放在胸前, 刺穿心脏。
- 使用注射器轻微的背压。如果针在心脏, 血液将流入注射器。
- 等待, 直到血液填补了注射器前增加额外的压力, 注射器。
- 从后部的方法, 穿刺膈更容易完成时, 鼠标或大鼠是垂直举行的颈背。
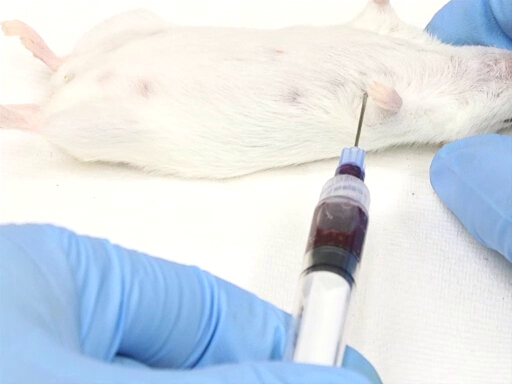
图3。用小鼠在背卧床位置取出心脏血。
- 技术提示
- 正常的心脏是位于与尖顶指向左边。在罕见的情况下, 心脏可能被逆转, 导致困难刺穿心脏。
- 注射器的过度背压可能会使心脏塌陷, 咬合针锥并阻止血液流向注射器。
- 应用背压并反复释放会在注射器中引发凝固。
- 轻轻地将压力施加到肝脏可以迫使血液进入循环系统, 使其可供提取。
4. 后腔静脉血退
- 设备
- 使用25-29 口径针头的 TB 注射器用于在老鼠身上采集血液。对于大鼠, 10-12 毫升注射器与22-25 口径 x 1 "针是必需的。
- 手术平台, 解剖托盘, 或其他表面, 以确保动物是需要的, 连同领带, 磁带, 或针, 以固定四肢的位置。
- 注射麻醉或吸入麻醉是必要的。如果使用吸入麻醉, 这是可取的麻醉是通过一个精密的汽化器与鼻锥。程序长度是这样的, 使用感应室没有额外的麻醉气体交付将不会提供足够的时间来完成的血液撤退之前, 动物苏醒。
- 虹膜剪刀为鼠标, 或手术室尖锐钝剪刀为大鼠, 是必需的, 连同小创伤拇指钳, 和一个 2 "x 2" 纱布海绵。
- 克制
- 当动物被完全麻醉时, 由脚趾捏或尾捏决定, 动物被放置在背卧床。
- 用胶带或大头针将四肢固定在平台上。四肢应延长远离身体。
- 撤出
- 皮肤被解除, 一个小的横向削减是通过皮肤略高于骨盆以上的女性, 或略高于男性包皮。
- 剪刀的点被放进切口, 中线切开是通过皮肤从骨盆/包皮到剑。
- 皮肤在侧面被反射到每边。钝性剥离可能是必要的, 以放松它的基础肌肉。
- 肌肉被解除, 和一个小的横向削减是通过肌肉刚刚在皮肤切割。
- 剪刀的点放在腹部, 中线切口通过肌肉剑。一定要把剪刀的角度向上角, 以避免切割任何器官。
- 沿两侧肋骨的曲线横向切割。要格外小心, 不要刺穿肝脏。
- 轻轻地将肠道移到动物的左侧, 露出后腔静脉。
- 将纱布垫放在肝脏上, 并将食指和中指放在肝脏上。
- 用另一只手插入针, 向上斜角, 进入肾血管交界处与髂分岔之间的腔静脉。
- 在肝脏上施加压力时, 慢慢地取出血液。
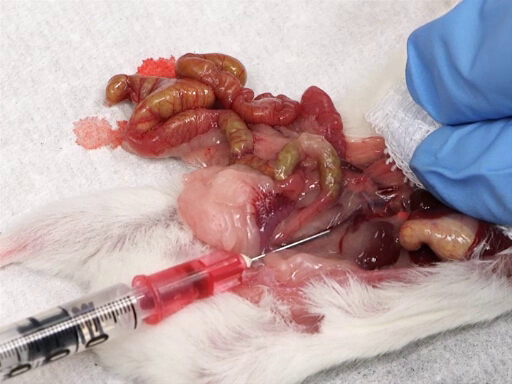
图4。从后腔静脉取出血。
Application and Summary
小鼠和老鼠的血液收集可以通过多种技术来完成。虽然许多因素, 如样本大小, 抽样频率, 以及动物的大小和年龄影响这一点, 最重要的组成部分是技能水平的技术员执行样本收集。 对于这里描述的方法, 正确使用麻醉剂对质量样品和动物的福祉也是至关重要的。
References
- Guidelines for the survival bleeding of mice and rats. 2010.
- Diehl, K.H., Hull, R., Morton, D., Pfister, R., Rabemampianina, Y., Smith, D., Vidal, J.M., and van de Vorstenbosch, C. 2001. A good practical guide to the administration of substances and removal of blood, including routes and volumes. Journal of Applied Toxicology. 21. 15-23.
- Omaye, S.T., Skala, J.H., Gretz, M.D., Schaus, E.E., and Wade, C.E. 1987. Simple method for bleeding the unanaesthetized rat by tail venipuncture. Laboratory Animals. 21. 261-264.
- Adeghe, A.J-H. and Cohen, J. 1986. A better method for terminal bleeding of mice. Laboratory Animals. 20. 70-72.
Tags
版权所属 © 2025 MyJoVE 公司版权所有,本公司不涉及任何医疗业务和医疗服务。