Method Article
Automatisierte Hochdurchsatz-Analysen in Behavioral Zebrafischlarven
In diesem Artikel
Zusammenfassung
Unser Labor eine neuartige automatisiertes Hochdurchsatz-Bildgebungssystem, die nützlich für die Detektion von verschiedenen Verhaltensweisen in 7 Tage alten Larven Zebrafisch ist. Das System kann zum Erfassen geringfügige Änderungen im Verhalten nach der Larven für Umweltgifte oder Arzneimitteln ausgesetzt wurden verwendet werden.
Zusammenfassung
Wir haben eine neue High-Throughput-Bildgebungssystem für die Analyse des Verhaltens erstellt in 7 Tage alten Zebrafischlarven in mehrspurigen Platten. Das System misst spontane Verhalten und die Reaktion auf einen unangenehmen Reiz, der zu den Larven als PowerPoint-Präsentation gezeigt. Die aufgenommenen Bilder werden mit einem ImageJ Makro, das automatisch spaltet die Farbkanäle analysiert, subtrahiert den Hintergrund, und eine Schwelle zu einzelnen Larven Platzierung in den Gassen zu identifizieren. Wir können dann importieren Sie die Koordinaten in einer Excel-Tabelle zu schwimmen Geschwindigkeit, Vorliebe für Rand oder an der Seite der Fahrspur, ruht Verhalten, Thigmotaxis, Abstand zwischen den Larven und Vermeidungsverhalten zu quantifizieren. Subtile Veränderungen im Verhalten sind leicht zu erkennen mit unserem System, so dass es nützlich für Verhaltens-Analysen nach der Einwirkung von Umweltgiften oder Arzneimitteln.
Einleitung
Zebrafische sind immer ein beliebtes Modell für genetische, Entwicklungs-und Verhaltenswissenschaften 1-4. Sie schlüpfen aus ihren Chorions von 2-3 Tagen nach der Befruchtung (DPF), entwickeln voll funktionsfähige Organe von 4-5 dpf, und weisen eine Vielzahl von Verhaltensweisen, die von 7 dpf 5,6. Zebrafisch-Larven sind ideal geeignet für High-Throughput-Analysen aufgrund ihrer geringen Größe 7,8 geeignet. Software ist im Handel erhältlich für die automatisierte Analyse von Verhalten in Larven und erwachsenen Zebrafisch 9-14. Jedoch kann diese Software teuer und hat begrenzte Möglichkeiten zur Messung komplexes Verhalten von Zebrafisch-Larven in Multiwell-Platten.
Wir haben eine neue High-Throughput-Bildgebungssystem, die kostengünstig zu installieren und kann eine Reihe von verschiedenen Verhaltensweisen in 7 dpf Zebrafischlarven 15,16 quantifizieren. Das System ermöglicht es uns, schnell und effizient testen subtile Verhaltensauffälligkeiten nach embryonale Exposition gegenüber einer Reihe vonPharma-und Umweltgifte 16-18.
Das System wurde mit Hilfe Holzschränke, die Haus eine digitale Kamera an der Oberseite des Gehäuses. Die Kamera weist nach unten zum Boden des Gehäuses, wo ein Laptop mit dem Bildschirm nach oben 15 angeordnet ist. Zeitraffer-Aufnahme verwendet wird, um die Platzierung der Larven in die Gassen zu erfassen. Larven können in untergebracht werden bis zu vier Multi-Well-oder multi-lane Platten, die oben auf dem Laptop-Bildschirm positioniert werden. Wir verwenden eine PowerPoint-Präsentation als aversiven Reiz auf die sich die Larven durch eine Abkehr (Vermeidung) und schwimmen auf der Kante (Thigmotaxis) 15,17 reagieren. Die Bilder werden in ImageJ importiert, in dem eine automatisierte Makro verwendet wird, um die Farbkanäle aufgeteilt, subtrahieren Sie den Hintergrund, und eine Schwelle zu einzelnen Larven zu identifizieren. Koordinaten werden für jede Larve in jedem Bild aufgeführt und können in eine Excel-Datei, die wir verwenden, um die Vermeidung und thigmota quantifizieren eingefügt werdenxis Verhalten, Fisch zu Fisch Distanz schwimmen Geschwindigkeit und Menge der Ruhe 16.
Protokoll
1. Sammlung von Zebrafisch Embryonen und Larven Raising
- Glass Pyrex Gerichte mit "fake" Gras (aus grünem Garn) (Abbildung 1) sollte in die Tanks in der Dämmerung eingesetzt und links in zwei Stunden, um Zebrafischembryonen sammeln. Die Glasschalen mit den Embryonen sollte über einen Handheld-Sieb gegossen und mit entionisiertem Wasser gespült. Die Embryos sollen dann in Ei Wasser angebaut werden. Das Ei Wasser enthält 60 mg / l Instant Ocean in entionisiertem Wasser und 0,25 mg / l Methylenblau, die als Form-Inhibitor verwendet wird.
- Abhängig von der Hypothese der einzelnen Experiment können Embryonen sofort oder während bestimmter Phasen der Entwicklung mit Giftstoffen oder Pharmazeutika behandelt werden. Die Giftstoffe und Arzneimittel sind in der Regel in DMSO gelöst (bei 1.000 X-Konzentration) und sollte weiter verdünnt werden direkt in das Ei Wasser Medium.
- Während der Embryonalentwicklung und Larven Behandlung mit Arzneimitteln oder Giftstoffs, können die Larven und Embryonen in Petrischalen tief bei einer Dichte von etwa 50-60 Larven pro 50 ml werden bis zu den Verhaltens-Analysen bei 7 dpf (Ei-Wasser-Lösung sollte geändert werden mindestens jeden zweiten Tag zu Pilz / Bakterienwachstum zu vermeiden untergebracht von toten Embryonen).
2. Vorbereiten Formen für Behavioral Analysen
- Speziell entwickelte Kunststoff-Formen, die 11.7 cm x 7.6 cm messen x 5 mm wurden in-house individuell gebaut. Die Formen werden benötigt, um die Bahnen unter Verwendung von Agarose in einzelne gut Kunststoffplatten von Thermo Scientific gegossen wird, zu erstellen. Die Single-Well-Platten Maßnahme 12.4 cm x 8.1 cm x 1.2 cm.
- Die Formen enthalten fünf Spuren in dessen Seiten bei 60 ° abgewinkelt sind. Die Spuren in den Formen sind 3,5 mm hoch, mit einer Grundfläche von 18 mm an der Spitze, die die breiteste ist, während die untere Breite beträgt 14 mm. Es ist ein Abstand von 4 mm zwischen den Spuren in der Form (Abbildung 2).
- Zur Herstellung der Bahnen gießen 50 ml geschmolzener Agarose (0,8% Agarose in deionized Wasser mit 60 mg / L Instant Ocean) in einem einzigen Well-Platte. Die Form sollte dann langsam auf das flüssige Agarose auf Blasenbildung beseitigen platziert und entfernt werden können, wenn der Agarose gekühlt werden (das dauert etwa 45 min).
- Die Agarose Gassen sollte frühestens einen Tag vor der Verhaltens-Experiment laufen soll (um die Agarose Austrocknen zu vermeiden) Die Bahnen können bei Raumtemperatur mit den Deckeln auf die Gerichte werden für gespeicherte bis zu etwa 36 Stunden werden. Die Agarose Gassen sind nur für einen Versuch verwendet werden und sollte dann entsorgt werden.
3. Bilderfassung
- Bis zu 20 Larven können in jeder Spur der Platten platziert werden. Typischerweise 5 Larven pro Spur verwendet werden, um die genaue Verfolgung der Schwimmgeschwindigkeit zu erleichtern und die Anzahl der Larven, die pro Versuch benötigt werden, zu reduzieren. Die Bahnen können mit Ei Wasser mit oder ohne Arzneimittel oder Giftstoffe in Abhängigkeit von dem Experiment gefüllt werden. Allerdings sollten Spuren nicht fden ganzen Weg, bis sie in den bildgebenden Schränken platziert illed, dies wird ein Überlaufen zu verhindern. Aus Gründen der Einheitlichkeit sollte die Larven haben eine Eingewöhnungszeit von zehn Minuten, nachdem sie in den Agarose Formen platziert und positioniert auf dem Laptop-Bildschirm. Effizient Bewegen der Larven aus der Petrischale zur Agarose Spur wird dazu beitragen, Larven Stress zu reduzieren. Dies ist am einfachsten, wenn die Larven in flachen Behältern oder Petrischalen untergebracht sind.
- Die Imaging-Schränke gehören eine Canon Digitalkamera für Zeitraffer-Fotografie und einem Laptop verwendet. Die Kamera sollte an der Oberseite des Gehäuses platziert werden und zielte in Richtung der Unterseite des Gehäuses, wo ein 15,6-Zoll-Bildschirm mit Laptop-Bildschirm nach oben (Abbildung 3) platziert werden soll. Vier Platten sollten direkt mit der Hand auf dem Laptop-Bildschirm positioniert werden. Zu dieser Zeit die Bahnen können mit Ei Wasser oder chemische Behandlung aufgefüllt werden, so dass es mit der Spitze der Spur ist (um Schatten an den Rändern des l beseitigenanes in den Bildern).
- Eine PowerPoint-Präsentation als aversiven Reiz für die Larven eingesetzt. In den letzten beweglichen roten Kugeln wurde gezeigt Larven in 6 oder 12 Multiwell-Platten 15,17,18 Zebrafische. Die aktuelle PowerPoint beginnt mit einem leeren weißen Hintergrund für 15 min, 15 min von einer sich bewegenden roten Balken auf der oberen Hälfte der Platte (Abbildung 4). Zur Beseitigung Überhitzung der Larven, ist es am besten, einen Laptop mit einem Bildschirm Temperatur nicht über 28 ° C nicht gehen kaufen Zum Verdampfen der Flüssigkeit innerhalb der Agarose Bahnen zu vermeiden, sollte die maximale Aufnahmezeit auf unter 1 Stunde gehalten werden.
- Die Digitalkamera sollte für Zeitraffer-Fotografie programmiert werden, fotografieren alle 6 sec für eine Gesamtmenge von 300 Bildern pro Experiment. Jedoch kann die Frequenz und Länge eingestellt je nach Experiment und Verhaltensstörungen Quantifizierung werden. In den letzten längeren Aufnahmezeiten beschäftigt waren mit größeren Abständen zwischen den einzelnen Bild. Die Kamerein bei einer niedrigeren Auflösung für die Bildgebung bei Video-Geschwindigkeit (30 Bilder pro Sekunde) eingestellt werden. Während die niedrigere Auflösung begrenzt die Aufnahmen zu einem einzigen Multiwellplatte sind die Videoaufnahmen geeignet für schnelle Bildgebung Schwimmen Ereignisse 15.
4. Bildanalyse
- Die Bilder sollten mit ImageJ geöffnet werden und mit einem Makro, das speziell in-house geschrieben wurde. Das Makro automatisch spaltet die Farbkanäle so dass die rote Farbe entfernt werden können, subtrahiert den Hintergrund, gilt eine Schwelle und identifiziert die Larven durch Partikelanalytik. Die aktuellste Makro für fünf lane Larven Analyse ist Zebrafish_macro25k. Verwenden Sie die Anweisungen in der Makro-auf die Anzahl der Bilder, Farbe subtrahiert werden, Bild Schwelle etc. eingestellt
- Nach all der Bilder durch die ImageJ Makro ausgeführt werden, eine Datei Ergebnisse angezeigt werden und wird x enthalten, y-Koordinaten der einzelnen Larven für jedes Bild zusammen mit dem Bild-Nummer und der Bahn-Nummer.
- Die Ergebnisse Datei sollte in einer Excel-Format gespeichert und sortiert werden basierend auf leere Hintergrund vs bewegenden bar Hintergrund und dann die Nummer gut. Eine Excel-Vorlage zu verwenden, dass hat Gleichungen gebaut in die automatisch bestimmt die Platzierung der Larven in den Vertiefungen, Abstand zwischen den Larven, die Geschwindigkeit der Bewegung und Menge der Ruhe werden. Die aktuelle Excel-Vorlage wird in der 25ib Creton Labor erstellt, die auf Wunsch zur Verfügung. Diagramme zeigen verschiedene Behandlungsgruppen sollten in die Excel-Tabelle zusammen mit t-Tests zum Vergleich zwischen den Behandlungsgruppen und Steuerungen gebaut werden. Weitere statistische Analyse kann unter Verwendung von SPSS werden.
Ergebnisse
In unserer früheren Tests mit dem springenden Ball aversiven Reiz, die unbehandelt sind Wildtyp-Larven reagieren auf die Bewegung Kugel durch Schwimmen in der Mulde (Vermeidungsverhalten) und zu den Rändern des Brunnens (Thigmotaxis Verhalten) 15. Wir haben später bestätigt, dass Thigmotaxis Verhalten in diesem Test ein Maß für Angstverhalten in Zebrafischlarven 17 ist. Es zeigten sich signifikante Unterschiede in den Larven Bewegung weg von der Kugel und Vorlieben für den Rand, wenn die leeren weißen Hintergrund verglichen. Diese Verhaltensweisen sind auch in unserem neuen Test unter Verwendung des beweglichen roten Balken bestätigt worden und sind noch robuster 16. Darüber hinaus können wir jetzt probieren, eine größere Anzahl von Verhaltensweisen in einem einzigen Assay einschließlich schwimmen Geschwindigkeit, Ruhe, Präferenz für das Ende oder der Seite des gut und der Abstand zwischen Fisch (Abbildung 5). Control-Larven im Ei Wasser gewachsen zeigen eine erhöhte Präferenz zu sein, die in der Schale und am Rande der Fahrbahn einerach sie sind mit einem aversiven Reiz (Bewegung roter Balken) dargestellt. Ähnliche Ergebnisse erhält man, wenn Larven im Ei Wasser mit 1 ug / ml DMSO, ein Lösungsmittel, das häufig verwendet wird, um verschiedene Arzneimittel und Giftstoffe wie 1000 X Stammlösungen auflösen angebaut werden.
Repräsentative Ergebnisse sind in Abbildung 5 in Larven mit Ei Wasser und DMSO (als Kontrolle) und verschiedene Konzentrationen eines Organophosphatschädlingsbekämpfungsmittelintoxikation häufig in Nicht-Bio-Lebensmitteln behandelt gezeigt. Die gezeigten Ergebnisse sind ein Sampling von einem Experiment. Wenn jedoch wiederholt, zeigen die Ergebnisse, dass schwimmen Geschwindigkeit und Thigmotaxis Verhalten durch niedrige Konzentrationen von Organophosphatschädlingsbekämpfungsmittel, die Ebenen in der menschlichen Nahrungsaufnahme 18 Mimik verändert wird.

Abbildung 1. Auffangwannen. Glass Pyrex Gerichte werden verwendet, um e zu sammelnmbryos von den Erwachsenen Aquarien. Deckel von den Pyrex Gerichte wurden geschnitten und mit Kunststoff-Gitter und grünen Garn wurde auf den Gittern in der Kunststoff genäht. Dies schafft eine Atmosphäre für die Zucht erwachsenen Zebrafisch durch Nachahmung der natürlichen Umwelt.

Abbildung 2. Kunststoff-Formenbau und Agarose Gassen. A) Die Form wird auf der linken Seite gezeigt. 0,8% Agarose in eine Ein-Well-Platte gegossen, die Form langsam eingeführt und dann entfernt werden, wenn die Agarose abgekühlt B) Die Platte auf der rechten Seite die Gassen in Agarose durch die Kunststoff-Formenbau erstellt zeigt..

Abbildung 3. Imaging Schränke. Imaging Schränke waren specially in unserem Labor gebaut und für High-Throughput-Verhaltens-Analysen. Ein 15-Megapixel-Digitalkamera wurde an die Spitze des Kabinetts nach unten, um Zeitraffer-Bilder der Larven in mehrspurigen Platten oben auf dem Bildschirm eines Laptops platziert sammeln angebracht. Zwischen den Platten und dem Bildschirm befindet sich eine Kunststoffabdeckung, die verwendet werden, um Moiré-Muster in den Bildern gesammelt verhindern.

Abbildung 4. Blank Hintergrund und PowerPoint aversiven Reiz. Dies ist die aktuelle PowerPoint, die verwendet werden, um Verhaltensänderungen in Zebrafischlarven hervorrufen wird. Es bietet robuste Verhaltensunterschiede zwischen a) dem leeren Hintergrund und B) der beweglichen roten Balken.
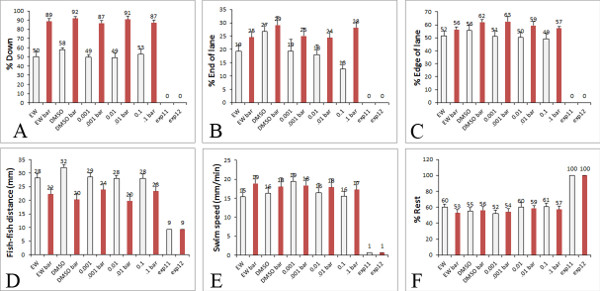
Abbildung 5. Verhalten in der High-Throughput-Assay quantifiziert. Beispiel der Verhaltensweisen, die von unseren Verhaltens-Assay in der Excel-Tabelle, die wir für x, y-Koordinaten der Larven quantifiziert werden. Die weißen Balken zeigen Daten aus Larven ausgesetzt auf eine leere Hintergrund und die roten Balken zeigen Daten aus den Larven ausgesetzt, um die rote bewegliche Stange in der PowerPoint. Die Diagramme zeigen die Messungen, die von der Verhaltensanalyse A) erhaltenen Prozentsatz der Larven untergliedert werden können in der Spur, B) Prozentsatz der Larven am Ende der Gasse, C) Prozentsatz der Larven auf dem Rand der Fahrspur, D) Abstand zwischen Fisch (mm), E) Schwimmen Geschwindigkeit der Larven (mm / min), F) Prozentsatz Rest der Larven. In den Diagrammen werden die Daten aus treatment der Larven mit DMSO Kontrolle und verschiedenen Konzentrationen eines Pestizids im Bereich von 0,001 bis 0,1 um (Level allgemein in der menschlichen Ernährung gefunden). Klicke hier, um eine größere Abbildung anzuzeigen .
Diskussion
Während wir die kontinuierliche Verbesserung sind unsere neuen Verhaltens-Test, war es schon immer für den Nachweis von Vermeidungs-und Thigmotaxis Verhalten in Zebrafischlarven 15 nützlich. Viele Studien wurden durchgeführt, um die Ergebnisse des Assays zu optimieren, wie z. B. Farbe des Stimulus, ideale Anzahl von Larven pro Spur, und die Länge der Verhaltens-Assay. Früher haben wir Multi-Well-Platten (mit 6 oder 12 Wells) 15,17,18. Doch vor kurzem haben wir die neue Form, um eine Spur größer Schwimmen Raum für die Larven ermöglicht es uns, eine größere Anzahl von Verhaltens-Maßnahmen in einem einzigen Assay 16 (Abbildung 5) sammeln erstellen erstellt. Weitere Modifikationen umfassen Variationen der PowerPoint dargestellt (verändert Bewegung oder die Länge der Assay) und die Größe der Bahnen verwendet (wir haben auch Formen für mehr engen Gassen).
Derzeit ist dies automatisiertes Hochdurchsatz-System einzigartig in seiner Fähigkeit, ein breites Spektrum von Verhaltensweisen in zebr messenafish Larven gleichzeitig wie Geschwindigkeit, Vermeidung, Nähe zu anderen Larven und Thigmotaxis in mehrspurigen Platten. Ergebnisse schnell erhalten werden und eine große Anzahl von Larven zum Zeitpunkt erfasst und analysiert werden. Das System ist sowohl kostengünstig zu bauen und schnell und einfach einzurichten. Eine Einschränkung dieses Systems ist, dass 3-D Bewegungen nicht im Zebrafischlarven beurteilt werden. Automatisierte Systeme, die erwachsenen Zebrafisch verfolgen haben die 3-D-Fähigkeit und kann ein breiteres Spektrum von Verhaltensweisen wie Bewegung nach oben oder unten in der Wassersäule 10,19 identifizieren. Eine weitere Einschränkung ist, dass unsere Imaging-System ist derzeit nicht für das Hochdurchsatz-Analysen auf Video Geschwindigkeit optimiert. Video Geschwindigkeit Bildgebung möglich ist, wenn die Einstellung der Kamera auf eine niedrigere Auflösung 15, aber dies schränkt die Analyse auf einer einzigen Platte.
Bei der Verwendung der neu geschaffenen "Spur"-Methode, benötigt mehrere Teile des Tests in einer präzisen Art und Weise ausgeführt werden. Beim Einsetzen der Larven in ter Spuren, ist es entscheidend, um sicherzustellen, dass das Niveau der Flüssigkeit ist sehr flach bis die Platten auf dem Laptop-Bildschirm positioniert sind. Wenn die Bahnen auch mit Flüssigkeit gefüllt sind, werden die Larven in die Peripherie der Platte entweichen kann. Darüber hinaus beim Einsetzen der Form in der Agarose ist darauf zu achten, um die Form sehr langsam verringern. Wenn die Form zu schnell eingeführt wird, werden Blasen in der Agarose bilden und wird durch die Image-J Makro als zusätzliche Larven identifiziert werden. Es wird darauf hingewiesen, dass, wenn die Agarose Fahrspuren sogar ein paar Blasen haben, ist es am besten, um neue zu machen.
In Zukunft möchten wir unsere Verhaltens-Assay zu optimieren, um andere komplexe Verhaltensweisen wie das Lernen in Zebrafisch-Larven zu analysieren und zu prüfen, wie das Lernen durch die Einwirkung von Giften und Arzneimitteln in der frühen Entwicklung beeinträchtigt werden kann. Wir arbeiten derzeit an Tests, die nützlich sein für die Analyse von Lernverhalten in denen die Verhaltens-Ergebnisse erleichtern festzustellen, welche Hirnareale sind, können möglicherweisebeeinflusst durch bestimmte Giftstoffe oder Arzneimittel während der Entwicklung. Automatisierte Tests sind zur Messung von Lernverhalten in Zebrafischlarven 20 und diesen Assays kann für High-Throughput-Screening amendable mit dem robusten Vermeidungsreaktion in multi-lane Platten entwickelt.
Wir schlagen vor, dass dieses Verhalten Assay in zukünftigen Studien konnte zum Testen der Wirkungen auf die Entwicklung einer Vielzahl von Pharma-und Giftstoffe eingesetzt werden. Solche Studien würden eine Fülle von Informationen über spezifische Risikofaktoren bieten und dazu beitragen, die Einstellung besser Gesundheits-und Sicherheitsrichtlinien für schwangere Frauen und Kinder.
Offenlegungen
Die Autoren erklären, dass sie keine finanziellen Interessen haben.
Danksagungen
Wir danken Sean Pelkowski für die Unterstützung bei Optimierung des Verhaltens Assay. Diese Arbeit wurde von der National Institute of Child Health and Human Development, R01 HD060647 und dem National Institute of Environmental Health Sciences, F32 und R03 ES021342 ES017755 unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Reagent | |||
| Instant Ocean | That Pet Place | 198262 | |
| Agarose | Fisher | BP1356-100 | |
| Methylene Blue | That Pet Place | 214325 | |
| Equipment | |||
| One well plates | Fisher | 12-565-493 | |
| Digital camera | Canon | EOS Rebel T1i | |
| Imaging Cabinets | WoodCraft Towers | ||
| Laptops | Acer Aspire | Any is good as long as it has a 15.6 in. LCD screen with 1366 x 768 pixel resolution and a brightness of 220 cd/m2. | |
| Camera Lens | Canon | EF-S 55 - 250 mm f/4.0 - 5.6 IS zoom lens | |
| Plastic diffuser | Pendaflex | 52345 | |
| Software | |||
| PowerPoint 2010 | Microsoft | ||
| ImageJ | NIH | http://rsb.info.nih.gov/ij/ | |
| Excel 2010 | Microsoft | ||
| Statistical software | SPSS 20 | ||
Referenzen
- Gerlai, R., Lahav, M., Guo, S., Rosenthal, A. Drinks like a fish: zebra fish (Danio rerio) as a behavior genetic model to study alcohol effects. Pharmacol. Biochem. Behav. 67, 773-782 (2000).
- Selderslaghs, I. W. T., Hooyberghs, J., De Coen, W., Witters, H. E. Locomotor activity in zebrafish embryos: A new method to assess developmental neurotoxicity. Neurotoxicol. Teratol. 32, 460-471 (2010).
- Norton, W., Bally-Cuif, L. Adult zebrafish as a model organism for behavioural genetics. BMC Neuroscience. 11, 90 (2010).
- Levin, E. D., Cerutti, D., Buccafusco, J. J. Ch. 15. Methods of behavioral analysis in neuroscience. , (2009).
- Kimmel, C., Ballard, W., Kimmel, S., Ullmann, B., Schilling, T. Stages of embryonic development of the zebrafish. Dev. Dyn. , 203-253 (1995).
- Westerfield, M. . The zebrafish book. A guide for the laboratory use of zebrafish (Danio rerio). , (2007).
- Kokel, D., Bryan, J., et al. Rapid behavior-based identification of neuroactive small molecules in the zebrafish. Nat. Chem. Biol. 6, 231-237 (2010).
- Rihel, J., Prober, D. A., et al. Zebrafish Behavioral Profiling Links Drugs to Biological Targets and Rest/Wake Regulation. Science. 327, 348-351 (2010).
- Cachat, J., Stewart, A., et al. Measuring behavioral and endocrine responses to novelty stress in adult zebrafish. Nat. Protoc. 5, 1786-1799 (2010).
- Cachat, J., Stewart, A., et al. Three-Dimensional Neurophenotyping of Adult Zebrafish Behavior. PLoS ONE. 6, e17597 (2011).
- Sledge, D., Yen, J. Critical duration of exposure for developmental chlorpyrifos-induced neurobehavioral toxicity. Neurotoxicol. Teratol. 33, 742-751 (2011).
- Stewart, A., Wu, N. Pharmacological modulation of anxiety-like phenotypes in adult zebrafish behavioral models. Prog. Neuropsychopharmacol. Biol. Psychiatry. 35, 1421-1431 (2011).
- Eddins, D., Cerutti, D., Williams, P., Linney, E., Levin, E. D. Zebrafish provide a sensitive model of persisting neurobehavioral effects of developmental chlorpyrifos exposure: comparison with nicotine and pilocarpine effects and relationship to dopamine deficits. Neurotoxicol. Teratol. 32, 99-108 (2010).
- Emran, F., Rihel, J., Dowling, J. A behavioral assay to measure responsiveness of zebrafish to changes in light intensities. J. Vis. Exp. (20), e923 (2008).
- Pelkowski, S., Kapoor, M., et al. A novel high-throughput imaging system for automated analyses of avoidance behavior in zebrafish larvae. Behav. Brain Res. 223, 135-144 (2011).
- Richendrfer, H., Pelkowski, S., et al. Assessment of developmental toxicity by automated analyses of behavior in zebrafish larvae. Unpublished observations. , (2012).
- Richendrfer, H., Pelkowski, S., Colwill, R. M., Creton, R. On the edge: pharmacological evidence for anxiety-related behavior in zebrafish larvae. Behav. Brain Res. 228, 99-106 (2012).
- Richendrfer, H. A., Pelkowski, S., Colwill, R., Creton, R. Developmental sub-chronic exposure to chlorpyrifos reduces anxiety-related behavior in zebrafish larvae. Neurotoxicol. Teratol. , (2012).
- Egan, R. J., Bergner, C. L., et al. Understanding behavioral and physiological phenotypes of stress and anxiety in zebrafish. Behav. Brain Res. 205, 38-44 (2009).
- Colwill, R., Creton, R., Kalluef, A., Stewart, A. . Zebrafish protocols for neurobehavioral research. 66, (2012).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten