Magnetisch fluoreszierende Bead-basierte Dual-Reporter-Flussanalyse der PDL1-Vaxx-Peptid-Impfstoff-induzierten Antikörperblockade der PD-1/PD-L1-Interaktion
* Diese Autoren haben gleichermaßen beigetragen
In diesem Artikel
Zusammenfassung
Checkpoint-Inhibitoren sind wichtige Angriffspunkte bei der Entwicklung von Therapien für den Kampf gegen Krebs. In diesem Bericht wird ein neuartiger PDL1-Peptid-basierter Krebsimpfstoff, PDL1-Vaxx, vorgestellt, der die neutralisierende Produktion polyklonaler Antikörper induziert, die die Bildung des PD-1/PDL1-Komplexes blockieren. Diese Arbeit beschreibt auch die Entwicklung und Erprobung eines fluoreszierenden Bead-basierten Assays zur Analyse dieser Aktivität.
Zusammenfassung
Die Hemmung von Checkpoint-Rezeptoren (PD-1, PD-L1 und CTLA-4) mit monoklonalen Antikörpern hat in klinischen Studien großen Nutzen für die Behandlung von Krebspatienten gezeigt und ist zu einem wichtigen Ansatz in der modernen Krebsimmuntherapie geworden. Allerdings spricht nur ein Teil der Patienten auf die Checkpoint-Immuntherapie mit monoklonalen Antikörpern an. Daher ist es dringend notwendig, neue therapeutische Strategien gegen Krebs zu entwickeln. Es wurde ein neuartiger B-Zell-Peptid-Epitop-PDL1-Krebsimpfstoff (programmierter Todesligand 1) entwickelt, bei dem die Aminosäuren 130-147 über einen GPSL-Linker an das MVF-Peptid ("promiskuitives" T-Zell-Masernvirus-Fusionsprotein) gebunden sind. Präklinische Tests haben gezeigt, dass dieser PDL1-Impfstoff (PDL1-Vaxx) hochimmunogene Antikörper bei Tieren wirksam stimuliert. Tiere, die mit PDL1-Vaxx immunisiert wurden, zeigten in verschiedenen Tierkrebsmodellen eine reduzierte Tumorlast und verlängerte Überlebensraten. Die Wirkmechanismen deuten darauf hin, dass impfstoffinduzierte Antikörper die Tumorzellproliferation hemmen, Apoptose induzieren und die PD-1/PD-L1-Interaktion blockieren. In diesem Manuskript wird ein magnetischer Bead-basierter Assay vorgestellt, der ein Dual-Reporter-Durchflussanalysesystem verwendet, um die PD-1/PD-L1-Interaktion und ihre Blockade durch die gegen PDL1-Vaxx gebildeten Anti-PDL1-Antikörper zu bewerten.
Einleitung
In den T-Zellen, B-Zellen und intrazellulären Checkpoints des Immunsystems regulieren Signalwege die Immunaktivitäten. Einige Krebszellen schützen sich vor Immunangriffen, indem sie Checkpoint-Ziele stimulieren, die die Immunfunktion hemmen und das neoplastische Überleben und die Proliferation fördern. Die onkologische Immuntherapie durch Checkpoint-Hemmung verwendet Antikörper, um die Signal-Checkpoints zu blockieren und so die anti-neoplastischen Funktionen des Immunsystems wiederherzustellen 1,2,3. Zu den hochwirksamen Krebstherapien gehören derzeit die monoklonalen Antikörper Nivolumab, die auf das programmierte Todesprotein 1 (PD-1)4 abzielen, und Atezolizumab, das auf den programmierten Todesliganden 1 (PD-L1)5 abzielt. Dieser Ansatz hat große klinische Erfolge bei der Behandlung von Krebspatienten gezeigt. Der klinische Nutzen aktueller Checkpoint-Inhibitionsstrategien wird jedoch durch unerwünschte Ereignisse und Behandlungsresistenzen gemindert, insbesondere bei der Monotherapie6. Eine Kombination aus Immuntherapie und wirksameren therapeutischen Strategien mit geringerer Toxizität ist in der Krebsbehandlung dringend erforderlich 1,3,6.
In den letzten 30 Jahren hat das Labor von Dr. Kaumaya Peptid-Krebsimpfstoffe und Peptid-imitierende Wirkstoffe für die Krebstherapie entwickelt, von denen sich einige in laufenden klinischen Studien befinden 1,2,7,8,9,10,11,12,13,14 . So hat beispielsweise B-Vaxx mit HER2-Kombinationsimmuntherapie in klinischen Studien einen Patientennutzen gegen metastasierende und/oder rezidivierende solide Tumore gezeigt12. Die neuesten Krebsimpfstoffe des Labors sind PD1-Vaxx 2,13 und PDL1-Vaxx14, die in präklinischen Studien, insbesondere in der Kombinationstherapie, große Vorteile gezeigt haben. Das PD1-Vaxx hat klinische Studien zur Dosiseskalation in den USA und Australien abgeschlossen. PD1-Vaxx wird in der Phase-1b-Studie, die im Mai 2023 beginnt, mit Atezolizumab kombiniert. Dieser Bericht konzentriert sich auf die Bewertung der Fähigkeit von PDL1-Vaxx-induzierten Antikörpern, die PD-1/PD-L1-Interaktion zu blockieren.
Der PDL1-Vaxx-Krebsimpfstoff ist ein neuartiger B-Zell-Peptid-Epitop-Impfstoff mit PD-L1-Aminosäuren 130-147, der über einen GPSL-Peptid-Linker mit dem promiskuitiven T-Zell-Masernvirus-Fusionspeptid (MVF) verbunden ist. Präklinische Studien haben gezeigt, dass PDL1-Vaxx die Produktion von Anti-Krebs-Antikörpern in verschiedenen Tiermodellen hochgradig immunogen stimuliert, das Überleben verlängert und die Tumorlast reduziert14. Diese Antikörper, die gegen das PD-L1-Peptid gebildet werden, können die PD1/PD-L1-Interaktion erfolgreich blockieren, was zu einer anti-neoplastischen Aktivität führt. In diesem Bericht wird ein Assay vorgestellt, der die Blockade der PD1/PD-L1-Komplexbildung durch PDL1-Vaxx-induzierte Antikörper unter Verwendung eines magnetischen Bead-basierten Formats mit einer Dual-Reporter-Auslesung auf einem Durchflusszytometriegerät analysiert.
Protokoll
1. Experimentelle Vorbereitung
HINWEIS: Die Details aller Reagenzien/Geräte, die in diesem Schritt erwähnt werden, sind in der Materialtabelle aufgeführt.
- Erhalten Sie rekombinantes humanes PD-1 (rhPD-1; Polyhistidin-markiert). Rekonstituieren Sie lyophilisiertes rhPD1 vor Gebrauch mit sterilfiltrierter phosphatgepufferter Kochsalzlösung (PBS), pH 7,4.
- Biotinyliertes rekombinantes humanes PD-L1 (rhPD-L1) erhalten. Rekonstituieren Sie lyophilisiertes rhPD-L1 vor Gebrauch mit sterilem deionisiertem Wasser.
- Besorgen Sie sich Streptavidin-konjugiertes R-Phycoerythrin-Nachweisreagenz (SAPE). Lagern Sie alle SAPE-Lösungen lichtgeschützt bei Kühlschranktemperaturen (d. h. 2-8 °C).
- Besorgen Sie sich fluoreszenzgefärbte magnetische Mikrosphären (6,5 μm Durchmesser, Polystyrol mit eingebettetem Magnetit) und das Bead Coupling Kit15 (falls verwendet, siehe Materialtabelle). Für die kovalente Kopplung an die Mikrosphären sind Sulfo-NHS (Sulfo-N-Hydrosuccinimid) und EDC (N-[3-Dimethylaminopropyl]-N′-ethylcarbodiimidhydrochlorid) erforderlich.
HINWEIS: Magnetische Perlensets sind mit einem von 500 eindeutigen fluoreszierenden Tags erhältlich, was die Identifizierung und Unterscheidung von verschiedenen Perlensätzenermöglicht 16. Die Perlen werden in Lagerkonzentrationen von 2,5 × 106 Kügelchen/ml und 12,5 × 106 Kügelchen/ml angeboten. Lagern Sie die Perlen lichtgeschützt bei Kühlschranktemperaturen (d.h. 2-8 °C). Frieren Sie die Kügelchensuspensionen nicht ein. - Erhalten Sie positive und negative Kontrollantikörper und mit Brilliant Violet 421 (BV421) markierte Sekundärnachweisantikörper. Lagern Sie alle fluoreszierenden konjugierten Moleküle lichtgeschützt.
- Führen Sie alle Kupplungsreaktionen in Röhrchen mit niedriger Proteinbindung und alle Assay-Reaktionen in 96-Well-Mikrotiterplatten mit niedriger Proteinbindung und rundem Boden durch. Versiegeln Sie die Platten mit Einweg-Klebefolie oder 96-Well-Mikrotiterplattenabdeckungen aus Kunststoff für die Assay-Inkubationsschritte. Verwenden Sie einen magnetischen Plattenseparator, um die Kügelchen während der Assay-Waschschritte zu immobilisieren.
HINWEIS: Das Dual-Reporter-Durchflussanalysesystem verfügt über drei Laser: (1) einen, der die Bead-Set-spezifische Fluoreszenz identifiziert und quantifiziert (Klassifizierungskanal); (2) eines, das die zielspezifische Phycoerythrin (PE)-Fluoreszenz detektiert und quantifiziert (Reporterkanal 1; 532 nm Anregung, "orange" 565-585 nm Emission); und (3) eines, das die zielspezifische BV421-Fluoreszenz eines zweiten Zielanalyten detektiert und quantifiziert (Reporterkanal 2; 405 nm Anregung, "blaue" 421-441 nm Emission).
2. Kopplung von rhPD-1 an Magnetperlen
HINWEIS: Das zu koppelnde Protein muss frei von Rinderserumalbumin (BSA), Natriumazid, Glycin, Glycerin, Tris(hydroxymethyl)aminomethan (Tris) oder aminhaltigen Zusätzen sein und sollte bei einem pH-Wert von 7,4 in PBS suspendiert werden. Es ist ein handelsübliches Kupplungskit erhältlich, das alle hier beschriebenen notwendigen Reagenzien und Puffer enthält (siehe Materialtabelle).
- Alle Kopplungsreagenzien aus dem Kühlschrank nehmen und 20-30 Minuten lang auf Raumtemperatur (RT, 18-22 °C) ausbalancieren lassen.
- Resuspendieren Sie die Stammmikrokugeln durch kurzes Wirbeln, Beschallen oder Drehen (15 Minuten bei 15-30 U/min), wie im Produktinformationsblatt beschrieben.
- 1 × 106 magnetische Kügelchen in ein 1,5-ml-Mikrozentrifugenröhrchen mit geringer Proteinbindung überführen (siehe Materialtabelle).
- Waschen Sie die Kügelchen mit 100 μl Aktivierungspuffer15: 0,1 M NaH2PO4 (monobasisch), pH 6,2.
HINWEIS: Die Kopplung kann auch mit einem vorkonfigurierten Kupplungskit durchgeführt werden, das 0,1 M 2-Morpholinoethansulfonsäure (MES), pH 6,0, als alternativen Aktivierungs- und Kopplungspuffer enthält (siehe Materialtabelle).- Legen Sie das Röhrchen mit den Perlen für 1-2 Minuten in einen Magnetabscheider.
HINWEIS: Alternativ können die Kügelchen durch Mikrozentrifugation bei ≥8.000 × g für 1-2 min getrennt werden. - Saugen Sie den Überstand mit einer Pipette aus den magnetimmobilisierten oder pelletierten Kügelchen ab, während sich das Röhrchen noch im Magnetabscheider befindet.
- Entfernen Sie das Mikrozentrifugenröhrchen vom Magneten und fügen Sie 80 μl Koppelpuffer hinzu (siehe Materialtabelle).
- Das Reaktionsrohr vorsichtig vortexzieren und 20 s lang beschallen, um die Kügelchen zu dispergieren.
- Legen Sie das Röhrchen mit den Perlen für 1-2 Minuten in einen Magnetabscheider.
- Aktivieren Sie die Kügelchen mit Sulfo-NHS und EDC.
HINWEIS: Die Stammlösung von Sulfo-NHS ist 50 mg/ml in Aktivierungspuffer gelöst. Die Stammlösung von EDC ist ebenfalls 50 mg/ml in Aktivierungspuffer gelöst. Sowohl der Aktivierungspuffer als auch die Feuchtigkeit in der Atmosphäre verursachen den EDC-Abbau. Es ist nicht ratsam, eine gelagerte EDC-Lösung zu verwenden. Stellen Sie vor dem Schritt gerade genug frische EDC-Lösung her und verwenden Sie sie sofort, wenn die Lösung fertig ist. Entsorgen Sie die überschüssige EDC-Lösung.
VORSICHT: EDC verursacht schwere Augenreizungen und reizt die Atemwege und die Haut.- Geben Sie 10 μl Sulfo-NHS in das Mikrofugenröhrchen, das die gewaschenen und aktivierten Kügelchen enthält.
- Geben Sie 10 μl EDC-Stammlösung in das Mikrofugenröhrchen, das die Kügelchen und das Sulfo-NHS enthält.
- Schützen Sie die lichtempfindlichen Mikrokugeln vor Licht und drehen Sie sie 20 Minuten lang auf dem Rotator bei 15-30 U/min bei RT (18-22 °C). Alternativ kann die Röhre während des Aktivierungsschritts stationär bleiben, wenn sie sanft vorgewirbelt wird, um die Kügelchen in 10-Minuten-Intervallen neu zu verteilen.
- Waschen Sie überschüssige Kupplungsreagenzien von den Perlen ab.
- Legen Sie das Röhrchen mit den aktivierten Kügelchen für 1-2 Minuten in einen Magnetabscheider.
- Saugen Sie den Überstand mit einer Pipette aus magnetimmobilisierten oder pelletierten Kügelchen an, wobei sich das Röhrchen noch im Magnetabscheider befindet.
- Entfernen Sie das Mikrozentrifugenröhrchen vom Magneten und fügen Sie 100 μl Aktivierungspuffer hinzu.
- Das Reaktionsrohr vorsichtig vortexen, um die Kügelchen zu dispergieren.
- Wiederholen Sie die Schritte 2.6.1-2.6.4 zwei weitere Male für insgesamt drei Wäschen. Am Ende des Waschens werden die Kügelchen in 100 μl Aktivierungspuffer mit einer ungefähren Konzentration von 10 × 106 Kügelchen/ml suspendiert.
- Koppeln Sie das rhPD-1-Peptid an die aktivierten Kügelchen.
- Geben Sie 390 μl Aktivierungspuffer in das Röhrchen mit den aktivierten Kügelchen, um das Gesamtvolumen der Kügelchensuspension auf 490 μl zu erhöhen.
- Geben Sie 1 μg PD-1-Peptid zur aktivierten Kügelchensuspension, indem Sie 10 μl PD-1-Peptidlösung (1 mg/ml gelöst in PBS) in das Röhrchen mit den aktivierten Kügelchen geben.
- Das Mikrozentrifugenröhrchen kurz vortexen, um das PD-1 und die aktivierten Kügelchen gleichmäßig zu verteilen.
- Die Kügelchen mit PD-1 für 2 h im Dunkeln bei RT (18-22 °C) mit Rotation (15-30 U/min) inkubieren.
- Waschen Sie die Kügelchen zweimal (2x) mit Assay/Wash Buffer (PBS-TBN: 1x PBS, pH 7,4 + 0,1 % BSA + 0,05 % Tween-20 + 0,05 % NaN315).
- Legen Sie das Röhrchen mit den aktivierten Kügelchen für 1-2 Minuten in einen Magnetabscheider.
- Saugen Sie den Überstand mit einer Pipette aus den magnetimmobilisierten oder pelletierten Kügelchen ab, während sich das Röhrchen noch im Magnetabscheider befindet.
- Entfernen Sie das Mikrozentrifugenröhrchen vom Magneten und fügen Sie 100 μl Aktivierungspuffer hinzu.
- Das Reaktionsrohr vorsichtig vortexen, um die Kügelchen zu dispergieren.
- Wiederholen Sie die Schritte 2.8.1-2.8.4 ein weiteres Mal für insgesamt zwei Wäschen. Am Ende des Waschens werden die Kügelchen in 100 μl Aktivierungspuffer in einer Konzentration von 10 × 106 Kügelchen/ml suspendiert.
HINWEIS: Der Assay/Wash-Puffer kann ohne Natriumazid (Konservierungsmittel) hergestellt werden, wenn der Puffer nicht auch als Speichermedium verwendet wird. - Lagern Sie die rhPD-1-gekoppelten Perlen im Dunkeln im Kühlschrank bei 2-8 °C, wenn sie nicht sofort verwendet werden. Proteingekoppelte Kügelchen sind bis zu 18 Monate stabil.
3. Bewertung der erfolgreichen rhPD-1-Kopplung an die Perlen
HINWEIS: Die rhPD-1-gekoppelten Mikrosphären werden mit biotinyliertem rhPD-L1 umgesetzt, wobei letzteres durch Inkubation mit SAPE und anschließender Bewertung auf dem Durchflusszytometer nachgewiesen wird. Dies verifiziert sowohl die erfolgreiche PD-1-Kopplung an die magnetischen Kügelchen als auch die funktionelle Interaktion zwischen den Proteinen rhPD-1 und rhPD-L1.
- Erzeugen Sie eine zweifache serielle Verdünnungsreihe von biotinyliertem rhPD-L1 in PBS-TBN (die rhPD-L1-Stammlösung beträgt 1 mg/ml). Der letzte zu testende rhPD-L1-Konzentrationsbereich ist eine Lösung von 8 μg/ml bis hinunter zu einer Lösung von 313 pg/ml. Erzeugen Sie 150 μl Volumina jeder rhPD-L1-Verdünnung: 50 μl für jede Reaktion und zwei Reaktionen pro Bedingung, plus ausreichend Überschuss, um Pipettierverluste auszugleichen.
- Beschriften Sie die rhPD-L1-Verdünnungsmikrofugenröhrchen mit 8 μg/ml, 4 μg/ml, 2 μg/ml, 1 μg/ml, 0,5 μg/ml, 0,25 μg/ml, 0,125 μg/ml, 0,063 μg/ml und 0,031 μg/ml. Ein 0 μg/ml-Röhrchen (nur PBS-TBN) dient als no-PD-L1-Kontrolle.
- 150 μl PBS-TBN in alle markierten rhPD-L1-Verdünnungsröhrchen vorladen.
HINWEIS: Die höchste zu testende Endkonzentration von rhPD-L1 beträgt 8 μg/ml, und das rhPD-L1 wird bei Zugabe zum Reaktionsgemisch 1:1 verdünnt, so dass sich das Verdünnungsröhrchen mit der Bezeichnung "8 μg/ml" auf die Endkonzentration bezieht und tatsächlich 16 μg/ml rhPD-L1 enthält. Die Etiketten auf allen Verdünnungsröhrchen geben die endgültige rhPD-L1-Konzentration nach Zugabe zur Reaktion an. - Stellen Sie die rhPD-L1-Verdünnung mit der höchsten Konzentration her (16 μg/ml tatsächlich). Dabei handelt es sich um eine zweistufige, 62,5-fache Verdünnung der 1 mg/ml rhPD-L1-Stammlösung (1.000 μg/16 μg = 62,5).
- Mischen Sie 84 μl PBS-TBN mit 16 μl rhPD-L1-Stammlösung (1 mg/ml, d. h. 1.000 μl) in einem Mikrozentrifugenröhrchen. Dies ist eine 6,25-fache Verdünnung, und die resultierende Konzentration beträgt 160 μg/ml rhPD-L1.
- In dem Röhrchen mit der Aufschrift "8 μg/ml" werden 270 μl PBS-TBN mit 30 μl der im vorherigen Schritt hergestellten rhPD-L1-Verdünnung (160 μg/ml) vermischt. Dies ist eine 10-fache Verdünnung, und die resultierende Konzentration beträgt tatsächlich 16 μg/ml. Das Etikett des Röhrchens "8 μg/ml" bezieht sich auf die Endkonzentration nach Zugabe zur Reaktion.
- 150 μl der in Schritt 3.1.3 hergestellten rhPD-L1-Verdünnung ("8 μg/ml") werden in das "4 μg/ml"-Röhrchen überführt, die Kappe des Mikrozentrifugenröhrchens verschlossen und die Lösung kurz vorgewirbelt.
- Wiederholen Sie Schritt 3.1.4 nacheinander, bis die rhPD-L1-Verdünnungsreihe abgeschlossen ist. Nach der Erstellung sollten alle Röhrchen zwischen "8 μg/ml" und "0,063 μg/ml" sowie die 0 μg/ml-Kontrolle 150 μl Lösung und das letzte Röhrchen "0,031 μg/ml" 300 μl Lösung enthalten. Dadurch entsteht ein ausreichendes Volumen jeder Verdünnung, um 50 μl jeder biotinylierten rhPD-L1-Verdünnung in doppelten Reaktionen zu testen, wobei genügend Überschuss verbleibt, um Pipettierverluste auszugleichen.
- Zählen Sie die rhPD-1-gekoppelten Beads mit einem Hämozytometer17.
- Verdünnen Sie die rhPD-1-gekoppelten Stammkügelchen auf 5 ×10 4 Kügelchen/ml mit einem Volumen, das für 2.500 Kügelchen/50 μl/Reaktion ausreicht.
- Die 5 ×10 4 Kügelchen/ml rhPD-1-gekoppelte Kügelchensuspension vortexen und 50 μl der Suspension in jede markierte/zugeordnete Vertiefung einer 96-Well-Mikrotiterplatte mit rundem Boden pipettieren, so dass für jede zu testende rhPD-L1-Verdünnung doppelte Vertiefungen erstellt werden.
- 50 μl jedes biotinylierten rhPD-L1-Verdünnungsröhrchens, das in Schritt 3.1 hergestellt wurde, in die entsprechenden Vertiefungen auf der Mikrotiterplatte geben.
- Decken Sie die Mikrotiterplatte mit einer Einwegfolie oder einem Kunststoff-Klebeplattenversiegeler ab und inkubieren Sie die Platte 1 Stunde lang im Dunkeln bei RT (18-22 °C) auf einem Orbitalschüttler (600 U/min).
- Waschen Sie überschüssiges biotinyliertes rhPD-L1 von den Kügelchen.
- Übertragen Sie die versiegelte Platte vom Orbitalschüttler für 2 Minuten auf den magnetischen Plattenseparator, um die Perlen zu immobilisieren.
- Entfernen Sie vorsichtig die Klebeplattenversiegelung, vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, drehen Sie die Platte um und schütten Sie die Überstände in ein Waschbecken oder einen Behälter für flüssige Abfälle mit biologischer Gefahr. Klopfen Sie die umgedrehte Platte vorsichtig, aber zügig auf ein Kissen aus saugfähigem Papiertaschentuch, um den verbleibenden Überstand zu entfernen.
- Entfernen Sie die Mikrotiterplatte aus dem Magnetplattenseparator und pipettieren Sie 150 μl PBS-TBN in jede Vertiefung.
- Legen Sie die unversiegelte Platte für 2 Minuten auf den Magnetabscheider, um die Perlen zu immobilisieren.
- Vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, drehen Sie die Platte um und schütten Sie die Überstände in eine Spüle oder einen Behälter für flüssige Abfälle mit biologischen Gefahren. Klopfen Sie die umgedrehte Platte vorsichtig, aber zügig auf ein Kissen aus saugfähigem Papiertaschentuch, um den verbleibenden Überstand zu entfernen.
- Wiederholen Sie die Plattenwaschschritte 3.7.3-3.7.5 zweimal für insgesamt drei Wäschen mit je 150 μl PBS-TBN. Stellen Sie sicher, dass am Ende des letzten Waschschritts kein Überstand in den Vertiefungen verbleibt. Arbeiten Sie gleichmäßig, um das Austrocknen der immobilisierten Kügelchen auf den Brunnenböden zu verhindern.
- Fügen Sie das SAPE-Erkennungsreagenz hinzu.
- Verdünnen Sie die SAPE-Stammlösung in PBS-TBN auf eine Arbeitskonzentration von 6 μg/ml. Bereiten Sie ein ausreichendes SAPE-Arbeitslösungsvolumen vor, damit alle Reaktionsvertiefungen 100 μl/Well aufnehmen können, mit ausreichend zusätzlichem Volumen, um Pipettierverluste auszugleichen.
- Entfernen Sie die Mikrotiterplatte vom Magnetplattenseparator.
- Geben Sie 100 μl SAPE-Arbeitslösung in jede Reaktionsvertiefung und resuspendieren Sie die gewaschenen Kügelchen durch Pipettieren.
- Versiegeln Sie die 96-Well-Mikrotiterplatte mit einer Folie oder einem Kunststoff-Klebeplattenversiegelungsmittel und inkubieren Sie 1 Stunde lang im Dunkeln bei RT (18-22 °C) auf einem Orbitalschüttler bei 600 U/min.
- Entfernen Sie die Mikrotiterplatte aus dem Inkubator, übertragen Sie sie in den Magnetplattenseparator, um die Kügelchen zu immobilisieren, entfernen Sie die Klebeplattenversiegelung und waschen Sie die Kügelchen dreimal mit 150 μL PBS-TBN, wie in den Schritten 3.7.3-3.7.5 beschrieben.
- Nach dem Entfernen der letzten Wäsche entfernen Sie die Platte vom magnetischen Plattenseparator und suspendieren Sie die Kügelchen wieder in 100 μl PBS-TBN pro Well.
- Analysieren Sie die Ergebnisse.
- Lesen Sie die Platte auf dem Durchflussanalysegerät ab (siehe Materialtabelle), um die mittlere Fluoreszenzintensität (MFI) jeder Reaktion mit den folgenden Geräteeinstellungen zu bestimmen: Aspirationsvolumen = 50 μl; Mindestanzahl der Perlen = 100 Perlen; Timeout-Einstellung = 40 s; Anschnitt = 7.000-17.000; Betriebsart = Single Reporter. Für jede Bedingung werden doppelte Bohrungen durchgeführt, und die beiden MFI-Ausgangswerte für jede Bedingung werden gemittelt, bevor weitere Datenberechnungen und grafische Darstellungen durchgeführt werden.
HINWEIS: Der MFI-Wert jeder Verdünnung sollte eine konzentrationsabhängige Bindung aufweisen, was auf eine akzeptable rhPD-1-Kopplungseffizienz an die Kügelchen hinweist und eine gute Interaktion der rekombinanten PD-1/PD-L1-Proteine bestätigt.
- Lesen Sie die Platte auf dem Durchflussanalysegerät ab (siehe Materialtabelle), um die mittlere Fluoreszenzintensität (MFI) jeder Reaktion mit den folgenden Geräteeinstellungen zu bestimmen: Aspirationsvolumen = 50 μl; Mindestanzahl der Perlen = 100 Perlen; Timeout-Einstellung = 40 s; Anschnitt = 7.000-17.000; Betriebsart = Single Reporter. Für jede Bedingung werden doppelte Bohrungen durchgeführt, und die beiden MFI-Ausgangswerte für jede Bedingung werden gemittelt, bevor weitere Datenberechnungen und grafische Darstellungen durchgeführt werden.
4. PD-L1 magnetischer Bead-basierter PD-1/PD-L1-Blocking-Assay
HINWEIS: Dieser Assay bewertet die blockierende Aktivität löslicher Mediatoren (z. B. Anti-PDL1-Peptid-Antikörper) auf rekombinante PD1/PD-L1-Interaktionen. Kurz gesagt, biotinyliertes rhPD-L1 wird mit Antikörpern vorinkubiert, die in Kaninchen nach verschiedenen PDL1-Vaxx-Peptid-Inokulationen gebildet wurden. Das rhPD-L1 + Anti-PDL1-Antikörpergemisch wird dann mit rhPD-1-gekoppelten Magnetkügelchen eingefangen, und die rhPD-L1-Bindung an die rhPD-1-gekoppelten Kügelchen wird durch Zugabe von Streptavidin-PE quantifiziert. Das PE-Fluoreszenzsignal korreliert umgekehrt mit der Blockierungsaktivität der getesteten Anti-PDL1-Antikörper/Inhibitoren. Die Bindung von Anti-PDL1-Peptid-Antikörpern wird gleichzeitig durch die Bindung eines BV421-gekoppelten Anti-Kaninchen-Antikörpers (für Anti-PDL1-Peptid-Antikörper) oder Anti-Human-Sekundärantikörpers (für Kontrollantikörper) und durch die Bewertung der BV421-Fluoreszenz im zweiten Kanal des Geräts bewertet. Die Assay-Schritte sind in Abbildung 1 bildlich dargestellt.
- Bereiten Sie eine zweifache serielle Verdünnungsreihe der Testantikörper vor, einschließlich PDL1-Vaxx-induzierter polyklonaler Antikörperkandidaten, eines Negativkontrollantikörpers (Trastuzumab, Herceptin, humanisierter monoklonaler Anti-HER2-Antikörper) und eines positiven Kontrollantikörpers (Atezolizumab; humanisierter monoklonaler Anti-PDL1-IgG1-Antikörper). Für jede Reaktion werden 25 μl der zugewiesenen Antikörperverdünnung verwendet, so dass die angezeigten Volumina ausreichen, um jede Reaktion in doppelten Wells pro Bedingung durchzuführen (d. h. 50 μl pro Bedingung), wobei ein gewisser Überschuss verbleibt, um Pipettierverluste auszugleichen.
- Stellen Sie für jeden impfstoffinduzierten Anti-PDL1-Peptid-Antikörper und Kontrollantikörper sicher, dass der Bereich der getesteten endgültigen Antikörperkonzentrationen von 1.000 μg/ml bis hinunter zu 8 μg/ml reicht. Bereiten Sie Stammlösungen aller Antikörper mit 2.000 μg/ml vor.
- Beschriften Sie für jeden Antikörper die Verdünnungsröhrchen mit 1.000 μg/ml, 500 μg/ml, 250 μg/ml, 125 μg/ml, 63 μg/ml, 31 μg/ml, 16 μg/ml und 8 μg/ml und geben Sie den Namen des Antikörpers an. Fügen Sie für jeden Antikörper auch ein "0 μg/ml"-Röhrchen hinzu, das als reine Vehikelkontrolle (PBS-TBN) dient.
HINWEIS: Bei Zugabe zur Reaktionsmischung wird die Antikörperkonzentration 1:1 verdünnt. Die Antikörper-Verdünnungsröhrchen werden nach Zugabe zur Reaktion als endgültige Antikörperkonzentration markiert und enthalten tatsächlich die doppelte Menge an Antikörpern als markiert. - Geben Sie 75 μl PBS-TBN in alle Antikörper-Verdünnungsröhrchen mit der Aufschrift "500 μg/ml" und darunter, einschließlich der "0 μg/ml"-Kontrollröhrchen, die nur für Vehikel bestimmt sind.
- Für jeden Antikörper werden 150 μl der 2.000 μg/ml-Stammlösung in das entsprechende Röhrchen mit der Bezeichnung "1.000 μg/ml" pipettiert. Dies wird verwendet, um alle nachfolgenden Verdünnungen für jeden Antikörper vorzunehmen.
- Erstellen Sie für jeden Antikörper eine vollständige Verdünnungsreihe, indem Sie 75 μl aus dem "1.000 μg/ml"-Röhrchen in das Röhrchen mit der nächstniedrigeren Verdünnung in der Reihe (d. h. "500 μg/ml") pipettieren. Verschließen Sie das neu fertiggestellte Verdünnungsröhrchen, wirbeln Sie es kurz vor und setzen Sie den Aufbau der Verdünnungsreihe fort, indem Sie 75 μl aus dem "500 μg/mL"-Röhrchen in das "250 μg/mL"-Röhrchen überführen. Wiederholen Sie dieses Muster, bis die letzte Verdünnung "8 μg/ml" für alle Antikörper erreicht ist.
HINWEIS: In der vollständigen Verdünnungsreihe für jeden Antikörper sollte ein Volumen von 75 μl für alle Röhrchen vorhanden sein, mit Ausnahme der niedrigsten Verdünnung, 8 μg/ml, die ein Volumen von 150 μl enthalten sollte. Für jede Reaktion werden 25 μl Antikörperverdünnung verwendet, so dass diese Volumina ausreichen, um jede Reaktion in doppelten Wells pro Bedingung durchzuführen (d. h. 50 μl pro Bedingung), mit zusätzlichen Volumina, um Pipettierverluste auszugleichen.
- Geben Sie 25 μl der verdünnten Antikörper in die dafür vorgesehenen Vertiefungen einer 96-Well-Mikrotiterplatte.
- Verdünnen Sie biotinyliertes rhPD-L1 auf eine Arbeitskonzentration von 4 μg/ml in PBS-TBN mit einem Volumen, das ausreicht, um 25 μl in doppelten Vertiefungen pro Bedingung aufzunehmen (d. h. 50 μl pro Bedingung), mit zusätzlichen Mengen, um Pipettierverluste auszugleichen.
ANMERKUNG: In dieser Arbeit führte biotinyliertes rhPD-L1 bei 4 μg/ml zu etwa 50% des maximalen MFI-Signals, das in der früheren Kopplungsbewertung gemessen wurde, und wurde für die PD-1/PD-L1-Blockadeanalyse verwendet. - 25 μl biotinyliertes rhPD-L1 (4 μg/ml) in jede Reaktionsvertiefung geben, die Mikrotiterplatte mit einer Folie oder einem Kunststoffklebesiegel abdecken und bei RT (18-22 °C) 1 h lang unter Schütteln auf einem Orbitalplattenschüttler bei 600 U/min inkubieren.
- Verdünnen Sie die rhPD-1-gekoppelten Kügelchen auf 50.000 Kügelchen/ml, mit einem ausreichenden Volumen für 50 μl/Well (2.500 Kügelchen/Well) plus zusätzlich, um Pipettierverluste auszugleichen.
- Entfernen Sie die 96-Well-Mikrotiter-Reaktionsplatte aus dem Schüttler und entfernen Sie die Klebeplattendichtung.
- Geben Sie 50 μl der rhPD-1-gekoppelten Kügelchenmischung in jede Vertiefung.
- Die Platte versiegeln und 1 Stunde im Dunkeln bei RT (18-22 °C) auf einem Orbitalschüttler bei 600 U/min inkubieren.
- Übertragen Sie die versiegelte Platte vom Orbitalschüttler für 2 Minuten auf den magnetischen Plattenseparator, um die Perlen zu immobilisieren.
- Entfernen Sie vorsichtig die Klebeplattenversiegelung, vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, drehen Sie die Platte um und entleeren Sie die Überstände. Klopfen Sie die umgedrehte Platte vorsichtig auf ein Kissen aus saugfähigem Papiertaschentuch, um überschüssigen Überstand zu entfernen.
- Waschen Sie überschüssige Reaktionsreagenzien von den Kügelchen.
- Entfernen Sie die Mikrotiterplatte aus dem Magnetplattenseparator und geben Sie 150 μl PBS-TBN in jede Vertiefung.
- Legen Sie die Mikrotiterplatte für 2 Minuten auf den Magnetplattenseparator, um die Kügelchen zu immobilisieren.
- Vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, und drehen Sie die Platte um und entleeren Sie die Überstände. Klopfen Sie die umgedrehte Platte vorsichtig auf ein Kissen aus saugfähigem Papiertaschentuch, um überschüssigen Überstand zu entfernen.
- Wiederholen Sie die Plattenwaschschritte 4.11.1-4.11.3 zweimal, insgesamt also drei Wäschen mit PBS-TBN. Stellen Sie sicher, dass das SAPE-Reagenz vorbereitet ist (siehe unten), bevor Sie die endgültige (dritte) Waschlösung entfernen.
- Fügen Sie das SAPE-Erkennungsreagenz hinzu.
- Verdünnen Sie die SAPE-Stammlösung auf eine Arbeitskonzentration von 6 μg/ml in PBS-TBN; Stellen Sie ein ausreichendes Volumen für 100 μl/Well sowie ein zusätzliches Volumen her, um Pipettierverluste auszugleichen.
- Geben Sie 100 μl/Vertiefung SAPE-Arbeitslösung in jede Reaktionsvertiefung und resuspendieren Sie die Kügelchen durch Pipettieren.
- Die Platte versiegeln und 1 Stunde im Dunkeln bei RT (18-22 °C) auf einem Orbitalschüttler bei 600 U/min inkubieren.
- Dekantieren Sie das überschüssige SAPE aus der Reaktion.
- Übertragen Sie die versiegelte Platte vom Orbitalschüttler für 2 Minuten auf den magnetischen Plattenseparator, um die Perlen zu immobilisieren.
- Entfernen Sie vorsichtig die Klebeplattenversiegelung, vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, drehen Sie die Platte um und entleeren Sie den Überstand. Klopfen Sie die umgedrehte Platte vorsichtig auf ein Kissen aus saugfähigem Papiertuch, um den Überstand mit überschüssigem SAPE zu entfernen.
- Waschen Sie das überschüssige SAPE von den Perlen ab.
- Entfernen Sie die Mikrotiterplatte aus dem magnetischen Plattenhalter.
- Geben Sie 150 μl PBS-TBN in jede Vertiefung, um die Kügelchen wieder zu suspendieren.
- Legen Sie die Mikrotiterplatte für 2 Minuten auf den Magnetplattenseparator, um die Kügelchen zu immobilisieren.
- Vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, drehen Sie die Platte um und lassen Sie den Überstand ab. Klopfen Sie die umgedrehte Platte vorsichtig auf ein Kissen aus saugfähigem Papiertaschentuch, um überschüssigen Überstand zu entfernen.
- Führen Sie zwei weitere Waschschritte mit PBS-TBN durch, also insgesamt drei Wäschen, indem Sie die Schritte 4.15.1-4.15.4 wiederholen. Lassen Sie die BV421-kongugierten sekundären Detektionsantikörper vorbereiten (nächster Schritt), bevor Sie die endgültige (dritte) Waschlösung entfernen.
- Fügen Sie die BV421-kongugierten Sekundärantikörper hinzu.
- Verdünnen Sie BV421-kongugiertes Anti-Human-IgG (zum Nachweis humanisierter Kontrollantikörper) und BV421-kongugiertes Anti-Kaninchen-IgG (zum Nachweis von PDL1-Vaxx-induzierten polyklonalen Antikörpern) (siehe Materialtabelle) im Verhältnis 1:400 in Wash/Assay-Puffer auf Volumina, die für die Verwendung von jeweils 100 μl/Well ausreichen, mit zusätzlichem Volumen, um Pipettierverluste auszugleichen.
- Geben Sie 100 μl verdünntes BV421-konjugiertes Anti-Human-IgG oder BV421-konjugiertes Anti-Kaninchen-IgG in die entsprechenden Vertiefungen.
- Die Platte versiegeln und 1 Stunde im Dunkeln bei RT (18-22 °C) auf einem Orbitalschüttler bei 600 U/min inkubieren.
- Dekantieren Sie die überschüssigen BV421-konjugierten sekundären Antikörper aus den Kügelchen.
- Übertragen Sie die versiegelte Platte vom Orbitalschüttler für 2 Minuten auf den magnetischen Plattenseparator, um die Perlen zu immobilisieren.
- Entfernen Sie vorsichtig die Klebeplattenversiegelung, vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, drehen Sie die Platte um und entleeren Sie den Überstand. Klopfen Sie die invertierte Platte vorsichtig auf ein Kissen aus saugfähigem Papiertuch, um den Überstand zu entfernen, der überschüssige BV421-konjugierte Sekundärantikörper enthält.
- Waschen Sie die überschüssigen BV421-konjugierten sekundären Antikörper von den Kügelchen.
- Geben Sie 150 μl PBS-TBN in jede Vertiefung, um die Kügelchen wieder zu suspendieren.
- Legen Sie die Mikrotiterplatte für 2 Minuten auf den Magnetplattenseparator, um die Kügelchen zu immobilisieren.
- Vergewissern Sie sich, dass der Magnet und die Mikrotiterplatte fest miteinander verbunden sind, drehen Sie die Platte um und lassen Sie den Überstand ab. Klopfen Sie die umgedrehte Platte vorsichtig auf ein Kissen aus saugfähigem Papiertaschentuch, um überschüssigen Überstand zu entfernen.
- Führen Sie drei zusätzliche Waschschritte mit PBS-TBN für insgesamt vier Wäschen durch, indem Sie die Schritte 4.19.1-4.19.3 wiederholen.
- Nach dem Entfernen des letzten (vierten) Waschpuffers entfernen Sie die Mikrotiterplatte aus dem Magnetplattenseparator und resuspendieren Sie die Kügelchen mit einer Pipette in 100 μL PBS-TBN/Well.
- Analysieren Sie die Ergebnisse.
- Lesen Sie die Platte auf dem Dual-Reporter-Durchflussanalysesystem ab, um den MFI jeder Reaktion mit den folgenden Geräteeinstellungen zu bestimmen: Aspirationsvolumen = 50 μl; Mindestanzahl der Perlen = 100 Perlen; Timeout-Einstellung = 40 s; Gating: 7.000-17.000; Betriebsart = Dual Reporter.
- Stellen Sie mit dem Dual-Reporter-System sicher, dass Reporterkanal 1 die orangefarbene PE-Fluoreszenz (Menge an rhPD-L1 an rhPD-1-konjugierte Kügelchen) und Reporterkanal 2 die blaue BV421-Fluoreszenz (Menge des an rhPD-L1 gebundenen blockierenden Antikörpers) misst.
- Führen Sie doppelte Bohrungen für jede Bedingung durch und mitteln Sie die beiden MFI-Ausgabewerte für jede Bedingung, bevor Sie weitere Datenberechnungen und grafische Darstellungen durchführen.
- Standardisieren Sie den MFI-Wert jeder Probe auf die Negativkontrolle und berechnen Sie den Prozentsatz der Hemmung für jede Probe:
Inhibition % = (100 × [Negativkontrolle MFI − Stichproben-MFI])/Negativkontrolle MFI
HINWEIS: Die MFI-Werte der Negativkontrolle (keine Hemmung) sind die höchsten Werte. das gebundene PD-L1-Signal MFI beträgt 100 % und die Hemmung der Bindung von rhPD-L1 an rhPD-1 ist mit 0 % definiert.
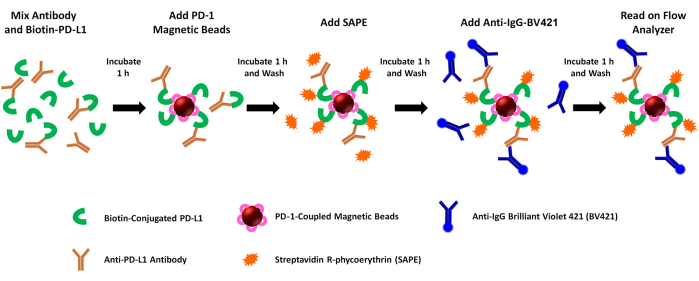
Abbildung 1: Schematische Darstellung des PD-1/PD-L1-Blockade-Assays mit zwei Reportern. Biotinyliertes rekombinantes humanes PD-L1 (rhPD-L1) wird mit ausgewählten PDL1-Vaxx-induzierten Anti-PDL1-Antikörpern vorinkubiert, bevor es mit rhPD-1-gekoppelten Magnetkügelchen kombiniert wird, um die Bildung von PD-1/PD-L1-Checkpoint-Komplexen zu ermöglichen. Komplexiertes rhPD-L1 wird dann durch Zugabe von Streptavidin-gekoppeltem Phycoerythrin (SAPE, orangefarbener Fluorophor) detektiert und markiert. Antikörper gegen PDL1-Vaxx-Epitope richten sich gegen rhPD-L1, das mit rhPD-1 an die magnetischen Kügelchen gekoppelt ist, und werden mit einem Brilliant Violet 421-konjugierten Sekundärantikörper (BV421, blauer Fluorophor) beleuchtet. Sowohl biotinyliertes rhPD-L1, das zu PD-1 (PE-Signal) komplexiert ist, als auch Anti-PDL1-Antikörper, die das rhPD-L1 (BV421-Signal) erkennen und binden, werden gleichzeitig mit einem durchflusszytometrischen Dual-Reporter-Instrument analysiert, das die Proben in zwei separaten Reporterkanälen auf beide Fluorophore untersucht. Die Ausgabewerte für jede Probe sind die mittlere Fluoreszenzintensität jedes Fluorophors. Die Hemmung der PD1/PD-L1-Komplexbildung durch verschiedene PDL1-Vaxx-induzierte Antikörper wird dann extrapoliert, indem die experimentellen Signale mit denen verglichen werden, die mit einem monoklonalen Antikörper der Negativkontrolle erzeugt wurden, der nicht an rhPD-L1 bindet (0%ige Hemmung). Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Der Assay war in der Lage, die Hemmung der PD-1/PD-L1-Interaktion durch vier einzigartige polyklonale Antikörper genau zu quantifizieren, die gegen die rhPD-L1-Impfstoffpeptide erzeugt wurden und als potenzielle Krebstherapeutika erforscht werden. Das Schema dieses Assays ist in Abbildung 1 dargestellt. Die Menge an biotinyliertem rhPD-L1, die an rhPD-1-konjugierte Kügelchen bindet, und die Hemmung dieser Bindung durch die vier PLD1-Vaxx-induzierten Antikörperkandidaten wurde im Reporterkanal 1 mit einem Streptavidin-PE-Detektionsreagenz gemessen, das rhPD-L1 direkt bindet (Abbildung 2).
Alle vier polyklonalen Anti-PDL1-Peptid-Antikörper blockierten die rhPD-L1-Interaktion mit PD-1, das auf Mikrosphären immobilisiert worden war, in unterschiedlichem Ausmaß. Der prozentuale Anteil der Hemmung der verschiedenen Anti-PDL1-Peptid-Antikörper lag zwischen 48 % und 74 % bei der maximal getesteten Konzentration von 1.000 μg/ml. Der monoklonale Positivkontrollantikörper Atezolizumab erreichte eine 92%ige Blockade der PD-1/PD-L1-Interaktion bei der getesteten maximalen Konzentration14 von 4 μg/ml (Abbildung 2). Alle experimentellen PDL1-Vaxx-Antikörper zeigten eine konzentrationsabhängige Hemmung der rhPD-L1-Bindung an rhPD-1-konjugierte Beads im Vergleich zu Trastuzumab, dem negativen Kontrollantikörper, von dem nicht erwartet wurde, dass er mit dem PD-1/PD-L1-System interagiert.
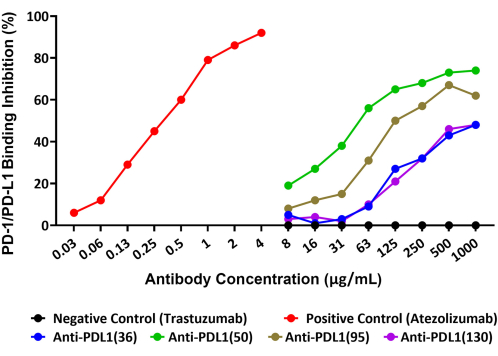
Abbildung 2: Blockade der rhPD-L1-Interaktion mit rhPD-1 gekoppelt an magnetische Kügelchen durch Anti-PDL1-Peptid-Antikörper, gezeigt durch einen neuen Fluoreszenz-Bead-basierten Immunoassay. Rekombinantes humanes PD-1 wurde an magnetische Mikrosphären gekoppelt, und die Kügelchen wurden dann mit biotinyliertem rhPD-L1 inkubiert, das mit verschiedenen Anti-PDL1-Peptid-Antikörpern vorinkubiert worden war. Ein Streptavidin-Phycoerythrin-Nachweisreagenz wurde verwendet, um das Biotin zu binden und somit die relative Menge an rhPD-L1 zu bestimmen, die für die Bindung an PD-1 zur Verfügung stand. Polyklonale Antikörper, die in Kaninchen gegen die PDL1-Peptidimpfstoffe (Anti-PDL1[36], Anti-PDL1[50], Anti-PDL1[95] und Anti-PDL1[130]) gezüchtet wurden, wurden auf ihre inhibitorische Aktivität getestet und zeigten eine Blockade von 48%-74% der rekombinanten PD-1/PD-L1-Interaktionen in der höchsten getesteten Konzentration. Als Positivkontrolle wurde Atezolizumab (ein anderer monoklonaler Anti-PDL1-Antikörper) verwendet. Der nicht verwandte kommerzielle monoklonale Antikörper Trastuzumab (Anti-HER2) wurde als Negativkontrolle verwendet. Diese Abbildung wurde von Guo et al.14 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
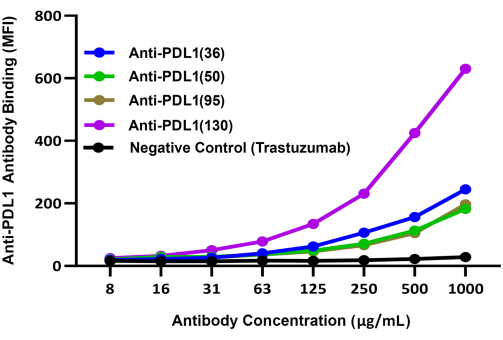
Abbildung 3: Vergleichende Bindung verschiedener PDL1-Vaxx-induzierter Antikörper an rhPD-L1, die mit rhPD1-beschichteten Magnetkügelchen komplexiert sind. Brillantvioletter 421-konjugierter sekundärer Detektionsantikörper wurde verwendet, um die Bindung verschiedener polyklonaler Anti-PDL1-Peptid-Antikörper von Kaninchen an rhPD-L1 über rhPD-1-beschichtete Beads zu vergleichen. Das blaue Fluoreszenzsignal BV421 wurde im Reporterkanal 2 des Dual-Reporter-Instruments aufgezeichnet; Dieses Signal korreliert mit der relativen Bindungseffizienz der experimentellen Anti-PDL1-Peptid-Antikörper. Trastezumab (Anti-HER2), ein monoklonaler Antikörper, der auf einen anderen Checkpoint als PD-1/PD-L1 abzielt, wurde als Negativkontrolle verwendet. MFI stellt die durchschnittliche mittlere Fluoreszenzintensität der Beads dar, die in doppelten Reaktionsvertiefungen pro Bedingung gemessen wurde. Diese Abbildung wurde von Guo et al.14 übernommen. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die relative Fähigkeit der vier experimentellen PDL1-Vaxx-induzierten Antikörperkandidaten, rhPD-L1 zu binden, wurde mit Hilfe eines separaten Detektionssystems (BV421-konjugiertes Anti-Kaninchen-IgG) verglichen, das auf dem zweiten Reporterkanal des Instruments evaluiert wurde. Diese Ergebnisse deuteten darauf hin, dass alle vier polyklonalen Anti-PDL1-Peptid-Antikörper konzentrationsabhängig an rhPD-L1 binden14 (Abbildung 3). Der Anti-PDL1(130)-Antikörper zeigte das höchste rhPDL1-Bindungssignal der vier PDL1-Vaxx-induzierten Antikörperkandidaten.
Diskussion
Der Zweck der Checkpoint-assoziierten Krebsimmuntherapie besteht darin, die Interaktion zwischen Checkpoint-Proteinen und ihren wichtigen Liganden für das Überleben und die Progression von Tumoren zu stören2. Diese Forschungsgruppe entwickelt aktiv neuartige PD-1- und PD-L1-Impfstoffe, die eine Antikörperantwort hervorrufen, die auf den PD-1/PD-L1-Checkpoint 3,8,13,14 abzielt und diesen unterbricht. Zuvor wurden zwei Variationen von Enzyme-linked Immunosorbent Assays (ELISAs) durchgeführt, um die Auswirkungen von Anti-PDL1-Peptid-Antikörpern auf die Hemmung der rekombinanten PD1/PD-L1-Interaktion zu untersuchen14. (1) In der ersten Variante wurde rhPD-L1 auf einer Mikrotiterplatte beschichtet und dann mit verdünnten Anti-PDL1-Impfstoffkandidaten-induzierten Antikörpern inkubiert. Die Hemmung der rekombinanten PD-1/PD-L1-Interaktion durch die Antikörper wurde dann durch Zugabe von biotinyliertem rhPD-1 und Quantifizierung der Bindung an das immobilisierte rhPD-L1 unter Verwendung eines Streptavidin-Meerrettich-Peroxidase-Konjugats und eines kolorimetrischen Substrats untersucht. Wir haben dies als direkten Blockade-Assay definiert. (2) Bei der zweiten Variante wurde PD-1 auf die Mikrotiterplatte aufgetragen. Biotinyliertes rhPD-L1 wurde mit jedem der Anti-PLD1-Kandidaten-induzierten polyklonalen Antikörper in separaten Reaktionsröhrchen vorinkubiert. Die rhPDL1/Anti-PDL1-Gemische wurden dann zu den Plattenvertiefungen gegeben, die immobilisiertes rhPD-1 enthielten, und man ließ sie reagieren. Jedes rhPDL1, das mit dem immobilisierten rhPD-1 in Gegenwart der potentiell blockierenden PDL1-Vaxx-induzierten Antikörper reagierte, wurde mit anschließender Streptavidin-HRP und kolorimetrischer Substratinkubation detektiert. Wir haben dies als umgekehrten Blockade-Assay definiert.
Die umgekehrte Blockade der rekombinanten PD-1/PD-L1-Interaktion durch Anti-PDL1-Peptid-Antikörper zeigte eine Hemmung des Signals (d. h. PD-1/PD-L1-Blockade) in einer von der Antikörperkonzentration abhängigen Weise14, während der direkte Blockadeansatz keine konsistenten Ergebnisse lieferte (nicht gezeigt). Der Bead-basierte Dual-Reporter-Blockade-Assay wurde entwickelt, um die ELISA-Ergebnisse zu verifizieren und die Blockade der PD-1/PD-L1-Wechselwirkung in einer flüssigen Phase zu untersuchen, wodurch die potenziellen Probleme mit der Verfügbarkeit von sterischen Behinderungen/Bindungsepitopen beseitigt werden, die mit der Immobilisierung rekombinanter Proteine auf Bohrlochböden verbunden sind. Die Mikrosphärenanalyse korrelierte direkt mit den ELISA-Blocking-Ergebnissen unter Verwendung des Reverse-Blocking-Assays (Abbildung 2). Darüber hinaus können fluoreszenzbasierte Immunoassays im Vergleich zu kolorimetrischen ELISAs18 eine verbesserte Assay-Sensitivität und einen erweiterten Dynamikbereich bieten, und darüber hinaus ermöglicht der Multiplex-Bead-basierte Assay die gleichzeitige Durchführung von zwei unabhängigen Immunoassays innerhalb einer einzigen Reaktion. Die für die kovalente Kopplung der Mikrosphären an rhPD-1 verwendeten Sulfo-NHS und EDC könnten zu den Leistungsunterschieden zwischen den Assays mit direkter Blockade und umgekehrter Blockade sowie zu den beobachteten Unterschieden in der Sensitivität zwischen den rekombinanten PD-1/PD-L1-Interaktionsassays auf Basis von ELISA und Luminex-Beads geführt haben. Weitere Untersuchungen auf chemischer und molekularer Ebene sind erforderlich, um die möglichen Mechanismen zu untersuchen, die für diese Unterschiede verantwortlich sind.
Sowohl ELISA14 als auch die Bead-basierten Assays zeigen, dass PDL1-Vaxx-induzierte Anti-PDL1-Antikörper die Bildung von PD1/PD-L1-Checkpoint-Komplexen hemmen können. Das peptidbasierte PDL1-Vaxx induziert erfolgreich Anti-PDL1-Antikörper, die die PD-1/PD-L1-Interaktion blockieren können. Dieser Ansatz könnte als neuartige therapeutische Strategie zur Behandlung von Krebs dienen, wie präklinische Tierstudien belegen 3,13,14. Geplante klinische Studien werden die Wirksamkeit des PDL1-Vaxx für die Checkpoint-Immuntherapie und Krankheitskontrolle bei Krebspatienten bestimmen.
Offenlegungen
Pravin T.P. Kaumaya ist Berater von Imugene, Ltd.
Danksagungen
Die Autoren danken Sherry Dunbar PhD, MBA der Luminex Corporation (Austin, TX) für die Unterstützung bei der Forschung und Matthew Silverman PhD von Biomedical Publishing Solutions (Panama City, FL; mattsilver@yahoo.com) für die wissenschaftliche und schriftliche Unterstützung. Diese Arbeit wurde durch Auszeichnungen an Pravin T. P. Kaumaya von den National Institutes of Health (R21 CA13508 und R01 CA84356) und Imugene Ltd, Sydney, Australien (OSU 900600, GR110567 und GR124326) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Buffers | |||
| Activation Buffer: 0.1 M NaH2PO4, pH 6.2 | Millipore/Sigma | S3139 | |
| Assay/Wash Buffer: PBS-TBN (1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3) | Millipore/Sigma | P3563 (PBS+Tween20), A7888 (Bovine serum albumin), S8032 (sodium azide) | |
| Coupling Buffer: 50 mM 2-morpholinoethanesulfonic acid (MES), pH 5.0 | MilliporeSigma | M2933 | |
| Coupling Reagents | |||
| 1-Ethyl-3-[3-dimethylaminopropyl]carbodiimide hydrochloride (EDC) | ThermoFisher Scientific (Waltham, MA) | 77149 | |
| xMAP Antibody Coupling Kit (if desired), includes: | Luminex Corp. (Austin, TX) | 40-50016 | |
| EDC, 10 mg | |||
| sNHS solution, 250 µL | |||
| Activation/Coupling Buffer: 0.1 M 2-morpholinoethanesulfonic acid (MES), pH 6.0 | |||
| Wash Buffer: 1x PBS, pH 7.4 + 0.1% BSA + 0.05 % (v/v) Tween-20; 0.05% NaN3 (PBS-TBN) | |||
| Sulfo-NHS (N-hydroxysulfosuccinimide) | ThermoFisher Scientific (Waltham, MA) | 24510 | |
| Instrumentation and Ancillary Lab Supplies | |||
| xMAP INTELLIFLEX (dual-reporter instrument) | Luminex Corp. (Austin, TX) | INTELLIFLEX-DRSE-RUO | |
| Low protein-binding round bottom 96-well plate | ThermoFisher Scientific (Waltham, MA) | 07-200-761 | |
| Luminex Magnetic Plate Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0269-01 | |
| Luminex Magnetic Tube Separator (or comparable) | Luminex Corp. (Austin, TX) | CN-0288-01 | |
| MagPlex Microspheres (magnetic, fluorescent, 6.5-µm-diameter beads) | Luminex Corp. (Austin, TX) | MC-1**** (varies by bead label) | |
| Protein LoBind microcentrifuge tubes | ThermoFisher Scientific (Waltham, MA) | 022431081 | |
| Peptides, Antibodies, & Detection Reagents | |||
| Atezolizumab (humanized anti-PDL1 IgG1 monoclonal antibody), positive control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) | |
| Biotinylated recombinant human PDL1 | Sino Biological (Wayne, PA) | 10084-H49H-B | |
| Brilliant Violet 421-congugated donkey anti-human IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 709-675-149 | |
| Brilliant Violet 421-congugated donkey anti-rabbit IgG | Jackson Immunoresearch Laboratories Inc. (Westgrove, PA) | 711-675-152 | |
| Recombinant human PD-1 (poly-histidine tagged) | Acro Biosystems (Newark, DE) | PD1-H5256 | |
| Streptavidin-conjugated R-phycoerythrin (SAPE) | Agilent (Santa Clara, CA) | PJRS34-1 | |
| Trastuzumab (Herceptin, humanized anti-HER2 monoclonal antibody), negative control | Genentech/Roche (San Francisco, CA) | n/a (prescription medications) |
Referenzen
- Kaumaya, P. T. B-cell epitope peptide cancer vaccines: a new paradigm for combination immunotherapies with novel checkpoint peptide vaccine. Future Oncology. 16 (23), 1767-1791 (2020).
- Pandey, P., et al. Revolutionization in cancer therapeutics via targeting major immune checkpoints PD-1, PD-L1 and CTLA-4. Pharmaceuticals. 15 (3), 335 (2022).
- Guo, L., Overholser, J., Good, A. J., Ede, N. J., Kaumaya, P. T. P. Preclinical studies of a novel human PD-1 B-cell peptide cancer vaccine PD1-Vaxx from BALB/c mice to beagle dogs and to non-human primates (cynomolgus monkeys). Frontiers in Oncology. 12, 826566 (2022).
- Brahmer, J. R., Hammers, H., Lipson, E. J. Nivolumab: Targeting PD-1 to bolster antitumor immunity. Future Oncology. 11 (9), 1307-1326 (2015).
- Shah, N. J., Kelly, W. J., Liu, S. V., Choquette, K., Spira, A. Product review on the Anti-PD-L1 antibody atezolizumab. Human Vaccines & Immunotherapeutics. 14 (2), 269-276 (2018).
- Postow, M. A., Sidlow, R., Hellmann, M. D. Immune-related adverse events associated with immune checkpoint blockade. The New England Journal of Medicine. 378 (2), 158-168 (2018).
- Kaumaya, P. T. A paradigm shift: Cancer therapy with peptide-based B-cell epitopes and peptide immunotherapeutics targeting multiple solid tumor types: Emerging concepts and validation of combination immunotherapy. Human Vaccines & Immunotherapeutics. 11 (6), 1368-1386 (2015).
- Guo, L., Kaumaya, P. T. P. First prototype checkpoint inhibitor B-cell epitope vaccine (PD1-Vaxx) en route to human Phase 1 clinical trial in Australia and USA: Exploiting future novel synergistic vaccine combinations. British Journal of Cancer. 125 (2), 152-154 (2021).
- Dakappagari, N. K., Douglas, D. B., Triozzi, P. L., Stevens, V. C., Kaumaya, P. T. Prevention of mammary tumors with a chimeric HER-2 B-cell epitope peptide vaccine. Cancer Research. 60 (14), 3782-3789 (2000).
- Dakappagari, N. K., et al. Conformational HER-2/neu B-cell epitope peptide vaccine designed to incorporate two native disulfide bonds enhances tumor cell binding and antitumor activities. The Journal of Biological Chemistry. 280 (1), 54-63 (2005).
- Kaumaya, P. T., et al. Phase I active immunotherapy with combination of two chimeric, human epidermal growth factor receptor 2, B-cell epitopes fused to a promiscuous Tcell epitope in patients with metastatic and/or recurrent solid tumors. Journal of Clinical Oncology. 27 (31), 5270-5277 (2009).
- Bekaii-Saab, T., et al. Phase I immunotherapy trial with two chimeric HER-2 B-cell peptide vaccines emulsified in montanide ISA 720VG and Nor-MDP adjuvant in patients with advanced solid tumors. Clinical Cancer Research. 25 (12), 3495-3507 (2019).
- Kaumaya, P. T. P., Guo, L., Overholser, J., Penichet, M. L., Bekaii-Saab, T. Immunogenicity and antitumor efficacy of a novel human PD-1 B-cell vaccine (PD1-Vaxx) and combination immunotherapy with dual trastuzumab/pertuzumab-like HER-2 B-cell epitope vaccines (B-Vaxx) in a syngeneic mouse model. Oncoimmunology. 9 (1), 1818437 (2020).
- Guo, L., Overholser, J., Darby, H., Ede, N. J., Kaumaya, P. T. P. A newly discovered PD-L1 B_cell epitope peptide vaccine (PDL1-Vaxx) exhibits potent immune responses and effective anti-tumor immunity in multiple syngeneic mice models and (synergizes) in combination with a dual HER-2 B-cell vaccine (B-Vaxx). Oncoimmunology. 11 (1), 2127691 (2022).
- . Luminex Corporation. The xMAP® Cookbook, 5th edition Available from: https://info.luminexcorp.com/en-us/research/download-the-xmap-cookbook?utm_referrr=https%3A%2F%2Fwww.luminexcorp.com%2F (2022)
- MagPlex® Microspheres Documentation. Product information sheet. Luminex Corporation Available from: https://www.luminexcorp.com/magplex-microspheres/#overview (2014)
- Green, M. R., Sambrook, J. . Estimation of cell number by hemocytometry counting. 2019 (11), (2019).
- Selecting the Detection System - Colorimetric, Fluorescent, Luminescent Methods for ELISA Assays. Corning Inc Available from: https://www.corning.com/catalog/cls/documents/application-notes/CLS-DD-AN-458.pdf (2019)
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten