Isolierung von gezielten hypothalamischen Neuronen zur Untersuchung der hormonellen, metabolischen und elektrischen Regulation
In diesem Artikel
Zusammenfassung
Hier stellen wir ein Protokoll vor, um spezifische Subtypen von Hypothalamuszellen in Kultur zu züchten. Die Zellen können auf der Grundlage geeigneter/einzigartiger Membranmarker ausgewählt und in vielen Anwendungen verwendet werden, einschließlich Immunfluoreszenz, elektrophysiologischer und biochemischer Assays.
Zusammenfassung
Der Hypothalamus reguliert grundlegende Stoffwechselprozesse, indem er so unterschiedliche Funktionen wie Nahrungsaufnahme, Körpertemperatur und Hormonausschüttung steuert. Da die Funktionen des Hypothalamus von bestimmten Untergruppen neuronaler Populationen gesteuert werden, ist die Fähigkeit, sie zu isolieren, ein wichtiges Werkzeug für die Untersuchung von Stoffwechselmechanismen. Die neuronale Komplexität des Hypothalamus stellt in dieser Hinsicht außergewöhnliche Herausforderungen dar.
Aus diesen Gründen wurden neue Techniken, wie z.B. die magnetisch aktivierte Zellsortierung (MACS), erforscht. Diese Arbeit beschreibt eine neue Anwendung der magnetisch aktivierten Zellsortierung (MACS) unter Verwendung der Mikrobead-Technologie, um eine gezielte neuronale Population aus pränatalen Mäusegehirnen zu isolieren. Die Technik ist einfach und garantiert eine hochreine und lebensfähige primäre hypothalamische Neuronenkultur mit hoher Reproduzierbarkeit. Der Hypothalamus wird sanft dissoziiert, Neuronen werden selektiv isoliert und von Gliazellen getrennt, und schließlich wird mit Hilfe eines spezifischen Antikörpers für einen Zelloberflächenmarker die interessierende Population ausgewählt.
Nach der Isolierung können Zielneuronen verwendet werden, um ihre morphologischen, elektrischen und endokrinen Eigenschaften und ihre Reaktionen unter normalen oder pathologischen Bedingungen zu untersuchen. Angesichts der vielfältigen Rolle des Hypothalamus bei der Regulierung von Ernährung, Stoffwechsel, Stress, Schlaf und Motivation kann ein genauerer Blick auf gezielte und regionenspezifische Neuronen einen Einblick in ihre Aufgaben in dieser komplexen Umgebung geben.
Einleitung
Der Hypothalamus ist ein mehrgleisiger Bereich des Gehirns, der endokrine, autonome, viszerale und Verhaltensfunktionen vermittelt, einschließlich Fütterung, Stoffwechsel, Schlaf, Körpertemperatur, Sozialverhalten und Sexualtrieb 1,2,3,4,5. Funktionelle Heterogenität wird durch eine synergistische Kombination biochemischer und elektrischer Mechanismen erreicht: Hypothalamische Neuronen feuern Aktionspotentiale ab und sezernieren und setzen Hormone und Neuropeptide frei, um Gehirnregionen und Organe des Körpers zu modulieren. Schließlich übersetzen hypothalamische Neuronen homöostatische Botschaften aus dem Körper und reagieren mit lang- und kurzfristigem Feedback und Feedforward-Regulierungen6.
Die komplexe neuronale Umgebung des Hypothalamus umfasst magnozelluläre endokrine Neuronen, die Oxytocin und Vasopressin freisetzen; parvozelluläre Neuronen, die in erster Linie an der systemischen Hormonregulation beteiligt sind und z. B. Thyreotropin-Freisetzungshormon (TRH) und Corticotropin-Freisetzungshormon (CRH) an die Hypophyse abgeben; große peptiderge Projektionsneuronen, die Orexin und Melanin-konzentrierendes Hormon (MCH) freisetzen; und parvozelluläre peptiderge Neuronen des Nucleus arcuatus (ARC), die POMC (Proopiomelanocortin) und AgRP (Agouti-verwandtes Protein) freisetzen, die als ARCPOMC bzw. ARCAgRP bezeichnet werden. Zusammen mit sekretorischen Zellen sind andere erregende und inhibitorische Neuronen, einschließlich dopaminerger, glutaminerger und GABAerger Neurone 7, an der Bildung intrahypothalamischer und extrahypothalamischer Schaltkreise beteiligt, wodurch großräumige koordinierte Netzwerke von beträchtlicher zellulärer Heterogenität entstehen8.
Die Diversität des Hypothalamus ist eine Herausforderung, die Forscher in den letzten 50 Jahren zu überwinden versucht haben. Um diese Heterogenität im sich entwickelnden, reifen und alternden Hypothalami zu untersuchen, haben die Forscher einerseits die Einzelzell-RNA-Sequenzierung eingesetzt, um die neuronale Organisation sowie molekulare und transkriptomische Signaturen zu untersuchen. Diese Bemühungen haben einen aufschlussreichen Einblick in die vielfältigen Rollen von Hypothalamus-Neuronen gegeben und sich mit den Zusammenhängen zwischen zellulärer Identität und ihrer möglichen Rolle im physiologischen System befasst 8,9,10. Auf der anderen Seite wurden neuronale Funktionen durch optogenetische Manipulationen und faserphotometrische Verhaltensansätze untersucht, die einen genauen Blick auf die Schaltkreisstruktur ermöglichen. In den letzten zwei Jahrzehnten hat die Cre-Rekombinase-Technologie es Forschern ermöglicht, eine bestimmte Gruppe von Neuronen ontogenetisch zu stimulieren oder zu hemmen und gleichzeitig Veränderungen im Verhaltenund in Körperreaktionen zu beobachten 6,11,12.
Diese Ansätze untersuchen jedoch die Funktionen des Hypothalamus aus einer allgemeinen Perspektive, ohne tiefer in die spezifischen zellulären Mechanismen oder die biologischen Grundlagen für ihre Rolle innerhalb der komplexen hypothalamischen Umgebung einzutauchen. Um dieses Problem anzugehen, haben sich nur sehr wenige Studien auf die Untersuchung molekularer, biochemischer und elektrischer Eigenschaften unter Verwendung heterogener primärer Hypothalamuskulturen konzentriert. Diese Studien zielten darauf ab, spezifische neuronale Prozesse in einer komplexen Umgebung zu analysieren und integrative Modelle physiologischer Mechanismen zu generieren13,14,15. Nichtsdestotrotz stellen unspezifische Kulturen große Herausforderungen dar. Zum Beispiel werden die physiologische Konnektivität und die anatomische Verteilung der Neuronen gestört, indem Neuronen aus verschiedenen hypothalamischen Regionen plattiert werden, die normalerweise nicht interagieren würden, was zu Störeffekten führt. Darüber hinaus hat jede Region unterschiedliche Rollen und vielfältige neuronale Populationen, was es schwierig macht, einfache biologische Prozesse zu untersuchen.
Um diesen Herausforderungen zu begegnen, wurden in den letzten zehn Jahren neue Ansätze zur Isolierung von Neuronen von Interesse implementiert, wie z. B. Immunopanning, Fluoreszenz-aktivierte-Zell-Sortierung (FACS) und Magnetisch-aktivierte-Zell-Sortierung (MACS). Immunopanning ist eine Strategie zur Aufreinigung von Zielzellen unter Verwendung von Antikörperschalen für eine Reihe von nicht-neuronalen (negativen) und neuronalen (positiven) Selektionen. Während diese Technik im Prinzip gereinigte Zellkulturen mit hoher Ausbeute erzeugen könnte, wird sie in der Praxis hauptsächlich für Astrozyten und Oligodendrozyten verwendet, da diese Zellen stundenlanger Manipulation widerstehen können16,17. Die FACS-Technologie ist ein leistungsstarkes Werkzeug zur Sortierung von Zellen auf der Grundlage von Fluoreszenzmarkern und zellulären Merkmalen mithilfe der Durchflusszytometrie18,19,20. Allerdings nutzten nur sehr wenige Studien diese Methode, um Zellen für die Zellkultur zu isolieren. Die Technik ist teuer und erfordert hochqualifiziertes Personal für die Anwendung und Wartung. Darüber hinaus ist es eine Herausforderung, lebensfähige und sterile Zellen am Ende des Sortierverfahrens21 zu erhalten. Insgesamt scheint MACS eine einfache, kostengünstige Technik zu sein, um hochreine und lebensfähige Kulturen von hypothalamischen primären Neuronen zu erhalten. Bei der Methode werden magnetische Kügelchen verwendet, die über einen Antikörper mit den Zellen verbunden sind. Dadurch können die Zellen mit Hilfe des Magnetfeldes der Säule isoliert werden.
Hier beschreiben wir eine Methode, die auf der MACS-Technologie basiert, die typischerweise bei kortikalen Neuronen eingesetzt wird. Dieses Protokoll ermöglicht es, im Prinzip lebensfähige und hochreine hypothalamische Neuronen zu isolieren. In dieser Studie präparieren wir Primärkulturen von Neuronen, die den Leptinrezeptor (LepR) exprimieren, wie z.B. ARCPOMC und ARCAgRP Neuronen, die nur im Nucleus arcuatus vorhanden sind. Diese Neuronen reagieren auf Leptin, ein magersüchtiges Hormon, das vom Fettgewebe ausgeschüttet wird, auf biochemische und elektrische Weise. Daher ermöglicht die Isolierung dieser Gruppe von Neuronen in Kultur die Untersuchung ihrer hormonellen, metabolischen und elektrischen Eigenschaften in vitro.
Protokoll
ANMERKUNG: Eine allgemeine Ansicht des Versuchsverfahrens ist in Abbildung 1A grafisch dargestellt. Alle Experimente mit Mäusen, die in dieser Studie durchgeführt wurden, wurden vom Animal Care and Use Committee (IACUC) unserer Institution genehmigt. Wir verwendeten 3 Monate alte C57BL6/J-Mäuse, die in einem von der Association for Assessment and Accreditation of Laboratory Animal Care International (AAALAC) zugelassenen Vivarium unter der Obhut eines Tierarztes untergebracht waren. Die Mäuse lebten in großen Käfigen mit einem 12-stündigen Hell-Dunkel-Zyklus und wurden ad libitum gefüttert.
1. Bestätigung der Empfängnis und Schwangerschaft
- Platzieren Sie Mäuse mit beliebigem Hintergrund und Genotyp für die Zucht. Notieren Sie das Datum und das Gewicht des Weibchens vor der Empfängnis.
- Nach 6 Stunden wird das Weibchen mit einer Sonde auf eine Plaque untersucht. Wenn die Plaque vorhanden ist, trennen Sie das Weibchen vom Männchen. Wenn die Plaque nicht vorhanden ist, halten Sie das Weibchen bis zum nächsten Tag im Käfig und trennen Sie dann die Mäuse.
- An den Tagen 7, 10 und 14 nach der Empfängnis wird das Weibchen gewogen, um die Schwangerschaft zu bestätigen.
2. Medien, 24-Well-Platte und Materialvorbereitung
- Am Tag der Zellisolierung werden gebrauchsfertige, mit Poly-D-Lysin beschichtete Glasdeckgläser (siehe Materialtabelle) wie folgt in eine 24-Well-Platte gelegt:
- Sterilisieren Sie unter einer biologischen Haube eine einzelne Packung mit 15 Deckgläsern mit 70 % Ethanol und lassen Sie sie trocknen. Öffnen Sie die Packung und legen Sie die Deckgläser in eine 60-mm-Platte. Schütteln Sie die Platte horizontal, um die Deckgläser zu trennen. Drehen Sie dann die Platte um, um einzelne Deckgläser aufzunehmen, die in die Vertiefungen einer 24-Well-Platte gelegt werden sollen.
- Waschen Sie die Deckgläser einmal 5 Minuten lang mit 1,0 ml steriler Hank's Balanced Salt Solution (HBSS).
- Bereiten Sie in der Zwischenzeit 20,0 ml Beschichtungsmedium wie folgt vor: Zu 18,31 ml BME (Basal Medium Eagle + Earle's Salts), ergänzt mit 1,0 ml hitzeinaktiviertem fötalem Kälberserum (FBS), fügen Sie 200 μl Natriumpyruvat (aus einem 100-fachen Stamm), 200 μl Glutamin (aus einem 200-nM-Stamm) und 100 μl Penicillin/Streptomycin (aus einem 200-fachen Stamm) hinzu.
- Ersetzen Sie das HBSS in den Vertiefungen durch 1,0 ml Beschichtungsmedium und legen Sie die Platte bei 37 °C in den Inkubator.
- Mit einem Bunsenbrenner drei Pasteurpipetten mit abnehmendem Durchmesser auf Feuer polieren. Halten Sie die Pipette mit einer Hand fest, stecken Sie die Spitze in die Flamme und entfernen Sie sie schnell. Wiederholen Sie den Vorgang, bis sich die Spitze glättet und der Durchmesser auf den gewünschten Durchmesser (Beurteilung mit Auge) reduziert ist.
3. Reagenzienvorbereitung für die neuronale Gewebedissoziation gemäß den Anweisungen des neuronalen Dissoziationskits
- Nachdem Sie den Aufschlusspuffer 1 bei Raumtemperatur erwärmt haben, bereiten Sie Enzymmischung 1 vor, indem Sie 50 μl Enzym 1 mit 1,91 ml Puffer 1 mischen, und Enzymmischung 2, indem Sie 15 μl Enzym 2 mit 30 μl Aufschlusspuffer 2 mischen. Die Mischungen reichen aus, um für das gesamte Gehirngewebe der Embryonen verwendet zu werden.
- Bereiten Sie 0,5 % Rinderserumalbumin (BSA) in HBSS vor, z. B. 0,25 g in 50,0 ml HBSS.
4. Entnahme von Embryonen
- Autoklavieren Sie zwei gerade feine Pinzetten, eine gebogene Punktzange und eine feine chirurgische Schere und sterilisieren Sie sie vor Gebrauch mit 70%igem Ethanol. Füllen Sie dann die Petrischalen mit HBSS.
- Euthanasieren Sie eine trächtige E14-E16-Mutter in der CO2 - Kammer und führen Sie eine Zervixluxation durch.
HINWEIS: Die folgenden Schritte müssen unter der Haube unter sterilen Bedingungen durchgeführt werden: - Sterilisieren Sie den Bauch mit 70%igem Ethanol. Schneiden Sie die Bauchhöhle von der Schambeinfuge bis zum Processus xiphoideus des Brustkorbs mit einer chirurgischen Schere und einer Pinzette auf.
- Entnehmen Sie das Gebärmutterhorn und legen Sie es in eine 100 mm große Platte, die mit eiskaltem HBSS gefüllt ist, und waschen Sie es gründlich.
- Entnehmen und trennen Sie alle Embryonen mit einer feinen Pinzette aus der Gebärmutter. Enthaupten Sie die Embryonen schnell mit einer feinen chirurgischen Schere und/oder Pinzette. Legen Sie die Köpfe in die mit HBSS gefüllte 60-mm-Petrischale.
5. Hypothalamus-Extraktion, -Entnahme und -Gewebedissoziation
- Platzieren Sie eine feine Pinzette in der Augenhöhle, um das Gehirn zu halten. Entfernen Sie mit der anderen feinen Pinzette die Haut und den Schädel, indem Sie sie abziehen, bis das Gehirn sichtbar ist. Unterscheiden Sie das Gehirn von anderen Geweben anhand seines weißen Aussehens. Haut und Schädel sind rosa und reich an Gefäßen.
- Entferne das Gehirn aus dem Schädel, indem du die gebogene Pinzette verwendest, und schaube das Gehirn aus den Riechkolben heraus, indem du es auf den Kopf stellst.
- Jetzt ist der Kortex ventral und der Hypothalamus dorsal auf der oberen Oberfläche sichtbar (Abbildung 1B). Entfernen Sie mit der gebogenen Pinzette die Schicht der Hirnhäute und Blutgefäße, bis das Gehirn weiß und klar erscheint.
- Trennen Sie mit der gekrümmten Zange den Hypothalamusbereich vom Rest des Gehirns.
- Schneiden Sie den Hypothalamus in 3-4 kleine Stücke und geben Sie die Stücke mit einer Pipette in ein 15-ml-Röhrchen.
- Wiederholen Sie die Schritte für die anderen Embryonen, während der Eileiter auf Eis liegt.
- Füllen Sie das Röhrchen mit 6,0 ml HBSS und lassen Sie das Gewebe absetzen, entfernen Sie den Überstand und fügen Sie Enzymmischung 1 hinzu. Mischen und rühren Sie das Röhrchen vorsichtig, um das Gewebe zu verhindern.
- Inkubieren Sie das Röhrchen 15 Minuten lang in einem 37 °C warmen Wasserbad und schütteln Sie das Gewebe alle 5 Minuten, um das Gewebe zu resuspendieren.
- Nach 15 Minuten 30 μl Enzymmischung 2 hinzufügen. Dissoziation des Hirngewebes mit der Pipette Pasteur mit dem größten Durchmesser (<1 mm). 10x auf- und abpipettieren, ohne Blasen zu bilden.
- 10 min bei 37 °C im Wasserbad inkubieren. Bewegen Sie den Schlauch vorsichtig, um das Gewebe alle 5 Minuten zu resuspendieren.
- Nach 10 Minuten die restlichen 15 μl Enzymmischung 2 hinzufügen. Dissoziieren Sie das Gewebe 10x mit den beiden anderen feuerpolierten Pipetten mit abnehmendem Durchmesser nach oben und unten, ohne Blasen zu bilden.
- In das Röhrchen mit dem dissoziierten Gewebe werden sofort 10,0 ml HBSS-0,5% BSA gegeben und bei 300 × g 10 Minuten bei Raumtemperatur zentrifugiert.
- Saugen Sie den Überstand ab und resuspendieren Sie das Zellpellet in 1,0 ml HBS-0,5% BSA.
6. Zählung der Zellen
- Verdünnen Sie die Zellsuspension im Verhältnis 1:5 mit HBSS-0,5% BSA.
- 10 μl der verdünnten Zellsuspension in eine Neubauer-Zählkammer geben.
- Zählen Sie unter einem Hellfeldmikroskop nur die Zellen, die sich in den Eckquadraten der vier Kammer befinden. Berechnen Sie den Durchschnitt und multiplizieren Sie ihn mit 5 × 104.
HINWEIS: Stellen Sie sicher, dass >106 Zellen vorhanden sind, um mit der Zellisolierung fortzufahren. Die optimale Zellzahl ist 107.
7. Negative Auswahl
HINWEIS: Die negative Selektion ermöglicht es Benutzern, eine reine primäre Neuronenkultur zu erhalten, indem neuronale und nicht-neuronale Zellen getrennt werden. Verwenden Sie vorgekühlte Lösungen.
- Zentrifugieren Sie die Zellsuspension bei 300 × g für 3 min (die Zentrifugation kann auf bis zu 10 min verlängert werden). Saugen Sie den Überstand vorsichtig an und resuspendieren Sie das Pellet auf eine Konzentration von 10bis 7 Zellen in 80 μl HBSS-0,5 % BSA.
- 20 μl Nicht-neuronaler Zell-Biotin-Antikörper-Cocktail zugeben und 5 Minuten bei 4 °C inkubieren.
- Waschen Sie die Zellen, um den freien Antikörper zu entfernen, mit 2,0 ml HBSS-0,5% BSA und zentrifugieren Sie sie 3 Minuten lang bei 300 × g .
- Saugen Sie den Überstand vorsichtig an und resuspendieren Sie das Pellet in 80 μl HBSS-0,5% BSA. Fügen Sie 20 μl Antibiotin-Mikrokügelchen hinzu, mischen Sie sie gründlich und inkubieren Sie 10 Minuten lang bei 4 °C.
- Fügen Sie 0,5 ml HBSS-0,5% BSA für bis zu 107 Zellen hinzu und warten Sie, bis die Magnetsäule fertig ist.
8. Magnetische Trennung, negative Selektion
HINWEIS: Die magnetische Trennung ist ein entscheidender Schritt, der die Trennung der nicht-neuronalen Zellen von den neuronalen Zellen ermöglicht. Die Probe, die neuronale und nicht-neuronale Zellen enthält, wird durch das Magnetfeld geleitet und die nicht-neuronalen Zellen, die an einen Biotin-Antikörper-Magnet-Bead-Komplex gebunden sind, werden in der Säule gefangen (Abbildung 1C). Die freien neuronalen Zellen werden durch die Säule eluiert und in einem 15-ml-Röhrchen gesammelt.
- Bereiten Sie den Ständer (im Kit enthalten) mit dem Separator und der MS-Säule vor, wie in Abbildung 1C gezeigt.
- Öffnen Sie die Säule und stellen Sie den Ständer erst auf, wenn die Zellen zum Trennen bereit sind.
- Spülen Sie die Säule mit 0,5 ml HBSS-0,5% BSA. Warten Sie, bis die Lösung nicht mehr tropft.
- Um neuronale Zellen zu sammeln, legen Sie ein 15-ml-Röhrchen unter die Säule und führen Sie 0,5 ml der Zellsuspension durch die Säule. Sammeln Sie das Eluat im Röhrchen, bis es nicht mehr tropft. Um verbleibende neuronale Zellen einzufangen, waschen Sie die Säule 3 x 0,5 ml HBSS-0,5% BSA.
- Um nicht-neuronale Zellen zu sammeln, entfernen Sie die Säule aus dem Magneten und legen Sie sie in ein neues 15-ml-Röhrchen. Geben Sie 1,0 ml HBSS-0,5 % BSA in die Säule und verwenden Sie den Kolben, um die magnetisch markierten nicht-neuronalen Zellen zu sammeln.
- Zentrifugieren Sie die neuronalen und nicht-neuronalen Zellen bei 300 × g für 3 Minuten. Saugen Sie den Überstand vorsichtig an und resuspendieren Sie die Zellen in 1,0 ml HBSS-0,5% BSA. Zählen Sie die Zellen wie zuvor in Abschnitt 6 beschrieben.
- Bei Bedarf werden die nicht-neuronalen Zellen in einer 24-Well-Platte plattiert. Andernfalls verwerfen Sie sie.
9. Positive Selektion
HINWEIS: Sobald eine reine neuronale Zellsuspension erhalten wurde, wird eine positive Selektion durchgeführt, um die Zielzellen zu isolieren. Zellen können isoliert werden, indem ein spezifischer Biotin-konjugierter Antikörper für ein Oberflächenantigen verwendet wird. Der Antikörper wird von Antibiotin-Magnetkügelchen erkannt. Durch das Fließen der Zellsuspension durch die Säule werden nur die interessierenden Zellen im Magnetfeld gefangen.
- Zentrifugieren Sie die reine neuronale Zellsuspension bei 300 × g für 3 min. Saugen Sie den Überstand vorsichtig an und resuspendieren Sie das Pellet in 80 μl HBSS-0,5% BSA. Fügen Sie den spezifischen Antikörper gemäß den Anweisungen des Herstellers hinzu und inkubieren Sie ihn 10 Minuten lang bei 4 °C.
HINWEIS: Wenn Zellen gesucht werden, die LepR exprimieren, empfehlen wir einen biotinylierten Maus-Leptin-R-Antikörper (siehe Materialtabelle) in einer Konzentration von 0,50 μg/106 Zellen. - Waschen Sie den überschüssigen Antikörper mit 2,0 ml HBSS-0,5% BSA ab und zentrifugieren Sie ihn 3 Minuten lang bei 300 × g .
- Entfernen Sie den Überstand, resuspendieren Sie das Pellet in 80 μl HBSS-0,5% BSA und fügen Sie 20 μl Anti-Biotin-Mikrokügelchen hinzu. Bei 4 °C 10 min inkubieren.
- Alle 10 bis 7 Zellen 0,5 ml HBSS-0,5 % BSA zugeben und warten,bis die magnetische Säule fertig ist.
10. Magnetische Trennung, positive Selektion
- Bereiten Sie den Ständer mit dem Separator und der MS-Säule vor. Spülen Sie die MS-Säule mit 0,5 ml HBSS-0,5% BSA. Warten Sie, bis das Tropfen aufhört.
- Platzieren Sie ein 15-ml-Röhrchen unter der Säule, leiten Sie 0,5 ml der Zellsuspension durch die Säule und sammeln Sie das Eluat, das die unspezifischen neuronalen Zellen enthält. Um die Säule von verbleibenden unspezifischen neuronalen Zellen zu reinigen, waschen Sie sie mit 3 x 0,5 ml HBSS-0,5% BSA.
- Entfernen Sie die Säule vom Magneten, legen Sie sie in ein neues 15-ml-Röhrchen und fügen Sie 1,0 ml HBSS-0,5% BSA hinzu. Verwenden Sie den Kolben, um die Zielzellen auszuspülen.
- Beide Röhrchen bei 300 × g für 3 min zentrifugieren. Entfernen Sie den Überstand vorsichtig und suspendieren Sie ihn wieder in 0,5 ml Beschichtungsmedium.
- Zählen Sie die Zellen wie zuvor in Abschnitt 6 beschrieben.
- Platte sowohl Zielzellen als Positivkontrolle als auch unspezifische Zellen als Negativkontrolle bei einer Dichte von 120.000 bis 200.000 Zellen/mm3 in der zuvor wie in Abschnitt 2 beschriebenen 24-Well-Platte und Inkubation bei 37 °C bei 5 % CO2, 9 % O2 und 95 % Luftfeuchtigkeit für12 Stunden.
11. Pflege der Zellkultur
- Bereiten Sie 20 ml Nährmedium mit 19,2 ml neuronalem Kulturmedium, 400 μl B27-Präparat (aus einem 50-fachen Stamm), 200 μl Glutamin (aus einem 200-μM-Stamm) und 100 μl Penicillin/Streptomycin (aus einem 200-fachen Stamm) vor.
- Ersetzen Sie das Beschichtungsmedium von der 24-Well-Platte, die neuronale oder nicht-neuronale Zellen enthält.
- Mit 2 x 1,0 ml HBSS waschen.
- Fügen Sie 1,0 ml Nährmedien hinzu.
- Aktualisieren Sie das Medium alle 2/3 Tage, indem Sie 0,5 ml alte Medien durch 0,5 ml frische Medien ersetzen.
HINWEIS: Zellen können in Kultur gehalten und bis zu 21 Tage in vitro verwendet werden (DIV21).
12. Immunfluoreszenzfärbung von Neuronen
- Zwölf Stunden vor der Färbung wird eine Lösung aus 50/50 Methanol und Aceton hergestellt und über Nacht bei -20 °C abgekühlt.
- Waschen Sie die Neuronen in der 24-Well-Platte mit 2 x 1,0 ml 1x phosphatgepufferter Kochsalzlösung (PBS) für 5 Minuten.
- Ersetzen Sie die PBS-Lösung durch 1,0 ml der 50/50-Lösung und inkubieren Sie sie 20 Minuten lang in Eis.
- Mit 1x PBS für 3 x 5 Min. waschen.
- Blockieren Sie die Neuronen mit 3% BSA in 1x PBS für 1 h bei Raumtemperatur.
- Bereiten Sie die primäre Antikörperlösung in 3% BSA in 1x PBS unter Verwendung der in den Anweisungen des Herstellers angegebenen Antikörperkonzentration vor. Die verwendeten Antikörper und Konzentrationen sind in der Materialtabelle aufgeführt.
- Die blockierende Lösung wird durch die primäre Antikörperlösung ersetzt und über Nacht bei 4 °C inkubiert.
- Waschen Sie die Zellen für 3 x 10 min mit 1x PBS.
- Bereiten Sie die Sekundärantikörperlösung mit 3% BSA in 1x PBS unter Verwendung der Konzentrationen der Antikörper gemäß den Anweisungen des Herstellers vor. Die verwendeten Sekundärantikörper sind in der Materialtabelle aufgeführt.
- Inkubieren Sie die Zellen mit der sekundären Antikörperlösung bei Raumtemperatur für 1 h.
- Waschen Sie die Zellen für 3 x 10 min mit 1x PBS.
- Lassen Sie die Neuronen während des Montagevorgangs in 1x PBS. Geben Sie einen kleinen Tropfen Eindeckmedium (mit oder ohne 4',6-Diamidino-2-phenylindol zur nuklearen Identifizierung) auf den Objektträger. Ziehen Sie mit einer Pinzette ein Deckglas mit Neuronen heraus und klopfen Sie die Seite des Deckglases auf ein Papiertuch, um das überschüssige PBS zu trocknen. Drehen Sie das Deckglas auf das Eindeckmedium und stellen Sie sicher, dass die Neuronen zu den Objektträgern zeigen. Drücken und entfernen Sie das überschüssige Eindeckmedium vorsichtig mit Seidenpapier.
- Die Objektträger können mit einem Hellfeld- oder Konfokalmikroskop analysiert werden.
Ergebnisse
In dieser Arbeit wird ein Protokoll zur Isolierung von Zielneuronen des Hypothalamus beschrieben (Abbildung 1). Ziel der Methode ist es, spezifische neuronale Eigenschaften in einem kontrollierten und isolierten Kontext zu untersuchen. So wurden den trächtigen Muttertieren bei E14-E16 Mäuseembryonen entnommen. Die Hirnhäute wurden entfernt und der Hypothalamus vom Rest des Gehirns isoliert. Das Gewebe wurde vorsichtig mit zwei Mischungen von Enzymen dissoziiert, die mit dem referenzierten Dissoziationskit frisch hergestellt wurden. Zuerst wurden nicht-neuronale Zellen von neuronalen Zellen getrennt - Glia, Mikroglia und Neuronen wurden in derselben Einzelzellsuspension gesammelt. Zu diesem Zweck wurden nicht-neuronale Zellen mit einem Cocktail von Antikörpern markiert, die nicht-neuronale Oberflächenepitope erkennen. Nach der Inkubation wurde der Antikörper-Zell-Komplex mit magnetischen Mikrokügelchen konjugiert und anschließend durch eine magnetische Säule geleitet, um die nicht-neuronalen Zellen einzufangen.
Dieser Schritt ergab zwei Zellsuspensionen, von denen eine nicht-neuronale und die andere neuronale Zellen enthielt. Beide Aufhängungen konnten sofort plattiert werden. Alternativ könnte die neuronale Zellsuspension weiter manipuliert werden, um eine neuronale Subpopulation (gezielte Suspension) mit der gleichen Strategie vom Rest zu trennen. Basierend auf dem interessierenden Experiment können die neuronalen Zellen von 125.000 bis 200.000 Zellen/mm3 plattiert werden. Die weniger dichten Kulturen können verwendet werden, um Neuronen mit Einzelzellauflösung zu analysieren: von der axonalen Entwicklung, der synaptischen Bildung und der Übertragung bis hin zur Elektrophysiologie. Die dichteren Kulturen können für biochemische Analysen verwendet werden, einschließlich DNA- und RNA-Extraktion, Western Blot, Southern Blot, Northern Blot, Real-Time-PCR und RNA-Sequenzierung.
In dieser Studie wurde LepR gezielt eingesetzt, um Neuronen zu isolieren, die am Melanocortin-System beteiligt sind, wie z. B. dieARC-POMC- undARC-AgRP-Neuronen. Die Zellen wurden mit Dichten von 120.000 Zellen/mm3 für LepR+-Neuronen bis 200.000 Zellen/mm3 für generische neuronale Populationen plattiert. Nach 48 h begannen LepR+-Neuronen Neuriten zu bilden (Abbildung 2). Bei DIV4 zeigten die axonalen Extensions Fortschritte, während dendritische Prozesse auftraten. Bei DIV6 waren die Neuronen ausreichend entwickelt und konnten daher analysiert werden. Immunfluoreszenzexperimente an LepR+-Neuronen zeigten eine 99%ige Expression von LepR (grün, Abbildung 3A). Es wurden keine Gliazellen oder andere nicht-neuronale Zellen beobachtet, was die Reinheit der primären neuronalen Kultur bestätigt. Die neuronale Natur der Zellen wurde durch die Färbung des Mikrotubuli-assoziierten Proteins 2 (MAP2) bestätigt, wobei Axone und dendritische Ausstülpungen identifiziert wurden (Abbildung 3B). Bei DIV10 exprimierten 30% der LepR+-Zellen POMC (rot). Dies ist zu erwarten, da die Mehrheit der LepR+-Zellen entweder POMC oder AgRP exprimiert. Abbildung 3C,D veranschaulicht die Kolokalisierung zwischen POMC- und LepR-Signalen. Beachten Sie, dass die Kolokalisation erwartungsgemäß am und um den Kern herum ausgeprägt war.
Zur Kontrolle wurden allgemeine Kulturen verwendet, die heterogene hypothalamische neuronale Populationen enthielten. Die Immunfluoreszenz zeigte synaptische Konnektivität und Funktionalität, wie durch die Ko-Färbung von Synapsin-1 (grün) und PSD 95 (rot) beurteilt wurde (Abbildung 4A,B). Die Anzahl der LepR+-Neuronen in der allgemeinen Kultur betrug ~5%, ein Prozentsatz, der mit der Vorstellung übereinstimmt, dass die Mehrheit der LepR-exprimierenden Neuronen während des magnetischen Trennungsprozesses selektiert worden war (repräsentative LepR+-Zellen sind in Abbildung 4C,D dargestellt). Alle Daten, die während dieser Studie generiert oder analysiert wurden, sind unter https://doi.org/10.5061/dryad.cnp5hqc9c verfügbar.
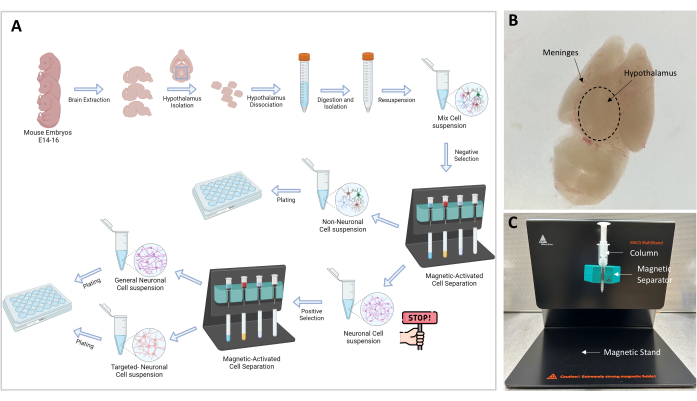
Abbildung 1: Experimentelles Flussdiagramm und Aufbau . (A) Grafische Darstellung des Versuchsablaufs. Go-no-go: ≥106 Zellen sind notwendig, um mit der Zellisolierung fortzufahren; Die optimale Zellzahl ist 107. (B) Repräsentatives Bild eines E16-Embryo-Gehirns. Der Hypothalamus und die Hirnhäute sind indiziert. (C) MACS-Aufbau für die Trennung und Isolierung von Zielzellen. Magnetständer, Magnetabscheider und Säule sind gekennzeichnet. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
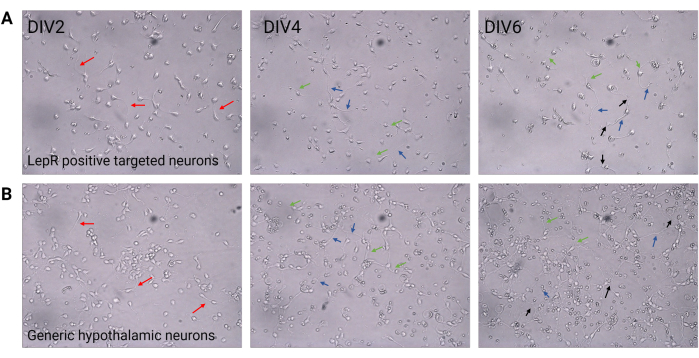
Abbildung 2: Neuronale Kultur zwischen DIV2 und DIV6. (A) LepR+-Zellen, die aus der positiven Selektion gewonnen wurden, zeigen eine reduzierte Zelldichte und Konnektivität, aber eine normale Entwicklung von Neuriten (rote Pfeile), Axone (blaue Pfeile) und Dendriten (grüne Pfeile). Die Zellen wurden mit einer Dichte von 120.000 Zellen/mm3 plattiert. Maßstabsbalken = 100 μm. (B) Generische hypothalamische Neuronen, die mit einer Dichte von 200.000 Zellen/mm3 plattiert sind, zeigen normale Entwicklungs- und Wachstumsmerkmale und Konnektivität (schwarze Pfeile). Maßstabsbalken = 100 μm. Abkürzungen: DIV = Tage in vitro; LepR = Leptinrezeptor. Alle Daten, die generiert oder analysiert wurden, um diese Zahl zu konstruieren, sind auf https://doi.org/10.5061/dryad.cnp5hqc9c verfügbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
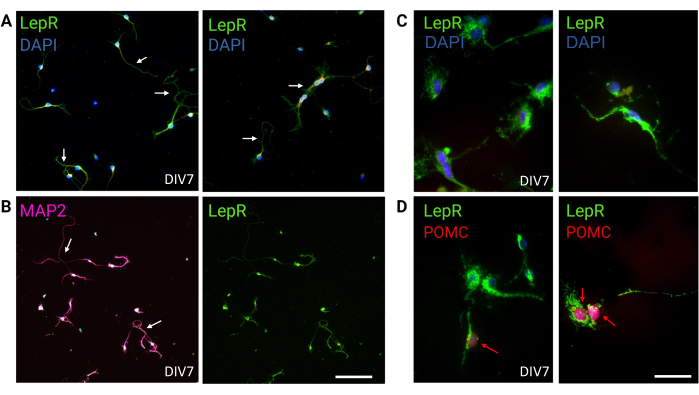
Abbildung 3: In-vivo-Neuronen werden von kultivierten LepR+-Neuronen rekapituliert. (A) Repräsentative Bilder einer Kultur von Neuronen, die den LepR exprimieren (grün; DAPI ist blau). Neunundneunzig Prozent der Zellen exprimierten den LepR. Neuronen wurden mit einer Dichte von 120.000 Zellen/mm3 plattiert. Bei DIV7 zeigten die Neuronen verlängerte Axone, dendritische Reifung und neuronale Konnektivität (Pfeile). Maßstabsleiste = 40 μm. (B) Immunfluoreszenz mit Anti-MAP2 wurde verwendet, um die neuronale Natur der Zellen zu bestätigen. Neuronal-spezifische Morphologien wie Axone, Dendriten und Ausstülpungen werden demonstriert (Pfeile). Maßstabsleiste = 40 μm. (C) Vergrößerung von LepR+-Zellen. LepR in Grün und DAPI in Blau. Maßstabsleiste = 10 μm. (D) Co-Färbung mit LepR (grün) und POMC (rot). Etwa 30 % der LepR+-Neuronen waren co-immunreaktiv gegenüber POMC, das auf der Ebene des Zellkerns nachgewiesen wurde (rote Pfeile). Maßstabsleiste = 10 μm. Abkürzungen: DAPI = 4',6-Diamidino-2-phenylindol; MAP2 = Mikrotubuli-assoziiertes Protein 2; POMC = Proopiomelanocortin; LepR = Leptinrezeptor. Alle Daten, die generiert oder analysiert wurden, um diese Zahl zu konstruieren, sind auf https://doi.org/10.5061/dryad.cnp5hqc9c verfügbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
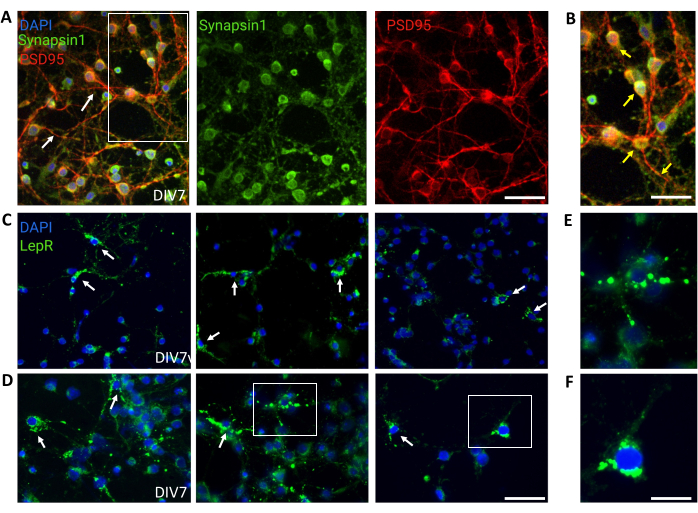
Abbildung 4: In-vivo-Zellen werden von kultivierten generischen hypothalamischen Neuronen rekapituliert. (A) Repräsentative Bilder einer generischen hypothalamischen neuronalen Kultur, gefärbt mit Synapsin 1 (grün), PSD95 (rot) und DAPI (blau). Die Neuronen wiesen eine gut entwickelte Konnektivität und synaptische Funktionalität auf (Pfeile). Maßstabsleiste = 40 μm. (B) Vergrößerung des Kastens in (A), der die Kolokalisation von Synapsin 1 (grün) und PSD95 (rot, Pfeile) zeigt. Maßstabsbalken = 20 μm. (C,D) Repräsentative Bilder, die LepR+ Zellen in einer Allgemeinkultur zeigen. LepR+-Zellen (grün) machten ~5% der Gesamtmenge aus. Repräsentative LepR+-Zellen sind durch Pfeile gekennzeichnet. Maßstabsleiste = 40 μm. (E,F) Vergrößerungen der Kästchen in (C,D) mit grünen Puncta-Leptin-Rezeptoren, die am Soma lokalisiert sind. Maßstabsbalken = 20 μm. Alle Daten, die generiert oder analysiert wurden, um diese Zahl zu konstruieren, sind auf https://doi.org/10.5061/dryad.cnp5hqc9c verfügbar. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Diskussion
Die Untersuchung der biochemischen und elektrischen Eigenschaften von Hypothalamus-Neuronen ist der Schlüssel zum Verständnis der molekularen Grundlagen des Stoffwechsels, der Thermoregulation, des Stimmungsmanagements, des Fressverhaltens und mehr. Die neuronale Heterogenität des Hypothalamus macht diese Bemühungen jedoch zu einer Herausforderung, und es werden Methoden benötigt, um spezifische hypothalamische Subpopulationen zu isolieren und zu untersuchen.
In-vivo-Techniken verwenden CRE-Rekombinase, Optogenetik, Faserphotometrie und Kalziumbildgebung. Diese Ansätze ermöglichen in erster Linie die Untersuchung der elektrischen Eigenschaften von hypothalamischen Neuronen, und es gibt derzeit nur sehr wenige Methoden, um ihre nicht-elektrischen Eigenschaften zu untersuchen. Die in dieser Studie entwickelte MACS-Technologie könnte eine Technik darstellen, die es ermöglicht, spezifische hypothalamische neuronale Subpopulationen in vitro zu isolieren und so gezielte Behandlungen und Analysen zu ermöglichen. Neuronale Kulturen sind im Vergleich zu Kokulturen verschiedener neuronaler Populationen einfacher zu handhaben. Darüber hinaus vermeiden Reinkulturen Störeffekte, die sich aus dem Vorhandensein von Glia- und Mikroglia ergeben. So konnten Neuronen aus der gleichen Hypothalamusregion und dem gleichen Hypothalamustyp als Reaktion auf spezifische metabolische und hormonelle Inputs untersucht werden.
In diesem Protokoll haben wir hypothalamische Neuronen ausgewählt, die den LepR exprimieren. Isolierte LepR+-Zellen wurden kultiviert, um ihre zellulären, morphologischen und molekularen Eigenschaften zu untersuchen, die in vivo nur schwer zu untersuchen sind.Die Reinheit der Kulturen lag bei 99 %, was die Genauigkeit der Methode unterstützt. Darüber hinaus waren die LepR+-Zellen bei DIV7 bis DIV21 gesund und lebensfähig.
Diese Technik hat jedoch einige Einschränkungen. E18 oder ältere reine Neuronenkulturen sind schwierig zu pflegen. Daher ist das Extraktionsfenster auf E14-E16 beschränkt. Dies impliziert, dass zelluläre Veränderungen, die nach E16 auftreten, übersehen werden. Zum Beispiel nimmt die Expression des Leptinrezeptors in ARC-Neuronen während der frühen postnatalen Phase zu22. Das Verfahren zur Isolierung muss so schnell wie möglich durchgeführt werden, um Zellstress und -tod zu reduzieren und die Ausbeute zu verbessern. Der Eingriff kann bis zu 5 Stunden dauern; Daher ist es wichtig, sterile Bedingungen aufrechtzuerhalten und die Manipulation auf das notwendige Minimum zu reduzieren. Die positive Selektion kann aufgrund der geringen Mengen an verfügbarem Gewebe zu einer geringen Ausbeute führen, was die Anzahl der Experimente, die mit einem einzigen Präparat durchgeführt werden können, begrenzt. Es wurde ein erhöhter neuronaler Tod beobachtet, wahrscheinlich aufgrund einer geringen Zelldichte und einer reduzierten neuronalen Konnektivität und intraneuronalen Unterstützung.
Darüber hinaus muss der Antikörper, der auf das betreffende Antigen abzielt, an die Zelloberfläche binden, um eine korrekte Trennung zu gewährleisten. In der Regel sind Antikörper, die für die Durchflusszytometrie verwendet werden, für die MACS-Technik geeignet. Wenn der Antikörper bisher noch nicht in Zelltrennungsmethoden verwendet wurde, sind Validierungs- und Titrationsexperimente erforderlich, um die ideale Verwendung und Konzentration zu bestimmen. Für die Extraktion von Zielzellen ist ein Zelloberflächenmarker erforderlich. Hier haben wir einen biotinylierten Antikörper verwendet, aber prinzipiell können auch Antikörper verwendet werden, die mit anderen Molekülen konjugiert sind, wie z.B. FITC (Fluoresceinisothiocyanat) und PE (gereinigtes Anti-Phycoerythrin). Die MACS-Technologie könnte auch auf Neuronen angewendet werden, die ein Fluorophor wie GFP oder ein anderes Tag-Protein exprimieren, was möglicherweise die Spezifität und Ausbeute erhöht. Wenn kein Fluorophor verwendet wird, besteht die Alternative darin, die Expression des interessierenden Moleküls durch Immunfluoreszenz zu bestätigen, bevor Lebendzellexperimente durchgeführt werden. Zukünftige Studien werden die Validität dieser Alternativen testen.
Ein wichtiger Aspekt, der in dieser Studie nicht angesprochen wurde, betrifft die "Treue" der subneuronalen Populationen. Wir stellten fest, dass die kultivierten LepR+-Neuronen POMC exprimierten, was eine Signatur nativerARC-POMC-Neuronen ist. Es sind jedoch weitere Tests erforderlich, um zu dem Schluss zu kommen, dass die neuronalen LepR+-Kulturen ihre nativen In-vivo-Gegenstücke rekapitulieren. Insgesamt könnte das hier vorgestellte neuronale MACS-Isolationsprotokoll eine valide und effektive Methode zur Untersuchung von in vitro hypothalamischen Mechanismen darstellen, die sonst in vivo nur schwer zu untersuchen wären.
Offenlegungen
Die Autoren erklären, dass sie keine Interessenkonflikte haben.
Danksagungen
Mit BioRender.com wurden grafische Figuren erstellt. Diese Arbeit wurde durch einen NIA-Zuschuss (R01AG060919) und einen NSF-Zuschuss (2030348) an FS unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Embryo extraction | |||
| 1 curved point forceps | Fine Science Tools | 11270-20 | Dumont |
| 1 fine surgical scissor | Fine Science Tools | 14058-11 | Dumont |
| 100 mm Petri dish | Corning | 430167 | |
| 2 straight fine forceps | Fine Science Tools | 11254-20 | Dumont |
| 60 mm Petri dish | Corning | 430196 | |
| 70% ethanol | Decon Laboratories, INC. | 2801 | Ethanol 190 Proof |
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Bench pads | |||
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Cell Culture | |||
| Anti-Biotin MicroBeads 1mL | Miltenyi Biotec | 130-115-390 | |
| Bovine Serum Albumin | Sigma-Aldrich | A9418-50G | |
| Buffer Y | Miltenyi Biotec | 130-094-802 | |
| Buffer Z | Miltenyi Biotec | 130-094-802 | |
| Enzyme A | Miltenyi Biotec | 130-094-802 | |
| Enzyme P | Miltenyi Biotec | 130-094-802 | |
| GG-12-1.5, 12 mm dia.#1.5 thick 100 pc cell culture tested German coverglasses | Neuvitro Corporation | GG-12-15 | |
| Gibco B-27 Supplement 10 mL | ThermoFisher | 17504-044 | |
| Gibco Basal Medium Eagle (BME) 500 mL | ThermoFisher | 21010046 | (+) Earle's Salts, (-) L-Glutamine |
| Gibco HBBS (1x) Hanks' Balanced Salt Solution 500 mL | ThermoFisher | 14025092 | Calcium, Magnesium, No phenol red |
| Gibco HI FBS 100 mL | ThermoFisher | 16140-063 | |
| Gibco L-Glutamine 200 mM (100x) | ThermoFisher | 25030-081 | |
| Gibco Penicilline/Streptomicine | ThermoFisher | 15140-122 | 10,000 U/mL |
| Gibco Sodium Pyruvate (100 mM) 100 mL | ThermoFisher | 11360070 | |
| MiniMACS Separator and Starting Kit | Miltenyi Biotec | 130-042-102 | |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 0.25 μg/106 cells |
| MS Column | Miltenyi Biotec | 130-042-201 | |
| Neaubeaur-Improved Brightline 100 µm Chamber | Hausser Scientific | 3120 | |
| Neural Tissue Dissociation Kit - Postnatal Neurons | Miltenyi Biotec | 130-094-802 | |
| Neuronal Culture Medium 500 mL | ThermoFisher | 88283 | |
| Non-Neuronal Cell Biotin-Antibody Cocktail mouse 1 mL | Miltenyi Biotec | 130-115-389 | |
| Olympus SZ61 Zoom Stereomicroscope | Olympus Life Science | SZ61/SZ51 | |
| Pierce Primary Neuron Isolation Kit | ThermoFisher | 88280Y | |
| Staining | |||
| Anti-MAP2 antibody | Abcam | ab5392 | 1 : 800 |
| Donkey anti-Mouse IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32766 | 1 : 500 |
| Donkey anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 488 | ThermoFisher | A32790 | 1 : 500 |
| Dulbecco's Phosphate Buffered Saline (DPBS) | Sigma Aldrich | MFCD00131855 | |
| Goat anti-Chicken IgY (H+L) Cross-Adsorbed Secondary Antibody, Alexa Fluor Plus 647 | ThemoFisher | A32933 | 1 : 500 |
| Goat anti-Rabbit IgG (H+L) Highly Cross-Adsorbed Secondary Antibody, Alexa Fluor 594 | ThermoFisher | A11037 | 1 : 200 |
| Invitrogen Leptin Receptor Recombinant Rabbit Monoclonal Antibody (JA73-01) | ThermoFisher | MA5-32685 | 1 : 500 |
| Mouse Leptin R Biotinylated Antibody | R&D Systems | ABAF497 | 1 : 500 |
| POMC Rabbit mAb | Cell Signaling Technology | D3R1U | 1 : 500 |
| PSD95 (D74D3) XP Rabbit mAb | Cell Signaling Technology | D74D3#3409 | 1 : 500 |
| Streptavidin, Alexa Fluor 594 conjugate | ThermoFisher | S11227 | 1 : 500 |
| Synapsin 1 Monoclonal Antibody (7H10G6) | ThermoFisher | MA5-31919 | 1 : 500 |
| Vectashield Plus Antifade Mountina Medium with DAPI 10 mL | Vector Laboratories | H-2000 |
Referenzen
- Cone, R. D. Anatomy and regulation of the central melanocortin system. Nature Neuroscience. 8 (5), 571-578 (2005).
- Clarke, I. J. Hypothalamus as an endocrine organ. Comprehensive Physiology. 5 (1), 217-253 (2015).
- Mignot, E., Taheri, S., Nishino, S. Sleeping with the hypothalamus: emerging therapeutic targets for sleep disorders. Nature Neuroscience. 5 Suppl, 1071-1075 (2002).
- Baird, A. D., Wilson, S. J., Bladin, P. F., Saling, M. M., Reutens, D. C. Neurological control of human sexual behaviour: insights from lesion studies. Journal of Neurology, Neurosurgery, and Psychiatry. 78 (10), 1042-1049 (2007).
- Caria, A., Dall, O. G. Functional neuroimaging of human hypothalamus in socioemotional behavior: a systematic review. Brain Sciences. 12 (6), 707 (2022).
- Andermann, M. L., Lowell, B. B. Toward a wiring diagram understanding of appetite control. Neuron. 95 (4), 757-778 (2017).
- Romanov, R. A., Alpar, A., Hokfelt, T., Harkany, T. Unified classification of molecular, network, and endocrine features of hypothalamic neurons. Annual Review of Neuroscience. 42, 1-26 (2019).
- Hajdarovic, K. H., Yu, D., Webb, A. E. Understanding the aging hypothalamus, one cell at a time. Trends in Neurosciences. 45 (12), 942-954 (2022).
- Zhang, Y. H., et al. Cascade diversification directs generation of neuronal diversity in the hypothalamus. Cell Stem Cell. 28 (8), 1483-1499 (2021).
- Chen, R., Wu, X., Jiang, L., Zhang, Y. Single-cell RNA-seq reveals hypothalamic cell diversity. Cell Reports. 18 (13), 3227-3241 (2017).
- Ma, C., et al. Neural pathways from hypothalamic orexin neurons to the ventrolateral preoptic area mediate sleep impairments induced by conditioned fear. Frontiers in Neuroscience. 17, 1122803 (2023).
- Wang, F., et al. A parabrachial to hypothalamic pathway mediates defensive behavior. Elife. 12, e85450 (2023).
- Cowley, M. A., et al. Leptin activates anorexigenic POMC neurons through a neural network in the arcuate nucleus. Nature. 411 (6836), 480-484 (2001).
- Parekh, R. U., et al. Hypothalamic kinin B1 receptor mediates orexin system hyperactivity in neurogenic hypertension. Scientific Reports. 11 (1), 21050 (2021).
- Schmidt, C. X., Tsang, A. H., Oster, H. Generation of mouse primary hypothalamic neuronal cultures for circadian bioluminescence assays. Bio-protocol. 11 (5), e3944 (2021).
- Foo, L. C. . Purification of rat and mouse astrocytes by immunopanning. 2013 (5), 421-432 (2013).
- Emery, B., Dugas, J. C. . Purification of oligodendrocyte lineage cells from mouse cortices by immunopanning. 2013 (9), 854-868 (2013).
- Zhao, H., et al. Changes of constituents and activity to apoptosis and cell cycle during fermentation of tea. International Journal of Molecular Sciences. 12 (3), 1862-1875 (2011).
- Zhang, Z. M., et al. Down-regulation of human leukocyte antigens class I on peripheral T lymphocytes and NK cells from subjects in region of high-incidence gastrointestinal tumor. Chinese Medical Journal. 124 (12), 1813-1817 (2011).
- Drake, S. S., Zaman, A., Simas, T., Fournier, A. E. Comparing RNA-sequencing datasets from astrocytes, oligodendrocytes, and microglia in multiple sclerosis identifies novel dysregulated genes relevant to inflammation and myelination. WIREs Mechanisms of Disease. 15 (2), e1594 (2023).
- Mattanovich, D., Borth, N. Applications of cell sorting in biotechnology. Microbial Cell Factories. 5, 12 (2006).
- Cottrell, E. C., et al. Developmental changes in hypothalamic leptin receptor: relationship with the postnatal leptin surge and energy balance neuropeptides in the postnatal rat. American Journal of Physiology. Regulatory, Integrative and Comparative Physiology. 296 (3), R631-R639 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten