Dioszin-vermittelte Linderung der IgA-Nephropathie durch Hemmung der B-Zell-Aktivierung in vivo und Verringerung der Galaktose-defizienten IgA1-Produktion in vitro
In diesem Artikel
Zusammenfassung
Diese Studie liefert experimentelle Daten zur Behandlung der Immunglobulin-A-Nephropathie (IgAN) mit Dioscin (DIO), dem Wirkstoff des Dioscoreae Nipponicae Rhizoma (DNR), und ein Paradigma für die Untersuchung der Wirkungen der Pflanzenheilkunde und der zugrunde liegenden Mechanismen in vivo und in vitro.
Zusammenfassung
Der Anstieg des zirkulierenden Galaktose-defizienten IgA1 (Gd-IgA1) wird durch eine übermäßige Aktivierung von IgA-positiven sekretorischen Zellen im Prozess der mukosalen Immunantwort verursacht, was ein kritisches Glied in der Pathogenese der IgA-Nephropathie (IgAN) darstellt. Das Peyer-Pflaster, die prominente Stelle, an der B-Lymphozyten in IgA-sezernierende Plasmazellen umgewandelt werden, ist die Hauptquelle für IgA. Darüber hinaus steht die geringere Expression der kernigen 1β-1,3-Galactosyltransferase (C1GalT1) und ihres molekularen Chaperons, des C1GalT1-spezifischen molekularen Chaperons (Cosmc), im Zusammenhang mit einer abnormalen Glykosylierung von IgA1 bei IgAN-Patienten. Unsere klinische Erfahrung zeigt, dass das pflanzliche Arzneimittel von Dioscoreae Nipponicae Rhizoma (DNR) Proteinurie und Hämaturie lindern und die Nierenfunktion bei IgAN-Patienten verbessern kann. Dioscin (DIO) ist einer der Hauptwirkstoffe von DNR, der verschiedene pharmakologische Aktivitäten hat. In dieser Studie wird der mögliche Mechanismus von DIO bei der Behandlung von IgAN untersucht.Die IgAN-Modellmaus wurde durch mukosale Immuninduktion etabliert. Die Mäuse wurden in die Kontroll-, Modell- und DIO-Sondengruppe eingeteilt. Die glomeruläre IgA-Ablagerung bei Mäusen, pathologische Veränderungen der Nieren und die B-Zell-Marker CD20 und CXCR5 in Peyers Patch wurden durch Immunfluoreszenz und Immunhistochemie nachgewiesen. Nach der Stimulation durch Lipopolysaccharid (LPS) wurden die Auswirkungen von DIO auf die Proliferation von DAKIKI-Zellen, die IgA- und Gd-IgA1-Sekretion, C1GalT1 und die Cosmc-Expression mittels Cell Counting Kit-8 (CCK-8)-Assay, ELISA-Test (Enzyme-linked Immunosorbent Assay), quantitativer Echtzeit-Polymerase-Kettenreaktion (QRT-PCR) und Western Blotting (WB) untersucht. In in vivo Studien wurde die IgA-Ablagerung, begleitet von einer glomerulären mesangialen Hyperplasie und einer erhöhten Expression von CD20 und CXCR5 im Peyer-Patch in der IgAN-Modellmaus, durch DIO gemildert. In-vitro-Studien zeigten, dass 0,25 μg/ml bis 1,0 μg/ml DIO die LPS-induzierte DAKIKI-Zellproliferation, die IgA- und Gd-IgA1-Sekretion hemmten und die mRNA- und Proteinexpression von C1GalT1 und Cosmc hochregulierten. Diese Studie zeigt, dass DIO die Gd-IgA1-Produktion reduzieren kann, indem es die übermäßige Aktivierung von IgA-sezernierenden Zellen hemmt und die C1GALT1/Cosmc-Expression hochreguliert.
Einleitung
Die IgA-Nephropathie (IgAN) ist die häufigste Form der primären Glomerulonephritis, für die es keine spezifische Behandlung gibt, und sie ist nach wie vor eine wichtige Ursache für Nierenerkrankungen im Endstadium1. Obwohl die Pathogenese von IgAN noch nicht vollständig verstanden ist, wird die "Multi-Hit-Hypothese" allgemein akzeptiert und durch eine große Anzahl klinischer und experimenteller Forschungsergebnisse gestützt2. Die Pathogenese von IgAN beinhaltet die Aktivierung von B-Zellen und die Produktion von Galactose-defizientem IgA1 (Gd-IgA1)3. Die Zunahme des zirkulierenden Gd-IgA1 aufgrund der übermäßigen Proliferation und Aktivierung von IgA-sezernierenden Zellen während der mukosalen Immunantwort ist ein kritisches Glied in der Pathogenese von IgAN 4,5,6. Als zentraler Ort für die Proliferation und Aktivierung der Umwandlung des B-Lymphozyten-Phänotyps in IgA-sezernierende Zellen ist das Peyer-Pflaster die primäre Quelle für die IgA-Sekretion, die eng mit dem Auftreten und der Entwicklung von IgAN zusammenhängt 7,8. Darüber hinaus waren die Proliferation von IgA1-sezernierenden Zellen sowie die Expression von Core 1β-1,3-Galactosyltransferase (C1GalT1) und C1GalT1-spezifischem molekularem Chaperon (Cosmc) mit einer abnormalen Glykosylierung von IgA1 verbunden, die bei IgAN-Patienten eine GD-IgA1-Produktion verursacht 6,9.
Die klinische Studie zur Behandlung von IgAN mit pflanzlichen Arzneimitteln hat in den letzten Jahren Fortschritte gemacht. Die Yiqi Qingjie-Formel ist eine essentielle Formel zur Behandlung von IgAN durch die Abteilung für Nephrologie des Guang'anmen-Krankenhauses. Die vorherige Studie unserer Gruppe ergab, dass Gd-IgA1 im Serum von IgAN-Patienten nach der Behandlung mit Yiqi Qingjie Formula abnahm. Als eines der am häufigsten verwendeten Kräuter in der Yiqi Qingjie-Formel ist Dioscoreae Nipponicae Rhizoma (DNR) das getrocknete Rhizom von Dioscorea Nipponica Makino, das verschiedene Funktionen wie die Regulierung der Immunität, die Unterdrückung von Entzündungen, die Linderung von Husten und Asthma hat10,11. Mehrere Gelehrte behandelten IgAN mit DNR und erzielten gute Ergebnisse 12,13,14. Als Hauptwirkstoff in DNR15 senkt Dioscin (DIO) die Harnsäure, hemmt die Fibrose, hemmt die Entzündungsreaktion und antioxidativen Stress16,17. Daher könnte DIO einen neuartigen Wirkmechanismus aufweisen, um die zelluläre Sekretion von überschüssigem Gd-IgA1 zu hemmen und spezifische Nierenschutzeffekte auszuüben. Dennoch wurde keine Studie über den Wirkmechanismus von DIO bei der Behandlung von IgAN berichtet.
Um den potenziellen therapeutischen Mechanismus von DIO auf IgAN zu erforschen und eine neue Methode für die Behandlung von IgAN bereitzustellen, haben wir Experimente zu den therapeutischen Effekten von DIO auf IgAN in vivo und in vitro durchgeführt.
Protokoll
Die Ethikkommission des Guanganmen-Krankenhauses genehmigte dieses Experiment (ethische Genehmigungsnummer für Tierversuche: IACUC-GAMH-2023-003).
1. Vorbereitung der Mäuse auf das experimentelle Verfahren
- Ziehen Sie 22 männliche Balb/c-Mäuse mit Lichtschutzfaktor (6-7 Wochen alt, Körpergewicht 20-25 g) in der Tiereinrichtung des Krankenhauses/Forschungszentrums auf. Teilen Sie die Tiere mit der Zufallstabellenmethode in Kontroll- (n = 8) und Modellgruppen (n = 14) ein.
- Nach 1 Woche adaptiver Aufzucht im Laborkäfig füttern Sie die Modellgruppe (IgAN-Gruppe) 9 Wochen lang mit 0,1%iger Rinder-Gammaglobulin-Lösung (BGG) in angesäuertem Wasser mit einem Gehalt von 6 mmol/L HCl gemäß dem Modellierungsprotokoll von Zou et al.18.
- Injizieren Sie 0,1 ml 0,1% ige BGG-Lösung in Kochsalzlösung in die Schwanzvene an 3 aufeinanderfolgenden Tagen, während Sie weiterhin BGG-Lösung trinken, um ein IgAN-Versuchsmaus Modell18 vorzubereiten.
- Lassen Sie die Kontrollgruppe 9 Wochen lang frei 6 mmol/L HCl gesäuertes Wasser ohne BGG trinken. Injizieren Sie das entsprechende Volumen Kochsalzlösung für aufeinanderfolgende 3 Tage in die Schwanzvene.
HINWEIS: Die Kontroll- und Modellgruppen wurden in der gleichen Qualität wie normales Futter gefüttert. - Nach der Schwanzveneninjektion wählen Sie nach dem Zufallsprinzip 2 Mäuse in der Kontrollgruppe und 2 Mäuse in der Modellgruppe aus und untersuchen sie mittels Proteinurie, Lichtmikroskopie und Immunfluoreszenz, um festzustellen, ob die Modellierung erfolgreich war.
HINWEIS: Den Tieren wird kein Futter zur Verfügung gestellt, aber es ist ihnen nicht verboten, Wasser zu trinken. Zeichnen Sie die Urinausscheidung auf. - Sammeln Sie den Urin für 24 h in Stoffwechselkäfigen und zentrifugieren Sie ihn 5 Minuten lang bei 400 x g ; Entsorgen Sie Urinsedimente. Nach einer 10-fachen Verdünnung des Überstands ist die Proteinurie-Konzentration mit einem Urinprotein-Assay-Kit zu messen und dann mit dem Verdünnungsfaktor und dem Urinvolumen zu multiplizieren, um 24 h Gesamturinprotein zu erhalten.
HINWEIS: Mikroskopie und Immunfluoreszenzmethoden sind in den Abschnitten 3 bzw. 4 dargestellt. - Nach erfolgreicher Vorbereitung des Modells teilen Sie 12 Mäuse der Modellgruppe in 6 Mäuse auf, jeweils in der Modellgruppe (IgAN-Gruppe) und der DIO-Sondengruppe (DIO-Gruppe), nach der Zufallszahltabellenmethode.
- Die Kontrollgruppe trinke weiterhin 6 mmol/L HCl angesäuertes Wasser ohne BGG und die Modellgruppe 0,1% ige BGG-Lösung, die aus angesäuertem Wasser mit 6 mmol/L HCl besteht. Berechnen Sie die Dosis der Verabreichung einer DIO-Gruppensonde gemäß der Dosisumwandlungsformel der pharmakologischen experimentellen Methodik (umgerechnet nach der menschlichen Körpermasse von 70 kg)19. Sonde DIO Tabletten 0,06 g/kg einmal täglich für 8 Wochen.
- Nach 8-wöchiger Sonde werden die Mäuse intraperitoneal mit 0,4 % Pentobarbital-Natrium (60 mg/kg) betäubt und nach Bestätigung der ordnungsgemäßen Anästhesie durch Zehenkneifen die Nieren und das Peyer-Pflaster für nachfolgende lichtmikroskopische und immunhistochemische Analysen isoliert.
HINWEIS: Das Schema für das In-vivo-Modell ist in der ergänzenden Abbildung 1 dargestellt.
2. Histologische Analyse
- Paraffinschnitte für Nieren und Peyer-Pflaster
- 3 mm dickes Nierengewebe oder 1 Peyer-Pflaster mit 4% Paraformaldehyd 24 h fixieren, mit Gradientenethanol und Xylol dehydrieren. 2 h in Wachs tauchen, versiegeln und einfrieren.
- Schneiden Sie 2 μm dicke Nierenschnitte und 4 μm dicke Peyer-Patch-Abschnitte ab und verteilen Sie sie in warmem Wasser. Die entfalteten Scheiben mit einem sauberen Glasschieber aufheben und im Backofen bei konstanter Temperatur bei 40 °C 1 h backen. Beginnen Sie mit der Färbung nach der Vorbearbeitung der Probe.
HINWEIS: Nehmen Sie die koronale Oberfläche des hilären Teils der Niere mit einer Dicke von 3 mm Gewebeblock.
- Entwachsen und färben Sie die Paraffinabschnitte bei Raumtemperatur (RT) für 10 Minuten mit periodischer saurer Lösung, wobei Sie Licht vermeiden sollten. Mit destilliertem Wasser abspülen und die Flecken 20-30 Minuten lang trocken wischen, dabei Licht vermeiden. Spülen Sie mit destilliertem Wasser ab, bis die Schnitte unter dem Mikroskop rot sind.
- Legen Sie die Schnitte in Hämatoxylin-Färbelösung, färben Sie die Kerne 3 Minuten lang (zu tief gefärbte Zellkerne können durch Ethanolhydrochlorid geteilt werden) und spülen Sie sie mit fließendem Wasser ab, bis die Objektträger farblos sind.
- Führen Sie eine routinemäßige Dehydrierung mit Gradientenkonzentrationen von Ethanol und Xylol durch, versiegeln Sie die Schnitte mit neutralem Gummi und betrachten Sie sie unter einem Mikroskop. PAS-positiv ist rot und der Zellkern blau.
3. Immunhistochemische Analyse des Peyer-Pflasters
- Bereiten Sie Paraffinabschnitte des Peyer-Pflasters vor, wie in Schritt 2.1 beschrieben.
HINWEIS: Die Dicke der Schnitte für die immunhistochemische und anschließende Immunfluoreszenz beträgt 4 μm. - Entwachse die Paraffinabschnitte:
- Legen Sie die Schnitte für 5 min in Xylol I, 5 min in Xylol II und 5 min in Xylol III.
- Spülen Sie die Objektträger weiterhin 5 min lang mit wasserfreiem Ethanol I, 5 min mit wasserfreiem Ethanol II, 5 min mit 85 % Alkohol und 5 min mit 75 % Alkohol. Spülen Sie dann die Objektträger in destilliertem Wasser ab.
- Antigen-Rückgewinnung
- Bereiten Sie eine 50%ige Stammlösung von Natriumcitrat vor und verdünnen Sie sie mit destilliertem Wasser auf 1x zur Verwendung. Erhitzen Sie es 2 Minuten lang in einem Autoklaven und legen Sie dann die Scheiben in den Autoklaven, wobei Sie darauf achten, dass der Flüssigkeitsstand den Wert der Scheiben übersteigt.
- 5 Minuten bei hoher Temperatur erhitzen, dann die Objektträger natürlich abkühlen lassen. Waschen Sie die Scheiben dreimal mit PBS-Lösung für jeweils 5 Minuten.
- Blockierung der endogenen Peroxidase: Markieren Sie die Ränder des Gewebes in einem Kreis mit einem immunhistochemischen Stift. Inkubieren Sie die Schnitte 15 Minuten lang in 3%iger Wasserstoffperoxidlösung bei RT, geschützt vor Licht, und waschen Sie die Schnitte dreimal jeweils 5 Minuten lang mit PBS-Lösung.
- Serumblockierung: Blockieren Sie die Abschnitte, indem Sie 10 % Ziegenserum auf die markierten Gewebeabschnitte für 30 Minuten bei RT tropfen. Stellen Sie sicher, dass die Abschnitte gleichmäßig mit dem Fleck bedeckt sind.
- Inkubation des Primärantikörpers: Schütteln Sie die Blockierungslösung vorsichtig ab und fügen Sie einen Teil des vorbereiteten Primärantikörpers (CD20 [1:800]; CXCR5 [1:800]) an den Abschnitt an. Legen Sie das Profil flach in eine Nassbox und inkubieren Sie es über Nacht bei 4 °C.
HINWEIS: Geben Sie eine kleine Menge Wasser in die Nassbox, um eine Verdunstung des Antikörpers zu verhindern. - Inkubation von Sekundärantikörpern: Waschen Sie die Schnitte dreimal 5 Minuten lang mit PBS-Lösung. Entfernen Sie PBS, indem Sie die Schnitte trocken schütteln, bedecken Sie das Gewebe mit einem Tropfen Sekundärantikörper (HRP-Markierung) der verwandten Spezies des Primärantikörpers und inkubieren Sie es 50 Minuten lang bei RT.
- 3,3'-Diaminobenzidin (DAB) Homogenisierung: Waschen Sie die Schnitte dreimal für jeweils 5 min mit PBS-Lösung. Nachdem Sie die Schnitte trocken geschüttelt haben, geben Sie die frisch zubereitete DAB-Chromogenlösung auf die Schnitte. Beobachten Sie die Farbentwicklungszeit unter dem Mikroskop; Das Positiv ist bräunlich-gelb. Mit Leitungswasser nachspülen, um die Farbentwicklung zu stoppen.
- Färben der Zellkerne: Färben Sie erneut mit Hämatoxylin für ca. 1 min., waschen Sie es mit Leitungswasser und spülen Sie es dann 10 min lang mit Leitungswasser ab, um wieder blau zu werden.
- Dehydrierung und Versiegelung:
- Legen Sie die Abschnitte 5 min lang in 75 % Alkohol und 5 min in 85 % Alkohol. Legen Sie die Abschnitte 5 min lang in wasserfreies Ethanol I, 5 min in wasserfreies Ethanol II und 5 min in wasserfreies Ethanol III.
- Die Abschnitte 5 min in Xylol I waschen, zum leichten Trocknen herausnehmen und mit neutralem Gummi versiegeln.
- Bildaufnahme: Sammeln Sie Bilder durch mikroskopische Untersuchung und analysieren Sie sie mit der Halo-Software für die Panoramabildanalyse des Gewebes.
HINWEIS: Hämatoxylin-gefärbte Zellkerne sind blau, und eine DAB-positive Expression wird als bräunlich-gelb beobachtet.
4. Nieren-IgA-Immunfluoreszenz
- Bereiten Sie Paraffinschnitte für die Nieren vor, wie in Schritt 2.1 beschrieben.
- Paraffinabschnitte entwachen:
- Legen Sie die Schnitte für 5 min in Xylol I, 5 min in Xylol II und 5 min in Xylol III. Die Abschnitte in wasserfreiem Ethanol I, wasserfreiem Ethanol II, 95 % Ethanol, 90 % Ethanol, 80 % Ethanol, 70 % Ethanol und 50 % Ethanol jeweils 5 Minuten lang behandeln und mit destilliertem Wasser waschen.
- Proteinase K-Entnahme: Schütteln Sie die Schnitte trocken und ziehen Sie mit einem histochemischen Stift einen Kreis um den Gewebeschnitt. Geben Sie die Proteinase K-Arbeitslösung (1:9-Verhältnis aus Stammlösung und PBS) tropfenweise zu, um das Gewebe zu bedecken, und inkubieren Sie es 30 Minuten lang bei 37 °C. Waschen Sie die Abschnitte dreimal mit PBS für jeweils 5 Minuten.
- Durchdringen der Zellmembran: Schütteln Sie die Abschnitte leicht trocken und bedecken Sie sie anschließend mit 0,1 % Triton. Inkubieren Sie 20 Minuten lang bei RT und waschen Sie die Abschnitte dreimal mit PBS für jeweils 5 Minuten.
- Blockierung: Fügen Sie 10% Ziegenserum tropfenweise hinzu, um das Gewebe gleichmäßig zu bedecken, um es bei RT für 30 Minuten zu blockieren.
- Inkubation des Primärantikörpers: Geben Sie eine angemessene Menge des Anti-Maus-Anti-Maus-IgA-Antikörpers (1:500) tropfenweise zu, um das Gewebe gleichmäßig zu bedecken, und inkubieren Sie es über Nacht bei 4 °C.
- Färbekern: Waschen Sie die Scheiben dreimal mit PBS für jeweils 5 Minuten. Nach dem Entfernen des PBS den 4′,6-Diamidino-2-phenylindol (DAPI)-Farbstoff tropfenweise auf die Schnitte geben und 15 min bei RT lichtgeschützt inkubieren.
- Waschen und versiegeln Sie die Abschnitte: Waschen Sie die Abschnitte dreimal 5 Minuten lang mit PBS und versiegeln Sie sie dann mit einem lichtbeständigen Eindeckmedium.
- Mikroskopie und Fotografie: Betrachten Sie die Schnitte unter dem Fluoreszenzmikroskop und machen Sie Bilder.
HINWEIS: Bei DAPI beträgt die ultraviolette Anregung eine Wellenlänge von 330-380 nm und die Emissionswellenlänge von 420 nm für blaues Licht. Die Anregungswellenlänge von Fluoresceinisothiocyanat (FITC) beträgt 465-495 nm und die Emissionswellenlänge 515-555 nm, grünes Licht.
5. Zellkultur
- Beziehen Sie die humane B-Lymphozytenlinie DAKIKI von ATCC, USA. Kultur von DAKIKI-Zellen in RPMI-1640-Medium, ergänzt mit 10 % FBS und 1 % Penicillin-Streptomycin.
- Kultivieren Sie die Zellen in einem 37 °C heißen Inkubator mit 5 % CO2 und subkultivieren Sie sie alle 2-3 Tage. Verwenden Sie für alle Experimente Zellen in der logarithmischen Wachstumsphase.
- Bei 70%-80% Konfluenz entnehmen Sie die Zellen mit einer sterilen Pipette und zentrifugieren Sie die Zellen bei 140 x g für 5 min. Den Überstand verwerfen, mit dem serumfreien Medium resuspendieren und nach 24 h alle Zellen für die nachfolgende Behandlung in einer Ruhephase belassen.
6. LDH-Zytotoxizitätsassays zum Screening sicherer DIO-Konzentrationen auf normalen DAKIKI-Zellen
- SAKIKI-Zellen in 96-Well-Platten mit einer Dichte von 4x105 Zellen/Well aussäen und eine niedrige Kontrollgruppe, eine hohe Kontrollgruppe und unterschiedliche DIO-Konzentrationen (0,25, 0,5, 1,0, 2,0, 4,0, 8,0 μg/ml) einrichten. Nach entsprechender Behandlung nach der Gruppierungsmethode 24 h in einem Inkubator mit 5 % CO2, 37 °C inkubieren.
- Geben Sie gemäß den Anweisungen des Zytotoxizitätsnachweis-Kits 5 μl Lysat pro Vertiefung in die hohe Kontrollgruppe und legen Sie die Platte dann für 15 Minuten in einen 5 % CO2 -, 37 °C-Inkubator.
- Nehmen Sie die Platte heraus, geben Sie 100 μl des Reaktionsgemisches in jede Vertiefung, inkubieren Sie 10 Minuten lang im Dunkeln bei RT und fügen Sie dann 50 μl der Stoppreaktionslösung hinzu. Messen Sie den OD-Wert bei 490 nm so schnell wie möglich auf dem Mikroplatten-Reader.
- Berechnen Sie die LDH-Freisetzungsrate verschiedener Konzentrationen von DIO und ≤10 % als maximale Dosis, die gemäß der Formel verabreicht wird: LDH-Freisetzungsrate = (experimentelle Vertiefung LDH - niedrige Kontroll-LDH) / (hohe Kontroll-LDH - niedrige Kontroll-LDH) x 100 %.
7. CCK-8-Assay zum Nachweis der Wirkung von DIO auf die Proliferation von DAKIKI-Zellen
- Basierend auf den Ergebnissen unserer vorangegangenen Experimente20 etablieren wir ein IgAN-Modell mit LPS 40 μg/ml zur Induktion von DAKIKI-Zellen.
- Säen Sie dann 4x105 Zellen/Well in 96-Well-Platten und teilen Sie sie in die Kontroll-, Modell- und DIO-Gruppen mit niedriger, mittlerer und hoher Konzentration (0,25 μg/ml, 0,5 μg/ml und 1,0 μg/ml) auf. Inkubieren Sie die Platten 24 h lang in einem Inkubator mit 5 % CO2 , 37 °C.
- Geben Sie dann 20 μl CCK-8-Reagenz in jede Vertiefung und legen Sie die Platten für 2 Stunden zurück in den Inkubator (5 % CO2, 37 °C). Weisen Sie nach der Inkubation den OD bei einer Wellenlänge von 450 nm so bald wie möglich auf dem Mikroplatten-Reader nach.
8. ELISA zum Nachweis der Wirkung von DIO auf die Sekretion von IgA und Gd-IgA1 durch DAKIKI-Zellen
- DAKIKI-Zellen in 6-Well-Platten mit einer Dichte von 6x106 Zellen/Well säen und die Zellen gemäß Schritt 7.2 gruppieren und behandeln. Die Zellen werden 24 h lang kultiviert, dann 10 min lang bei 4 °C bei 850 x g zentrifugiert, um den Überstand zu erhalten.
- Ermitteln Sie die IgA- und Gd-IgA1-Konzentrationen gemäß den Anweisungen des Kits.
9.qRT-PCR zum Nachweis der Wirkung von DIO auf C1GALT1- und Cosmc-mRNA-Spiegel in DAKIKI-Zellen
- Die DAKIKI-Zellen mit einer Dichte von 6x106 Zellen/Well in eine 6-Well-Platte aussäen, die Zellen gruppieren und als CCK8 behandeln, wie in Schritt 7.2 erwähnt, und 24 Stunden inkubieren. Extrahieren Sie die Gesamt-RNA aus DAKIKI-Zellen gemäß den Anweisungen des Gesamt-RNA-Extraktionskits.
- Nachdem Sie 1 μl extrahierte RNA aus jeder Probengruppe entnommen und deren Konzentration gemessen haben, transkribieren Sie umgekehrt 1 μg Gesamt-RNA aus jeder Probe in cDNA gemäß den Anweisungen des Kits.
- Führen Sie dann eine RT-PCR-Amplifikation durch, um die Expression jedes Gens nachzuweisen (95 °C für 15 Minuten, 95 °C für 10 s und 60 °C für 30 s). Berechnen Sie das Expressionsniveau jedes Gens mit der 2-ΔΔCT-Methode mit β-Aktin als interner Referenz.
HINWEIS: Die Primersequenzen waren wie folgt:
C1GALT1: 5'-AAGGTTGACACCCAGCCTAA-3', 5'-CTTTGACGTGTTTGGGGCCTTT-3';
Cosmc: 5'-GCTCCTTTTTGAAGGGTGTG-3', 5'-TACTGCAGCCCAAAGACTCA-3';
β-Aktin: 5'-TCACCCACACTGTGCCCATCTACGA-3', 5'-CAGCGGAACCGCTCATTGCCAATGG-3'.
10. Western Blotting zur Untersuchung der Wirkung von DIO auf die Expression von C1GALT1- und Cosmc-Proteinen in DAKIKI-Zellen
- Aussaat der DAKIKI-Zellen mit einer Dichte von 6x106 Zellen/Well in einer 6-Well-Platte. Gruppieren und behandeln Sie sie wie in Schritt 7.2 beschrieben. Nach 24 Stunden Inkubation sammeln Sie jede Zellgruppe.
- Eine angemessene Menge Zelllyselösung (PMSF: Phosphatasehemmer: RIPA-Lyselösung = 1:1:100) zugeben und 30 min auf Eis inkubieren. Anschließend bei 13.500 x g für 10 min bei 4 °C zentrifugieren und den Überstand auffangen.
- Bestimmen Sie die Proteinkonzentration mit dem BCA-Proteinkonzentrations-Assay-Kit.
- Mischen Sie die Proteinproben mit 5x SDS-PAGE Ladepuffer im Verhältnis 4:1 durch Vortexen und erhitzen Sie die gemischten Proben 5 min lang bei 100 °C, um das Protein zu denaturieren.
- Um Proteine mit unterschiedlichen Molekulargewichten nachzuweisen, geben Sie den Proteinmarker (5 μl/Well) und die Proben (20 μg/Well) in verschiedene Bahnen eines 12%igen SDS-PAGE-Gels, führen Sie die SDS-PAGE-Elektrophorese durch und übertragen Sie das Gel auf PVDF-Membranen.
- Blockieren Sie die Membranen mit 5% fettfreier Milch für 2 h bei RT und inkubieren Sie mit den entsprechenden Primärantikörpern (C1GALT1 [1:1000], Cosmc [1:2000]) für 24 h. Verwenden Sie β-Aktin-Antikörper (1:100000) als interne Kontrolle.
- Waschen Sie die Membran aus Polyvinylidenfluorid (PVDF) dreimal (10 min/Zeit) mit 1x Tris-gepufferter Kochsalzlösung, 0,1 % Tween 20 Reinigungsmittel (TBST) und inkubieren Sie dann mit dem entsprechenden sekundären Ziegen-Anti-Kaninchen-IgG-Antikörper (1: 10000) bei RT für 2 h.
- Waschen Sie die Membran erneut mit TBST (dreimal für jeweils 10 Minuten) und behandeln Sie sie mit einer angemessenen Menge verbesserter Chemilumineszenz (ECL)-Arbeitslösung (gemäß den Anweisungen des Herstellers) für den Nachweis der Proteinbande.
- Nehmen Sie die Bilder mit dem Chemilumineszenz-Bildgebungssystem auf und führen Sie eine semiquantitative Analyse der Grauwerte von Proteinen mit dem Bildanalysesystem Image J durch.
11. Anmelden Statistische Analyse
- Verwenden Sie eine geeignete Softwareanwendung zur Analyse der Daten. Geben Sie alle Daten als Mittelwert ± SD (Standardabweichung) aus und werten Sie mehrere Stichproben durch einen Einweg-ANOVA-Test zum Vergleich zwischen den Gruppen aus.
HINWEIS: Für die statistische Analyse wurde die SPSS-Statistiksoftware 26.0 verwendet. Die LSD-Methode wurde für bidirektionale Vergleiche zwischen Gruppen verwendet, wenn die Varianzen gleich waren, und die Dunnett T3-Methode wurde für bidirektionale Vergleiche zwischen Gruppen verwendet, wenn die Varianzen nicht gleich waren. P<0,05 wurde als Hinweis auf einen statistisch signifikanten Unterschied angesehen.
Ergebnisse
Wirkung von DIO auf das Nierengewebe im IgAN-Mausmodell
Im Vergleich zur Kontrollgruppe wies das mukosale immuninduzierte IgAN-Mäusemodell (Modellgruppe) einen signifikanten Anstieg der Proteinurie auf (Ergänzende Abbildung 2), die IgA-Ablagerung war in der Mesangialregion sichtbar, die Fluoreszenz war gleichmäßig in Clustern über die gesamte Mesangialregion verteilt (Abbildung 1A), die PAS-Färbung des Nierengewebes zeigte eine Proliferation der Mesangialzellen und eine Stromahyperplasie (Abbildung 1B), die in der DIO-Sondengruppe (DIO-Gruppe) reduziert wurde.
Wirkung von DIO auf B-Lymphozyten im Peyer-Pflaster
Das Peyer-Pflaster ist die führende Stelle für die Umwandlung von B-Lymphozyten in IgA-sezernierende Zellen. Wir nahmen Peyers Pflaster als Forschungsobjekt, um die Wirkung von DIO auf B-Lymphozyten zu beobachten, indem wir die Expression der B-Zell-Marker CD20 und CXCR5 nachweisen konnten. Immunhistochemische Ergebnisse zeigten, dass die Expression von CD20 und CXCR5 in der Modellgruppe im Vergleich zur Kontrollgruppe signifikant höher war. DIO könnte die Expression der oben genannten molekularen Marker hemmen (Abbildung 2A,B).
Der sichere Konzentrationsbereich von DIO auf DAKIKI-Zellen
LDH ist ein Marker für die Integrität der Plasmamembran und ein Indikator für den Zelltod, wobei höhere LDH-Freisetzungsraten auf schwerere Zellschäden hinweisen. Der LDH-Release-Assay wurde verwendet, um den sicheren Konzentrationsbereich von DIO zu bestimmen. Die maximale sichere Konzentration von DIO wurde durch eine LDH-Freisetzungsrate von unter 10 % bestimmt. Die Ergebnisse (Abbildung 3) zeigten keine signifikante Zytotoxizität, die durch DIO bei Konzentrationen von 0,25 bis 1,0 μg/ml induziert wurde. Daher wurde in der folgenden Studie 0,25, 0,5 und 1,0 μg/ml DIO als Dosierungsniveau verwendet.
Auswirkungen von DIO auf die Proliferation von DAKIKI-Zellen
Die experimentellen Ergebnisse (Abbildung 4) zeigten, dass DIO im Vergleich zur Modellgruppe (LPS-stimulierte Gruppe) die LPS-induzierte DAKIKI-Zellproliferation konzentrationsabhängig hemmte. DIO in Konzentrationen von 0,5 und 1,0 μg/ml hemmte signifikant die LPS-induzierte DAKIKI-Zellproliferation (P < 0,01).
Auswirkungen von DIO auf die sekretorische Funktion von DAKIKI-Zellen
Die Gd-IgA1-Spiegel stehen in engem Zusammenhang mit dem pathologischen Prozess von IgAN, und das Gesamt-IgA wird zusammen als Indikator für die zelluläre sekretorische Funktion getestet. Ein ELISA-Assay wurde verwendet, um den IgA- und Gd-IgA1-Gehalt im Überstand der DAKIKI-Zellkultur nachzuweisen. Die Ergebnisse zeigten (Abbildung 5A,B), dass DAKIKI-Zellen, die durch LPS stimuliert wurden, im Vergleich zur Kontrollgruppe mehr IgA sezernierten (P < 0,01). Im Vergleich dazu hemmte DIO DAKIKI-Zellen signifikant an der konzentrationsabhängigen Sekretion von IgA (P < 0,01). Im Vergleich zur Kontrollgruppe sezernierten DAKIKI-Zellen, die durch LPS stimuliert wurden, mehr Gd-IgA1 mit statistischer Tendenz (P < 0,10), und DIO hemmte die Gd-IgA1-Sekretion von LPS-stimulierten DAKIKI-Zellen konzentrationsabhängig (P < 0,05 und P < 0,01), wobei DIO mit 1,0 μg/ml die Sekretion von Gd-IgA1 mit der gehemmten Rate von 25% signifikant hemmte.
Der Mechanismus von DIO hemmt die Gd-IgA1-Sekretion durch DAKIKI-Zellen
Um den möglichen Mechanismus der Hemmung der übermäßigen Gd-IgA1-Sekretion durch DAKIKI-Zellen weiter zu untersuchen, wurden die Spiegel der glykosylierten Transferase C1GALT1 und des Chaperonproteins Cosmc mRNA in DAKIKI-Zellen mittels qRT-PCR nachgewiesen, und die Ergebnisse zeigten (Abbildung 6A,B), dass die relative mRNA-Expression von C1GALT1 und Cosmc in DAKIKI-Zellen in der Modellgruppe im Vergleich zur Kontrollgruppe herunterreguliert war (P < 0,01). DIO regulierte die relative mRNA-Expression von C1GALT1 und Cosmc im Vergleich zur Modellgruppe unterschiedlich stark hoch, wobei DIO 1,0 μg /ml die relative mRNA-Expression von C1GALT1 und Cosmc signifikant hochregulierte (P < 0,05).
Gleichzeitig wurde die WB-Methode verwendet, um die Wirkung von DIO auf die Proteinexpression von C1GALT1 und Cosmc in DAKIKI-Zellen nachzuweisen. Im Vergleich zur Kontrollgruppe nahm die Proteinexpression von C1GALT1 und Cosmc in DAKIKI-Zellen in der Modellgruppe deutlich ab (P < 0,05). Im Vergleich zur Modellgruppe war die Proteinexpression von C1GALT1 und Cosmc nach DIO-Intervention hochreguliert. Die Proteinexpression von C1GALT1 und Cosmc wurde durch DIO bei einer Konzentration von 1,0 μg/ml (P < 0,05) signifikant hochreguliert (Abbildung 7A-C).
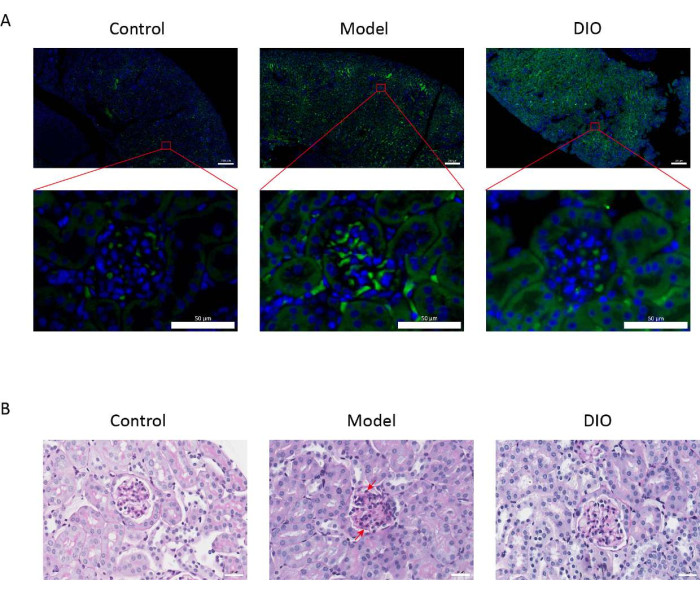
Abbildung 1: Histopathologie der Nieren. (A) Immunfluoreszenzmikroskop. Nierenschnitte von Mäusen in jeder Gruppe wurden mit Anti-IgA (grün) und DAPI (blau) gefärbt. Der obige Bildmaßstab = 200 μm. Der Maßstabsbalken unten = 50 μm. n = 6 pro Gruppe. (B) Repräsentative Bilder der PAS-Färbung von Nierengewebe von Mäusen in den Kontroll-, Modell- und DIO-Gruppen. Maßstabsleiste = 30 μm. Der Pfeil nach unten zeigt die Mesangialzellen und der Pfeil nach oben zeigt das Stroma. Maßstabsleiste = 30 μm. n = 6 pro Gruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
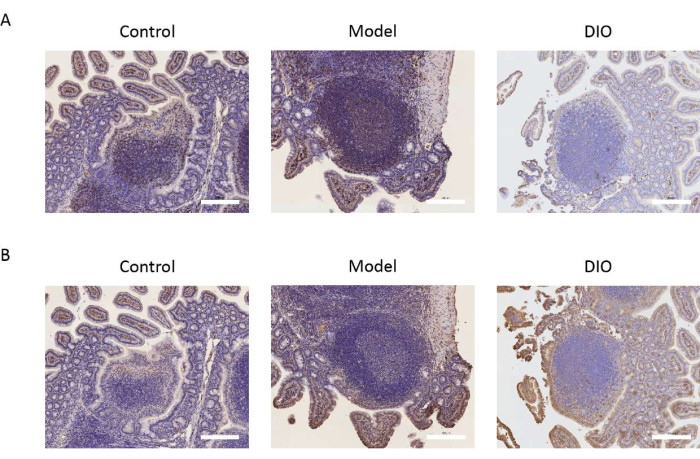
Abbildung 2: Wirkung von DIO auf B-Lymphozytenmarker. (A) Die Expression von CD20 im Peyer-Pflaster. Maßstabsleiste = 200 μm. n = 6 pro Gruppe. (B) Die Expression von CXCR5 im Peyer-Pflaster. Die Maßstabsleisten befinden sich in der unteren rechten Ecke des Bildes. Maßstabsleiste = 200 μm. n = 6 pro Gruppe. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
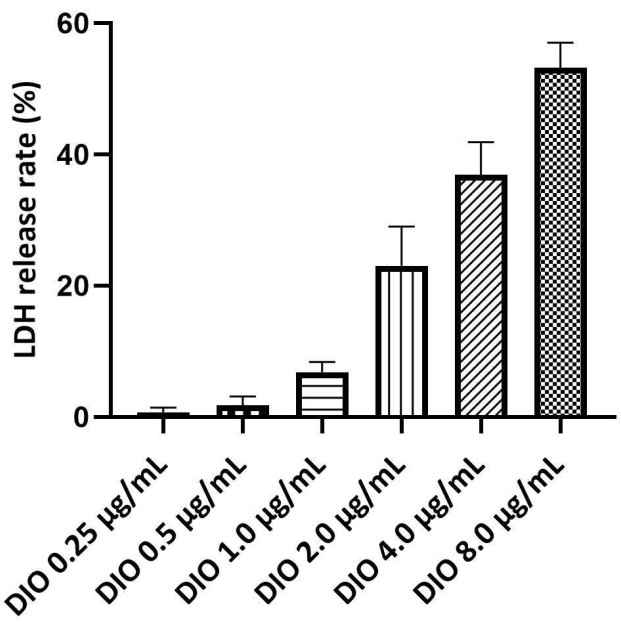
Abbildung 3. Screening der sicheren Konzentration von DIO auf DAKIKI-Zellen. Die statistischen Werte werden als Mittelwert ± SD aus drei unabhängigen Experimenten ausgedrückt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
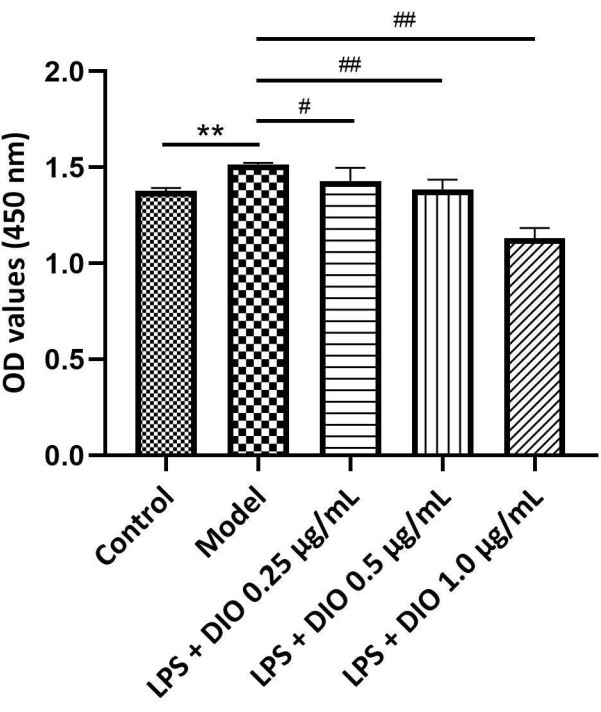
Abbildung 4. Unterschiedliche Konzentrationen von DIO beeinflussen die Proliferation von DAKIKI-Zellen. Die Daten wurden als mittlerer ±SD ausgedrückt. Im Vergleich zur Kontrollgruppe betrug **P < 0,01; verglichen mit der Modellgruppe, #P < 0,05' ##P < 0,01; Die Ergebnisse aller Experimente wurden dreimal wiederholt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
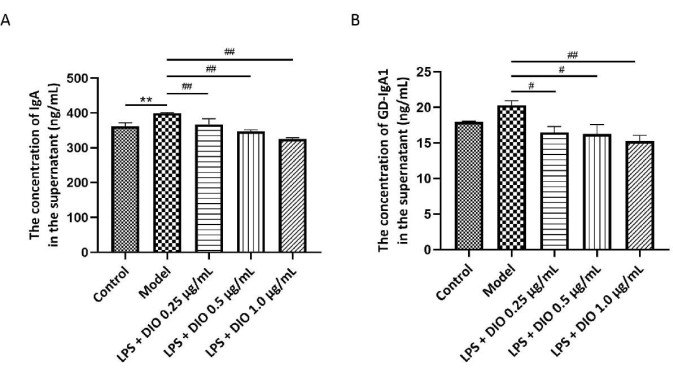
Abbildung 5. DIO hemmt die IgA- und Gd-IgA1-Sekretion durch DAKIKI-Zellen. (A) Die ELISA-Methode wies die Expression von IgA in jeder Gruppe nach. (B) Mit der ELISA-Methode wurde die Expression von Gd-IgA1 in jeder Gruppe nachgewiesen. Die Daten wurden als Mittelwert ± SD ausgedrückt. Im Vergleich zur Kontrollgruppe betrug **P < 0,01; im Vergleich zur Modellgruppe #P < 0,05, ##P < 0,01; Alle experimentellen Ergebnisse wurden dreimal wiederholt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
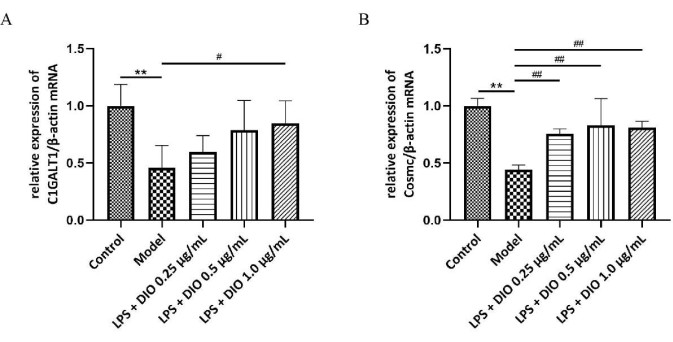
Abbildung 6. Der Mechanismus von DIO hemmt die übermäßige Gd-IgA1-Sekretion durch DAKIKI-Zellen. (A) Die QRT-PCR detektierte die mRNA-Expression von C1GALT1. (B) Die QRT-PCR detektierte die mRNA-Expression von Cosmc. Die Daten wurden als mittlere ± SD ausgedrückt. Im Vergleich zur Kontrollgruppe wurden **P<0,01; verglichen mit der Modellgruppe #P < 0,05, ##P < 0,01; Alle experimentellen Ergebnisse wurden dreimal wiederholt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
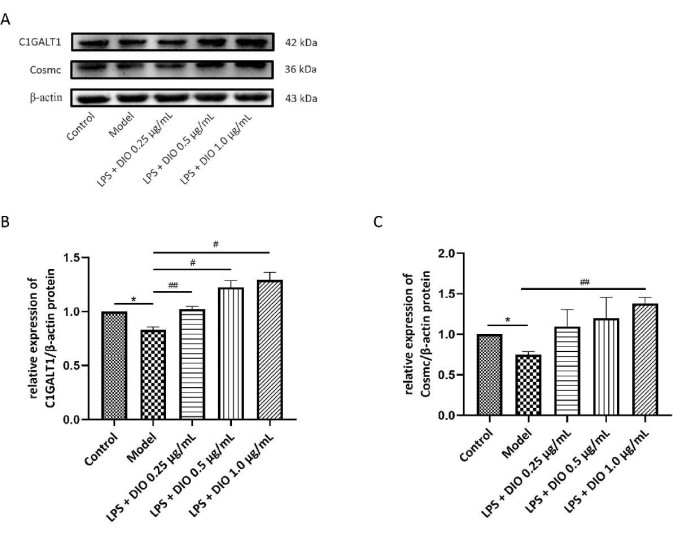
Abbildung 7. DIO beeinflusst die Proteinexpression von C1GALT1 und Cosmc in DAKIKI-Zellen. (A) WB verifizierte die Hochregulierung der Proteinexpression von C1GALT1 und Cosmc durch DIO. (B) Die semiquantitative Analyse der C1GALT1 Expression wurde unter Verwendung von Bild J durchgeführt. (C) Die semiquantitative Analyse der Cosmc-Expression wurde unter Verwendung von Bild J durchgeführt. Die Daten wurden als mittlerer ±SD ausgedrückt. Im Vergleich zur Kontrollgruppe*P < 0,05; verglichen mit der Modellgruppe #P < 0,05, ##P < 0,01 wurden alle experimentellen Ergebnisse dreimal wiederholt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergänzende Abbildung 1. Das Schema für das In-vivo-Modell . Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Ergänzende Abbildung 2. Veränderungen der Proteinurie. Die Daten wurden als Mittelwert ± SD ausgedrückt; n = 6 pro Gruppe. Bitte klicken Sie hier, um diese Abbildung herunterzuladen.
Diskussion
Charakteristisches pathologisches Merkmal von IgAN ist die Ablagerung von IgA1- und GD-IgA1-haltigen Immunkomplexen in der mesangialen Region des Glomerulus21,22. Die Verringerung der Bildung von Immunkomplexen kann Nierenschäden reduzieren und die klinischen Symptome von IgAN lindern. In einem In-vivo-Experiment untersuchten wir die therapeutische Wirkung von DIO auf IgAN und fanden heraus, dass DIO die IgA-Ablagerung in der Niere von IgAN-Modellmäusen reduzieren kann. Es wird gezeigt, dass die Akkumulation von IgA-sezernierenden Zellen in der Niere mit der Pathogenese von IgAN23 zusammenhängt. Als wichtiger Ort der Proliferation und Aktivierung von B-Lymphozyten ist das Peyer-Pflaster eine wichtige Quelle für IgA-sezernierende Zellen, daher untersuchten wir die Expression von B-Lymphozytenmarkern (CD20, CXCR5) in Peyer-Pflaster und fanden heraus, dass DIO die Expression von B-Lymphozyten im Peyer-Pflaster des IgAN-Mausmodells hemmen könnte. Diese experimentellen Ergebnisse könnten eine Grundlage für den Einsatz von DIO bei der Behandlung von IgAN bilden.
Wir haben die folgenden Experimente in vitro durchgeführt, um den Wirkmechanismus von DIO auf IgAN weiter zu untersuchen. Erstens wurde bereits gezeigt, dass DAKIKI, eine EBV-immortalisierte B-Zelllinie, die IgA1 sezerniert, zu dem auch GD-IgA124 gehört, ideal für die In-vitro-Erforschung des Wirkmechanismus des Medikaments auf IgAN ist. Wir haben uns für DAKIKI-Zellen entschieden, um den molekularen Mechanismus von DIO bei der Behandlung von IgAN zu untersuchen. Darüber hinaus spielt die schleimhauteigene entzündliche Immunantwort eine wesentliche Rolle bei der Pathogenese von IgAN. Wie oben erwähnt, verwenden wir LPS, um DAKIKI-Zellen zu stimulieren, die entzündungsfördernde Faktoren freisetzen und Entzündungsreaktionen vermitteln können, wodurch der Mechanismus der Immunantwort der Schleimhaut in IgAN besser nachgeahmt werden kann. Das in vitro zelluläre Modell könnte helfen, die Möglichkeiten und den Mechanismus anderer Medikamente zur Behandlung von IgAN zu untersuchen. Die Ergebnisse zeigten, dass DIO die Proliferation von DAKIKI-Zellen, die durch LPS stimuliert wurden, konzentrationsabhängig hemmte. DIO könnte die Sekretion von IgA und Gd-IgA1 in DAKIKI-Zellen durch LPS-Stimulation hemmen und die Expression von mRNA und Protein von C1GalT1 und seinem Chaperon Cosmc in DAKIKI-Zellen hochregulieren, was darauf hindeutet, dass DIO die Sekretion von Gd-IgA1 durch Hochregulierung der C1GALT1/Cosmc-Expression reduzieren und somit die übermäßige Aktivierung von DAKIKI-Zellen hemmen könnte.
Wichtige Schritte sollten während der experimentellen Verfahren notiert werden. Die Konzentration von Gd-IgA1 im DAKIKI-Zellüberstand liegt nicht innerhalb des Nachweisbereichs des ELISA-Kits (1,56 ~ 100 ng/ml), und der gesammelte Überstand muss durch ein Ultrafiltrationsröhrchen zentrifugiert werden, um das konzentrierte Gd-IgA1 zu erhalten. Stellen Sie außerdem sicher, dass das Volumen des Überstands ab jeder Gruppe gleich ist und das nach der Ultrafiltration erhaltene Endvolumen des Konzentrats gleich ist.
In dieser Studie haben wir sowohl in vitro als auch in vivo Methoden gleichzeitig eingesetzt, die sich gegenseitig in pharmakologischen Wirkungen unterstützen können und ein Beispiel für die Untersuchung der Wirkungen und ihrer Mechanismen der pflanzlichen Medizin darstellen. Einige Dinge könnten in diesem Protokoll verbessert werden. Erstens haben wir keine Blutkonzentrationen in der DIO-Sondengruppe der Mäuse nachgewiesen; Daher wird die DIO-Konzentration, die den Blutkonzentrationen entspricht, in vitro-Experimenten nicht verwendet. Zweitens wurde nur das DIO-Monomer, die aktive Komponente von DNR, untersucht; Die Auswirkungen anderer Komponenten von DNR auf IgAN müssen noch weiter untersucht werden.
Zusammenfassend lässt sich sagen, dass diese Studie eine experimentelle Grundlage für die Behandlung von IgAN mit DIO, dem Wirkstoff von DNR, bietet. Diese Studie etablierte ein zelluläres pathologisches Modell von IgAN, indem sie die mukosale Immunantwort von IgAN sowohl in vitro als auch in vivo nachahmte. Es gibt eine neue Idee für das Studium der traditionellen chinesischen Medizin zur Vorbeugung und Behandlung von IgAN.
Offenlegungen
Die Autoren erklären, dass sie keine konkurrierenden finanziellen Interessen haben.
Danksagungen
Diese Arbeit wurde von der National Natural Science Foundation of China (81973675) unterstützt.
Materialien
| Name | Company | Catalog Number | Comments |
| Anti-CD20/MS4A1 Antibody | Boster Biotechnology Company | A03780-3 | |
| Antifade mounting medium | Beyotime, Shanghai, China | P0128S | |
| Balb/c mice | Beijing Weitong Lihua Laboratory Animal Technology Co., Ltd. | 110322220101424000 | |
| blocking serum | Solarbio, Beijing, China | SL038 | |
| Bovine gamma globulin | ShangHai YuanYe Biotechnology Company | S12031 | |
| C1GALT1 polyclonal antibody | Proteintech Group, Inc,USA | 27569-1-AP | |
| Citrate antigen retrieval solution(50×) | Phygene Biotechnology Company | PH0422 | |
| COSMC polyclonal antibody | Proteintech Group, Inc,USA | 19254-1-AP | |
| Cytotoxiciy detection kit | Roche Company | 4744926001 | |
| Dako REAL EnVision detection system, Peroxidase/DAB+ | Dako | K5007 | |
| DAPI | Invitrogen | D1306 | |
| Dioscin | National Institute For Food and Drug Control | 111707-201703 | |
| DIO tablets | Chengdu No 1 Pharmaceutical Co. Ltd. | H51023866 | |
| ECL working solution | Merck Biotechnology, Inc | WBKLS0100 | |
| Enhanced cell counting kit-8 | Beyotime, Shanghai, China | C0043 | |
| Fasking one-step removal of gene cDNA first-strand synthesis premix | TIANGEN,Beijing, China | KR118-02 | |
| Glycogen Periodic acid Schiff (PAS) stain kit | BaSO Biotechnology Company | BA4080A | |
| Goat anti-mouse IgA-AF488 | SouthernBiotech | 1040-30 | |
| Goat anti-rabbit IgG antibody (H+L), HRP conjugated | BeiJing Bioss Biotechnology Company | BS-0295G-HRP | |
| Human Gd-IgA1 ELISA kit | IBL | 27600 | |
| Human IgA ELISA kit | MultiSciences (LiankeBio) | 70-EK174-96 | |
| Pierce BCA protein assay kit | Thermo Scientific | 23227 | |
| PMSF solution | Beyotime, Shanghai, China | ST507 | |
| Proteinase K | Phygene Biotechnology Company | PH1521 | |
| Rabbit anti-CXCR5 polyclonal antibody | BeiJing Bioss Biotechnology Company | bs-23570R | |
| RIPA lysis buffer | Beyotime, Shanghai, China | P0013B | |
| RNAsimple total RNA extraction kit | TIANGEN,Beijing, China | DP419 | |
| RPMI Medium 1640 | Solarbio, Beijing, China | 31800 | |
| Super-Bradford protein assay kit | CWBIO, Beijing, China | CW0013 | |
| Triton X-100 | Beyotime, Shanghai, China | ST795 | |
| β-Actin Rabbit mAb | Abclonal, Wuhan, China | AC026 |
Referenzen
- Knoppova, B., et al. The origin and activities of IgA1-containing immune complexes in IgA nephropathy. Frontiers in Immunology. 7, 117 (2016).
- Suzuki, H., et al. The pathophysiology of IgA nephropathy. Journal of The American Society of Nephrology. 22 (10), 1795-1803 (2011).
- He, L., et al. Synthetic double-stranded RNA poly(I:C) aggravates IgA nephropathy by triggering IgA class switching recombination through the TLR3-BAFF axis. American Journal of Nephrology. 42 (3), 185-197 (2015).
- Zhao, N., et al. The level of galactose-deficient IgA1 in the sera of patients with IgA nephropathy is associated with disease progression. Kidney International. 82 (7), 790-796 (2012).
- Xing, Y., et al. C1GALT1 expression is associated with galactosylation of IgA1 in peripheral B lymphocyte in immunoglobulin a nephropathy. BMC Nephrology. 21 (1), 18 (2020).
- Qin, W., et al. External suppression causes the low expression of the Cosmc gene in IgA nephropathy. Nephrology Dialysis Transplantation. 23 (5), 1608-1614 (2008).
- Sakai, F., et al. Lactobacillus gasseri SBT2055 induces TGF-β expression in dendritic cells and activates TLR2 signal to produce IgA in the small intestine. PLoS One. 9 (8), 105370 (2014).
- Gutzeit, C., Magri, G., Cerutti, A. Intestinal IgA production and its role in host-microbe interaction. Immunological Reviews. 260 (1), 76-85 (2014).
- Serino, G., et al. In a retrospective international study, circulating miR-148b and let-7b were found to be serum markers for detecting primary IgA nephropathy. Kidney International. 89 (3), 683-692 (2016).
- Lu, F., et al. Therapeutic effect of Rhizoma Dioscoreae Nipponicae on gouty arthritis based on the SDF-1/CXCR 4 and p38 MAPK pathway: an in vivo and in vitro study. Phytotherapy research: PTR. 28 (2), 280-288 (2014).
- Wang, W., Xu, L., Zhou, L., Wan, S., Jiang, L. A Network pharmacology approach to reveal the underlying mechanisms of Rhizoma Dioscoreae Nipponicae in the treatment of asthma. Evidence-Based Complementary and Alternative Medicine: eCAM. 2022, 4749613 (2022).
- Tian, W. W., Wei, Y. Professor TONG Xiaolin used the experience of Dioscoreae Nipponicae. Jilin Journal of Chinese Medicine. 40 (05), 589-592 (2020).
- Rao, X. R., Bai, Y. W. Das Xiwen's experience in treating IgA nephropathy. Beijing Journal of Traditional Chinese Medicine. 9, 691-693 (2008).
- Si, Y., Zhang, Y. A data mining study on the pattern of medication use in the treatment of IgA nephropathy by Professor Zhang Yu. Journal of Chinese Physician. 20 (01), 109-111 (2018).
- Jiang, H., et al. Optimization of the enzymatic extraction technology of Diosgenin from Dioscorea nipponica. Chinese Traditional Patent Medicine. 39 (03), 621-624 (2017).
- Qi, M., et al. Dioscin alleviates lipopolysaccharide-induced inflammatory kidney injury via the microRNA let-7i/TLR4/MyD88 signaling pathway. Pharmacological Research. 111, 509-522 (2016).
- Yang, L., et al. Recent advances in the pharmacological activities of Dioscin. BioMed Research International. 2019, 5763602 (2019).
- Nal Zou, J., et al. Toll-like receptor 4 signaling pathway in the protective effect of Pioglitazone on experimental immunoglobulin A nephropathy. Chinese Medical Journal. 130 (8), 906-913 (2017).
- Xu, S. Y., Bian, R. L., Chen, X. Pharmacological experiments methodology. Chinese Pharmacological Bulletin. 1, 19 (1992).
- Shen, J. C., Ren, Y., Rao, X. R., You, Y., Li, S. Network pharmacology, molecular docking, and in vitro experiments to explore the molecular mechanism of Dioscorea Nipponica Makion in the treatment of IgA nephropathy. World Journal of Integrated Traditional and Western Medicine. 16 (12), 2246-2254 (2021).
- Mestecky, J., et al. IgA nephropathy: molecular mechanisms of the disease. Annual Review of Pathology. 8, 217-240 (2013).
- Novak, J., et al. IgA1-containing immune complexes in IgA nephropathy differentially affect proliferation of mesangial cells. Kidney International. 67 (2), 504-513 (2005).
- Nihei, Y., et al. Identification of IgA autoantibodies targeting mesangial cells redefines the pathogenesis of IgA nephropathy. Science Advances. 9 (12), (2023).
- Raska, M., et al. Identification and characterization of CMP-NeuAc: GalNAc-IgA1 alpha2,6-sialyltransferase in IgA1-producing cells. Journal of Molecular Biology. 369 (1), 69-78 (2007).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten