Bewertung der Wirkung von Antidiarrhoika und Pflanzenextrakten auf Drosophila melanogaster
In diesem Artikel
Zusammenfassung
Hier wird eine Methode beschrieben, um Drosophila melanogaster mit Medikamenten und Pflanzenextrakten zu füttern und deren Wirkung auf den Magen-Darm-Trakt durch Analyse der Kotablagerungen der Fruchtfliegen zu beurteilen. Die medikamentös behandelten Fliegen können als Modell für weitere Forschungen dienen.
Zusammenfassung
Um die Physiologie des menschlichen Magen-Darm-Trakts zu untersuchen, haben sich biomedizinische Wissenschaftler auf die Verwendung von Modellorganismen verlassen. Obwohl viele Forscher Mäuse als Modell verwendet haben, um die Darmfunktion zu untersuchen, haben sich nur wenige Berichte auf Drosophila melanogaster (D. melanogaster) konzentriert. Im Vergleich zu Mäusen bieten Fruchtfliegen viele Vorteile, wie z. B. einen kurzen Lebenszyklus, eine kostengünstige und einfache Wartung sowie keine ethischen Probleme. Darüber hinaus sind die gastrointestinale Physiologie, die Anatomie und die Signalwege von Säugetieren in D. melanogaster hoch konserviert. Pflanzenextrakte werden traditionell zur Behandlung von Durchfall und Verstopfung eingesetzt. Zum Beispiel ist Psidium guajava (P. guajava) eines der bekanntesten Antidiarrhoika in den Tropen. Es gibt jedoch keine Studien, die die Wirkung von Antidiarrho- und Abführmitteln und Pflanzenextrakten bei D. melanogaster untersucht haben, und es bleibt unbekannt, ob ähnliche Wirkungen (z. B. kleinere, konzentriertere und weniger häufige Kotablagerungen im Falle von Antidiarrhoika) bei den Fruchtfliegen im Vergleich zu Säugetieren auftreten können. In dieser Studie wurde eine durch P. guajava induzierte antidiarrhoische Wirkung bei einem D. melanogaster-Stamm nachgewiesen, der einen Diarrhö-Phänotyp aufweist. Die von Fliegen produzierten Kotproben werden mit einem mit Farbstoffen angereicherten Futter überwacht. Dieses Protokoll beschreibt die Methode, die für die Zubereitung von Lebensmitteln mit Medikamenten verwendet wird, die Bewertung der Kotablagerungen von Fliegen, die mit diesen Lebensmittelzubereitungen gefüttert wurden, und die Interpretation der gewonnenen Daten.
Einleitung
Der Magen-Darm-Trakt, auch Verdauungstrakt genannt, ist für die Verdauung und Aufnahme von Nährstoffen und die Ausscheidung unverdauter Produkte verantwortlich1. Der Magen-Darm-Trakt ist anfällig für eine Reihe von Störungen, die Beschwerden, Schmerzen und Störungen des täglichen Lebens verursachen können. Zu den Magen-Darm-Erkrankungen gehören Bauchschmerzen und -beschwerden, Blähungen, Sodbrennen, Verdauungsstörungen oder Dyspepsie, Übelkeit, Erbrechen, Durchfall und Verstopfung2. Durchfall ist das häufigste Symptom der gastrointestinalen Störung3 und wird als eine Erkrankung mit mindestens drei lockeren und wässrigen Stühlen während eines Zeitraums von 24 Stunden definiert4. Durchfall wird durch eine Vielzahl von Krankheitserregern verursacht, darunter Bakterien, Viren, Parasiten, Pilze und kann auch durch Medikamente verursacht werden 5,6. Weltweit ist Durchfall nach wie vor die zweithäufigste Todesursache bei Kindern unter 5 Jahren7. Obwohl sich Durchfall von selbst auflösen kann, kann er auch auf eine schwerere Grunderkrankung hinweisen, wenn er länger als ein paar Tage anhält.
Um den Darmtrakt zu untersuchen, greifen die Forscher auf Tiermodelle wie Mäuse, Ratten und Schweine zurück 8,9. Der Einsatz dieser Tiere kann jedoch teuer und zeitaufwändig sein, da sie spezielle Einrichtungen und ethische Überlegungen erfordern. Neuere Studien haben gezeigt, dass D. melanogaster als Modell verwendet werden kann, um den Magen-Darm-Trakt zu untersuchen und einige Mechanismen wie die Aufrechterhaltung der regenerativen Homöostase, die Entwicklung von Immunseneszenz, den Verlust der epithelialen Barrierefunktion und den Rückgang der metabolischen Homöostase zu untersuchen10,11. D. melanogaster, bekannt als Fruchtfliege, teilt ein hohes Maß an genetischer Homologie mit dem Menschen; Es wird angenommen, dass etwa 75 % der menschlichen Krankheitsgene ein funktionelles Homolog in Fly12 aufweisen. Sie haben auch ein einfaches Verdauungssystem, das aus einem Vorderdarm, einem Mitteldarm und einem Hinterdarm besteht13. D. melanogaster lässt sich leicht im Labor kultivieren und kann auf unterschiedliche Weise genetisch verändert werden14. Daher ist die Verwendung von D. melanogaster für In-vivo-Tests ein leistungsfähiges Werkzeug, das es Forschern ermöglicht, komplexe biologische Prozesse in einer kontrollierten Umgebung zu untersuchen.
Nach Angaben der Weltgesundheitsorganisation (WHO) nutzen etwa 80 % der Menschen, die in Entwicklungsländern leben, die traditionelle Medizin für ihre primären Gesundheitsbedürfnisse15. Der hohe Einsatz von Heilpflanzen lässt sich dadurch erklären, dass sie leicht verfügbar, kostengünstig und nebenwirkungsarm sind16. Zu den wichtigsten Pflanzenteilen, die in der Kräutertherapie verwendet werden, gehören Blätter, Rinde, Wurzeln und Samen17, während die wichtigsten Zubereitungsmethoden Aufguss, Abkochung und Mazeration18 sind. Diese pflanzlichen Heilmittel enthalten sekundärchemische Substanzen wie Alkaloide, Terpenoide, Flavonoide, Steroide, Gerbstoffe und Kohlenhydrate19, die therapeutische Wirkungen auf den menschlichen Körper haben. Menschen verwenden eine Vielzahl von Heilpflanzen, um Magen-Darm-Erkrankungen wie Durchfall, Bauchschmerzen und Ruhr zu behandeln20. Zum Beispiel ist Psidium guajava eine der weltweit am häufigsten verwendeten Pflanzen zur Behandlung von Durchfall. Verschiedene pharmakologische und klinische Tests haben bereits seine Sicherheit gezeigt, was es zu einem guten Antidiarrhoe-Kandidaten für die Studie21,22 macht. Die größten Einschränkungen pflanzlicher Arzneimittel sind jedoch die mangelnde Wirksamkeit und Sicherheitsbewertung sowie das Fehlen eindeutiger und vollständiger Informationen über die Zusammensetzung der verwendeten Pflanzenextrakte23. Um die Wirksamkeit und Sicherheit pflanzlicher Arzneimittel zu validieren, ist ein systematischer Ansatz erforderlich, der eine experimentelle und klinische Validierung umfasst, und der Ansatz sollte durch genügend Daten aus In-vivo- und In-vitro-Studien gestützt werden.
Um traditionelle Heilmittel auf ihre Wirksamkeit bei der Behandlung von Durchfall hin zu bewerten, war in den letzten Jahrzehnten die Verwendung von Mäusen und Ratten vorherrschend24,25. Aufgrund der oben erwähnten Hauptvorteile, d.h. einfache Anwendung, erschwingliche, replizierbare, konservierte Absorptions- und Verdauungsfunktionen zwischen Fliegen und Säugetieren, schlagen wir vor, D. melanogaster als Modell zu verwenden, um die antidiarrhoische Aktivität von Pflanzen zu bewerten. Der Diarrhö-Phänotyp bei D. melanogaster kann durch mehrere Merkmale charakterisiert werden, darunter eine erhöhte Häufigkeit von Kotablagerungen, größere Ablagerungen, eine hellere Färbung (weniger konzentriert) und ein höheres Kotmaterial26. Dieser Phänotyp kann anhand verschiedener Parameter quantifiziert werden: Anzahl der fäkalen Ablagerungen, Gesamtfläche der Ablagerungen, mittlere Helligkeit und gesamte integrierte optische Dichte (IOD). Der Gesamt-IOD ist definiert als der gesamte Farbstoffgehalt der Ablagerung, d. h. das gesamte ausgeschiedene Fäkalmaterial27. Zuvor wurde ein Assay entwickelt, um fäkale Ablagerungen von D. melanogaster27,28 zu analysieren. In diesem Assay wurde der Ultimate Reader of Dung (T.U.R.D.) als fäkales Analysewerkzeug verwendet, das es ermöglicht, die Anzahl, Größe und Leichtigkeit der Kotablagerungen zu überprüfen und somit die Darmphysiologie der Fruchtfliegen zu überwachen. Diese Methode wurde jedoch nie angewendet, um den Durchfall-Phänotyp bei Fliegen zu bewerten. Das Ionentransportpeptid (ITP)-Gen ist ein wichtiger endokriner Regulator von Durst und Ausscheidung und kombiniert die Wasserhomöostase mit der Fütterung von D. melanogaster. In einer kürzlich durchgeführten Studie wurde gezeigt, dass die Geschwindigkeit des Nahrungstransports durch den Magen-Darm-Trakt und die Häufigkeit von Stuhlgängen durch ITP-Überexpression verringert und durch ITP-Knockdown erhöht wurden. Der letztgenannte Phänotyp wurde von den Autoren dieser Studie als Diarrhö beschrieben29.
In diesem Protokoll wird eine modifizierte Version des fäkalen Ablagerungstests verwendet, um die Wirkung eines Antidiarrhoikums (d. h. Guavenblattextrakt) auf den Magen-Darm-Trakt von D. melanogaster unter Verwendung des ITPi-Stammes als Durchfallmodell zu bewerten. Das übergeordnete Ziel dieser Methode ist es, 1) eine einfache und zuverlässige Methode zur Bewertung der antidiarrhoischen Wirkung von Medikamenten und Pflanzenextrakten bereitzustellen und 2) die Entdeckung bioaktiver Verbindungen zu ermöglichen, die für die antidiarrhoische Wirkung in Pflanzenextrakten verantwortlich sind, indem ein bioaktivitätsgesteuerter Ansatz angewendet wird.
Protokoll
1. Zubereitung von Pflanzenextrakt
- Sammeln Sie Psidium guajava L.Blätter 30 von einem ausgewachsenen Baum und verarbeiten Sie sie wie folgt: Trocknen Sie die Blätter 6 Tage lang in einem Ofen bei 40 °C, trocknen Sie sie dann 6 Tage lang an der Luft, trocknen Sie sie dann erneut im Ofen bei 40 °C für 4 Tage und bereiten Sie schließlich Blattpulver zu, indem Sie die trockenen Blätter in einer Mühle oder einer Kaffeemühle mahlen.
- 100 g des getrockneten Pulvers in 1 l 96%igem Ethanol 24 h lang unter ständigem Rühren mit einem Schüttler mazerieren. Die Pflanzenreste werden noch einmal dem gleichen Prozess unterzogen und die entstehenden Filtrate werden mit einem Vakuum-Rotationsverdampfer unter reduziertem Druck (175 mbar) bei 40 °C zur Trockne verdampft.
- Lösen Sie den Pflanzenextrakt in Ethanol auf, um die gewünschte Konzentration zu erhalten. Bestimmen Sie die optimale Konzentration (unter Verwendung des hier beschriebenen Protokolls), indem Sie eine Reihe von Konzentrationen testen.
- Testen Sie Pflanzenextrakte in einem Konzentrationsbereich von 100 μg/ml, 1 mg/ml, 10 mg/ml, 100 mg/ml und verwenden Sie solche, die die Überlebensrate der Fliege nicht beeinflussen. Bei reinen Verbindungen ist der folgende Konzentrationsbereich zu prüfen: 0,05, 0,5, 5 und 50 mM12.
2. Zubereitung des Lebensmittelmediums
- 100 ml destilliertes Wasser abmessen und mit 4 g Zucker und 0,8 g Agar in das Becherglas gießen (siehe Materialtabelle). Unter Rühren auf 100 °C erhitzen und 10 Min. halten.
- Die Temperatur auf 80 °C senken, 7,4 g Mehl und 2,8 g Hefe unter Rühren hinzufügen. Mindestens 20 Minuten erhitzen, dabei immer noch umrühren und die Temperatur kontrollieren, die etwa 80 °C betragen sollte.
- Fügen Sie die Moldex-Propionsäure-Lösung hinzu (1 ml Moldex und 0,3 g Propionsäure gut mischen). Warten Sie, bis die Temperatur auf etwa 50 °C gesunken ist, fügen Sie die Pflanzenextraktlösung (1 mg/ml) und 0,5 g Bromphenolblaupulver hinzu.
ANMERKUNG: Weitere Einzelheiten zu den anderen zu prüfenden Konzentrationen finden Sie in Abschnitt 1.3.1. - Gießen Sie das Essen in die Petrischalen und hören Sie auf, wenn die Petrischale voll ist (Abbildung 1A). Die Petrischalen auf Raumtemperatur (ca. 3 h) abkühlen lassen, dann den Deckel schließen und bei 4 °C im Kühlschrank aufbewahren.
HINWEIS: Petrischalen sollten nicht länger als 2 Wochen im Kühlschrank aufbewahrt werden, um eine Verdunstung von Wasser zu vermeiden.
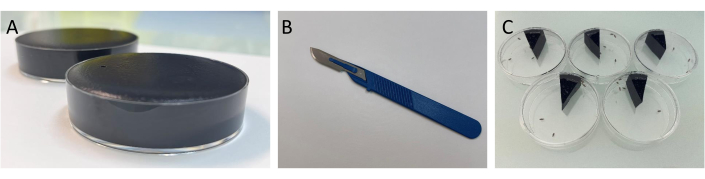
Abbildung 1: Demonstration des experimentellen Verfahrens für den Stuhlablagerungstest. (A) Bild zeigt Petrischalen voller Nahrungsmedium. Achten Sie darauf, genügend Futter in der Petrischale zu haben, damit keine Lücken die Fliegen einfangen und sie daran hindern, sich zu bewegen. Überladen Sie die Petrischale jedoch nicht mit Speisen, damit die Oberfläche gleichmäßig bedeckt werden kann. (B) Abbildung des Spatels, wie im Protokoll beschrieben. (C) Bild des Stuhlablagerungstests, wie im Protokoll beschrieben. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Fliegen vorbereiten
- Bereiten Sie die CO2 - Tanks, die CO2 - Blaspistole mit Nadeln, das Fliegenkissen, den Pinsel und das Mikroskop vor. Die Fliegenstation versorgt sowohl das Fliegenpad als auch die Blaspistole mit CO2 . Das Fliegenkissen wird zum Sortieren von Fliegen verwendet, während die CO2 - Blaspistole zur Betäubung von Fliegen in Fläschchen, Flaschen und Petrischalen verwendet wird.
- Standardisieren Sie das Alter der Fliegen, indem Sie Fläschchen auswählen, die Puppen enthalten (mindestens 10), und werfen Sie die erwachsenen Fliegen mit der folgenden Methode aus der Röhre. Drehen Sie die Durchstechflaschen nacheinander auf den Kopf und führen Sie die Nadel zwischen den Wattestopfen und die Seitenwand der Durchstechflasche ein. Betäuben Sie erwachsene Fliegen mit der CO2 - Blaspistole, bis alle Fliegen auf dem Wattestöpsel schlafen (einige Sekunden werden benötigt, um sie zu betäuben, und die Anästhesiewirkung hält nach dem Loslassen der Blaspistole einige Sekunden an). Öffnen Sie das Fläschchen über einer Glasflasche mit 70% Ethanol und lassen Sie die Fliegen hineinfallen. Verschließen Sie die Durchstechflasche mit dem Wattestopfen und bewahren Sie sie in einem Inkubator bei 25 °C und 60 % Luftfeuchtigkeit auf. Stellen Sie den Lichtzyklus des Inkubators auf 12 h hell/12 h dunkel ein.
- Sortieren Sie sie nach der Inkubation (maximal 8 Stunden) unter dem Mikroskop und der Fliegenunterlage in jungfräuliche Weibchen und Männchen, indem Sie sie auf den Rücken drehen und ihre Genitalien betrachten.
- Die weiblichen Genitalien sind blass im Vergleich zu den männlichen Genitalien, die rötlich gefärbt sind. Männchen können auch durch das Vorhandensein dunkler Borsten, sogenannte Sexkämme, auf ihrem vorderen Beinpaar identifiziert werden. Teilen Sie die Fliegen in zwei frische Röhrchen (eines für Männchen und eines für Weibchen) und brüten Sie sie 6-8 Tage lang bei 25 °C aus.
HINWEIS: Bei 25 °C bleiben die Weibchen nach dem Schlüpfen ca. 8 h jungfräulich.
- Die weiblichen Genitalien sind blass im Vergleich zu den männlichen Genitalien, die rötlich gefärbt sind. Männchen können auch durch das Vorhandensein dunkler Borsten, sogenannte Sexkämme, auf ihrem vorderen Beinpaar identifiziert werden. Teilen Sie die Fliegen in zwei frische Röhrchen (eines für Männchen und eines für Weibchen) und brüten Sie sie 6-8 Tage lang bei 25 °C aus.
4. Test der Stuhlablagerung
- Beschriften Sie die Petrischalen mit der entsprechenden Sorte, dem Geschlecht und der Droge, um Verwechslungen zwischen den Petrischalen zu vermeiden. Die Petrischalen übereinander stapeln.
- Nimm die Petrischalen mit den gefärbten Lebensmitteln und drehe sie auf dem Löschpapier um, um die überschüssige Flüssigkeit aufzunehmen. Schneiden Sie das Essen mit einem Spatel (Abbildung 1B) in 12 gleiche Teile und legen Sie dann mit dem Spatel eine Scheibe in eine leere Petrischale.
HINWEIS: Abhängig von der Anzahl der Wiederholungen kann die Anzahl der zu schneidenden Scheiben auf bis zu 20 pro Petrischale erhöht werden. Jede Scheibe sollte die gleiche Größe haben. - Betäuben Sie die Fliegen mit CO2 , bis alle Fliegen auf dem Wattestöpsel schlafen. Geben Sie sechs gesunde Fliegen in jede Petrischale (Abbildung 1C), schließen Sie den Deckel sofort und legen Sie sie dann in den Inkubator (25 °C, 60 % Luftfeuchtigkeit, 12 h hell / 12 h dunkel).
- Damit die Fliegen während des Experiments nicht aus der Petrischale entkommen, befestigen Sie die obere und untere Abdeckung der Petrischale mit einem Klebeband. Bereiten Sie für jede Testgruppe (mindestens) sechs replizierte Petrischalen vor.
- Nachdem Sie die Fliegen 24 Stunden lang aufziehen lassen, verwenden Sie CO2 , um sie zu betäuben, geben Sie die Fliegen in einen Behälter, der mit 70 % Ethanol gefüllt ist, und entsorgen Sie das restliche Futter.
- Bewahren Sie die Petrischalen auf und fahren Sie mit Schritt 5 fort.
5. Quantifizierung von Petrischalen
- Legen Sie einen Ordner auf dem Computer fest und benennen Sie ihn um, indem Sie den Namen des Versuchsstamms, das Geschlecht der Fliegen und die Art der verwendeten Medikamente angeben. Erstellen Sie in diesem Ordner Unterordner mit den Namen "Original", "Ausschneiden" und "Analyse".
- Scannen Sie die Petrischalen mit einem hochauflösenden Scanner mit einer optischen Auflösung von 6.400 Pixel pro Zoll (ppi). Scannen Sie die obere und untere Abdeckung jeder Petrischale separat, indem Sie sie einzeln in die Mitte des Scannerfeldes legen.
- Öffnen Sie die auf dem Computer installierte Anwendung. Auf dem Computerbildschirm öffnet sich ein Willkommensfenster mit allen allgemeinen Einstellungen (Abbildung 2A).
HINWEIS: Ändern Sie nicht die erweiterten Einstellungen. Dieser Schritt ist nur für Benutzer gültig, die über den gleichen Scanner verfügen, der in der Materialtabelle vorgeschlagen wird. Bitte beachten Sie die Richtlinien, wenn Sie eine andere Software verwenden.- Benennen Sie die Petrischale in der Anwendung, indem Sie die Sequenznummer, die obere oder untere Abdeckung, das Geschlecht und die Art des verwendeten Lebensmittels angeben. Wählen Sie den Unterordner aus, der in Schritt 5.1 ursprünglich festgelegt wurde.
- Sehen Sie sich die Petrischale in der Vorschau an. Klicken Sie unten im Fenster auf Vorschau , warten Sie einige Sekunden, bis der Scanner vorgescannt hat, dann erscheint ein Fenster auf dem Computerbildschirm. Verschieben Sie das auf dem Bildschirm angezeigte Quadrat, um die Petrischale zu umgeben.
- Klicken Sie unten rechts im Fenster auf dem Computerbildschirm auf Scannen , der Scan wird automatisch als Bild im Ordner Ihrer Wahl gespeichert.
- Schneiden Sie das Bild mit einer Anwendung (z. B. der Open-Source-Anwendung Fiji) zu, damit keine Artefakte und Essensreste als Ablagerungen betrachtet werden.
HINWEIS: Die folgenden Schritte gelten nur für Benutzer, die über die Fiji-Anwendung verfügen. Bitte beachten Sie die Richtlinien, wenn Sie eine andere Software verwenden.- Öffnen Sie die Fiji-Anwendung und warten Sie einige Sekunden, bis eine Symbolleiste auf dem Bildschirm erscheint.
- Ziehen Sie das Bild, das zugeschnitten werden soll, auf die Symbolleiste. Wählen Sie das 3. Symbol Polygonauswahl in der Symbolleiste, schneiden Sie den unerwünschten Teil des Fotos (das farbige Tortendiagramm) zu, indem Sie auf den Bildschirm klicken, um einen Winkel um das Tortendiagramm zu markieren (Abbildungen 2B-1,2).
HINWEIS: Bei der Abgrenzung des Zuschneidebereichs innerhalb eines Bildes ist es zwingend erforderlich, dass die ausgewählten Rahmen nahtlos miteinander verbunden sind. - Klicken Sie oben links in der Leiste auf Bearbeiten und dann auf Füllen/Löschen (Abbildung 2B-3).
- Um das Foto zu speichern, klicken Sie oben links in der Leiste auf Datei , dann auf Speichern unter und schließlich auf Tiff. Wählen Sie den Unterordner Cut set in Schritt 5.1 aus.
HINWEIS: Achten Sie beim Speichern des zugeschnittenen Bildes darauf, dass der Dateiname keine Sonderzeichen (z. B. !, &, $, #, _,-,...) oder zu viele Zeichen enthält.
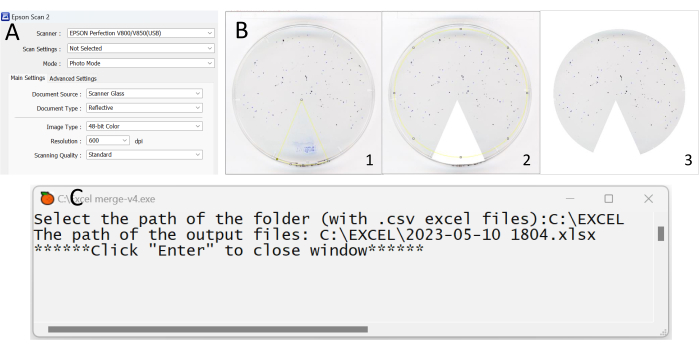
Abbildung 2: Die wichtigsten Schritte bei der Analyse der Daten aus dem Stuhlablagerungstest. (A) Screenshot mit den Einstellungsinformationen der Scan-Anwendung. (B) Bilder, die mit der Fiji-Anwendung zugeschnitten wurden. Achten Sie darauf, dass keine Artefakte und Essensreste als Ablagerungen gelten. (C) Screenshot, der zeigt, wie es beim Öffnen der Excel_merge-v4-Anwendung aussieht. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Identifizierung von Fäkalablagerungen mit dem ultimativen Lesegerät der Dung-Open-Source-Software
HINWEIS: Die Einführung und Verwendung des ultimativen Lesegeräts für Mistsoftware finden Sie in der Zusatzdatei 1.
- Öffnen Sie zunächst die T.U.R.D.-Software (ergänzende Abbildung 1). Erstellen Sie ein neues Experiment, geben Sie dem Dokument einen Namen und speichern Sie es dann im Unterordner Analyse, der in Schritt 5.1 festgelegt wurde.
- Klicken Sie auf Platten und dann auf Platte hinzufügen. Wählen Sie die Petrischale aus, die verarbeitet werden soll. Es erscheint ein neues Fenster mit den Namen der ausgewählten Platten und neuen Parametern. Legen Sie die Blockgröße, den Versatz, die Mindestgröße und die Höchstgröße fest (Ergänzende Abbildung 2).
- Um zu überprüfen, ob es sich bei den erkannten Kotablagerungen um die richtigen handelt, klicken Sie auf Platten, dann auf Ausgewählte Platten inspizieren, dann auf Grafiken und Kommentierte Bilder anzeigen (ergänzende Abbildung 3). Zoomen Sie hinein und sehen Sie sich die Anzahl an. Wenn es nur wenige Ablagerungen gibt, die nicht in die Analyse einbezogen werden sollen, deaktivieren Sie die Ablagerungen, die ausgeschlossen werden sollen (Ergänzende Abbildung 4).
- Starten Sie für jedes neue Bild, das verarbeitet werden soll, mit Schritt 6.3 neu.
- Nachdem Sie die Platten mit der T.U.R.D.-Software analysiert haben, ändern Sie die Anzahl der Fliegen, indem Sie auf Nein klicken. Fliegen (ergänzende Abbildung 5).
- Ändern Sie den Gruppennamen, indem Sie auf Platten > Gruppen bearbeiten > Hinzufügen klicken und dann in der Spalte Gruppe den Gruppennamen auswählen.
- Exportieren Sie die verschiedenen Replikationsdaten separat, indem Sie auf Analysieren > Deskriptive Statistik klicken > Gruppe auswählen (ergänzende Abbildung 6). Bewahren Sie alle Tabellenkalkulationsdateien (.csv) im selben Ordner auf.
- Um alle Dateien (die Sie in Schritt 6.7 erhalten haben) in einer eindeutigen Tabelle zu sammeln, öffnen Sie die Anwendung Excel_merge-v4 (Supplementary Coding File 1), warten Sie, bis der folgende Satz erscheint: Wählen Sie den Pfad des Ordners (mit .csv Dateien) aus: und fügen Sie dann die obige Ordneradresse ein. Der Pfad könnte z. B. C:\Experiment\Fecal deposit test\ lauten und dann auf der Tastatur zweimal die Eingabetaste drücken (Abbildung 2C). Danach wird eine neue Tabellenkalkulationsdatei im selben Ordner erstellt. Die neue Tabellenkalkulationsdatei enthält alle exportierten Dateien in verschiedenen Tabellen.
- Fügen Sie in der vorherigen Tabellenkalkulationsdatei ein weiteres Blatt hinzu, um den Mittelwert der einzelnen Parameter aller Replikate zu erfassen (verwenden Sie die SVERWEIS-Funktion zum Verarbeiten der Daten). Ein Beispiel ist in der Ergänzenden Tabelle 1 aufgeführt.
- Analysieren Sie den p-Wert.
Repräsentative Ergebnisse
Die hier vorgestellte Studie zeigt, dass die Messung von Durchfall bei D. melanogaster durch den Einsatz des fäkalen Ablagerungstests erreicht werden kann. Signifikante Unterschiede zwischen den Phänotypen (Durchfall oder nicht) können durch die Analyse verschiedener Parameter bestimmt werden, einschließlich der Anzahl der fäkalen Ablagerungen, der Gesamtfläche der Ablagerungen, der mittleren Fläche der Ablagerungen, der mittleren Helligkeit und der gesamten integrierten optischen Dichte (IOD), die ein Maß für die Gesamtmenge des in der Ablagerung vorhandenen Farbstoffs ist und den gesamten ausgeschiedenen Fäkalmaterialgehalt darstellt27.
Der ITP-Gen-Knockdown in Fliegen kann einen Diarrhö-Phänotyp induzieren, der durch eine erhöhte Häufigkeit des Stuhlgangs gekennzeichnet ist, was sie zu einem geeigneten Modell für die Untersuchung von Diarrhö macht29. Im Rahmen dieses Experiments wurde der ITPi-Stamm (w1118; daughterless-GeneSwitch, UAS-ITPi /(CyO)) verwendet und auf einem Standardmedium aufgezogen. Psidium guajava-Blattextrakt wurde als Anti-Durchfall-Intervention ausgewählt, da diese Pflanze in tropischen Regionen weit verbreitet ist, um Durchfall zu behandeln. Crofelemer, ein Antidiarrhoikum, wurde von der US-amerikanischen Food and Drug Administration (FDA) zur symptomatischen Linderung von nicht-infektiösem Durchfall bei erwachsenen Patienten mit HIV/AIDS, die sich einer antiretroviralen Therapie unterziehen, zugelassen31. Crofelemer ist ein Extrakt aus dem Latex von Croton lechleri Müll.Arg. Stammrinde32. Loperamid ist ein synthetisches Medikament, das weltweit zur Behandlung von Durchfall eingesetztwird 33. Sowohl Crofelemer als auch Loperamid wurden als potenzielle Positivkontrollen verwendet.
Die Hypothese war, dass die Fütterung von Fliegen mit P. guajava-Extrakt , Crofelemer und Loperamid den Durchfall-Phänotyp im Vergleich zu denen, die mit normalem Futter gefüttert wurden, reduzieren würde. Um diese Hypothese zu überprüfen, wurde eine Messung der fäkalen Ablagerungen in D. melanogaster durchgeführt, indem mehrere Parameter zwischen Fliegen, die mit normalem Futter gefüttert wurden, und solchen, die mit P. guajava-Extrakt (1 g/100 ml), Crofelemer (1 g/100 ml) und Loperamid (10 mM) gefüttert wurden, verglichen wurden. Für den Versuchsaufbau wurden 6-7 Tage alte, jungfräuliche Weibchen oder Männchen verwendet. Jede Petrischale enthielt sechs Fliegen, und es wurden sechs Replikate durchgeführt. Die Fliegen wurden 24 Stunden lang aufgezogen und dann wurde jede Gruppe analysiert. Der t-Test des Schülers wurde verwendet, um den signifikanten Unterschied zwischen den Testgruppen zu vergleichen. Die Ergebnisse zeigen, dass die Anzahl der fäkalen Ablagerungen (Abbildung 3A), die Gesamtfläche der Ablagerungen (Abbildung 3B) und die Gesamt-IOD (Abbildung 3C) signifikant höhere Werte in der normalen Lebensmittelgruppe im Vergleich zur Gruppe mit P. guajava-Extrakt (1 g/100 ml) aufwiesen, sowohl bei jungfräulichen Weibchen als auch bei Männern. Leider zeigte Loperamid bei beiden Geschlechtern keine Wirkung (aber es wurde bereits gezeigt, dass es bei D. melanogaster krampflösend wirkt)34 , während Crofelemer nur bei Frauen wirkte.
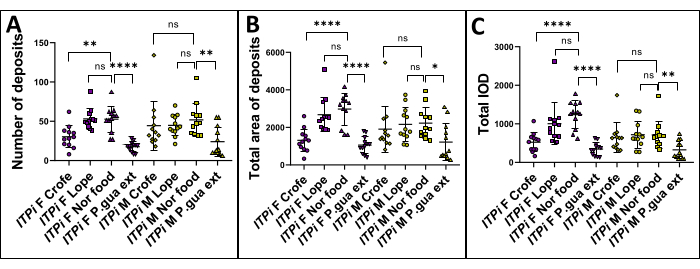
Abbildung 3: ITPi-Dehnungsanalyse . Der ITPi-Stamm wurde unter vier Bedingungen analysiert: Fütterung mit normaler Nahrung, Nahrung mit 1 g/100 ml P. guajava-Extrakt , 1 g/100 ml Crofelemer und 10 mM Loperamid. Die Daten werden als mittlere ± SD jeder Erkrankung sowohl bei Frauen als auch bei Männern dargestellt (für sechs Wiederholungen von zwei Seiten einer Petrischale). Die statistische Analyse wurde mit Hilfe eines t-Tests durchgeführt, bei dem zwei Gruppen verglichen wurden. Die p-Werte werden wie folgt dargestellt: *: p < 0,05; **: p < 0,01; : p < 0,001, ****: p < 0,0001. (A) Die Anzahl der fäkalen Ablagerungen des ITPi-Stammes wurde bei Fliegen verglichen, die mit Futter gefüttert wurden, das mit 1 g/100 ml Crofelemer, 10 mM Loperamid, 1 g/100 ml P. guajava-Extrakt gefüttert wurde, und bei Fliegen, die mit normalem Futter gefüttert wurden. Zusätzlich wurde der Unterschied in der Anzahl der Kotablagerungen zwischen jungfräulichen Weibchen und Männchen analysiert. In beiden Gruppen war die Anzahl der Kotablagerungen bei Fliegen, die mit normalem Futter gefüttert wurden, signifikant höher als bei denen, die mit 1 g/100 ml P. guajava-Extrakt gefüttert wurden. (B) Die Gesamtfläche der fäkalen Ablagerungen des ITPi-Stammes wurde bei Fliegen, die mit normalem Futter gefüttert wurden, und bei Fliegen, die mit Futter gefüttert wurden, das mit 1 g/100 ml P. guajava-Extrakt , 1 g/100 ml Crofelemer und 10 mM Loperamid ergänzt wurde, verglichen. Bei Männchen und Weibchen war die Gesamtfläche der Kotablagerungen bei Fliegen, die mit normalem Futter gefüttert wurden, signifikant höher als bei Fliegen, die mit 1 g/100 ml P. guajava-Extrakt gefüttert wurden. (C) Der Unterschied in der Gesamt-IOD des ITPi-Stammes wurde zwischen Fliegen, die mit normalem Futter gefüttert wurden, und Fliegen, die mit Futter gefüttert wurden, das mit 1 g/100 ml P. guajava-Extrakt , 1 g/100 ml Crofelemer und 10 mM Loperamid ergänzt wurde, analysiert. Bei Männchen und Weibchen war der Gesamt-IOD bei Fliegen, die mit normalem Futter gefüttert wurden, signifikant höher als bei Fliegen, die mit 1 g/100 ml P. guajava-Extrakt gefüttert wurden. Abkürzungen: F = weiblich; M = männlich; Crofe = Crofelemer; Lope = Loperamid; Noch Nahrung = Normales Essen; P. gua ext = Psidium guajava Extrakt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Um zu zeigen, dass die reduzierte Ausscheidung, die in der Gruppe mit P. guajava-Extrakt beobachtet wurde, auf die hemmende Wirkung des Extrakts und nicht auf eine reduzierte Nahrungsaufnahme zurückzuführen ist, führten wir die Methode35 zur direkten Schätzung der Aufnahme und Verfolgung des Verzehrs fester Lebensmittel (DIETS) durch. Die Ergebnisse zeigten, dass es keine signifikanten Unterschiede in der Nahrungsaufnahme zwischen den mit Medikamenten versorgten Gruppen und denen ohne Drogen gab, mit Ausnahme von Loperamid bei Männchen, das dazu führte, dass die Fliegen weniger Nahrung als normal zu sich nahmen (Abbildung 4).
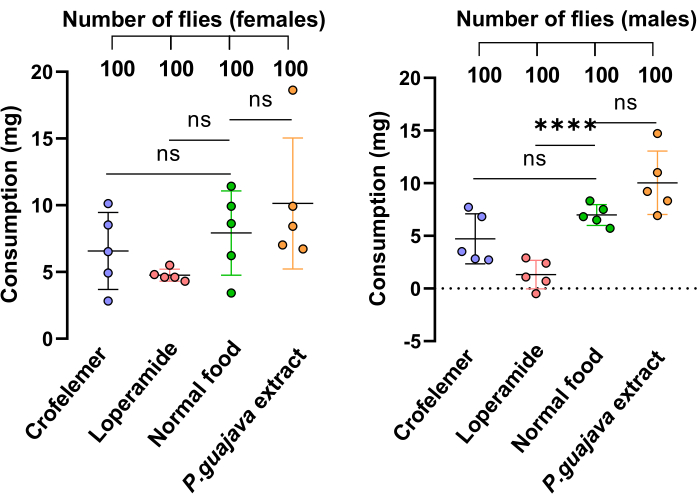
Abbildung 4: Fütterungs-Assay. Der Fütterungsassay maß die Aufnahme von fester Nahrung bei Fliegen. Die Fliegen wurden mit vier verschiedenen Medien gefüttert: 1 g/100 ml P. guajava-Extrakt , 1 g/100 ml Crofelemer, 10 mM Loperamid und normalem Futter. Jede Gruppe bestand aus 20 Fliegen mit fünf Replikaten. Die Daten werden als Mittelwert ± SD jeder Erkrankung sowohl bei Frauen als auch bei Männern dargestellt. Die statistische Analyse wurde mit Hilfe eines t-Tests durchgeführt, bei dem zwei Gruppen verglichen wurden. Die p-Werte werden wie folgt dargestellt: *: p < 0,05; **: p < 0,01; : p < 0,001, ****: p < 0,0001. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Kotablagerungen und die Ergebnisse des Fütterungstests zeigten, dass P. guajava-Extrakt eine zuverlässige Heilpflanze zur Behandlung von Durchfall bei Fruchtfliegen ist.
Ergänzende Abbildung 1: T.U.R.D.-Öffnungsfenster. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 2: T.UR.D.-Fenster mit anzupassenden Einstellungen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 3: T.U.R.D.-Fenster mit einem kommentierten Bild. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 4: T.U.R.D.-Fenster, das jeden erkannten Punkt aus einem bereits verarbeiteten Bild anzeigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 5: T.U.R.D.-Fenster mit jedem bearbeiteten Bild. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Abbildung 6: T.U.R.D.-Fenster, das den Prozess zum Exportieren der Daten für jede Gruppe zeigt. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzungsdatei 1: Kurzanleitung für die Verwendung der T.U.R.D.-Software. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Beispiel für die endgültigen Tabellenkalkulationen, die zur Analyse bereit sind. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Codierungsdatei 1: Anwendung zum Zusammenführen von Tabellenkalkulationen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
D. melanogaster wurde aufgrund der Ähnlichkeit der Gene zwischen D. melanogaster und dem Menschen weithin als Modell für verschiedene biologische Prozesse akzeptiert36. Die Verwendung von D. melanogaster als Modell zur Untersuchung des Darmtrakts ist weit verbreitet und die Anwendung von T.U.R.D. wurde verwendet, um die Anzahl, Fläche und Menge der fäkalen Ablagerungen abzuschätzen. Die phänotypische Nachweismethode wurde jedoch nicht zur Beurteilung der Diarrhö bei Fruchtfliegen verwendet. Daher führt dieses Protokoll eine neue Methode ein, um das Vorhandensein von Durchfall durch den Nachweis der Stuhlablagerungen grob zu beurteilen.
Stuhlablagerungen sind ein wesentlicher Indikator für die Funktion und Gesundheit des Darmtrakts37. In diesem Zusammenhang wird eine Methode zur Aufzucht von D. melanogaster auf arzneimittelhaltigem Medium vorgeschlagen, um verschiedene Parameter von fäkalen Ablagerungen zu untersuchen. Durch die Überwachung der Anzahl der Ablagerungen ist es möglich, die Häufigkeit des Stuhlgangs zu bestimmen und zu beurteilen, ob ein Medikament einen Einfluss auf die Darmpassage hat. Die Gesamtfläche der Ablagerungen kann gemessen werden, um die Konzentration und Verdünnung der Fäkalien zu bewerten, die ein wichtiger Faktor für die Bestimmung der allgemeinen Gesundheit des Darmtrakts ist. Darüber hinaus kann die Total Integrated Optical Density (IOD) verwendet werden, um die Gesamtmenge des in den Ablagerungen vorhandenen Fäkalienmaterials zu erfassen. Dieses Protokoll bietet eine effiziente Methode zum Screening und zur Bewertung von Medikamenten sowie Pflanzenextrakten, die den Darmtrakt beeinflussen. Wenn D. melanogaster als Modellorganismus verwendet wird, ist es möglich, die Wirksamkeit potenzieller Medikamente zu bewerten, was dazu beitragen kann, den Prozess der Arzneimittelforschung zu beschleunigen. Durch die Anwendung dieser Methode auf Pflanzenextrakte können Forscher dazu beitragen, deren Verwendung als Antidiarrhoika zu validieren.
Es gibt mehrere kritische Schritte, die bei der Verwendung dieses Protokolls zur Untersuchung von fäkalen Ablagerungen in D. melanogaster zu berücksichtigen sind. Zunächst ist es wichtig, die Masse zu berechnen, die erforderlich ist, um die gewünschte Konzentration des Arzneimittels im Medium zu erreichen. Darüber hinaus ist es wichtig, bei der Zugabe des Arzneimittels zum Medium auf einen guten Vorbereitungszustand zu achten, da hohe Temperaturen das Arzneimittel beeinträchtigen und seine Wirksamkeit beeinträchtigen können. Zweitens ist die Auswahl der weiblichen Fliegen in diesem Protokoll wichtig. Es ist wichtig, jungfräuliche weibliche Fliegen zu verwenden, um die Unterschiede in der Kotleistung zwischen jungfräulichen und begatteten Weibchen zu vermeiden. Zum Beispiel sind die Flecken, die von jungfräulichen Weibchen produziert werden, kreisförmiger als die von begatteten Weibchen, und begattete Weibchen neigen dazu, mehr Kotmaterial auszuscheiden als jungfräuliche Weibchen27,28. Daher wird empfohlen, die Fliegen vor 8 Stunden nach dem Auslaufen zu sammeln, um sicherzustellen, dass alle gefangenen Weibchen Jungfrauen sind. Darüber hinaus sollten die getesteten Fliegen stark und gesund sein, da ihre Gesundheit die Nahrungsaufnahme und die Kotausscheidung beeinflussen kann. Zum Beispiel können Fliegen mit einer anormalen Flügelform Schwierigkeiten haben, das Futter zu bekommen. Um T.U.R.D. erfolgreich nutzen zu können, sind die Blockgröße (Pixel) und die Offset-Einstellungen entscheidend. Aufgrund des unterschiedlichen Lichtkontrasts der Bilder kann es notwendig sein, verschiedene Einstellungen auszuprobieren, um eine bestmögliche Identifizierung von Kotablagerungen zu erreichen.
Obwohl die vorgestellte Methode effektiv ist, gibt es mehrere Einschränkungen. Einer davon ist die Genauigkeit der Wirkstoffkonzentration im Medium. Da das Medium während der Zubereitung erhitzt wird, kann etwas Wasser verdampfen, was die Konzentration des Arzneimittels beeinflussen kann. Eine weitere Einschränkung ist das Scannen der Petrischalen. Einige Teile der Petrischalen (d. h. Ränder) werden nicht gescannt, was zu einer Fehlberechnung der gesamten Kotablagerungen führen kann. Außerdem produzieren die Fliegen nicht die gleiche Menge an Kotablagerungen auf der Ober- und Unterseite der Petrischale. Da sie dazu neigen, mehr Ablagerungen auf der unteren Abdeckung zu erzeugen, kann die Standardabweichung der Analyse zwischen der oberen und unteren Abdeckung hoch sein, was die Genauigkeit der Ergebnisse beeinträchtigen kann.
Mit diesem Protokoll können Forscher Durchfall bei D. melanogaster untersuchen. Durch Modifikation des wirkstoffhaltigen Mediums kann diese Methode zum Screening von Antidiarrhoe-Pflanzen verwendet werden, was einen neuartigen Ansatz für die Wirkstoffforschung bietet. Traditionelle Medizin und Naturprodukte werden seit Jahrhunderten zur Behandlung verschiedener Krankheiten, einschließlich Magen-Darm-Erkrankungen, eingesetzt. Durch die Verwendung dieses Protokolls zur Bewertung der Wirksamkeit von Pflanzenextrakten auf fäkale Ablagerungen können potenzielle neue Behandlungen für Erkrankungen des Darmtrakts identifiziert und eine wissenschaftliche Begründung für ihre Verwendung als Antidiarrhoika bereitgestellt werden. Dieser Ansatz kann einen wertvollen Beitrag auf dem Gebiet der Wirkstoffforschung und Ethnopharmakologie leisten.
Offenlegungen
Die Autoren haben nichts zu verraten.
Danksagungen
Wir danken Dr. Martina Gáliková für die Bereitstellung der Drosophila-Stämme . Wir danken dem Team von Michelle Crozatier-Borde und Marc Haenlin für das Feedback zu unserer Studie und die Unterstützung bei der Verbesserung unseres Modells. Wir möchten uns bei der Napo Pharmaceuticals Company für die Bereitstellung des Medikaments Crofelemer bedanken. Die Autoren danken auch dem Gastherausgeber Dr. Hugues Petitjean, der uns die Möglichkeit gegeben hat, dieses Protokoll zu veröffentlichen. Diese Studie wurde von der Agence Nationale de la Recherche (ANR) im Rahmen des Projekts ANR-22-CE03-0001-01 finanziert.
Materialien
| Name | Company | Catalog Number | Comments |
| Chemical & Food medium | |||
| Agar | Sigma Aldrich | A7002 | 5 Kg bucket |
| Bromophenol blue | Sigma Aldrich | 34725-61-6 | B5525-25G |
| Corn flour | Nature et Cie | *910007 | 25 Kg bag |
| Crofelemer | Napo pharmaceuticals | - | - |
| Ethanol 96% | - | - | - |
| Loperamide | Sigma Aldrich | L4762 | 5 grams |
| Moldex | VWR | 1.06757.5000 | 5 Kg bag |
| Propionic acid | Dutscher | 409553-CER | 1 Liter bottle |
| Sugar | Pomona EpiSaveurs | 52705 | 1 Kg bag |
| Yeast | Dutscher | 789195 | 10 Kg bag |
| Materials | |||
| Beaker | DWK LIFE SCIENCE | - | 250 mL |
| Centrifugation tube | Eppendorf | 30119401 | Eppendorf tubes 5.0 mL |
| CO2 tank | - | - | - |
| Erlen Meyer flask | - | - | 500 mL (for extraction) |
| Filter paper grade | Whatman | - | 3 mm chr. |
| Flowbuddy socle | Genesis | - | - |
| Flugs Narrow Plastic vials | Genesis | 49-102 | - |
| Flystuff Blow gun | Genesis | - | - |
| Flystuff Ultimate Flypad | Genesis | - | - |
| Flystuff Foot pedal | Genesis | - | - |
| Forceps | Dumostar | 11295-51 | - |
| Graduated cylinder | - | - | 100 mL |
| Inox spatula | - | - | - |
| Micropipette | Eppendorf | 4924000088 | Eppendorf Reference 2 |
| Micropipette tip | Eppendorf | 30000919 | epT.I.P.S. Standard |
| Narrow Drosophila vials | Genesis | 32-120 | - |
| Paintbrush | - | - | - |
| Petri dish | Greiner | 628162 | Size: 60 x 15mm |
| Round-bottom flask | - | - | 500 mL (for evaporation) |
| Thermometer | Avantor | 620-0916 | |
| Whisk | - | - | - |
| Equipments | |||
| Chiller | HUBER | Minichiller | - |
| Heating bath | BÜCHI | B-490 | - |
| Heating plate | BIOBLOCK SCIENTIFIC | - | Magnetic stirrer hot plate |
| Incubator | Memmert | - | HPP110eco |
| Rotary evaporator | BÜCHI | R-200 | - |
| Scanner | Epson | V850 pro | - |
| Shaker | Edmund Bühle | KS 10 | - |
| Stereomicroscope binocular | Zeiss | Stemi 305 | - |
| Vacuum pump | VACUUBRAND | PC500 series | - |
| Vortex mixer | Sigma Aldrich | CLS6776-1EA | Corning LSE vortex mixers |
| Weighing scale | OHAUS Scout | SKX622 | - |
Referenzen
- Cheng, L. K., et al. Gastrointestinal system. WIREs Sys Bio Med. 2 (1), 65-79 (2010).
- Greenwood-Van Meerveld, B., Johnson, A. C., Grundy, D. Gastrointestinal physiology and function. Handb Exp Pharmacol. 239, 1-16 (2017).
- Doyle, L. A., et al. A clinicopathologic study of 24 cases of systemic mastocytosis involving the gastrointestinal tract and assessment of mucosal mast cell density in irritable bowel syndrome and asymptomatic patients. Am J Surg Pathol. 38 (6), 832-843 (2014).
- Levine, G. A., Walson, J. L., Atlas, H. E., Lamberti, L. M., Pavlinac, P. B. Defining pediatric diarrhea in low-resource settings. J Pediatric Infect Dis Soc. 6 (3), 289-293 (2017).
- Abraham, B., Sellin, J. H. Drug-induced diarrhea. Curr Gastroenterol Rep. 9 (5), 365-372 (2007).
- Badry, A. H. H., Jameel, A. Y., Mero, W. M. S. Pathogenic microorganisms associated with arrhea in infants and children in Duhok Province, Kurdistan Region / Iraq. Sci J Uni Zakho. 2 (2), 266-275 (2014).
- Manetu, W. M., M'masi, S., Recha, C. W. Diarrhea disease among children under 5 years of age: A global systematic review. Open J Epidemiol. 11 (3), 207-221 (2021).
- Fu, J., et al. Aquatic animals promote antibiotic resistance gene dissemination in water via conjugation: Role of different regions within the zebra fish intestinal tract, and impact on fish intestinal microbiota. Mol Ecol. 26 (19), 5318-5333 (2017).
- Zhang, Q., Widmer, G., Tzipori, S. A pig model of the human gastrointestinal tract. Gut Microbes. 4 (3), 193-200 (2013).
- Cox, C. R., Gilmore, M. S. Native microbial colonization of Drosophila melanogaster and its use as a model of Enterococcus faecalis pathogenesis. Infect Immun. 75 (4), 1565-1576 (2007).
- Jasper, H. Exploring the physiology and pathology of aging in the intestine of Drosophila melanogaster. Invertebr Reprod Dev. 59, 51-58 (2015).
- Pandey, U. B., Nichols, C. D. Human disease models in Drosophila melanogaster and the role of the fly in therapeutic drug discovery. Pharmacol Rev. 63 (2), 411-436 (2011).
- Miguel-Aliaga, I., Jasper, H., Lemaitre, B. Anatomy and physiology of the digestive tract of Drosophila melanogaster. Genetics. 210 (2), 357-396 (2018).
- Jennings, B. H. Drosophila- a versatile model in biology & medicine. Materials Today. 14 (5), 190-195 (2011).
- Kumar, V. S., Navaratnam, V. Neem (Azadirachta indica): Prehistory to contemporary medicinal uses to humankind. Asian Pac J Trop Biomed. 3 (7), 505-514 (2013).
- Shrestha, P., Adhikari, S., Lamichhane, B., Shrestha, B. G. Phytochemical screening of the medicinal plants of Nepal. J Environ Sci Tech Food Tech. 1 (6), 11-17 (2015).
- Perveen, S., Al-Taweel, A. Pharmacognosy: Medicinal Plants. IntechOpen. , (2019).
- Noumi, E., Yomi, A. Medicinal plants used for intestinal diseases in Mbalmayo Region, Central Province, Cameroon. Fitoterapia. 72 (3), 246-254 (2001).
- Njoku, V. O., Obi, C., Onyema, O. M. Phytochemical constituents of some selected medicinal plants. African J Biotechnol. 10 (66), (2011).
- Rokaya, M. B., et al. Traditional uses of medicinal plants in gastrointestinal disorders in. Nepal. J Ethnopharmacol. 158, 221-229 (2014).
- Birdi, T., Krishnan, G. G., Kataria, S., Gholkar, M., Daswani, P. A randomized open label efficacy clinical trial of oral guava leaf decoction in patients with acute infectious diarrhoea). J Ayurveda Integr Med. 11 (2), 163-172 (2020).
- van Vuuren, S. F., Nkwanyana, M. N., de Wet, H. Antimicrobial evaluation of plants used for the treatment of diarrhoea in a rural community in northern Maputaland, KwaZulu-Natal, South Africa. BMC Complement Altern Med. 15, 53 (2015).
- Firenzuoli, F., Gori, L. Herbal medicine today: Clinical and research issues. Evid Based Complement Alternat Med. 4, 37-40 (2007).
- Rawat, P., Singh, P. K., Kumar, V. Evidence based traditional anti-diarrheal medicinal plants and their phytocompounds. Biomed Pharmacother. 96, 1453-1464 (2017).
- Palombo, E. A. Phytochemicals from traditional medicinal plants used in the treatment of diarrhoea: modes of action and effects on intestinal function. Phytother Res. 20 (9), 717-724 (2006).
- Koyama, T., et al. A nutrient-responsive hormonal circuit mediates an inter-tissue program regulating metabolic homeostasis in adult Drosophila. Nat Commun. 12 (1), 5178 (2021).
- Wayland, M. T., et al. Spotting the differences: Probing host/microbiota interactions with a dedicated software tool for the analysis of faecal outputs in Drosophila. J Insect Physiol. 69, 126-135 (2014).
- Cognigni, P., Bailey, A. P., Miguel-Aliaga, I. Enteric neurons and systemic signals couple nutritional and reproductive status with intestinal homeostasis. Cell Metab. 13 (1), 92-104 (2011).
- Gáliková, M., Dircksen, H., Nässel, D. R. The thirsty fly: Ion transport peptide (ITP) is a novel endocrine regulator of water homeostasis in Drosophila. PLoS Genet. 14 (8), 1007618 (2018).
- Chassagne, F., Quave, C. L. Collection, extraction, and in vitro antibacterial evaluation of plants used in traditional medicine. Methods Mol Biol. 2296, 19-41 (2021).
- Patel, T. S., Crutchley, R. D., Tucker, A. M., Cottreau, J., Garey, K. W. Crofelemer for the treatment of chronic diarrhea in patients living with HIV/AIDS. HIVAIDS. 5, 153-162 (2013).
- Cottreau, J., Tucker, A., Crutchley, R., Garey, K. W. Crofelemer for the treatment of secretory diarrhea. Expert Rev Gastroenterol Hepatol. 6 (1), 17-23 (2012).
- Wu, P. E., Juurlink, D. N. Loperamide cardiac toxicity: Pathophysiology, presentation, and management. Can J Cardiol. 38 (9), 1378-1383 (2022).
- Benguettat, O., et al. The DH31/CGRP enteroendocrine peptide triggers intestinal contractions favoring the elimination of opportunistic bacteria. PLoS Pathog. 14 (9), 1007279 (2018).
- Thakare, M. R., et al. Direct intake estimation and longitudinal tracking of solid-food consumption (DIETS) in Drosophila. bioRxiv. , 543033 (2023).
- Miller, J., et al. Drosophila melanogaster as an emerging translational model of human nephrolithiasis. J Urol. 190 (5), 1648-1656 (2013).
- Zierer, J., et al. The fecal metabolome as a functional readout of the gut microbiome. Nat Genet. 50 (6), 790-795 (2018).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten