Schnelle Quantifizierung von oxidierten und reduzierten Formen von Glutathion unter Verwendung von ortho-Phthalaldehyd in kultivierten Säugetierzellen in vitro
In diesem Artikel
Zusammenfassung
Die Quantifizierung sowohl oxidierter als auch reduzierter Formen von Glutathion (GSSG bzw. GSH) wurde durch die Verwendung von Ortho-Phthalaldehyd (OPA) erreicht. OPA wird stark fluoreszierend, sobald es an GSH konjugiert wird, ist aber nicht in der Lage, GSSG zu konjugieren, bis es reduziert wird. Hier beschreiben wir einen multiparametrischen Assay, um beides mittels Proteinquantifizierung zur Normalisierung zu quantifizieren.
Zusammenfassung
Glutathion gilt seit langem als wichtiger Biomarker für die Bestimmung der antioxidativen Reaktion der Zelle. Daher ist es ein primärer Marker für Studien zu reaktiven Sauerstoffspezies. Die Methode verwendet Ortho-Phthalaldehyd (OPA), um die zelluläre Konzentration von Glutathion (en) zu quantifizieren. OPA-Konjugate mit reduziertem Glutathion (GSH) über Sulfhydrylbindung bilden anschließend ein Isoindol, was zu einem stark fluoreszierenden Konjugat führt. Um ein genaues Ergebnis sowohl von oxidiertem Glutathion (GSSG) als auch von GSH zu erhalten, ist eine Kombination aus Maskierungsmitteln und Reduktionsmitteln erforderlich, die in diesem Protokoll implementiert wurden. Behandlungen können sich auch auf die Lebensfähigkeit der Zellen auswirken. Daher wird in diesem multiparametrischen Assay die Normalisierung über einen Proteinassay dargestellt. Der Assay zeigt einen pseudolinearen Nachweisbereich von 0,234 - 30μM (R2=0,9932±0,007 (N=12)) spezifisch für GSH. Der vorgeschlagene Assay ermöglicht auch die Bestimmung von oxidiertem Glutathion unter Zugabe des Maskierungsmittels N-Ethylmaleimid zur Bindung von reduziertem Glutathion, und das Reduktionsmittel Tris(2-carboxyethyl)phosphin wird eingeführt, um die Disulfidbindung in GSSG zu spalten und zwei Moleküle GSH zu erzeugen. Der Assay wird in Kombination mit einem validierten Bicinchoninsäure-Assay zur Proteinquantifizierung und einem Adenylatkinase-Assay zur Beurteilung der Zytotoxizität verwendet.
Einleitung
Reaktive Sauerstoffspezies (ROS) sind ein primärer Induktor von oxidativem Stress; Oxidativer Stress ist bei der Entstehung von DNA-Mutationen, Zellalterung/Zelltod, verschiedenen Krebsarten, Diabetes, neurologischen Erkrankungen (wie Parkinson und Alzheimer) und mehreren anderen lebensbedrohlichen Erkrankungen gut etabliert 1,2,3,4,5. Eine wichtige Abwehr gegen ROS sind thiolische, nicht-enzymatische Antioxidantien, die in der Lage sind, Oxidantien oder Radikale zu reduzieren, indem sie als Protonendonoren wirken 6,7. Glutathion (GSH) und Cystein sind die beiden am weitesten verbreiteten Thiole, die in Säugetieren vorkommen8, während verschiedene andere Thiole mit niedrigem Molekulargewicht existieren (wie z. B. Ergothionein), GSH und Cystein die am häufigsten gemessenen nicht-enzymatischen Antioxidantien sind, die in der Literatur gefunden werden 9,10,11 und die größte Bedeutung für die Bekämpfung von ROS haben 8,12,13,14.
Wenn GSH als Antioxidans verwendet wird, werden zwei Moleküle von GSH über eine Disulfidbindung kovalent miteinander verbunden, um Glutathiondisulfid (GSSG) herzustellen. Der Abbau von GSH wird häufig als Indikator für oxidativen Stress verwendet15,16. Diese Abschätzung kann auch mit dem Nachweis von GSSG kombiniert werden, obwohl ein Anstieg des GSSG in Zellen oft durch aktive Exportprozesse begrenzt wird, da GSSG in Zellen relativ reaktiv sein kann, was zur Bildung von Disulfidbindungen mit anderen Proteinthiolen führt16.
Herkömmliche Methoden zur Messung von GSH und GSSG sind keine einfachen Verfahren und erfordern zahlreiche Schritte, einschließlich der zellulären Extraktion mit lytischen Reagenzien17,18. Das hier skizzierte Protokoll vereinfacht diese Methoden und ermöglicht die genaue Messung von nicht-enzymatischen Thiolen und die Normalisierung anhand des zellulären Proteingehalts oder der Adenylatkinase-Freisetzung. Darüber hinaus ist es möglich, die zelluläre Lebensfähigkeit vor der GSH/GSSG-Extraktion zu messen. Mehrere Methoden haben bereits versucht, reduzierte und oxidierte nicht-enzymatische Thiole effizient zu identifizieren und zu quantifizieren; Methoden, einschließlich der Verwendung von HPLC 19,20,21, Plate Assay (biochemisch)22,23,24,25, und die gängige Reagenzien für die Thiolkonjugation verwenden, wie z. B. 5,5-Dithio-bis-(2-nitrobenzoesäure) (DTNB/Ellman-Reagenz)19, Monochlorbiman (mBCI)26,27,28. Mehrere Unternehmen haben auch proprietäre Kits für den Nachweis von Glutathion entwickelt; Sie veröffentlichen jedoch keine Reagenzienunverträglichkeiten, was Probleme aufwirft, die von den verwendeten Behandlungen abhängen29.
Dieses Protokoll beschreibt einen multiparametrischen Assay, der reduzierte Thiole (wie GSH) durch Ortho-Phthalaldehyd (OPA)-Konjugation nachweist, um ein Fluoreszenzsignal zu erzeugen, das bei 340/450 Ex/Em nachweisbar ist. Dieser Assay erleichtert den gleichzeitigen Nachweis von GSH und GSSG (in der Platte) durch die Verwendung von Maskierungsmitteln (N-Ethylmaleimid) und GSSG-Reduktionsmitteln (Tris(2-carboxyethyl)phosphin). Dieses Multi-Biomarker-Protokoll bietet auch die Möglichkeit, Proteine während der zellulären Lysephase über einen Bicinchoninsäure-Assay für die Normalisierung von Proben nach Abschluss der Endmessung oder über einen Adenylatkinase-Assay aus dem Zellmedium zu quantifizieren. Dieser Assay kann mit mehreren Reagenzien durchgeführt werden, die in den meisten Labors leicht verfügbar sind, und erfordert nur einige zusätzliche ungewöhnliche Chemikalien. Der Prozess ist einfach, leicht zugänglich und kann ohne mühsame Schritte in weniger als 2 Stunden durchgeführt werden.
In diesem Protokoll wurden verschiedene Nanomaterialien ausgewählt, von denen entweder bereits gezeigt wurde, dass sie ROS induzieren, oder bei denen der Verdacht bestand, oxidativen Stress zu induzieren30,31. Es wurde ein Konzentrationsbereich untersucht, um die Auswirkungen der Exposition dieser Nanomaterialien auf verschiedene Zelllinien und die Wirksamkeit des Assays bei der Quantifizierung von antioxidativen Thiolen zu sehen.
Protokoll
HINWEIS: Das folgende Protokoll wurde so konzipiert, dass es in Verbindung mit einem Bicinchoninsäure (BCA)-Proteinassay und einem Adenylatkinase (AK)-Assay verwendet werden kann, um Proben auf Behandlungen zu normalisieren. Stellen Sie sicher, dass der Bediener während der gesamten Vorbereitung und Verwendung von Materialien angemessene Kleidung und die erforderliche Sicherheitsausrüstung wie einen Howie-Laborkittel, Nitrilhandschuhe und eine Schutzbrille der Klasse I trägt. Das Protokoll ist in mehrere Stufen unterteilt.
1. Vorbereitung des Lagers und der Arbeitslösungen
- Herstellung von Stammlösungen des 100 mM GSH-Standards in 1 mM HCl (hergestellt aus 37 % HCl in doppelt destilliertem Wasser (ddH2O)).
HINWEIS: Bei der Verdünnung mit hochkonzentrierter Säure, wie z. B. 37 % HCl, ist die korrekte Zugabe von Säure zum Wasser in einem Abzug der Klasse I sicherzustellen. - Bereiten Sie einen Vorrat von 22,35 mM OPA in absolutem Ethanol vor. Führen Sie diesen Schritt in einem Abzug der Klasse I durch. 25 mM N-Ethylmaleimid (NEM) in ddH2O herstellen. Dieser Schritt wird in einem Abzug der Klasse I durchgeführt.
HINWEIS: Diese drei Lösungen können bis zu 3 Monate bei -20 °C gelagert werden. - Bereiten Sie 0,01 M Tris(2-carboxyethyl)phosphin (TCEP) auf ein Gesamtvolumen von 500 μl vor, das für 100 Vertiefungen erforderlich ist. Bereiten Sie 100 μl 1 mM GSH-Standard vor, verdünnt aus 100 mM Stamm mit ddH2O.
- Verwenden Sie entweder einen Immunpräzipitations-Lysepuffer (IP) oder die folgende Formulierung: 394 mg Tris-HCl (Endkonzentration 25 mM), 877 mg NaCl (Endkonzentration 150 mM), 29 mg EDTA (Endkonzentration 1 mM), entweder 1 ml 100 % NP-40 oder IGEPAL CA-630 (Endkonzentration von 1 % V/V), 5 ml Glycerin (Endkonzentration 5 % V/V), 84 mL ddH2O. Die Komponenten unter leichtem Rühren mischen und den pH-Wert auf 7,4 einstellen. In einen 100-ml-Meßkolben umfüllen und das restliche Volumen von ddH2O zugeben, um ein Endvolumen von 100 mL zu erreichen. Steril filtrieren durch einen 0,22 μm Filter und bis zu 6 Monate bei 2-8 °C lagern.
HINWEIS: Lysing-Lösungen wirken in diesem Assay als Kontaminant/Interferenz; Daher werden die oben genannten Formulierungen spezifiziert. - Bereiten Sie 1 l 0,1 M phosphatgepufferte Kochsalzlösung zu, die mit Ethylendiamintetraessigsäure (PBS-EDTA) bei 3 verschiedenen pH-Werten ergänzt wird, insbesondere 7,2, 8,5 und 9,0. Verwenden Sie einen handelsüblichen 0,1 M PBS-Puffer, der mit 1 mM EDTA (292,24 mg/L) oder der folgenden 10x (1 l) Formulierung ergänzt wird: 80 g NaCl, 2,0 g KCl, 14,4 g Na2HPO4, 2,4 g KH2PO4, 800 mL ddH2O. Zugeben und mischen; Füllen Sie bis zu 1 l auf. Autoklavieren Sie die Lösung für die Sterilität und lagern Sie sie 12 Monate lang bei Raumtemperatur. Aus der 10-fachen Stammlösung wird eine Arbeitslösung aus PBS hergestellt und mit EDTA (Konzentration wie oben angegeben) ergänzt.
HINWEIS: Der pH-Wert ist von entscheidender Bedeutung; Stellen Sie sicher, dass der pH-Wert genau ist, bevor Sie mit dem Protokoll beginnen. - Führen Sie eine serielle 1:2-Verdünnung von 1 mM GSH mit ddH2O (1 mM, 500 μM, 250 μM, 125 μM, 62,5 μM, 31,25 μM, 15,625 μM und 7,8125 μM) durch. Geben Sie 10 μl jeder Konzentration in Standard-Wells (in doppelter Ausführung). Die Proben werden weiter in Lysepuffer verdünnt; Daher betragen die Konzentrationen danach 1/5 ihrer ursprünglichen Konzentration (200, 100, 50, 25, 12,5, 6,25, 3,125, 1,5625 μM).
HINWEIS: Die endgültigen Konzentrationen für die Kalibrierung betragen 30 μm, 15 μm, 7,5 μm, 3,75 μm, 1,875 μm, 937,5 nm, 468,8 nm und 234,4 nm.
2. Vorbereitung des Assays
HINWEIS: Dieses Protokoll verwendet die humanen Zelllinien HepG2, A549 und J774, die kommerziell von ATCC erworben wurden. Diese Zelllinien wurden gemäß den genehmigten Richtlinien verwendet, die in den Tier- und Gewebekulturgesetzen und -vorschriften der Universität festgelegt sind.
- 24 Stunden vor Beginn des Assays Keimzellen in den in Tabelle 1 angegebenen Konzentrationen; Abhängig von der Zelllinie/dem Typ und der verwendeten Behandlung ist die Dichte jedoch nach Bedarf anzupassen. Züchten Sie Zellen in vollständigem Wachstumsmedium (Eagles modified essentials medium (EMEM) mit 10 % hitzeinaktiviertem fötalem Kälberserum (HIFS), 1 % Penstrep (10.000 U/ml Penicillin/10 mg/ml Streptomycin) und 1 % nicht-essentiellen Aminosäuren.
- Keimzellen mit herkömmlichen Zellaussaatmethoden32. Samenzellen in vollständig schwarzen Platten, wenn nicht mit Mikroskopie nach dem Assay. Untersuchen Sie die Zellen vor der Verwendung mittels Mikroskopie im T75-Kolben auf Konfluenz und allgemeinen Gesundheitszustand.
- In einer sauberen, sterilen biologischen Sicherheitswerkbank der Klasse II und nach einer strengen aseptischen Technik werden die Zellmedien entsorgt, die Zellen vorsichtig mit ~15 ml sterilem PBS bei Raumtemperatur (RT) gewaschen und entsorgt.
- In den Zellkolben werden 5 ml steriles 1x Trypsin gegeben, vorsichtig geschüttelt, um die Abdeckung der Zellmonoschicht zu gewährleisten, und 5 Minuten lang bei 37 °C in einen Inkubator gegeben, um die Zellablösung zu erleichtern.
- Stoppen Sie die Trypsinisierung durch Zugabe von Wachstumsmedium mit hitzeinaktiviertem fötalem Kälberserum (10%), ca. 10 ml.
- Die Zellen in ein 50 mL Zentrifugenröhrchen geben und 5 Minuten lang mit 200 x g pelletieren. Entsorgen Sie das Medium, und ersetzen Sie es durch 5 ml desselben Mediums. Die Zellen werden im Röhrchen resuspendiert, bis sie homogen sind und keine Verklumpung mehr zu beobachten ist.
- Entfernen Sie 20 μl Zellsuspension und geben Sie sie zur Zählung in ein Hämozytometer. Sobald die Anzahl der erforderlichen Zellen berechnet wurde, führen Sie eine Verdünnung durch, um eine Lösung mit der richtigen Zelldichte herzustellen.
- Pipettieren Sie Medien, die Zellen in 96-Well-Platten (350 μl Kapazität) mit einem maximalen Volumen von 200 μl pro Vertiefung enthalten. Die Zellen für 24 h in einen 37 °C heißen Inkubator mit 5 % CO2 legen, damit sie an der Plattenoberfläche haften.
- Um sowohl Gesamtglutathion als auch GSSG zu bestimmen, behandeln Sie die Proben auf beide Erkrankungen. Saat und Aufbereitung von 6 Wells, um jeweils 2 Sätze GSH und GSSG mit 3 technischen Wiederholungen bereitzustellen (Abbildung 1 zeigt das Layout).
- Sicherstellen, dass alle Reagenzien vor Beginn des Assays angemessen vorbereitet sind; Stellen Sie sicher, dass alle Pufferkomponenten und Reagenzien auf RT sind, bevor Sie mit der Konstruktion der Puffer oder der Verwendung im Assay beginnen, mit Ausnahme von pH 7,4 PBS (ohne EDTA), der bis zur Verwendung auf Eis / gekühlt aufbewahrt werden sollte.
HINWEIS: Es ist von entscheidender Bedeutung, dass die Blasenbildung auf ein Minimum beschränkt wird, damit die gewünschten Reaktionen innerhalb des Assays stattfinden können und eine genaue Quantifizierung über den Plattenleser möglich ist.
| Zelllinie | Aussaatdichte (96-Well-Platte) |
| HepG2 | 10.000 Zellen / Vertiefung |
| Nr. A549 | 5.000 Zellen / Vertiefung |
| Nr. J774 | 10.000 Zellen / Vertiefung |
Tabelle 1: Vorgeschlagene Aussaatdichten für ausgewählte Zelllinien. Gezeigt werden unterschiedliche Seeding-Dichten für drei verschiedene Zelllinien, die in den dargestellten Daten verwendet werden, insbesondere A549, J774 und HepG2.
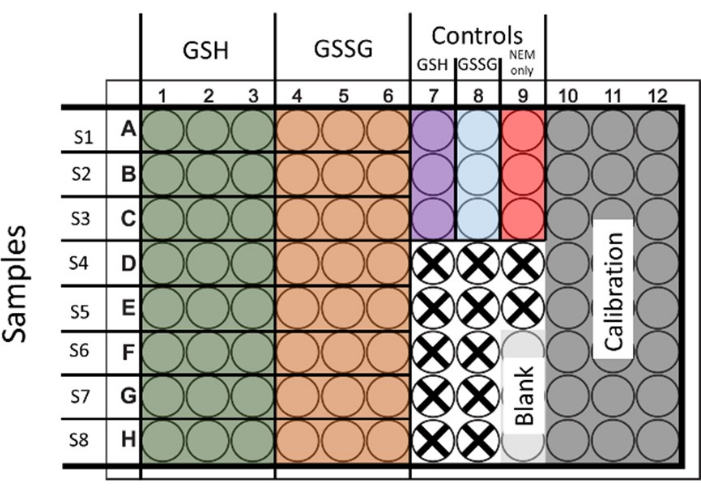
Abbildung 1: Vorgeschlagenes Layout für die Aussaat von 96-Well-Platten zur gleichzeitigen Bestimmung von Gesamtglutathion und Glutathiondisulfid. Bohrlöcher für die Kalibrierung und Kontrolle werden ebenfalls vorgeführt. Brunnen, die nicht genutzt werden, werden mit einem Kreuz dargestellt. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
3. Behandlung von Nanomaterialien
- Wiegen Sie Nanomaterialien (insbesondere ZnO,TiO 2, CuO und Ag) in einer μg-fähigen Waage. Führen Sie eine Berechnung durch, um eine Anfangskonzentration von 1 mg/ml pro Nanomaterial zu erreichen.
- Nanomateriallösungen in ein Ultraschallgerät geben und 16 Minuten lang mit einem Ultraschallbad (38 W) beschallen, um eine homogene Lösung herzustellen. Nehmen Sie eine Reihe von Verdünnungen für jedes Nanomaterial bei 125, 62,5, 31,25, 15,625 μg/ml vor.
- Nehmen Sie die Zellen aus dem Inkubator und waschen Sie sie leicht mit RT PBS. Nachdem Sie sichergestellt haben, dass alle PBS entfernt wurden, geben Sie 100 μl Behandlungen mit Kontrollen (Nährmedien ohne HIFS) auf die Platte. Nach der Behandlung der Zellen mit den Nanomaterialien in einem 37 °C heißen Inkubator (5 % CO2) für 4 h inkubieren; Verwenden Sie anschließend das folgende Protokoll, um GSH zu quantifizieren: GSSG, Proteinkonzentration und AK-Freisetzung.
4. Assay-Protokoll
- Nach der Exposition gegenüber der Behandlung (Abbildung 2A) ist die Lebensfähigkeit anhand der Aktivität der Adenylatkinase (AK) zu beurteilen (optional). Verwenden Sie für diesen Assay ein handelsübliches Kit gemäß den Anweisungen des Herstellers.
- Schleudern Sie die Platten in einer Zentrifuge bei 200 x g für 5 Minuten, um die Behandlung und Zelltrümmer leicht zu pelletieren (Abbildung 2B).
- Entfernen Sie vorsichtig 20 μl des Medienüberstands aus jeder Probe und Kontrollvertiefung (wie oben angegeben) und pipettieren Sie sie in eine benachbarte 96-Well-Weißplatte im gleichen Layoutformat (Abbildung 2C).
- Geben Sie 100 μl Arbeitslösung aus dem AK-Kit in jede Vertiefung, schirmen Sie die Platte vor Licht ab und lassen Sie sie 10 Minuten lang bei Raumtemperatur ziehen. Zeichnen Sie die Lumineszenz mit einem Plattenlesegerät mit 1000 Zählungen/s auf.
- Für GSH-Standards geben Sie 40 μl Gesamtglutathionpuffer in jede Vertiefung (Abbildung 2D; optional, für die Quantifizierung erforderlich).
- Restliches Medium von der Platte absaugen und 3x mit eiskaltem 0,1 M PBS, pH 7,2 waschen, wobei jeder Waschgang (Abbildung 2E) mit Ausnahme von Standards verworfen wird. Lassen Sie die letzte Wäsche in der Platte, bis die GSH-Kalibrierung in die Platte eingelegt wurde.
- 10 μl jeder Glutathionkonzentration und Blindmenge (ddH2O) in dreifacher Ausfertigung in die Vertiefungen geben.
- Entfernen Sie die abschließende PBS-Wäsche und geben Sie die Mischungen in jede Vertiefung gemäß Tabelle 2 für die gewünschte Zielquantifizierung (Abbildung 2E). Berechnen Sie die erforderlichen Volumina vor Beginn dieses Schritts aufgrund eines zeitkritischen Aktivitätsverlusts mit vollständigen Puffern. Stellen Sie sicher, dass diese Reagenzienmischungen vor Beginn des Assay-Prozesses hergestellt werden, aber lassen Sie sie nicht länger als 30 Minuten ruhen, bevor Sie sie verwenden.
- Stellen Sie die Platte auf einen Orbitalplattenschüttler und lassen Sie die Platte 2 Minuten lang bei 300 U/min schütteln (Abbildung 2F).
- Aus dem Shaker nehmen und 5 μl 0,01 M TCEP-Lösung in jede Vertiefung geben, mit Ausnahme der NEM-Kontrollvertiefung. Stellen Sie die Platte wieder in den Schüttler und inkubieren Sie sie 10 Minuten lang (Abbildung 2F).
- Die Platte in die Zentrifuge überführen und bei 200 x g 5 min schleudern. Übertragen Sie 25 μl aus jeder Probenvertiefung auf eine andere 96-Well-Platte (klar); Dies wird für die Proteinkonzentration verwendet (siehe Schritt 4.15 ; Abbildung 2G). Übertragen Sie keine Standards oder Assay-Kontrollen.
- Stellen Sie sicher, dass das endgültige Volumen für jede Vertiefung 30 μl beträgt. Entfernen Sie die Lautstärke von Reglern und Normen, um diese Anforderung zu erfüllen (Abbildung 2H).
- Geben Sie 170 μl Arbeits-OPA-Lösung in jede Vertiefung, schirmen Sie die Platte vor Licht ab und stellen Sie sie für 15 Minuten auf den Schüttler (Abbildung 2I).
- Lesen Sie die Fluoreszenz mit einem Platten-Reader an Ex340/EM450 (Abbildung 2J). Stellen Sie sicher, dass während der Messphase keine Blasen vorhanden sind. Sie wirken sich nachteilig sowohl auf die Reaktion als auch auf die Quantifizierung mittels Plate Reader aus.
- Um den Proteingehalt von lysierten Zellen zu quantifizieren, verwenden Sie ein kommerzielles BCA-Assay-Kit. Übertragen Sie Proben aus Schritt 4.12 auf eine neue 96-Well-Platte (klar) mit 25 μl pro Well.
- Verwenden Sie ein in IP-Lysepuffer verdünntes Rinderserumalbumin (BSA)-Standard und geben Sie es in dreifacher Ausfertigung mit 25 μl pro Vertiefung auf die Platte. Die genauen Konzentrationen sind im BCA-Kit-Protokoll definiert.
- Bereiten Sie eine Arbeitslösung vor, die aus den Reagenzien A und B im Verhältnis 50:1 aus dem BCA-Kit besteht, und geben Sie 200 μl in jede Vertiefung, die die Probe, den Standard und die Kontrolle enthält. Die Platten vor Licht schützen und 30 Minuten lang bei 37 °C inkubieren (Abbildung 2K).
- Nehmen Sie die Proben aus dem Inkubator, lassen Sie sie 5 Minuten lang bei Raumtemperatur äquilibrieren und lesen Sie dann die Absorption mit einem Plattenleser bei 562 nm ab (Abbildung 2L).
| Gesamtglutathionkonzentration Lysereagenzienmischung | |
| Bestandteil | Volumen |
| Lyse-Puffer | 50μL |
| Gesamtvolumen / Vertiefung | 50μL |
| Oxidierter Glutathion-Konzentrations-Lyse-Reagenzien-Mix | |
| Bestandteil | Volumen |
| Lyse-Puffer | 49,5 μl |
| NEM (25 mM) | 0,5 μl |
| Gesamtvolumen / Vertiefung | 50μL |
| VERWENDEN SIE BEIDE LÖSUNGEN INNERHALB VON 30 MINUTEN NACH DER ZUSAMMENSTELLUNG DER MISCHUNG | |
| Komponente der OPA-Erkennungslösung | Volumen |
| OPA 3mg/ml | 5μL |
| PBS (pH 9,0) | 165μL |
| Gesamtvolumen / Vertiefung | 170μL |
Tabelle 2: Erforderliche Mengen an Reagenzien für die Durchführung des Protokolls. Erforderliche Volumina pro Vertiefung für die Bestimmung des Gesamtglutathions, des Glutathiondisulfids und des erforderlichen Arbeitsreagenzes. Stellen Sie sicher, dass die erforderlichen Volumina berechnet werden und ein Überschuss enthalten ist, um den Volume-Verlust durch die Übertragung zu berücksichtigen.
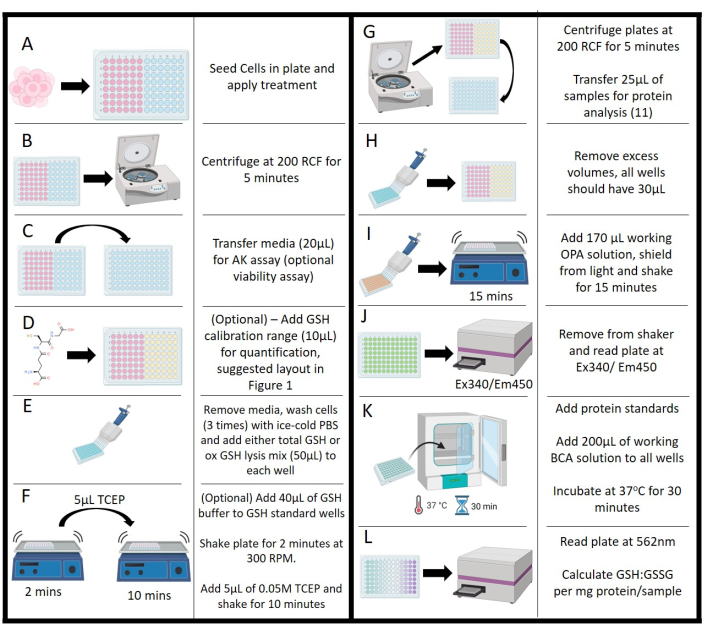
Abbildung 2: Schematische Darstellung des Protokolls. (A) Erstaussaat, Inkubation und Behandlung der Zellen. (B) Zentrifugation zur Trennung von Medien und Schwebstoffen. (C) Medientransfer für den Adenylatkinase-Assay. (D) Addition von Glutathionkonzentrationen für den Kalibrierbereich. (E) Waschstufen und Zugabe von Lysingreagenzien. (F) Pufferzugabe und Tris(2-carboxyethyl)-phosphin-Zugabe mit Schüttelschritt. (G) Zentrifugation von lysierten Zellen zur Medienentfernung für die Proteinanalyse. (H) Entfernen des Mediums zum Ausgleich des Volumens auf der Platte. (I) Zugabe von ortho-Phthalaldehyd-Arbeitslösung mit Schüttelinkubation. (J) Messung der ortho-Phthalaldehyd-Fluoreszenz mit Hilfe eines Platten-Readers. (K) Inkubationsstufen für den Bicinchoninsäure-Assay zur Proteinbestimmung. (L) Messung der Proteinkonzentration, die eine Normalisierung der Glutathion-Werte ermöglicht: Glutathiondisulfid-Werte. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Ergebnisse
Gemäß diesem Protokoll wurden die Zelllinien A549 und J774 mit einer Dichte von 5.000 Zellen/Well bzw. 10.000 Zellen/Well ausgesät und bei 37 °C in 5 % CO2 für 48 Stunden kultiviert. Die AK-Analyse nach der Behandlung mit Nanomaterialien ist in der ergänzenden Tabelle 1 und die Proteinkonzentration in der ergänzenden Tabelle 2 dargestellt.
Diagramm der Kalibrierung
In Abbildung 3 sind drei Kalibrierungen unter Verwendung des angegebenen Konzentrationsbereichs (0,234 - 30 μM Endkonzentration) von drei separaten Platten aus drei verschiedenen Zelltypen (sollten die Kalibrierung jedoch nicht beeinträchtigen) an drei verschiedenen, nicht aufeinanderfolgenden Tagen gezeigt. Während 3 Stichproben gezeigt werden, wurde ein N von 12 beobachtet, der ähnliche lineare Regressionen mit einem durchschnittlichen R2-Wert von 0,9932 ± 0,007 zeigte.
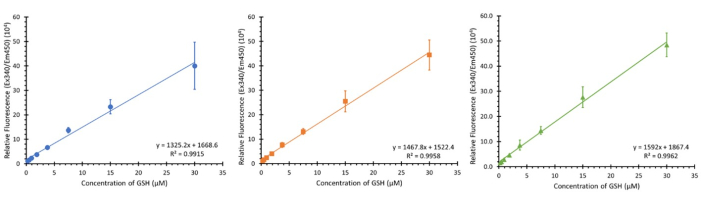
Abbildung 3: Glutathion-Kalibrierungsdiagramme für den Assay. Drei Kalibrierungsdiagramme aus separaten Glutathion-Kalibrierungsbereichen in der Platte, die jeweils im Abstand von einer Woche durchgeführt wurden; Fehlerbalken ± SD (n=3, N=12) n=technische Replikate, N=biologische Replikate. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Beispiele für Ergebnisse
HepG2-, A549- und J774-Zellen wurden bei der Bewertung verschiedener Nanomaterialien verwendet, die im Verdacht stehen, Veränderungen der zellulären Mechanismen durch oxidativen Stress zu induzieren. Es wurde das beschriebene Nachweis- und Quantifizierungsprotokoll verwendet.
Die Daten aus den 3 Messungen (AK, BCA und GSH/GSSG) wurden wie folgt behandelt. Der AK- und BCA-Assay wurde zur Normalisierung implementiert; Der AK-Assay unter Verwendung des empfohlenen Kits liefert die schnellsten und einfachsten Daten für die Menge an AK, die in das Zellmedium freigesetzt wird. Für die Erhöhung des Zelltods wird ein Anstieg der AK-Werte erwartet. Daher ist eine -ve (Alive) und +ve (Dead) Steuerung erforderlich. Dies ermöglicht eine Normalisierung auf der Grundlage des Prozentsatzes.
Der BCA-Assay ist ein längerer Prozess, ermöglicht aber quantifizierbare Ergebnisse durch Proteinquantifizierung (mg/ml). Dies erfordert keine -ve- oder +ve-Kontrolle wie in der AK, sondern immer noch eine allgemeine -ve-Kontrolle (unbehandelte Zellen), um die Normalisierung der zu erreichenden Werte zu ermöglichen.
In diesem repräsentativen Ergebnisteil wurde festgestellt, dass die Behandlung (Nanomaterialien) das Potenzial hat, den AK-Assay zu stören. Daher wurden alle Normalisierungen unter Verwendung der BCA-Daten durchgeführt. Daher werden die Informationen als Konzentration der nachgewiesenen Spezies (GSH oder GSH+GSSG (es wird jedoch eine Subtraktion der GSH+GSSG-Gesamtkonzentration durchgeführt, um die GSSG-Konzentration zu erhalten) pro mg/ml Protein (über einen BCA-Assay) dargestellt. Auf Wunsch kann dies dann in ein Verhältnis umgewandelt werden, um die Veränderung des GSH:GSSG durch die gewünschte Behandlung zu beurteilen.
In Abbildung 4 sind die GSH: GSSG-Verhältnisdaten von drei verschiedenen Zelllinien (A549, J774 und HepG2) dargestellt, die mit dem OPA-Protokoll erfasst und über BCA (μg/ml) auf Proteinexpression normiert wurden, weitere Daten, die zusätzliche GSH- und GSSG-Werte angeben, finden Sie in der ergänzenden Abbildung 1.
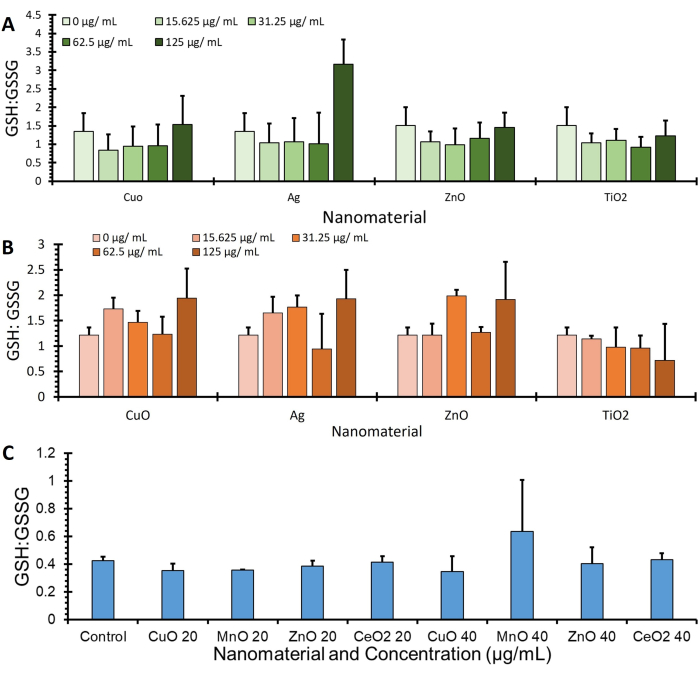
Abbildung 4: Glutathion: Glutathion-Disulfid-Verhältnis bei der Durchführung des Assays. Dargestellt sind die Glutathion: Glutathion-Disulfid-Verhältnisse von 3 Zelllinien, nämlich (A) A549, (B) J774 und (C) HepG2. Die Zellen wurden mit Behandlungen (verschiedene Nanomaterialien in serumfreien Medien) für 4 Stunden inkubiert. Die Zellen wurden unter Verwendung dieses Protokolls verarbeitet, um Veränderungen von Glutathion und Glutathiondisulfid zu quantifizieren und durch Proteinquantifizierung, Fehlerbalken ± SE (n=3, N=3) zu normalisieren. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
Die Platte enthält auch eine Reihe von Kontrollen, um sicherzustellen, dass der Assay korrekt durchgeführt wurde. NEM wird als einzelne Komponente hinzugefügt, um einen Mangel an Interaktion mit OPA-Detektionsmedien zu demonstrieren. Der Kalibrierstandard zeigt einen linearen Anstieg mit der GSH-Konzentration, was die effektive Fähigkeit des OPA-Nachweisreagenzes zeigt, effektiv an steigende GSH-Konzentrationen zu binden.
Es muss beachtet werden, dass dieser Assay speziell auf freie Sulfhydrylgruppen abzielt, die häufig in Thiolen vorkommen (wie z. B. GSH, die allgemein als Antioxidantien gelten). Eine mögliche Wechselwirkung ist die Bindung von OPA an Proteinthiole, was zu einer ungenauen Datenerfassung führen würde. Daher ist der BCA-Assay ein entscheidender Schritt, um Daten auf Protein zu normalisieren und eine genaue Reflexion von freiem GSH zu ermöglichen.
Ergänzende Abbildung 1: Abbildungen, die das Verhältnis von Glutathion, Glutathiondisulfid und Glutathion: Glutathiondisulfid aus 3 Zelllinien zeigen, nämlich (A) A549, (B) J774 und (C) HepG2. Die Zellen wurden mit Behandlungen (verschiedene Nanomaterialien in serumfreien Medien) für 4 Stunden inkubiert. Die Zellen wurden unter Verwendung dieses Protokolls verarbeitet, um Veränderungen von Glutathion und Glutathiondisulfid zu quantifizieren und durch Proteinquantifizierung zu normalisieren, Fehlerbalken ± SE (n=3, N=3) Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 1: Metadaten der Adenylatkinase-Werte für A549- und J774-Zellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Ergänzende Tabelle 2: Metadaten der Bicinchoninsäure-Werte mit Kalibrierung für A549-, J774- und HepG2-Zellen. Bitte klicken Sie hier, um diese Datei herunterzuladen.
Diskussion
Wie bereits erwähnt, war die Notwendigkeit, zelluläre Redoxzustände zu verstehen, Zustände von oxidativem Stress und die antioxidative Reaktion zu überwachen, schon immer entscheidend für das Verständnis und die Vorbeugung einer Vielzahl von Krankheiten wie Krebs und Neurodegeneration33,34. Hier wird gezeigt, wie die translationale Landschaft verbessert werden kann, indem die Zugänglichkeit eines präzisen GSH: GSSG-Nachweises mit schneller und minimaler Vorbereitung verbessert wird.
Dieses Protokoll demonstriert eine multiparametrische Sequenz von Assays zur Bestimmung intrazellulärer Glutathion/Thiol-Spezies (reduziert und oxidiert), mit 2 Normalisierungsmitteln über BCA-Protein-Assay und/oder AK-Assay. Dieser Assay kann auch modifiziert werden, um verschiedene andere Marker durch den ersten Mediator-Extraktionsschritt zu detektieren und kann so vereinfacht werden, dass einfach ein oxidiertes/reduziertes Thiolverhältnis unter Ausschluss des Kalibrierbereichs erhalten wird.
Bei der Bewertung der Analyten wurden sowohl mBCI als auch OPA untersucht und für die Verwendung verglichen. Während mBCl anfangs ein gutes Signalpotenzial zeigte, wurden erhebliche Einschränkungen bei der Verwendung festgestellt. In erster Linie zeigt die Verwendung von lebenden Zellen die beste Verwendung von mBCl; Nach der Zelllyse wurde jedoch festgestellt, dass das Signal gelöscht ist und im Allgemeinen in einem Multiwell-Format im Vergleich zu OPA35 vermindert ist. Ein weiteres Problem ist die Messung von GSSG über mBCl, die Literatur dazu ist spärlich, und durch Protokolloptimierung/-exploration wurde kein genauer Nachweis von GSSG durch mBCl erreicht.
Wir haben gezeigt, dass der OPA-Assay mit einem R2-Durchschnitt von 0,9932 ± 0,007 (N=12) über einen GSH-Konzentrationsbereich von 0,234 bis 30 μM signifikant zuverlässige Kalibrierbereiche aufweist. Dieser Bereich wurde aufgrund früherer Referenzbereiche in der Literatur gewählt35. Es ist theoretisch möglich, Glutathion außerhalb dieser Bereiche nachzuweisen, erfordert jedoch eine Änderung der Konzentration der Reagenzien, der Inkubationszeit und möglicherweise der für die Detektion verwendeten Ausrüstung. Es ist zu beachten, dass jede Platte ihren eigenen Standardbereich für die Quantifizierung benötigt; Die geringste Abweichung in der Zeit zwischen den Platten, die an verschiedenen Tagen durchgeführt werden, kann einen erheblichen Einfluss auf die während der Messung erhaltenen Werte haben.
Um genaue und zuverlässige Daten aus diesem Protokoll zu erhalten, müssen mehrere entscheidende Schritte strikt eingehalten werden. Bei der Konstruktion der verschiedenen Puffer, die im Protokoll benötigt werden, ist es entscheidend, dass der pH-Wert genau ist. Daher sollten Puffer, die einen pH-Wert von 9 erfordern, keine Abweichung über ± 0,1 dieses Wertes hinaus aufweisen. Dies ist darauf zurückzuführen, dass Pufferkomponenten mit dem falschen pH-Wert aus der Lösung ausfallen können. Wenn Sie dieses Protokoll genau befolgen, wird dieses Problem vermieden.
Die vollständige Entfernung der Behandlung und das genaue Waschen vor der Lyse sind ebenfalls entscheidend, um Artefakte und ungenaue Datenerfassung während der Plattenlesephase zu vermeiden. Sobald die Zellen lysiert wurden (Schritt 4.8), ist eine Entfernung der Behandlung nicht möglich, und die Platte kann nicht mehr gerettet werden. Da die Volumina von Puffern/Reagenzien, die im Laufe des Protokolls hinzugefügt werden, je nach Probe und Standard variieren, ist es wichtig, dass der Benutzer die unterschiedlichen Volumina in den Schritten 4.12 und 4.13 kennt. Der Assay-Bediener wird auch auf diese unterschiedlichen Volumina aufmerksam gemacht und angewiesen, sicherzustellen, dass alle Volumina gleich sind, um eine genaue Messung zu ermöglichen. Da die Volumina zwischen den Proben und Standards nicht sichtbar signifikant sind, kann es ein leichter Fehler sein, eine überschüssige Lösung in der Probenvertiefung zu haben.
Es gibt Einschränkungen bei diesem Protokoll, die auf entscheidenden Schritten beruhen, die für die Erfassung genauer und zuverlässiger Daten entscheidend sind. Die Anwender, die diesen Assay durchführen, müssen über ein angemessenes Maß an Laborkenntnissen verfügen, um unerwünschte Probleme, wie z. B. Blasenbildung, zu vermeiden. Die Blasenbildung hat drastische Auswirkungen sowohl auf die Reaktionsfähigkeit innerhalb der Mikroplatte als auch auf die Messung der Fluoreszenz. Das in diesem Protokoll verwendete Lysierungsmittel enthält ein Detergens, das für einen unerfahrenen Forscher, der Schwierigkeiten haben könnte, die Blasenbildung zu verhindern, Schwierigkeiten darstellt. Durch sofortiges Zentrifugieren kann dieser Fehler behoben werden. Das Protokoll ist möglicherweise auch in Bezug auf den Zelltyp eingeschränkt; Die Zelllinien A549, J774 und HepG2 wurden verwendet, um Daten für dieses Protokoll zu optimieren und zu produzieren. Andere Zelllinien erfordern möglicherweise andere Seeding-Dichten und eine Optimierung des Protokolls, um genaue Daten zu erhalten.
Dieses Protokoll bietet zahlreiche Vorteile gegenüber mehreren bestehenden Assays. Während der Nachweis von Thiolen mit Phthalaldehyd kein neues Konzept ist, bietet die Verwendung in einem kombinierten Assay-Format wie diesem in einer Mikroplatte mit begrenzten erforderlichen Materialien und Geräten ein großes Potenzial für alle Labore, auf dieses Protokoll zuzugreifen. Die meisten Thiol/GSH-Kits von kommerziellen Anbietern geben die Zusammensetzung ihrer Reagenzien nicht an. Daher kann es schwierig sein, das Potenzial für Inkompatibilitäten/Interferenzen vorherzusehen. Hier stellen wir jede Komponente aller verwendeten Reagenzien vor, um dieses Potenzial zu begrenzen.
Auch dieses Protokoll wird relativ schnell nach Abschluss der ersten Behandlungsphase durchgeführt. Unter Berücksichtigung der Benutzerverarbeitung zwischen den Inkubationsphasen kann der Thiol-Quantifizierungsaspekt dieses Protokolls in weniger als 1 h durchgeführt werden. Die Proben werden gleichzeitig lysiert und gebunden, um eine Autooxidation der Proben zu verhindern, was für diese Reaktionsspezies optimal ist. Obwohl im Protokoll nicht spezifiziert, können die Proben technisch in einer Platte lysiert und versiegelt werden, so dass sie für zukünftige Analysen eingefroren werden können. Diese Änderung des Protokolls wurde jedoch nicht untersucht.
Offenlegungen
Die Autoren erklären, dass keine Interessenkonflikte bestehen.
Danksagungen
Diese Forschung wurde durch die europäischen Projekte GRACIOUS (GA760840) und SUNSHINE (GA952924) finanziert. Die Verfasser möchten sich auch bei all jenen bedanken, die in irgendeiner Weise an der Entwicklung dieses Protokolls mitgewirkt haben.
Materialien
| Name | Company | Catalog Number | Comments |
| 0.22µm filter (optional-For lysis buffer) | Fisher scientific | 12561259 | |
| 100mL volumetric flask | Fisher scientific | 15290866 | |
| 1L Volumetric flask | Fisher scientific | 15230876 | |
| 250mL beaker (optional-For lysis buffer) | Fisher scientific | 15409083 | |
| 8-Channel micropipette (20-200µL) | SLS | FA10011D2 | |
| 8-Channel micropipette (2-20µL) | SLS | B2B06492 | |
| 96 well plates - black with clear bottom, TC treated | Fisher scientific | 10000631 | Preferred plate for seeding and fluoresence, use TC treated clear if unavailable |
| 96 well plates - clear (TC treated and untreated) | Fisher scientific | 10141161 | If black plates with clear bottom is not available/ suitable use TC treated clear |
| 96 well plates - white, Not TC treated | Fisher scientific | 11457009 | |
| A549 (lung carcinoma) cell line | ATCC | CCL-185 | |
| Absolute ethanol | Merck (Sigma-Aldrich) | 1.08543 | |
| Aluminium foil | Fisher scientific | 11779408 | For protecting plates from light |
| BCA Assay Kit | Thermo | 23225 | |
| Benchtop Centrifuge (with 96 plate rotor) | Eppendorf | 5804 | |
| Ethylenediaminetetraacetic acid (EDTA) | Merck (Sigma-Aldrich) | E9884 | |
| Glutathione (GSH) | Merck (Sigma-Aldrich) | G6013 | |
| Glutathione disulfide (GSSG) | Merck (Sigma-Aldrich) | G4501 | |
| Glycerol | Merck (Sigma-Aldrich) | G5516 | |
| HCl, 37% | Merck (Sigma-Aldrich) | 258148 | Dilute to 1mM for GSH stock, pH adjustment also |
| HepG2 (Hepatocarcinoma) cell line | ATCC | HB-8065 | |
| IGEPAL CA-630 | Merck (Sigma-Aldrich) | 18896 | Use either IGEPAL CA-630 or NP-40 for solution, not both |
| IP lysis buffer | Fisher scientific | 11825135 | |
| J774 (monocyte, macrophage) cell line | ATCC | TIB-67 | |
| KCl | Merck (Sigma-Aldrich) | P3911 | |
| KH2PO4 | Merck (Sigma-Aldrich) | P0662 | |
| Micropipette (20-200µL) | SLS | B2B06482 | |
| Micropipette (2-20µL) | SLS | B2B06478 | |
| Microplate shaker | VWR | 444-0041 | |
| Na2HPO4 | Merck (Sigma-Aldrich) | S9763 | |
| NaCl | Merck (Sigma-Aldrich) | S9888 | |
| NaOH, 10M | Merck (Sigma-Aldrich) | 72068 | For pH adjustment only |
| N-Ethylmaleimide (NEM) | Merck (Sigma-Aldrich) | E3876 | |
| NP-40 | Merck (Sigma-Aldrich) | 492016 | Use either IGEPAL CA-630 or NP-40 for solution, not both. NP-40 alternative suggested |
| Ortho -Phthaldialdehyde (OPA) | Merck (Sigma-Aldrich) | P1378 | |
| PBS 0.1M | Merck (Sigma-Aldrich) | P2272 | PBS can either be acquired pre-made or made in house, see notes |
| Plate reader (with fluoresence capacity) | Tecan | SPARK | |
| Stir bar (optional-For lysis buffer) | Fisher scientific | 16265731 | |
| Toxilight bioassay kit (AK assay) | Lonza | LT17-217 | |
| Tris(2-carboxyethyl)phosphine hydrochloride (TCEP) 0.5M in H2O | Alfa Aesar | H51864 | Can also be purchased crystalised and suspended |
| TRIS-HCl | Merck (Sigma-Aldrich) | 93363 | |
| X100 phosphatase and protease cocktail | Fisher scientific | 10025743 |
Referenzen
- Barnham, K. J., Masters, C. L., Bush, A. I. Neurodegenerative diseases and oxidative stress. Nat Rev Drug Discov. 3 (3), 205-214 (2004).
- Arfin, S., et al. Oxidative stress in cancer cell metabolism. Antioxidants. 10 (5), 642 (2021).
- Cooke, M. S., Evans, M. D., Dizdaroglu, M., Lunec, J. Oxidative DNA damage: mechanisms, mutation, and disease. The FASEB Journal. 17 (10), 1195-1214 (2003).
- Ghezzi, P., Jaquet, V., Marcucci, F., Schmidt, H. H. H. W. The oxidative stress theory of disease: levels of evidence and epistemological aspects. Br J Pharmacol. 174 (12), 1784-1796 (2017).
- Bhattacharyya, A., Chattopadhyay, R., Mitra, S., Crowe, S. E. Oxidative stress: An essential factor in the pathogenesis of gastrointestinal mucosal diseases. Physiol Rev. 94 (2), 329-354 (2014).
- Yin, F., Sancheti, H., Cadenas, E. Mitochondrial thiols in the regulation of cell death pathways. Antioxi Redox Sig. 17 (12), 1714-1727 (2012).
- Balcerczyk, A., Bartosz, G. Thiols are main determinants of total antioxidant capacity of cellular homogenates. Free Rad Res. 37 (5), 537-541 (2003).
- McBean, G. J. Cysteine, glutathione, and thiol redox balance in astrocytes. Antioxidants. 6 (3), 62 (2017).
- Nimse, S. B., Pal, D. Free radicals, natural antioxidants, and their reaction mechanisms. RSC Adv. 5 (35), 27986-28006 (2015).
- Nordberg, J., Arnér, E. S. J. Reactive oxygen species, antioxidants, and the mammalian thioredoxin system1. Free Rad Biol Med. 31 (11), 1287-1312 (2001).
- Pham-Huy, L. A., He, H., Pham-Huy, C. Free radicals, antioxidants in disease and health. Int J Biomed Sci. 4 (2), 89 (2008).
- Harris, I. S., DeNicola, G. M. The complex interplay between antioxidants and ROS in cancer. Trend Cell Biol. 30 (6), 440-451 (2020).
- Traverso, N., et al. Role of glutathione in cancer progression and chemoresistance. Oxid Med Cell Longev. 2013, 972913 (2013).
- Day, R. M., Suzuki, Y. J. Cell proliferation, reactive oxygen and cellular glutathione. Dose-Resp. 3 (3), 425-442 (2005).
- Aquilano, K., Baldelli, S., Ciriolo, M. R. Glutathione: new roles in redox signaling for an old antioxidant. Front Pharmacol. 5, 196 (2014).
- Zitka, O., et al. Redox status expressed as GSH: GSSG ratio as a marker for oxidative stress in paediatric tumour patients. Onco Lett. 4 (6), 1247-1253 (2012).
- Childs, S., Haroune, N., Williams, L., Gronow, M. Determination of cellular glutathione: glutathione disulfide ratio in prostate cancer cells by high performance liquid chromatography with electrochemical detection. J Chrom A. 1437, 67-73 (2016).
- Giustarini, D., et al. glutathione disulfide, and S-glutathionylated proteins in cell cultures. Free Rad Biol Med. 89, 972-981 (2015).
- Özyürek, M., et al. Determination of biothiols by a novel on-line HPLC-DTNB assay with post-column detection. Analytica Chimica Acta. 750, 173-181 (2012).
- Zhang, L., Lu, B., Lu, C., Lin, J. Determination of cysteine, homocysteine, cystine, and homocystine in biological fluids by HPLC using fluorosurfactant-capped gold nanoparticles as postcolumn colorimetric reagents. J Sep Sci. 37 (1-2), 30-36 (2014).
- Tsiasioti, A., Georgiadou, E., Zacharis, C. K., Tzanavaras, P. D. Development and validation of a direct HPLC method for the determination of salivary glutathione disulphide using a core shell column and post column derivatization with o-phthalaldehyde. J Chromat B. 1197, 123216 (2022).
- Huang, D., Ou, B., Prior, R. L. The chemistry behind antioxidant capacity assays. J Agri Food Chem. 53 (6), 1841-1856 (2005).
- Berker, K. I., Güçlü, K., Tor, &. #. 3. 0. 4. ;., Demirata, B., Apak, R. Total antioxidant capacity assay using optimized ferricyanide/prussian blue method. Food Anal Meth. 3 (3), 154-168 (2010).
- Rahman, I., Kode, A., Biswas, S. K. Assay for quantitative determination of glutathione and glutathione disulfide levels using enzymatic recycling method. Nat Prot. 1 (6), 3159-3165 (2007).
- Kampa, M., et al. A new automated method for the determination of the Total Antioxidant Capacity (TAC) of human plasma, based on the crocin bleaching assay. BMC Clin Pathol. 2 (1), 3 (2002).
- Fernández-Checa, J. C., Kaplowitz, N. The use of monochlorobimane to determine hepatic GSH levels and synthesis. Anal Biochem. 190 (2), 212-219 (1990).
- Nauen, R., Stumpf, N. Fluorometric microplate assay to measure glutathione S-transferase activity in insects and mites using monochlorobimane. Anal Biochem. 303 (2), 194-198 (2002).
- Stevenson, D., Wokosin, D., Girkin, J., Grant, M. H. Measurement of the intracellular distribution of reduced glutathione in cultured rat hepatocytes using monochlorobimane and confocal laser scanning microscopy. Toxicol in vitro. 16 (5), 609-619 (2002).
- McBeth, C., Stott-Marshall, R. J. Interference of reversible redox compounds in enzyme catalysed assays–Electrochemical limitations. Anal Biochem. 662, 114972 (2023).
- Yu, Z., et al. Reactive oxygen species-related nanoparticle toxicity in the biomedical field. Nanoscale Res Lett. 15 (1), 115 (2020).
- Boyles, M., et al. Development of a standard operating procedure for the DCFH2-DA acellular assessment of reactive oxygen species produced by nanomaterials. Toxicol Mech Meth. 32 (6), 439-452 (2022).
- Segeritz, C. P., Vallier, L. Cell culture: Growing cells as model systems in vitro. Basic Sci Meth Clin Res. , 151-172 (2017).
- Ma, Q. Role of nrf2 in oxidative stress and toxicity. Ann Rev Pharmacol Toxicol. 53, 401-426 (2013).
- Calabrese, V., Cornelius, C., Dinkova-Kostova, A. T., Calabrese, E. J., Mattson, M. P. Cellular stress responses, the hormesis paradigm, and vitagenes: novel targets for therapeutic intervention in neurodegenerative disorders. Antioxid redox Signal. 13 (11), 1763-1811 (2010).
- Ishkaeva, R. A., Zoughaib, M., Laikov, A. V., Angelova, P. R., Abdullin, T. I. Probing cell redox state and glutathione-modulating factors using a monochlorobimane-based microplate assay. Antioxidants. 11 (2), 391 (2022).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten