Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Ein visueller Ansatz zur Induktion von Dolichoektasie bei Mäusen zur Modellierung der durch große Gefäße vermittelten zerebrovaskulären Dysfunktion
In diesem Artikel
Zusammenfassung
Wir zeigen die chemische Induktion großer Blutgefäßerweiterungen bei Mäusen als Modell für die Untersuchung zerebrovaskulärer Dysfunktion, das für die Modellierung von vaskulärer Demenz und Alzheimer verwendet werden kann. Wir demonstrieren auch die Visualisierung des Gefäßsystems durch Injektion von Silikonkautschukmischung und eine klare visuelle Anleitung zur Messung von Veränderungen der Blutgefäßgröße.
Zusammenfassung
Das Blut-Hirn-Gehirn (BHS) ist ein entscheidendes System, das die selektive Gehirnzirkulation mit der Peripherie reguliert und es den notwendigen Nährstoffen ermöglicht, in das Gehirn einzudringen und überschüssige Aminosäuren oder Toxine aus dem Gehirn auszuscheiden. Um zu modellieren, wie die BHS bei Krankheiten wie vaskulärer Demenz (VaD) oder Alzheimer (AD) beeinträchtigt werden kann, entwickelten Forscher neuartige Methoden zur Modellierung der Gefäßerweiterung. Eine beeinträchtigte BHS in diesen Krankheitszuständen kann nachteilig sein und zu einer Fehlregulation der BHS führen, was zu unerwünschten und pathologischen Folgen führt, die sich auf die Gehirnfunktion auswirken. Wir waren in der Lage, eine bestehende Technik zu modifizieren, die es uns ermöglichte, direkt in die Cisterna magna (CM) zu injizieren, um die Erweiterung der Blutgefäße mit Hilfe von Elastase zu induzieren und die Tight Junctions (TJ) der BHS zu stören. Mit dieser Methode konnten wir verschiedene Erfolgsmetriken im Vergleich zu früheren Techniken feststellen, darunter eine konsistente Erweiterung der Blutgefäße, eine geringere Mortalität oder eine verbesserte Genesung sowie die Verbesserung des Füll-/Trübungsmittels, einer Silikonkautschukmischung, die zur Markierung von Blutgefäßen für die Dilatationsanalyse verabreicht wird. Diese modifizierte minimal-invasive Methode hat vielversprechende Ergebnisse erzielt, mit einer Steigerung der anhaltenden Dilatation großer Blutgefäße um 19 % bis 32 % bei Mäusen von 2 Wochen bis 3 Monaten nach der Injektion. Diese Verbesserung steht im Gegensatz zu früheren Studien, die erst nach 2 Wochen eine erhöhte Dilatation zeigten. Zusätzliche Daten deuten auf eine anhaltende Expansion auch nach 9,5 Monaten hin. Dieser Anstieg wurde durch den Vergleich des Durchmessers der Blutgefäße der Elastase und der Vehikel-injizierten Gruppe bestätigt. Insgesamt ist diese Technik wertvoll für die Untersuchung pathologischer Störungen, die das Zentralnervensystem (ZNS) betreffen, anhand von Tiermodellen.
Einleitung
Mikrovaskuläre Endothelzellen, die die Hirnkapillaren auskleiden, sind die Hauptkomponenten für die Bildung der Blut-Hirn-Schranke (BHS)1, die eine entscheidende Rolle bei der Regulierung dessen spielt, was in den Gehirnkreislauf mit der Peripherie eintritt oder ihn verlässt. Essentielle Nährstoffe, die für das Nervengewebe benötigt werden, dürfen in die BHS gelangen, während einige essentielle Aminosäuren wie Glutamat aus dem Gehirn ausgeschieden werden, da hohe Konzentrationen das Hirngewebe dauerhaft neuroexzitatorisch schädigen können2. Unter normalen physiologischen Bedingungen begrenzt die BHS die Menge an Plasmaproteinen wie Albumin 3,4 und Prothrombin, da diese schädliche Auswirkungen haben können 5,6,7. Schließlich schützt die BHS das Gehirn vor Neurotoxinen, die in der Peripherie zirkulieren, wie z. B. Xenobiotika aus der Nahrung oder der Umwelt1. Insgesamt ist die Schädigung des Hirngewebes irreversibel, und das Altern, das mit einem niedrigen Niveau der Neurogenese korreliert8, unterstreicht die Bedeutung der BHS für den Schutz und die Verhinderung von Faktoren, die den neurodegenerativen Prozess beschleunigen.
Bei der Dolichoektasie (oder Erweiterung der großen Blutgefäße) wird eine Abnahme der Gefäßelastizität beobachtet, die dazu führt, dass die Gefäße morphologische Veränderungen erfahren, wodurch sie dysfunktional werden9 und der Blutfluss im Gehirn vermindert wird. Diese Verringerung des Blutflusses verringert in der Folge die Sauerstoff- und Glukoseversorgung, was schließlich zu einer Schädigung der BHS durch die Aktivierung reaktiver Astrozyten führt10. Wenn die innere Elastinlamina der Gefäße durch Dolichoektasiegeschädigt ist 11, ist eine wiederholte Stimulation des vaskulären endothelialen Wachstumsfaktors (VEGF) für die Angiogenese erforderlich. Dies kann zur Bildung von undichten Gefäßen führen und schließlich zu einer pathologischen Angiogenese führen, die durch die Entwicklung defekter Gefäße gekennzeichnetist 12. Während der pathologischen Angiogenese, wenn Blutgefäße defekt werden, scheint ein Kompensationsmechanismus die Integrität der Gefäße wiederherzustellen, indem er die Tight-Junction-Proteine hochreguliert. Dieser Prozess kann jedoch unbeabsichtigt die BHS stören, wenn die strukturelle Integrität eines Blutgefäßes verloren geht13. Dies kann durch eine weitere Störung der BHS und die Förderung der Produktion von Amyloid-Plaquegeschehen 14. Darüber hinaus kann ein Austritt aus der Peripherie eine Neuroinflammation15 verursachen, die zu einer neuronalen Degeneration und einem anschließenden Gedächtnisverlust führt.
Strukturell gesehen besteht der Schutz, den die BHS bietet, in den Tight Junctions, die verhindern, dass xenobiotische Wirkstoffe aus dem Blut in das Gehirn gelangen. Wenn die BHS bestimmte Substanzen in das Gehirn eindringen lässt, geschieht dies hauptsächlich durch zwei Hauptprozesse: passive Diffusion oder spezifische Kanäle (wie Ionenkanäle und Transporter)1. Bei AD hat die Forschung gezeigt, dass ein dysfunktionales Gefäßsystem eine bedeutende Rolle beim Fortschreiten der Erkrankung spielt12,13. Die Bildung von Amyloid-beta (Aβ)-Plaques und Neurodegeneration können durch den Abbau der BHS12,13 und Störungen des zerebralen Blutflusses16 verursacht werden. Eine Verringerung des zerebralen Blutflusses ist bei älteren Personen zu beobachten, bei denen vaskuläre Demenz und AD 17,18 diagnostiziert wurden. Eine Schädigung der Blut-Hirn-Schranke (BHS) zusammen mit einer gestörten zerebralen Durchblutung (CBF) kann zu einer erhöhten Produktion von Aβ-Konzentration im Gehirn beitragen, begleitet von der Infiltration von Fremdstoffen aus dem peripheren Kreislauf19.
Um die Pathogenese neurologischer Erkrankungen wie Alzheimer und vaskuläre Demenz (VaD) zu untersuchen, werden Modelle entwickelt, um die Krankheit zu replizieren. In-vitro-Modelle werden häufig verwendet, aber es fehlt die biologische Umgebung für umfangreiche Krankheitsmodellierungen wie gemischte Zellpopulationen, was die Bedeutung von in vivo-Modellen erforderlich macht. Mäuse werden häufig verwendet, da sie leicht genetisch manipuliert werden können, um menschenähnliche Eigenschaften (z. B. Pathologie) bei Krankheiten zu erzeugen. Mit den Fortschritten, die bisher gemacht wurden, besteht immer noch ein Bedarf an verbesserten Modellen, um Krankheitsphänotypen wie die Erweiterung großer Gefäße und ihre Rolle bei AD zu emulieren. Zu diesem Zweck sahen wir eine Chance und modifizierten eine Technik, die die Injektion von Elastase in die Cisterna magna von Mäusen beinhaltete20,21. Elastase ist ein Enzym, von dem gezeigt wurde, dass es Elastin im Bindegewebe22 und in den umgebenden Tight Junctions23 abbaut. Als Injektionspunkt wurde die Cisterna magna gewählt, da sie sich direkt über dem Willis-Kreis, dem größten Blutgefäß im Gehirn, befindet. Durch die Injektion von Elastase in die Cisterna magna können wir die BHS und die Blutgefäße beeinträchtigen, indem wir die Tight Junctions aufbrechen und eine Erweiterung der Blutgefäße induzieren (Willis-Kreis)24,25. Die Kombination dieser Technik mit der Verwendung eines AD-Mausmodells der Pathologie für ein besseres Verständnis der Pathogenese für die vaskuläre Komponente der AD kann wertvolle Einblicke in die komplexen Wechselwirkungen und Einflüsse zwischen diesen beiden unterschiedlichen Pathologien liefern.
Frühere Studien haben Fälle gezeigt, in denen Patienten sowohl die pathologischen Merkmale von AD als auch von VaD aufweisen, eine Erkrankung, die typischerweise als gemischte Demenz bezeichnet wird26,27. Das Verständnis der miteinander verbundenen Mechanismen zwischen beiden Erkrankungen kann daher eine umfassendere Perspektive auf das Fortschreiten und die Manifestation dieser neurodegenerativen Erkrankungen bieten und unser Verständnis der zugrunde liegenden Mechanismen und potenziellen therapeutischen Strategien verbessern. Zu diesem Zweck demonstrieren wir die Anwendung von Elastase in einem Mausmodell für die Alzheimer-Pathologie (AppNL-F) zur Identifizierung vaskulärer Veränderungen.
Protokoll
Für diese Studie wurdenApp-NL-F-Mäuse(3 Monate alt) verwendet, die humane Amyloid-Plaque auf physiologischer Ebene exprimieren, obwohl dieses System mit jedem Nagetiermodell verwendet werden kann. Alle Tierverfahren wurden vom Animal Care Committee des CAMH genehmigt (Protokoll #843) und entsprachen den ethischen Standards der Richtlinien des Canadian Council on Animal Care. Die Mäuse wurden im eigenen Haus gezüchtet und in einem 12-stündigen Hell-Dunkel-Zyklus mit ad libitum Zugang zu Futter und Wasser gehalten.
1. Ablauf der Injektion von Cisterna magna (CM)
- Chirurgischer Eingriff
- Legen Sie die Maus (APPNL-F, beide Geschlechter, 3 Monate) für 1 min in eine Narkose-Induktionskammer.
HINWEIS: Spülen Sie die Kammer mindestens 1 Minute lang mit 5 % Isofluran, gemischt mit 1 % Sauerstoff. - Nachdem die Maus betäubt wurde, nehmen Sie das Tier aus der Kammer und legen Sie es auf ein frisches OP-Tuch und halten Sie die Narkose (Isofluran, 2,5 %-3 %) aufrecht, indem Sie einen Nasenkegel über die Nase legen.
HINWEIS: Überprüfen Sie die Tiefe der Anästhesie, indem Sie den Zeh einklemmen, um sicherzustellen, dass keine Reflexe auftreten. - Tragen Sie eine Augensalbe auf, um Trockenheit vorzubeugen. Dann injizieren Sie subkutan 0,1 ml Bupivacain (Lokalanästhetikum; 1-2 mg/kg 0,125%, mit einem Verdünnungsverhältnis von 1:2) an die Inzisionsstelle und Metacam (Analgetikum; 5 mg/kg, mit einem Verdünnungsverhältnis von 1:10). Halten Sie das Tier hydratisiert, indem Sie 0,5 ml Kochsalzlösung subkutan injizieren, bevor Sie den Eingriff durchführen, um einen möglichen Blutverlust während der Operation auszugleichen.
- Für eine klare Schnittstelle rasieren Sie den Hals an der Basis des Hinterhauptbeins, wischen Sie die Oberfläche mit sterilem PBS ab und übertragen Sie das Subjekt in Bauchlage auf den stereotaktischen Rahmen.
HINWEIS: Stellen Sie sicher, dass die Anästhesie durch den stereotaktischen Nasenkonus aufrechterhalten wird. - Platzieren Sie die Nasenstange vom stereotaktischen Rahmen auf der Maus, um Stabilität zu gewährleisten und sicherzustellen, dass die oberen Zähne befestigt sind.
- Positionieren Sie den Tierkopf in einem Winkel von 120° zum Körper, um den Nacken anzuheben und zu dehnen, um den gewünschten chirurgischen Bereich freizulegen.
- Reinigen Sie die Operationsstelle mit Betadin-Peeling 3x, 70% Ethanol 3x und Betadinlösung 1x mit steriler 2 Zoll x 2 Zoll Gaze.
- Falten Sie die Haut vorsichtig mit Hilfe einer Pinzette und machen Sie mit einer chirurgischen Schere einen kleinen Schnitt (1 cm).
HINWEIS: Dies sollte die Mittellinie des Nackens zeigen. - Führen Sie das Skalpell vorsichtig entlang der Mittellinie, um die Muskeln zu durchtrennen. Trennen Sie dann mit einer Pinzette vorsichtig die Muskeln, indem Sie sie nach links und rechts auseinander ziehen.
HINWEIS: Dies sollte die Cisterna magna (umgekehrtes Dreieck) zeigen, die sich unter der Schädelbasis befindet (Abbildung 1).
- Legen Sie die Maus (APPNL-F, beide Geschlechter, 3 Monate) für 1 min in eine Narkose-Induktionskammer.
- Zubereitung von Elastase
HINWEIS: Die bestellte Packung Elastase (Pulverform) enthielt 250 Einheiten (U). Die Menge der Elastase, die jedem Tier injiziert werden soll, beträgt 2,5 μl. Die Menge an Elastase, die in den 2,5 μl enthalten sein sollte, sollte 15 Millieinheiten mU betragen.- Berechnen Sie zunächst die Konzentration der zu injizierenden Lösung.
Konzentration = Masse/ Volumen
= 15 mU/2,5 μL
= 6 mU/μL
Daher beträgt die erforderliche Konzentration 6 mU/μL. - Die Menge der Elastase beträgt 250 u und die Studie arbeitet mit MilliUnits, also konvertieren Sie die Einheiten in MilliUnits, was 250000 mU ergibt.
- Nachdem Sie eine Masse von 250000 mU und eine Konzentration von 6 mU/μl erreicht haben, ermitteln Sie das Volumen (PBS), das eine Verdünnung der Elastase und die Aufrechterhaltung einer Konzentration von 6 mU/μl erfordern würde.
- Ordnen Sie die gleiche Formel wie oben an, um das Volumen zu lösen:
Volumen = Masse/Conc.
= 250000 mU/ 6 mU/μL
= 41666,67 μL - Da es schwierig ist, 41666,67 μl zu pipettieren, wandeln Sie es einfach in Milliliter um, indem Sie es durch 1000 dividieren, um 41,66667 ml zu erhalten, um eine 1x-Lösung zu erhalten.
- Um die Lösung konzentrierter zu machen,erhöhen Sie sie um das 10- oder 100-fache.
- Erstellen Sie eine 10x-Lösung, da sie einfacher zu handhaben ist (siehe unten).
10x Lösung ---------- 4,166667 mL (konz.)
- Geben Sie die 250 HE in ein 5-ml-Aliquotröhrchen und geben Sie 4,167 mL steriles PBS in das Aliquotröhrchen, um die 10-fache Stammlösung herzustellen.
- 10 μl Stammlösung pipettieren und in 100 aliquote Röhrchen geben, wobei 1000 μl der 4,167 ml Stammlösung gegeben werden. Lagern Sie die Röhrchen bei -20 °C.
- Den Rest der Stammlösung in aliquoten Röhrchen bei 100 μl pro Röhrchen lagern und im Gefrierschrank bei -20 °C lagern.
HINWEIS: Die Lösungen sind bei -20 °C bis zu 6 Monate lang ohne nennenswerten Aktivitätsverlust stabil. Darüber hinaus ist es wichtig zu beachten, dass ein übermäßiges Einfrieren und Auftauen der Elastase die Stabilität verringern kann. Um dies zu verhindern, kann die Stammlösung vor dem Einfrieren so geteilt werden, dass jeweils nur eine Probe für die Injektion aufgetaut werden muss. - Nach dem Auftauen eines der Aliquotröhrchen, das 10 μl einer 10-fachen Lösung enthält, fügen Sie 90 μl steriles PBS hinzu, um eine 100 μl 1x-Lösung zu erhalten.
- Wenn das Aliquotröhrchen, das 100 μl einer 10x-Lösung enthält, stattdessen aufgetaut wurde, fügen Sie einfach 900 μl PBS hinzu, um 1000 μl zu erhalten, was einer 1x-Lösung entspricht. Lagern Sie beide Lösungen 1 Woche lang bei 4 °C.
- Berechnen Sie zunächst die Konzentration der zu injizierenden Lösung.
- Injizieren in die Cisterna magna
HINWEIS: Reinigen Sie die Hamilton-Spritze vor dem Befüllen mit Elastase, indem Sie 5x mit destilliertem Wasser, dann 5x mit Ethanol und schließlich 5x mit destilliertem Wasser befüllen und aspirieren.- Füllen Sie die Hamilton-Spritze mit 2,5 μl Elastase (Konzentration von 15 mU) und stellen Sie sicher, dass keine Luftblasen vorhanden sind.
- Führen Sie die Spritze langsam mit der Fase nach oben in die Mitte der Cisterna magna ein.
HINWEIS: Vermeiden Sie es, Blutgefäße zu durchstechen, die durch die Cisterna magna verlaufen. - Entfernen Sie nach der Punktion die Fase. Dies erleichtert die Freisetzung einer kleinen Menge Liquor cerebrospinalis (CSF). Verwende ein steriles Wattestäbchen, um den überschüssigen Liquor aufzusaugen.
- Führen Sie die Fase wieder in die Einstichstelle ein, injizieren Sie langsam Elastase oder Vehikel über 1 Minute in die Cisterna magna und lassen Sie die Nadel 1 Minute lang an Ort und Stelle, um ein Austreten von Elastase zu verhindern.
- Nach dem Entfernen der Fase verschließen Sie die Inzisionsstelle mit einer nicht resorbierbaren chirurgischen Naht (#4-0 mit 3/8"-Nadel) und schalten Sie das Anästhetikum aus.
- Nehmen Sie das Tier aus dem stereotaktischen Rahmen und legen Sie es auf ein warmes Heizkissen mit 37 °C, bis sich das Subjekt erholt hat.
HINWEIS: Eine weitere Dosis Metacam wird nach der Operation empfohlen, um die Schmerzen während der postoperativen Genesung zu lindern.
2. Injektion der Silikonkautschukmischung und Gewebeentnahme
- Betäuben Sie das Tier mit einer Überdosis Avertin (1 ml, 125-250 mg/kg).
HINWEIS: Kneifen Sie den Zeh zusammen, um sicherzustellen, dass die Reflexe aufhören. - Legen Sie das Tier auf eine Windel und befestigen Sie alle Gliedmaßen mit chirurgischem Klebeband mit der Brusthöhle nach oben
- Öffne die Brusthöhle mit einer Pinzette und einer Schere, um das Herz freizulegen.
- Führen Sie eine stumpfe 23-G-Nadel in den linken Ventrikel des Herzens ein und perfundieren Sie sie 4 Minuten lang mit PBS, das mit Heparin (100 U/ml) infundiert ist, um die Blutgefäße mit einer Mikroperfusionspumpe zu reinigen.
- Ersetzen Sie die Pufferflasche durch eine Flasche mit 4 % Paraformaldehyd (PFA) (hergestellt aus PBS) und perfundieren Sie weitere 4 Minuten.
- Bereiten Sie die Lösung der Silikonkautschukmischung (gelb) vor, indem Sie 5 mL der Verbindung mit 5 mL des Verdünnungsmittels in einem 50 mL Röhrchen mischen. Vor Gebrauch gründlich mischen.
- Füllen Sie eine 10 mL Spritze mit 10 mL Silikon Kautschuk Compo und. Befestigen Sie die Spritze an dem Schlauch, der mit einer stumpfen 23-G-Nadel verbunden ist, und injizieren Sie die Lösung vorsichtig manuell in das Herz.
HINWEIS: Aufgrund der hohen Viskosität der Silikonkautschukmischung ist es wichtig, eine größere Zylinderspritze zu verwenden, da sonst der Druck zu groß ist, um den Kolben zu drücken. - Entfernen Sie den Kopf der Maus nach der Injektion und lagern Sie sie über Nacht bei 4 °C, damit die Silikonkautschukmischung in den Gefäßen aushärten kann.
- Entfernen Sie am nächsten Tag vorsichtig den Schädel der Maus (vorzugsweise mit einer feinen Pinzette), extrahieren Sie das Gehirn und inkubieren Sie es über Nacht bei Raumtemperatur (RT) in 4% PFA.
- Nach einer 24-stündigen Inkubation in PFA das Gehirn in PBS 3x waschen, in 30%ige Saccharose geben und bei 4 °C lagern.
3. Quantitative Analyse
- Um qualitativ hochwertige Bilder des Circle of Willis im gesamten Gehirn aufzunehmen (Abbildung 3):
- Entferne das Gehirn aus der Saccharoselösung. Trocknen Sie das Gehirn gründlich mit einem Papiertuch ab, um die Oberflächenfeuchtigkeit abzuleiten.
- Positionieren Sie das Gehirn in einem Brain-Slicer. Platzieren Sie den Brain-Slicer unter ein Lichtmikroskop, das mit einer Kamera ausgestattet ist.
- Fokussieren Sie das Mikroskop auf eine klare, hochauflösende Auflösung des Willis-Kreises.
- Verwenden Sie eine Bildanalysesoftware mit einer 10-cm-Linealreferenz, um ca. 1 cm zu messen und die Pixelzahl zu notieren. Stellen Sie die 1-cm-Skala basierend auf dieser Messung ein und messen Sie dann die Dicke der Arteria basilaris horizontal, um ihren Durchmesser zu ermitteln.
- Verwenden Sie eine Standard-Pixeldichtemessungssoftware, um das Bild zu analysieren. Messen Sie (in Zentimetern) fünf separate Messwerte der Arteria basilaris mit einer Bildanalysesoftware und berechnen Sie den Mittelwert, um eine genaue Darstellung des Durchmessers der Arteria basilaris zu erhalten.
- Verwenden Sie eine 2-Wege-Varianzanalyse (ANOVA), um die durchschnittliche Durchmesseränderung zwischen der Elastase und der Kontrollgruppe zu vergleichen.
- Berechnen Sie die prozentuale Änderung des Durchmessers mit der Formel unter 21:
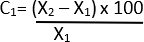
C = relative Veränderung
X1 = Anfangswert (Fahrzeug)
X2 = Endwert (Elastase)
Betrachten Sie P-Werte unter 0,05 als statistisch signifikant. Führen Sie alle statistischen Analysen mit einer statistischen Analysesoftware durch.
- Berechnen Sie die prozentuale Änderung des Durchmessers mit der Formel unter 21:
4. Entfernung der Silikonkautschukmischung durch Alkoholentwässerung
HINWEIS: Es ist wichtig, das Gehirn zu dehydrieren, um die überschüssige Silikonkautschukmischung aus dem Blutgefäß zu entfernen, was möglicherweise die Qualität der Immunfärbung verbessern kann.
- Waschen Sie das Gehirn 3x mit PBS, um die Saccharose zu entfernen.
- Platzieren Sie das Gehirn in 25%, 50%, 75%, 95% und absolutes Ethanol für 24 Stunden bei jeder Konzentration, für eine Gesamtzeit von 5 Tagen.
- Nach der Dehydrierung des Gewebes legen Sie das Gewebe für 12-24 Stunden in Methylsalicylat (Konz. ≤100%). Das Ethanol und das Methylsalicylat ermöglichen die Entfernung von überschüssigem Silikon im Gewebe.
- Waschen Sie das Gehirn 3x in PBS, um Chemikalienreste zu entfernen, und lassen Sie es über Nacht auf einer Wippe bei 4 °C in frischem PBS ruhen.
- Legen Sie das Gehirn in Saccharose und lagern Sie es bei 4 °C, bevor Sie es schneiden und immunfärben.
5. Immunhistochemische Färbung
- Sektionierung von Gehirnen
- Lassen Sie das Gehirn vor der Immunsektion am Boden des mit Saccharose gefüllten Röhrchens absetzen.
- Frieren Sie das Gehirn auf der Mikrotomplattform mit einer Verbindung mit optimaler Schnitttemperatur (OCT) ein, die von Trockeneis umgeben ist. Schneiden Sie das Gehirn mit der Mikrotomklinge in 40 μm große Abschnitte.
- Übertragen Sie jeden Abschnitt mit einem feinen Pinsel in eine 96-Well-Platte mit Kryoschutzmittel, um ein Einfrieren zu verhindern.
- Verschließen Sie die 96-Well-Platte sicher mit Plastikfolie. Lagern Sie die versiegelte Platte in einem -20 °C Gefrierschrank.
- Immunfluoreszenzfärbung (am Beispiel von NeuN)
- Legen Sie die Abschnitte in eine 24-Well-Platte. Führen Sie drei Waschgänge mit PBS durch, um das Kryoprotektivum zu beseitigen.
- Um eine unspezifische Bindung zu vermeiden, inkubieren Sie 1 h lang bei RT mit einer Blockierungslösung, die 2 % Ziegenserum, 0,1 % Triton-X 100 und 1 % BSA enthält.
- Bereiten Sie alle Komponenten in PBS vor.
HINWEIS: Der verwendete Primärantikörper enthielt monoklonales Maus-Anti-NeuN mit einer Verdünnung von 1: 500. Der verwendete Sekundärantikörper enthielt polyklonales Ziegen-Anti-Maus-568 mit einer Verdünnung von 1:200. - Verdünnen Sie das monoklonale Maus-Anti-NeuN in der oben erwähnten Blockierungslösung.
- Geben Sie den verdünnten Antikörper in jede Vertiefung. Über Nacht bei 4 °C inkubieren, durch Folie vor Licht geschützt.
- Nach der Primärinkubation waschen Sie die Abschnitte 3x mit PBS. Verdünnen Sie das polyklonale Ziegen-Anti-Maus-568 in der gleichen Blockierungslösung.
- Geben Sie den verdünnten Antikörper in jede Vertiefung. 2 h bei Raumtemperatur inkubieren, durch Folie lichtgeschützt.
- Waschen Sie die Abschnitte nach der zweiten Inkubation 3x mit PBS.
- Bereiten Sie die Montage vor, indem Sie die Abschnitte langsam mit feinen Pinseln auf Dias übertragen. Alle Abschnitte trocknen lassen.
- Tragen Sie 125-150 μl lichtbeständiges Eindeckmedium auf, sobald die Abschnitte getrocknet sind. Platzieren Sie Deckgläser vorsichtig.
- Lassen Sie die Dias 24 h bei RT im Dunkeln trocknen und versiegeln Sie die Kanten mit Nagellack. Nehmen Sie Fluoreszenzbilder mit Bildgebungssoftware auf.
Ergebnisse
Es gelang uns, die Cisterna magna unterhalb der Hinterhauptregion des Schädels zu lokalisieren, nachdem wir die Maus vorsichtig auf dem stereotaktischen Rahmen positioniert und die Muskeln präpariert hatten. Diese anatomische Struktur, die einem umgekehrten Dreieck ähnelt und gelb hervorgehoben ist, befindet sich unter der Schädelbasis (Abbildung 1). Um die Präzision zu gewährleisten und eine Schädigung des Hirngewebes zu vermeiden, wurden 1-2 mm der Hamilton-Spritzenfase sanft in die...
Diskussion
Dieser Artikel zeigt ein verbessertes Protokoll für die zerebrovaskuläre Dilatation, das einen präzisen und unkomplizierten Ansatz für die Elastase-Injektion in die Cisterna magna von Mäusen bietet. Dieser anatomische Punkt dient als direkter Zugang zum Liquor cerebrospinalis und bietet einen wertvollen Weg für die Untersuchung verschiedener neurologischer Erkrankungen. Einer der Hauptvorteile dieser modifizierten Technik besteht darin, dass die Injektion einer Einzeldosis Elastase in die Cisterna magna von Mäusen...
Offenlegungen
Es besteht kein Interessenkonflikt.
Danksagungen
Diese Studie wurde durch die unschätzbaren Beiträge von Stephanie Tam ermöglicht, die bei den Operationen Unterstützung geleistet hat. Wir danken ihr herzlich für ihre Hilfe. Die National Institutes of Health (AG066162) zur Unterstützung dieser Forschung.
Materialien
| Name | Company | Catalog Number | Comments |
| 23 G catheter | University Medstore | 2546-CABD305145 | Needed for perfusion (https://www.uoftmedstore.com/index.sz) |
| Absolute ethanol | University Medstore | https://www.uoftmedstore.com/index.sz | For removing the microfil |
| Betadine scrub | # | https://www.pittsborofeed.com/products/betadine-surgical-scrub | Sterilization |
| Betadine solution | Amazon | https://www.amazon.ca/Povidone-Iodine-10-Topical-Solution-100ml/dp/B09DTKJGHW | Sterilization |
| Bupivacaine | Provided by animal facility | N/A | Analgesic |
| Clippers | BrainTree Scientific Inc | CLP-41590 | Shave fur |
| Cotton Q-tip | University Medstore | 1962 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Elastase | Sigma-aldrich | E7885 | Used for the dilatation of blood vessel |
| Ethanol | University Medstore | 39752-P016-EAAN | Sterilization (https://www.uoftmedstore.com/index.sz) |
| Goat anti-mouse 568 | Invitrogen | A11004 | For staining mature neurons |
| Graphpad prism 10 | Graphpad prism 10 | https://www.graphpad.com/ | Statistical analysis software |
| Hamilton syringe | Sigma-aldrich | 28614-U | Injection elastase |
| Heat pad | Amazon | https://www.amazon.ca/iPower-Temperature-Controller-Terrarium-Amphibians/dp/B08L4DBFFZ | Maintain body temperature |
| ImageJ software | Fiji Imagej software | imagej.net (USA) | Image analysis software |
| Induction chamber | Provided by animal facility | N/A | Anesthesia induction |
| Metacam | Provided by animal facility | N/A | Analgesic |
| Methyl salicylate | Sigma-aldrich | M6752 | For removing the microfil |
| Microfil | Flow Tech, Carver, Massachusetts | https://www.flowtech-inc.com/order/ | Dye (yellow) |
| Mouse monoclonal anti-NeuN | Millipore Sigma | MAB377 | For staining mature neurons |
| Olympus VS200 slide scanner and VSI software. | Olympus Life Science | https://www.olympus-lifescience.com/en/downloads/detail-iframe/?0[downloads][id]=847254104 | Imaging software |
| Paraformaldehyde | University Medstore | PAR070.1 | For protein fixation (https://www.uoftmedstore.com/index.sz) |
| Perfusion pump | VWR International | https://pr.vwr.com/store/product/4787969/vwr-variable-speed-peristaltic-pumps | Needed for perfusion |
| Scalpel | University Medstore | 2580-M90-10 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Stereotaxic | Provided by animal facility | N/A | So secure the animal for surgery |
| Surgical scissor | University Medstore | 22751-A9-240 | For surgery (https://www.uoftmedstore.com/index.sz) |
| Surgical tape | University Medstore | https://www.amazon.ca/3M-Micropore-Tape-1530-2-Rolls/dp/B0082A9GS2 | Secure the animal on the diaper |
| Sutures | University Medstore | 2297-VS881 | For surgery (https://www.uoftmedstore.com/index.sz) |
| X2 tweezers | University Medstore | 7731-A10-612 | For surgery (https://www.uoftmedstore.com/index.sz) |
Referenzen
- Kadry, H., Noorani, B., Cucullo, L. A blood-brain barrier overview on structure, function, impairment, and biomarkers of integrity. Fluids Barriers CNS. 17 (1), 69 (2020).
- Sethi, B., Kumar, V., Mahato, K., Coulter, D. W., Mahato, R. I. Recent advances in drug delivery and targeting to the brain. J Control Release. 350, 668-687 (2022).
- Vagnucci, A. H., Li, W. W. Alzheimer's disease and angiogenesis. Lancet. 361 (9357), 605-608 (2003).
- Banks, W. A., et al. Lipopolysaccharide-induced blood-brain barrier disruption: roles of cyclooxygenase, oxidative stress, neuroinflammation, and elements of the neurovascular unit. J Neuroinflamm. 12, 223 (2015).
- Archie, S. R., Shoyaib, A. A., Cucullo, L. Blood-brain barrier dysfunction in CNS disorders and putative therapeutic targets: an overview. Pharmaceutics. 13 (11), 1779 (2021).
- Jefferies, W. A., Price, K. A., Biron, K. E., Fenninger, F., Pfeifer, C. G., Dickstein, D. L. Adjusting the compass: new insights into the role of angiogenesis in Alzheimer's disease. Alzheimers Res Ther. 5 (6), 64 (2013).
- Kook, S. Y., Seok-Hong, H., Moon, M., Mook-Jung, I. Disruption of blood-brain barrier in Alzheimer disease pathogenesis. Tissue Barriers. 1 (2), e23993 (2013).
- Kempermann, G. Activity dependency and aging in the regulation of adult neurogenesis. Cold Spring Harb Perspect Biol. 7 (11), a018929 (2015).
- Del Brutto, V. J., Ortiz, J. G., Biller, J. Intracranial arterial dolichoectasia. Front Neurol. 8, 344 (2017).
- de la Torre, J. C., Mussivand, T. Can disturbed brain microcirculation cause Alzheimer's disease. Neurol Res. 15 (3), 146-153 (1993).
- Gutierrez, J., Sacco, R. L., Wright, C. B. Dolichoectasia-an evolving arterial disease. Nat Rev Neurol. 7 (1), 41-50 (2011).
- Desai, B. S., Schneider, J. A., Li, J. L., Carvey, P. M., Hendey, B. Evidence of angiogenic vessels in Alzheimer's disease. J Neural Transm. 116 (5), 587-597 (2009).
- Biron, K. E., Dickstein, D. L., Gopaul, R., Jefferies, W. A. Amyloid triggers extensive cerebral angiogenesis causing blood brain barrier permeability and hypervascularity in Alzheimer's disease. PLoS One. 6 (8), e23789 (2011).
- Zenaro, E., Piacentino, G., Constantin, G. The blood-brain barrier in Alzheimer's disease. Neurobiol Dis. 107, 41-56 (2017).
- Brandl, S., Reindl, M. Blood-Brain barrier breakdown in neuroinflammation: current in vitro models. Int J Mol Sci. 24 (16), 12699 (2023).
- Austin, B. P., et al. Effects of hypoperfusion in Alzheimer's disease. J Alzheimers Dis. 26, 123-133 (2011).
- Jagust, W. J., Budinger, T. F., Reed, B. R. The diagnosis of dementia with single photon emission computed tomography. Arch Neurol. 44 (3), 258-262 (1987).
- Schuff, N., et al. Cerebral blood flow in ischemic vascular dementia and Alzheimer's disease, measured by arterial spin-labeling magnetic resonance imaging. Alzheimers Dement. 5 (6), 454-462 (2009).
- Singh, C., Pfeifer, C. G., Jefferies, W. A. Pathogenic Angiogenic Mechanisms in Alzheimer's Disease. Physiologic and Pathologic Angiogenesis - Signaling Mechanisms and Targeted Therapy. , (2017).
- Dai, D., Kadirvel, R., Rezek, I., Ding, Y. H., Lingineni, R., Kallmes, D. Elastase-induced intracranial dolichoectasia model in mice. Neurosurgery. 76 (3), 337-343 (2015).
- Liu, F. X., et al. Modified protocol for establishment of intracranial arterial Dolichoectasia model by injection of elastase into cerebellomedullary cistern in mice. Front Neurol. 13, 860541 (2022).
- Lee, A. Y., Han, B., Lamm, S. D., Fierro, C. A., Han, H. Effects of elastin degradation and surrounding matrix support on artery stability. Am J Physiol Heart Circ Physiol. 302 (4), H873-H884 (2012).
- Li, Y., et al. The role of elastase in corneal epithelial barrier dysfunction caused by Pseudomonas aeruginosa exoproteins. Invest Ophthalmol Vis Sci. 62 (9), 7 (2021).
- Temesvári, P., Ábrahám, C. S., Gellén, J., Speer, C. P., Kovács, J., Megyeri, P. Elastase given intracisternally opens blood-brain barrier in newborn piglets. Biol Neonatol. 67 (1), 59-63 (1995).
- Takata, F., et al. Elevated permeability of the blood-brain barrier in mice intratracheally administered porcine pancreatic elastase. J Pharmacol Sci. 129 (1), 78-81 (2015).
- Hanyu, H. Diagnosis and treatment of mixed dementia. Brain Nerve. 64 (9), 1047-1055 (2012).
- Chui, H. C., Ramirez-Gomez, L. Clinical and imaging features of mixed alzheimer and vascular pathologies. Alzheimers Res Ther. 7 (1), 21 (2015).
- Saito, T., et al. Single app knock-in mouse models of alzheimer's disease. Nat Neurosci. 17 (5), 661-663 (2014).
- Dobrin, P. B., Canfield, T. R. Elastase, collagenase, and the biaxial elastic properties of dog carotid artery. Am J Physiol. 247, H124-H131 (1984).
- Wagenseil, J. E., Ciliberto, C. H., Knutsen, R. H., Levy, M. A., Kovacs, A., Mecham, R. P. Reduced vessel elasticity alters cardiovascular structure and function in newborn mice. Circ Res. 104 (10), 1217-1224 (2009).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten