Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Laserzellablation in intakten Drosophila-Larven zeigt synaptische Konkurrenz
In diesem Artikel
Zusammenfassung
Dieses Protokoll demonstriert die Laserzellablation einzelner Neuronen in intakten Drosophila-Larven . Die Methode ermöglicht es, die Wirkung der Verringerung der Konkurrenz zwischen Neuronen im sich entwickelnden Nervensystem zu untersuchen.
Zusammenfassung
Das Protokoll beschreibt die Ablation einzelner Neuronen mit einem 2-Photonen-Lasersystem im Zentralnervensystem (ZNS) von intakten Larven von Drosophila melanogaster . Mit dieser nicht-invasiven Methode kann das sich entwickelnde Nervensystem zellspezifisch manipuliert werden. Die Störung der Entwicklung einzelner Neuronen in einem Netzwerk kann genutzt werden, um zu untersuchen, wie das Nervensystem den Verlust des synaptischen Inputs kompensieren kann. Einzelne Neuronen wurden im Riesenfasersystem von Drosophila spezifisch abgetragen, wobei der Schwerpunkt auf zwei Neuronen lag: der präsynaptischen Riesenfaser (GF) und dem postsynaptischen tergotrochanteralen Motoneuron (TTMn). Das GF synapsiert mit dem ipsilateralen TTMn, das für die Fluchtreaktion entscheidend ist. Die Ablation eines der GFs im 3. Instar-Gehirn, kurz nachdem das GF mit dem axonalen Wachstum begonnen hat, entfernt die Zelle dauerhaft während der Entwicklung des ZNS. Das verbleibende GF reagiert mit dem fehlenden Nachbarn und bildet ein ektopisches synaptisches Terminal zum kontralateralen TTMn. Dieses atypische, bilateral symmetrische Terminal innerviert beide TTMns, wie durch Farbstoffkopplung nachgewiesen wird, und steuert beide Motoneuronen, wie elektrophysiologische Assays zeigen. Zusammenfassend lässt sich sagen, dass die Ablation eines einzelnen Interneurons einen synaptischen Wettbewerb zwischen einem bilateralen Neuronenpaar zeigt, das den Verlust eines Neurons kompensieren und die normalen Reaktionen auf den Escape-Kreislauf wiederherstellen kann.
Einleitung
Die Laserablation ist ein bevorzugtes Werkzeug zum Sezieren neuronaler Schaltkreise in einer Vielzahl von Organismen. Es wurde in genetischen Modellsystemen wie Würmern und Fliegen entwickelt und im gesamten Tierreich eingesetzt, um die Struktur, Funktion und Entwicklung des Nervensystems zu untersuchen 1,2,3. Hier wurde die Einzelneuronenablation eingesetzt, um zu untersuchen, wie Neuronen während des Schaltkreisaufbaus in Drosophila interagieren. Das Fluchtsystem der Fliege ist ein beliebter Schaltkreis für die Analyse, da es die größten Neuronen und die größten Synapsen in der erwachsenen Fliege enthält, und der Schaltkreis wurde in denletzten Jahrzehnten gut charakterisiert 4. Die Rolle, die Neuron-Neuron-Interaktionen beim Aufbau des Riesenfaser-Schaltkreises spielen, ist ein Schwerpunkt dieser Forschung.
Eine Art von Interaktion, die seit der Arbeit von Hubel und Wiesel in den 1960er Jahren ein Schwerpunkt der Neurowissenschaften ist, ist der "synaptische Wettbewerb"5,6. In diesem Protokoll wurde die Laserablation verwendet, um die Rolle der Konkurrenz durch Einzelzellablation im Riesenfasersystem (GFS) von Drosophila zu überdenken, wo die molekularen Grundlagen der Phänomene entdeckt werden könnten.
Die Ablation von Neuronen in der sich entwickelnden Fliege war aus einer Vielzahl von Gründen schwierig, darunter die Visualisierung der Zielneuronen, die Präzision der Ablationsmethode und das Überleben der Probe. Um diese Probleme im GFS zu überwinden, wurde das UAS/Gal4-System7 verwendet, um die interessierenden Neuronen zu markieren, und ein Zwei-Photonen-Mikroskop wurde verwendet, um die präsynaptische Riesenfaser oder das postsynaptische Sprungmotoneuron (TTMn) zu entfernen.
Um die Rolle zu bestimmen, die benachbarte bilaterale Neuronen bei der Anpassung der synaptischen Konnektivität und der synaptischen Stärke im GFS spielen, wurde in dieser Studie eines der bilateralen Neuronenpaare (entweder präsynaptisches GF oder postsynaptisches Motoneuron) kurz vor der Puppenentwicklung deletiert. In diesem Entwicklungsstadium ist die GF-Axonogenese noch nicht abgeschlossen8. Anschließend wurden die GF-Struktur und die Funktion des synaptischen Schaltkreises beim Erwachsenen untersucht, wobei besonderes Augenmerk auf den Output des verbleibenden GF gelegt wurde.
Protokoll
Alle für das Protokoll verwendeten Tiere gehörten der Art Drosophila melanogaster an. Es gibt keine ethischen Probleme im Zusammenhang mit der Verwendung dieser Art. Eine ethische Freigabe war für die Durchführung dieser Arbeit nicht erforderlich. Die Einzelheiten zu den Drosophila-Arten , den Reagenzien und der Ausrüstung, die in der Studie verwendet wurden, sind in der Materialtabelle aufgeführt.
1. Drosophila züchten und das richtige Larvenstadium auswählen
- Wählen Sie eine Gal4-Treiberlinie, die die Expression in den Zellen steuert, die abgetragen werden sollen, und kombinieren Sie sie mit einer UAS-GFP-Reporterlinie oder kreuzen Sie sie mit ihr. Ziehen Sie die Fliegen mit handelsüblichem Fliegenfutter bei 25 °C auf.
HINWEIS: Für die Ablation von Riesenfasern (GF) wurde R91H05-Gal4 oder A307-Gal4 mit UAS-GFP rekombiniert. ShakB(letal)-GAL4, rekombiniert mit UAS-GFP, wurde für TTMn-Ablationen verwendet (siehe Materialtabelle). - Wählen Sie Larven aus, die begonnen haben, aus dem Futter zu schlüpfen, und kriechen Sie an der Seite des Futterfläschchens nach oben. Diese Larven befinden sich im Wanderstadium, dem bevorzugten Stadium für die Durchführung der GF-Zellablation.
HINWEIS: Die Ablation kann in jedem Larvenstadium durchgeführt werden. Das letzte Larvenstadium war wichtig für die Manipulation der Entwicklung des GFS, da die GF-Zellkörper im Gehirn leicht identifiziert werden können, die GF-Axone jedoch in diesem Stadium keine Verbindungen zu ihren Zielen hergestellt haben.
2. Vorbereitung derLarve des 3. Stadiums
HINWEIS: Die Larven wurden mit einer ähnlichen Methode wie Burra et al.9 betäubt. Um die Eingriffszeiten kurz zu halten, bereiten Sie jeweils nur eine Larve vor. Eine kurze Exposition gegenüber einem Narkosemittel verbessert das Überleben von Versuchstieren10.
- Bereiten Sie eine Glasschale mit dicht schließendem Deckel vor. Legen Sie einen Wattebausch in die Schüssel und fügen Sie unter einem Abzug etwa 3-5 ml Ethylether (gefährliche, brennbare Flüssigkeit, Laborkittel, Handschuhe, Schutzbrille) hinzu. Decken Sie die Form mit dem Deckel ab.
- Sammeln Sie einzelne Larven des 3. Stadiums aus Fliegenfläschchen. Im 3. Larvenstadium verlassen die Larven das Futtermedium und kriechen an der Seite des Futterfläschchens11 nach oben.
- Stellen Sie sicher, dass sich die Larven noch bewegen und nicht mit der Puppenbildung begonnen haben. Larven, die stationär sind und eine Verkürzung des Körpers aufweisen, beginnen mit der Verpuppung und sind für eine Ablation ungeeignet. Heben Sie die Larven mit einem kleinen Pinsel auf.
HINWEIS: Das 3. Larvenstadium beginnt nach der zweiten Häutung nach 72 Stunden Entwicklung (nach der Eiablage) und dauert bis zur Puppenbildung bei Fliegen, die bei 25 °C aufgezogen werden, nach 120 Uhr.
- Stellen Sie sicher, dass sich die Larven noch bewegen und nicht mit der Puppenbildung begonnen haben. Larven, die stationär sind und eine Verkürzung des Körpers aufweisen, beginnen mit der Verpuppung und sind für eine Ablation ungeeignet. Heben Sie die Larven mit einem kleinen Pinsel auf.
- Setze eine Larve in ein kleines, offenes Gefäß um. Stellen Sie den Behälter in die Glasschale mit Ethylether und verschließen Sie die Schale fest. Wenn Sie die Glasschale öffnen, legen Sie sie unter einen Schnorchel oder in einen Abzug, um zu verhindern, dass Dämpfe entweichen.
- Im Abstand von 30 s den Deckel mit der Larve von der Schale nehmen und die Larve unter dem Präpariermikroskop auf Beweglichkeit untersuchen. Die Larve wird in der Regel innerhalb von 1 min ruhiggestellt. Sobald die Maulhaken aufhören zu zucken, ist die Larve bereit zum Aufsitzen. Entsorgen Sie alle Larven, die nach 3 Minuten nicht vollständig immobilisiert sind.
HINWEIS: Die Oberseite eines umgedrehten Deckels eines Mikrozentrifugenröhrchens (Deckel vom Röhrchen entfernt) kann als Behälter verwendet werden.
- Im Abstand von 30 s den Deckel mit der Larve von der Schale nehmen und die Larve unter dem Präpariermikroskop auf Beweglichkeit untersuchen. Die Larve wird in der Regel innerhalb von 1 min ruhiggestellt. Sobald die Maulhaken aufhören zu zucken, ist die Larve bereit zum Aufsitzen. Entsorgen Sie alle Larven, die nach 3 Minuten nicht vollständig immobilisiert sind.
3. Montage von Larven auf Objektträgern für die Ablation
- Legen Sie die betäubte Larve auf einen Objektträger aus Glasmikroskop. Tauchen Sie die Larve in einen Tropfen Insektensalzlösung; Dadurch werden einige der Speisereste weggespült, die an der Larve haften bleiben könnten.
- Entfernen Sie unter dem Präpariermikroskop den größten Teil der Kochsalzlösung mit einem Papiertuch. Positionieren Sie die dorsale Seite der Larve nach oben für die GF-Ablation oder die ventrale Seite nach oben für die TTMn-Ablation. Senken Sie langsam ein Glasdeckglas auf die Larve. Tragen Sie Kochsalzlösung an der Seite des Deckglases auf, um den Raum zwischen dem Glasobjektträger und dem Deckglas zu füllen.
- Bei der GF-Ablation ist die Positionierung des Gehirns unter starker Vergrößerung am Dissektionsmikroskop zu überprüfen. Achten Sie darauf, dass das Gehirn waagerecht liegt und durch die Nagelhaut sichtbar ist. Oft ist das Gehirn mit Fettgewebe bedeckt, was eine Visualisierung und Zellablation unmöglich macht.
- Um das Fettgewebe, das das Gehirn bedeckt, zu entfernen, üben Sie mit einer Pinzette leichten Druck auf das Deckglas aus und bewegen Sie das Deckglas von einer Seite zur anderen. Wenn das Fettgewebe auf diese Weise nicht vom Gehirn wegbewegt werden kann, verwenden Sie stattdessen eine andere Larve.
4. Auffinden der Zielzellen
HINWEIS: Das für diese Studie verwendete Multiphotonensystem wurde an einem aufrechten Mikroskop montiert. Zur Steuerung der Erfassungs- und Laserstimulationseinstellungen wurde eine systemspezifische Software verwendet. Das System wurde mit einer Epifluoreszenzlichtquelle ausgestattet, um die Proben zu lokalisieren. Bei der Objektivlinse handelte es sich um eine Wasserimmersionslinse mit 25-facher Vergrößerung, einem langen Arbeitsabstand von 2 mm und einer NA von 1,10.
- Legen Sie die Probe auf den Tisch des Multiphotonenmikroskops und verwenden Sie den GFP-Filter, um die Probe im Epifluoreszenzmodus zu lokalisieren. Bei der GF-Ablation können die Zellkörper im Gehirn identifiziert werden, wie in Abbildung 1A,C,D zu sehen ist. Für die TTMn-Ablation kann ein Cluster von vier Zellen von der ventralen Seite im ventralen Nervenstrang (VNC) identifiziert werden, wie in Abbildung 1A,B gezeigt. Wenn Sie mit dem Fokussieren fertig sind, zentrieren Sie die Zellen im Sichtfeld und wechseln Sie in den 2-Photonen-Modus.
5. Einrichten der Ablationsparameter
- Passen Sie die Lasereinstellungen und die Detektorverstärkung an, um die GFP-exprimierenden Zellen mit dem Galvano-Scanner zu betrachten. Eine Wellenlänge von 870 nm eignet sich am besten zur Visualisierung des GFP-Signals. Zentrieren Sie die Zelle im Sichtfeld.
- Verwenden Sie einen kreisförmigen Interessenbereich (ROI), um den Bereich für die Ablation zu definieren. Stellen Sie sicher, dass der ROI den größten Teil der Oberfläche der Zelle bedeckt (Abbildung 1E,G).
- Richten Sie das Ablationsprotokoll in der Software ein. Stellen Sie einen Aufnahme-Frame ein, dann die Stimulation, gefolgt von einem weiteren Erfassungs-Frame.
- Starten Sie die Leistungseinstellung des Stimulationslasers auf einem niedrigeren Wert (10%-20 %) und führen Sie das Stimulationsprotokoll aus. Eine erfolgreiche Ablation ist an einem deutlichen Kreis in der Mitte des Zellsomas an der Stelle des ROI und einer Zunahme der Fluoreszenz um den ROI herum zu erkennen (Abbildung 1F).
- Wenn die Ablation nicht erfolgreich war und die Zelle lediglich gebleicht wurde (Abbildung 1H), erhöhen Sie die Laserleistung in Schritten von 5 % oder die Anzahl der Schleifen nacheinander und führen Sie das Protokoll erneut aus. Die angewandte Laserleistung lag zwischen 10 % und 40 % für das im Protokoll verwendete System.
HINWEIS: Die Einstellungen für die Laserleistung für die Ablation hängen stark davon ab, wie tief sich die Zellen im Gewebe befinden und von anderen Faktoren wie der Nagelhautfaltung. Wenn die Zellen hell und deutlich sichtbar sind, liegt die Laserleistung am unteren Ende des Bereichs. Die Laserleistung ist je nach Lasermodell und Alter des Lasers für jedes System unterschiedlich.
- Wenn die Ablation nicht erfolgreich war und die Zelle lediglich gebleicht wurde (Abbildung 1H), erhöhen Sie die Laserleistung in Schritten von 5 % oder die Anzahl der Schleifen nacheinander und führen Sie das Protokoll erneut aus. Die angewandte Laserleistung lag zwischen 10 % und 40 % für das im Protokoll verwendete System.
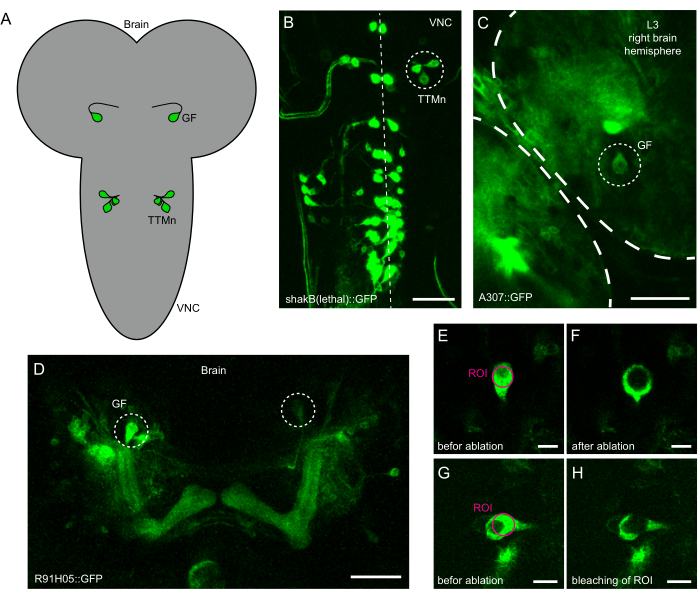
Abbildung 1: Identifizierung von Neuronen für die Laserablation in intakten Drosophila L3-Larven. (A) Schematische Darstellung der Lokalisation des Riesenfaser-Somas (GF) im Gehirn und eines Clusters von Motoneuronen, die das tergotrochanterale Motoneuron (TTMn) im ventralen Nervenstrang (VNC) enthalten. (B) Projektion der maximalen Intensität von shakB(letal)-Gal4, die die Expression von GFP in der VNC der Larve antreibt. Die Mittellinie wird durch die gestrichelte Linie angezeigt. Der Kreis zeigt den Cluster von Neuronen an, die das TTMn enthalten und für die Laserablation vorgesehen sind. Maßstabsbalken: 50 μm. (C) Teilprojektionsansicht des Larvengehirns, das GFP exprimiert, unter der Kontrolle von A307-Gal4. Der Kreis zeigt das GF-Soma, das für die Laserablation vorgesehen ist. Maßstabsbalken: 50 μm. (D) Projektion der maximalen Intensität des Gehirns mit R91H05-Gal4 zur Ansteuerung von UAS-GFP. Beide GFs (Kreise) sind durch Lage, Form und Größe identifizierbar. Maßstabsbalken: 50 μm. (E) GF Soma vergrößerte Ansicht vor der Laserablation. Der magentafarbene Kreis zeigt die Zielregion für die Laserablation an. Maßstabsbalken: 10 μm. (F) GF soma vergrößerte Ansicht nach Abgabe der lokalisierten Laserleistung und erfolgreicher Ablation. Maßstabsbalken: 10 μm. (G) GF soma vergrößerte Ansicht vor der Laserablation. Der magentafarbene Kreis zeigt die Zielregion für die Laserablation an. Maßstabsbalken: 10 μm. (H) GF Soma vergrößerte Ansicht nach Abgabe von lokalisierter Laserleistung und erfolgloser Ablation (Bleaching). Maßstab: 10 μm. Bitte klicken Sie hier, um eine größere Version dieser Abbildung anzuzeigen.
6. Bergung der Larven
- Nachdem Sie die Zelle erfolgreich abgetragen haben, entfernen Sie das Deckglas und nehmen Sie die Larven vorsichtig mit einem Pinsel vom Objektträger auf. Legen Sie die Larven in ein Futterfläschchen. Die Larven beginnen innerhalb von 30 Minuten wieder herumzukrabbeln.
HINWEIS: Eine kurze Verfahrenszeit verbessert die Überlebensraten der Tiere. Mit viel Erfahrung kann das Experiment in knapp 10 min durchgeführt werden. - Die Larven werden unter normalen Bedingungen aufgezogen, bis sie sich von der Puppenhülle lösen.
7. Testen der Funktionalität des GFS an erwachsenen Fliegen
HINWEIS: Die folgenden Schritte werden in Allan und Godenschwege12 und Augustin et al.13 ausführlich erläutert.
- Testadulte Fliegen im Alter von 2-5 Tagen nach der Eklosion. Betäuben Sie Fliegen mit CO2 und montieren Sie sie auf Zahnwachs, indem Sie die Beine in das Wachs drücken. Spreizen Sie die Flügel im 90°-Winkel und fixieren Sie sie mit dem Wachs. Sichern Sie den Kopf, indem Sie den Rüssel in das Wachs schieben.
- Legen Sie Stimulationsdrähte in beide Augen, einen Erdungsdraht in den Bauch und Aufzeichnungselektroden aus Glas in die Sprungmuskulatur (TTMs) auf jeder Seite.
- Stimulieren Sie den GF-Schaltkreis mit einzelnen Stimuli, um die Reaktionslatenz für beide Muskeln zu messen. Stimulieren Sie den Zirkel mit 100 Hz bzw. 200 Hz Reizfolgen, um die folgende Frequenz für beide Muskeln zu messen.
8. Dissektion und Markierung des Riesenfasersystems für die konfokale Bildgebung
HINWEIS: Die Fliegen-ZNS-Dissektion und die Farbstoffinjektion sind in Boerner und Godenschwege14 ausführlich beschrieben.
- Entfernen Sie die Fliege vorsichtig mit einer Pinzette aus dem Zahnwachs und übertragen Sie sie in eine mit Silikonelastomer ausgekleidete Petrischale unter einem Dissektionszielfernrohr.
- Entfernen Sie die Beine, Flügel und den Rüssel mit einer Schere und befestigen Sie die Stirnseite mit Insektennadeln in der Elastomerbeschichtung.
- Machen Sie einen seitlichen Schnitt entlang der Mittellinie vom Mittelbauch durch den gesamten Brustkorb und den Hals hinauf, um den Brustkorb mit dem Kopf zu verbinden. Öffnen Sie den Hosenschlitz mit Insektenstecknadeln. Entfernen Sie Organe und Drüsen aus der Fliege, ohne das Nervensystem zu schädigen.
ANMERKUNG: Zu diesem Zeitpunkt können GF-Axone mit Farbstoffen injiziert werden, um die GFs und elektrisch gekoppelten Neuronen13 zu markieren. - Entferne die Kopfkapsel vom Kopf, um das Gehirn freizulegen.
9. Immunhistochemie des Nervensystems
- Fixieren Sie die Fliege nach der ZNS-Dissektion 45 Minuten lang bei Raumtemperatur (RT) in 4% PFA in PBS. 20 min in PBS bei RT waschen (3 Mal).
- Die Probe wird 1 h lang bei RT in 3 % BSA in PBS mit 0,5 % Detergenzienlösung blockiert.
- 2-3 Nächte bei 4 °C in 3 % BSA in PBS mit 0,3 % Detergenzlösung und Kaninchen-Anti-GFP (1:500) inkubieren. 20 min in PBS bei RT waschen (6 Mal).
- Über Nacht bei 4 °C in PBS mit Anti-Kaninchen Alexa 488 inkubieren. 20 min in PBS bei RT waschen (6 Mal).
- Dehydrieren Sie die Proben mit einer aufsteigenden Ethanolreihe (50 %, 70 %, 90 %, 100 % Ethanol) für 10 Minuten pro Schritt. Entferne die Stecknadeln und schneide den Bauch und die Flugmuskulatur ab. Übertragen Sie den Rest des Thorax, der das Nervensystem enthält, auf einen Objektträger und bedecken Sie ihn mit einem Eindeckmedium wie Methylsalicylat. Legen Sie ein Deckglas auf die Probe und versiegeln Sie sie mit Nagellack.
- Stellen Sie das Nervensystem auf einem konfokalen Mikroskop dar, um die Anatomie des GF-Terminals zu analysieren.
Ergebnisse
Mit dieser Methode kann die Entwicklung spezifischer neuronaler Netzwerke im Nervensystem von Drosophila manipuliert werden. Die primäre Forschungsfrage dabei war die Bildung synaptischer Verbindungen. Die Entfernung des präsynaptischen GF oder des postsynaptischen TTMn ermöglichte die Untersuchung der reaktiven Synaptogenese an dieser zentralen Synapse und der molekularen Mechanismen, die für die synaptische Funktion und Entwicklung entscheidend sind. Wie im Protokoll beschrieben, wurde eine Laserzellenabla...
Diskussion
Die Zellablation mit einem 2-Photonen-Mikroskop erwies sich als sehr erfolgreiche Methode, um die Entwicklung neuronaler Schaltkreise in Drosophila zu manipulieren. Da diese Methode nicht-invasiv ist, verursacht sie nur minimalen Schaden für das Tier. Die Daten unterstützen die Nützlichkeit dieser zellspezifischen Manipulation bekannter Schaltkreise.
Entscheidend für den Erfolg der Ablation war die Auswahl des am besten geeigneten Gal4-Treibers. Da das GFS gut untersucht ist, wurd...
Offenlegungen
Die Autoren haben nichts offenzulegen.
Danksagungen
Die Experimente am 2-Photonen-Mikroskop wurden im Advanced Cell Imaging Core des Stiles-Nicholson Brain Institute der FAU durchgeführt. Wir danken der Jupiter Life Science Initiative für die finanzielle Unterstützung.
Materialien
| Name | Company | Catalog Number | Comments |
| Alexa Fluor 488 AffiniPure Goat Anti-Rabbit IgG (H+L) | Jaxkson ImmunoResearch | 111-545-003 | |
| Anti-green fluorescent protein, rabbit | Fisher Scientific | A11122 | 1:500 concentration |
| Apo LWD 25x/1.10W Objective | Nikon | MRD77220 | water immersion long working distance |
| Bovine Serum Albumin (BSA) | Sigma | B4287-25G | |
| Chameleon Ti:Sapphire Vision II Laser | Coherent | ||
| Cotton Ball | Genesee Scientific | 51-101 | |
| Dextra, Tetramethylrhodamine, 10,000 MW, Lysine Fixable (fluoro-Ruby) | Fisher Scientific | D1817 | |
| Drosophila saline | recipe from Gu and O'Dowd, 2006 | ||
| Ethyl Ether | Fisher Scientific | E134-1 | Danger, Flammable liquid |
| Fly food B (Bloomington recipe) | LabExpress | 7001-NV | |
| Methyl salicylate | Fisher Scientific | O3695-500 | |
| Microcentrifuge tube 1.5 mL | Eppendorf | 22363204 | |
| Microscope cover-slip 18x18 #1.5 | Fisher Scientific | 12-541A | |
| Neurobiotin Tracer | Vector Laboratories | SP-1120 | |
| Nikon A1R multi-photon microscope | Nikon | on an upright FN1 microsope stand | |
| NIS Elements Advanced Research | Nikon | Acquisition and data analysis software | |
| Paraformaldehyde (PFA) | Fisher Scientific | T353-500 | |
| PBS (Phosphate Buffered Salin) | Fisher BioReagents | BP2944-100 | Tablets |
| R91H05-Gal4 | Bloomington Drosophila Stock Center | 40594 | |
| shakB(lethal)-GAl4 | Bloomington Drosophila Stock Center | 51633 | |
| Superfrost microscope glass slide | Fisher Scientific | 12-550-143 | |
| Triton X-100 | Fisher Scientific | 422355000 | detergent solution |
| UAS-10xGFP | Bloomington Drosophila Stock Center | 32185 |
Referenzen
- Chung, S. H., Mazur, E. Femtosecond laser ablation of neurons in C. elegans for behavioral studies. Appl Phys A Mater Sci Process. 96 (2), 335-341 (2009).
- Bower, D. V., et al. Airway branching has conserved needs for local parasympathetic innervation but not neurotransmission. BMC Biol. 12, 92 (2014).
- Angelo, J. R., Tremblay, K. D. Laser-mediated cell ablation during post-implantation mouse development. Dev Dyn. 242 (10), 1202-1209 (2013).
- Allen, M. J., Godenschwege, T. A., Tanouye, M. A., Phelan, P. Making an escape: Development and function of the Drosophila giant fibre system. Semin Cell Dev Biol. 17 (1), 31-41 (2006).
- Hubel, D. H., Wiesel, T. N. Binocular interaction in striate cortex of kittens reared with artificial squint. J Neurophysiol. 28 (6), 1041-1059 (1965).
- Wiesel, T. N., Hubel, D. H. Comparison of the effects of unilateral and bilateral eye closure on cortical unit responses in kittens. J Neurophysiol. 28 (6), 1029-1040 (1965).
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Allen, M. J., Drummond, J. A., Moffat, K. G. Development of the giant fiber neuron of Drosophila melanogaster. J Comp Neurol. 397 (4), 519-531 (1998).
- Burra, S., Wang, Y., Brock, A. R., Galko, M. J. Using Drosophila larvae to study epidermal wound closure and inflammation. Methods Mol Biol. 1037, 449-461 (2013).
- Kakanj, P., Eming, S. A., Partridge, L., Leptin, M. Long-term in vivo imaging of Drosophila larvae. Nat Protoc. 15 (3), 1158-1187 (2020).
- Bainbridge, S. P., Bownes, M. Staging the metamorphosis of Drosophila melanogaster. J Embryol Exp Morphol. 66, 57-80 (1981).
- Allen, M. J., Godenschwege, T. A. Electrophysiological recordings from the Drosophila giant fiber system (GFs). Cold Spring Harb Protoc. 2010 (7), 5453 (2010).
- Augustin, H., Allen, M. J., Partridge, L. Electrophysiological recordings from the giant fiber pathway of d. Melanogaster. J Vis Exp. (47), e2412 (2011).
- Boerner, J., Godenschwege, T. A. Whole mount preparation of the adult Drosophila ventral nerve cord for giant fiber dye injection. J Vis Exp. (52), e3080 (2011).
- Blagburn, J. M., Alexopoulos, H., Davies, J. A., Bacon, J. P. Null mutation in shaking-b eliminates electrical, but not chemical, synapses in the Drosophila giant fiber system: A structural study. J Comp Neurol. 404 (4), 449-458 (1999).
- Kennedy, T., Broadie, K. Newly identified electrically coupled neurons support development of the Drosophila giant fiber model circuit. eNeuro. 5 (6), 0346 (2018).
- Mcfarland, B. W., et al. Axon arrival times and physical occupancy establish visual projection neuron integration on developing dendrites in the Drosophila optic glomeruli. bioRxiv. , (2024).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenWeitere Artikel entdecken
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten