Una serie de materiales naturales y sintéticos muestran permeabilidad selectiva, lo que significa que sólo moléculas o iones de un determinado tamaño, forma, polaridad, carga, etc. son capaces de pasar (permear) el material. Las membranas celulares biológicas proporcionan ejemplos elegantes de permeabilidad selectiva en la naturaleza, mientras que los tubos de diálisis utilizados para eliminar los desechos metabólicos de la sangre son un ejemplo tecnológico más simplista. Independientemente de cómo se fabrican, estos materiales se denominan generalmente membranas semipermeables.
Considere un aparato en forma de U, en el que las muestras de disolvente puro y una solución están separadas por una membrana que sólo pueden permear las moléculas de disolvente. Las moléculas de disolvente se dispersarán a través de la membrana en ambas direcciones. Dado que la concentración de disolvente es mayor en el disolvente puro que en la solución, estas moléculas difunden desde el lado del disolvente de la membrana hasta el lado de la solución a una velocidad más rápida que en la dirección inversa. El resultado es una transferencia neta de moléculas desde disolvente del disolvente puro a la solución. La transferencia de moléculas de disolvente por difusión a través de una membrana semipermeable es un proceso conocido como ósmosis.
Cuando la ósmosis se realiza en un aparato como el descrito anteriormente, el volumen de la solución aumenta a medida que se diluye por la acumulación de disolvente. Esto hace que el nivel de la solución aumente, aumentando su presión hidrostática (debido al peso de la columna de la solución en el tubo) y dando como resultado una transferencia más rápida de moléculas de disolvente de vuelta al lado del disolvente puro. Cuando la presión alcanza un valor que produce una tasa de transferencia inversa de disolvente igual a la tasa de ósmosis, la transferencia masiva de disolvente cesa. Esta presión se denomina presión osmótica (Π) de la solución. La presión osmótica de una solución diluida está relacionada con la molaridad de su soluto, M, y con temperatura absoluta, T, según la ecuación
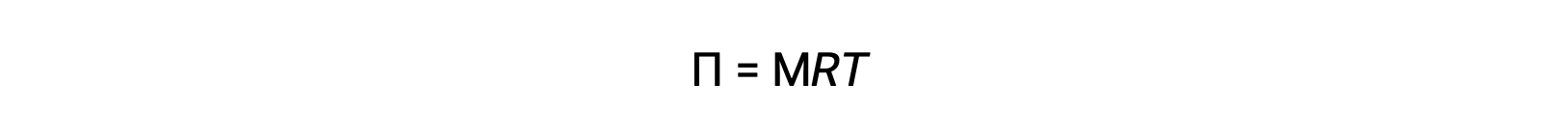
Donde R es la constante de gas universal.
Si se coloca una solución en dicho aparato, aplicar una presión mayor que la presión osmótica de la solución invierte la ósmosis y empuja las moléculas de disolvente de la solución hacia el disolvente puro. Esta técnica de ósmosis inversa se utiliza para la desalinización del agua de mar a gran escala y en escalas más pequeñas para producir agua de grifo de alta pureza para beber.
Este texto está adaptado de Openstax, Química 2e, Sección 11.4: Propiedades Coligativas.
Del capítulo 12:

Now Playing
12.11 : Ósmosis y Presión Osmótica de las Soluciones
Soluciones y coloides
38.2K Vistas

12.1 : Formación de las Soluciones
Soluciones y coloides
30.3K Vistas

12.2 : Las Fuerzas Intermoleculares en las Soluciones
Soluciones y coloides
32.1K Vistas

12.3 : Entalpía de Solución
Soluciones y coloides
24.2K Vistas

12.4 : Soluciones Acuosas y Calores de Hidratación
Soluciones y coloides
13.9K Vistas

12.5 : Equilibrio y Saturación de las Soluciones
Soluciones y coloides
17.9K Vistas

12.6 : Propiedades Físicas que Afectan la Solubilidad
Soluciones y coloides
21.8K Vistas

12.7 : Expresando la concentración de las Soluciones
Soluciones y coloides
57.6K Vistas

12.8 : Reducción de la Presión de Vapor
Soluciones y coloides
25.0K Vistas

12.9 : Soluciones Ideales
Soluciones y coloides
18.4K Vistas

12.10 : Descenso del punto de Congelamiento y Elevación del Punto de Ebullición
Soluciones y coloides
33.1K Vistas

12.12 : Electrolitos: Factor de van't Hoff
Soluciones y coloides
32.0K Vistas

12.13 : Coloides
Soluciones y coloides
17.1K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados