16.11 : Factores que Afectan la Solubilidad
En comparación con el agua pura, la solubilidad de un compuesto iónico es menor en soluciones acuosas que contienen un ion común (uno también producido por disolución del compuesto iónico). Este es un ejemplo de un fenómeno conocido como el efecto del ion común, que es una consecuencia de la ley de acción de masas que puede explicarse utilizando el principio de Le Châtelier. Considere la disolución del yoduro de plata:
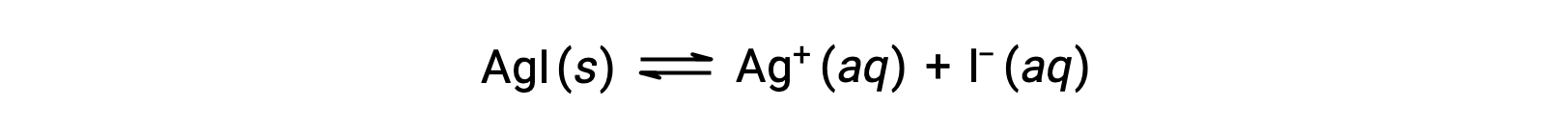
Este equilibrio de solubilidad puede ser desplazado hacia la izquierda por la adición de iones de plata o yoduro, resultando en la precipitación del AgI y concentraciones reducidas de Ag+ y I– disueltos. En soluciones que ya contienen cualquiera de estos iones, se puede disolver menos AgI que en soluciones sin estos iones.
Este efecto también puede explicarse en términos de acción de masas, tal como se representa en la expresión del producto de solubilidad:
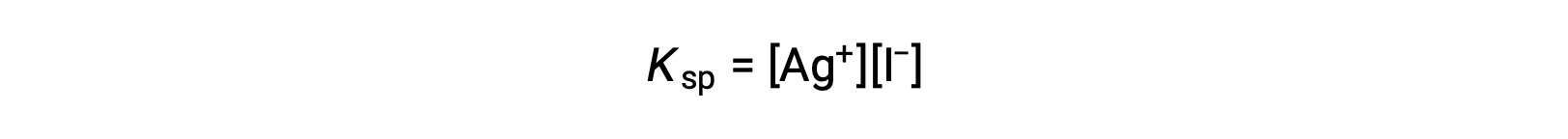
En una mezcla en equilibrio, el producto matemático de las molaridades de los iones de plata y yoduro es constante, independientemente de la fuente de los iones, por lo que un aumento de la concentración de un ión debe equilibrarse con una disminución proporcional en el otro.
El papel de la precipitación en el tratamiento de las aguas residuales
Los equilibrios de solubilidad son herramientas útiles en el tratamiento de las aguas residuales realizado en instalaciones que pueden tratar el agua municipal en una ciudad o un pueblo. Específicamente, la precipitación selectiva se utiliza para eliminar contaminantes de las aguas residuales antes de que sean liberadas nuevamente a cuerpos de agua naturales. Por ejemplo, los iones fosfato (PO43−) suelen estar presentes en el agua servida de las fabricas. La abundancia de fosfato hace que crezca un exceso de algas, lo que afecta la cantidad de oxígeno disponible para la vida marina y hace que el agua no sea apta para el consumo humano.
Una forma común de eliminar los fosfatos del agua es mediante la adición de hidróxido de calcio, o cal, Ca(OH)2. A medida que el agua se hace más básica, los iones de calcio reaccionan con los iones fosfato para producir hidroxiapatita, Ca5(PO4)3·OH, que luego precipita fuera de la solución:
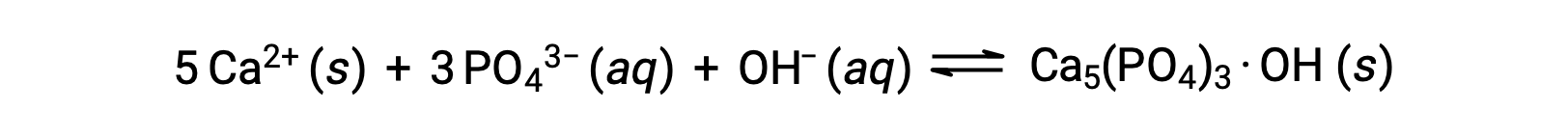
Debido a que la cantidad de ion calcio añadido no excede los productos de solubilidad de otras sales de calcio, los aniones de esas sales permanecen en las aguas residuales. El precipitado se elimina luego por filtración, y el agua vuelve a un pH neutro mediante la adición de CO2 en un proceso de descarbonización. También se pueden utilizar otros productos químicos para la eliminación de fosfatos mediante precipitación, incluyendo el cloruro de hierro (III) y el sulfato de aluminio.
Este texto es adaptado de Openstax, Química 2e, Sección 15.1: Precipitación y Disolución.
Del capítulo 16:

Now Playing
16.11 : Factores que Afectan la Solubilidad
Equilibrio ácido-base y de solubilidad
32.9K Vistas

16.1 : Efecto del Ion Común
Equilibrio ácido-base y de solubilidad
40.8K Vistas

16.2 : Amortiguadores
Equilibrio ácido-base y de solubilidad
163.3K Vistas

16.3 : Ecuación de Henderson-Hasselbalch
Equilibrio ácido-base y de solubilidad
68.0K Vistas

16.4 : Calculando los Cambios de pH en una Solución Amortiguadora
Equilibrio ácido-base y de solubilidad
52.5K Vistas

16.5 : Efectividad de un Amortiguador
Equilibrio ácido-base y de solubilidad
48.3K Vistas

16.6 : Cálculos de Titulación: Ácido Fuerte - Base Fuerte
Equilibrio ácido-base y de solubilidad
28.9K Vistas

16.7 : Cálculos de Titulación: Ácido Débil - Base Débil
Equilibrio ácido-base y de solubilidad
43.7K Vistas

16.8 : Indicadores
Equilibrio ácido-base y de solubilidad
47.7K Vistas

16.9 : Titulación de un Ácido Poliprótico
Equilibrio ácido-base y de solubilidad
95.6K Vistas

16.10 : Equilibrio de Solubilidad
Equilibrio ácido-base y de solubilidad
51.9K Vistas

16.12 : Formación de Iones Complejos
Equilibrio ácido-base y de solubilidad
23.1K Vistas

16.13 : Precipitación Iónica
Equilibrio ácido-base y de solubilidad
27.4K Vistas

16.14 : Análisis Cualitativo
Equilibrio ácido-base y de solubilidad
20.2K Vistas

16.15 : Curvas de Titulación Ácido-Base
Equilibrio ácido-base y de solubilidad
126.2K Vistas
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados