Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En vivo Ca 2 + - Imágenes de las neuronas del cuerpo de hongos durante el aprendizaje olfativo en la abeja de la miel
En este artículo
Resumen
Las abejas pueden ser acondicionadas en una paradigma de aprendizaje olfativo apetito (PER acondicionado). Utilizando los olores como estímulo, hemos establecido un método en el que el comportamiento se registra al mismo tiempo imágenes de calcio se utiliza para medir la actividad de olor evoca en las neuronas del cuerpo de setas In vivo.
Resumen
En vivo y semi-vivo en la preparación para obtener imágenes de calcio se ha desarrollado en nuestro laboratorio por Joerges, Kuttner y Galicia más de diez años, para medir la actividad olor evoca en el lóbulo antenal 1. A partir de entonces, ha sido constantemente perfeccionado y aplicado a neuropiles diferente en el cerebro de las abejas. Aquí se describe la preparación se utilizan actualmente en el laboratorio para medir la actividad en las neuronas del cuerpo de setas, junto con un dextrano colorante sensible al calcio (Fura-2). Nos retrógrada mancha de hongo neuronas del cuerpo mediante la inyección de contraste en sus axones o región soma. Nos centramos en la reducción de la invasión, para lograr una preparación en la que todavía es posible entrenar a las abejas con PER acondicionado. Somos capaces de controlar y cuantificar la respuesta de comportamiento mediante el registro electro-myograms del músculo que controla el PER (M17) 2.
Después del experimento fisiológico las estructuras proyectadas se investigan con mayor detalle mediante microscopía confocal de barrido para hacer frente a la identidad de las neuronas.
Protocolo
Abeja Preparación y posterior relleno
- Captura recolectores de miel de abeja en la colmena y se enfría en hielo durante la inmovilización.
- Montaje en Plexiglas las cámaras de los tres. Fijar los ojos y el tórax a las paredes de la cámara de grabación con cera de bajo punto de fusión duro.
- Tire de capilares de vidrio como de uso general para la electrofisiología y la ruptura en la punta para obtener un diámetro de la punta de la ca. 10μm. Cobertura en la punta del capilar con pasta de tinte. Pasta de colorante consiste en una mezcla 10:01 de la Fura-2 dextrano y lisina puede arreglar tetrametilrodamina dextrano.
- Para el procedimiento de tinción inmovilizar antenas con minucias o n eicosano. Extraer un pedazo de cutícula sobre el cerebro y las glándulas empuje y la tráquea hacia el lado para permitir el acceso al cuerpo de hongo.
- Se inyecta en los capilares ya sea el soma o región axonal de las neuronas del cuerpo de setas. Esto se puede hacer manos libres o el uso de un micromanipulador. A continuación, restaurar piezas cutícula cápsula de la cabeza y aflojar las antenas.
- Alimentar a las abejas con solución de sacarosa al 30% antes de guardarlos en una caja húmeda por lo menos durante cuatro horas o durante la noche a 20 ° C.
En vivo de imágenes
- Evitar los movimientos de las abejas, por ejemplo con un pequeño pedazo de esponja que se aprieta contra el abdomen y se fija con un clip o una cinta en la cámara de grabación.
- Para evitar el movimiento del cerebro como resultado del bombeo del esófago, el corte de una pequeña incisión en la cutícula por encima del labrum y sacar con cuidado el esófago y sus alrededores estructuras sólidas para ponerlo bajo tensión sin dañar el esófago 4. Cubierta de silicona de dos componentes.
- Hacer agujeros con una aguja e insertar electrodos de alambre para la grabación de la M17.
- Retire la pieza cutícula, la tráquea y las glándulas sobre el cerebro. Chupe heamolymph dentro de la cápsula con la cabeza un pedazo de papel.
- Llene la cápsula de la cabeza con silicona de dos componentes. Es importante que el cerebro está completamente cubierto.
- Abeja en lugar platina del microscopio y coloque una gota de agua en la superficie de la silicona para sumergir el objetivo de inmersión en el microscopio en la gota. Se centran en las neuronas de colores.
Olor estimulación y registro de señales
Olfatómetro: Nosotros usamos un ordenador controlado, personalizado dispositivo construido estimulación o "olfatómetro", como se describe anteriormente por Galicia y Vetter 3. Los olores se diluyen en una corriente constante de aire dirigido hacia las antenas. Cualquier estímulo consiste en un impulso de olor 3s de aire saturado de olor a 0,2 ml. El protocolo de estimulación se puede ajustar en el TILLVision software de grabación.
Imagen de microscopio y puesta en marcha: utilizamos un microscopio de fluorescencia Zeiss. Las imágenes se graban a 25 ° C con una tasa de muestreo de 5 Hz usando un dispositivo de Till-Fotónica de imagen montado en el microscopio. Señales de calcio se registran a través de un X60, Olympus 0,9 W inmersión objetivo con una cámara CCD Imago (640X480 pixeles, 4X agrupadas en el chip de hasta 160x120 píxeles). Fura-2 se excita con luz monocromática de 380 nm de longitud de onda 340 y para las mediciones radiométrica. La fluorescencia se detecta a través de un espejo dicroico 410 nm y un filtro de 440nm pase largo. Los parámetros para la grabación se encuentra en el software de grabación. Cada medida dura 10 segundos y el tiempo de exposición para las dos longitudes de onda se puede ajustar a la intensidad de la tinción en cada preparación.
M17 grabación: El transportador muscular del labio (M17) se registra extracelularmente para monitorear las respuestas conductuales relacionados con el aprendizaje, es decir, por cada 5, 6. Se inyecta un hilo de cobre en el músculo cerca de la partes de la boca. Inyectar electrodo de tierra en el ojo. Los potenciales de los músculos son amplificadas con un encargo de la estructura pre-amplificador, digitalizadas y almacenadas en un ordenador. Inicio del estímulo se desencadena por el olfatómetro.
Análisis de Datos
- Durante el experimento: Las grabaciones de la señal de calcio se introducen en un ordenador y se almacenan. El software de grabación TILLVision permite una inspección inicial de las señales, como el cálculo de la relación entre las longitudes de onda (340nm/380nm) y el cálculo de deltaF (sustracción de la línea de base).
- Procesamiento de imágenes se realiza con la costumbre de los programas escritos en IDL. Calcular la relación de Ca 2 + señales de 340 nm y 380 nm mediciones para cada píxel. Determinar la fluorescencia de fondo (F) por un promedio de más cuadros antes que el estímulo y la resta de la señal radiométrica (deltaF).
- Para definir la región de interés (ROI): Calcular media de fotogramas durante el estímulo y aplicar un filtro de paso bajo (3X3px). Convertir en escala de grises de la escala de colores falsos. Determinar la actividad neuronal en las estructuras de la actividad en forma de manchas en las imágenes en falso color y definir el ROI.
- Calcular la dinámica temporal de las regiones activas de un promedio de los píxeles en el retorno de la inversión sobre todos los marcos, sin ningún tipo de filtro o corrección.
Análisis morfológico y reconstrucción
Junto con el dextrano Fura-2 llenamos las neuronas con el colorante rodamina dextrano puede arreglar ("mini rubí"). Ambos colorantes tienen el mismo peso molecular, sino que debe ser colocado en las neuronas. Amplio campo de la imagen sólo permite una resolución espacial muy limitada, por lo tanto se recomienda para investigar las estructuras teñidas después del experimento mediante microscopía confocal de barrido.
- Después de las mediciones fisiológicas, diseccionar el cerebro y fijar.
- Enjuague en PBS y se deshidratan por pasos en el etanol y el salicilato de metilo en claro.
- Por microscopía confocal incrustar en el cerebro salicilato de metilo.
- Nosotros usamos un microscopio Leica TCS SP2. Longitud de onda de excitación es 543nm.
- Podemos escanear el cerebro con un objetivo de inmersión en aire o aceite y comparar las estructuras teñidas con los datos de imagen.
Los resultados representativos:
Si la coloración y la preparación se ha realizado correctamente, la señal en la escala de colores falsos, por ejemplo, en las neuronas de setas cuerpo alfa lóbulo extrínseca, se vería así en la figura 1.
La respuesta conductual (PER) se puede calcular como la frecuencia de pico durante el estímulo menos frecuencia pico antes de que el estímulo (figura 2).
Las estructuras teñidas pueden ser investigados con mayor detalle mediante un microscopio confocal (Figura 3).

Figura 1: Representante de las señales de imágenes de calcio (estimulación con heptanal). R: Toma de imágenes de la región del cerebro de las abejas. B: imagen Raw fluorescentes como se ve a través de una inmersión X20 objetivo en la longitud de onda de excitación 380 nm, la alfa-lóbulo del cuerpo de setas se describe en la púrpura. Se inyectó en el borde ventro-lateral de los lóbulos alfa-para teñir las neuronas extrínsecas. C: Imagen en falso color deriva de la media de la señal, deltaF (340/380), en el estímulo de tres segundos, la alfa-lóbulo se indica en morado, seleccionados ROI delineados en negro. D: Dinámica temporal de la señal de calcio en respuesta a la estimulación olor, señal promedio de la región de interés, como se indica en el C. E: Dinámica temporal de la señal de calcio en respuesta a la estimulación de sacarosa de la ipsilateral y la antena contra-lateral, respectivamente, al retorno de la inversión indicada en C.

Figura 2: Representante M17 respuesta. Después del acondicionamiento olfativa de la abeja se extiende la probóscide, cuando el olor se presenta sin recompensa. La línea roja indica el estímulo del olor. Recuadro: PER de la abeja.
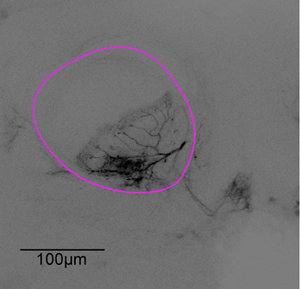
Figura 3: pila de imágenes Representante. Después del experimento de imágenes del cerebro se diseccionó. La neurona de la figura 1 se analiza con un microscopio confocal con un objetivo de inmersión en aceite de X20, la alfa-lóbulo se indica en morado.
Discusión
En esta presentación se han seguido todos los pasos necesarios para investigar en las señales de calcio in vivo en la abeja melífera. Hemos aplicado esta técnica a las neuronas del cuerpo de hongos, pero las imágenes se puede realizar en todas las neuronas que puede ser una técnica de tinción establecida. Nos hemos centrado en las neuronas de la vía olfativa de la abeja de la miel. Los experimentos son realizados en un cuarto oscuro. La puesta en marcha se ilumina con una luz de onda l...
Agradecimientos
Este trabajo está financiado por la DFG.
Materiales
| Name | Company | Catalog Number | Comments |
| low melting point hard wax Deiberit 502 | Dr. Böhme Schöps Dental GmbH | ||
| FURA-2 dextran potassium salt, 10 000 MW | Invitrogen | F-3029 | Protect from light. |
| tetramethylrhodamine dextran 10 000 MW | Invitrogen | D-3312 | Protect from light. |
| n-eicosane | Sigma-Aldrich | 21, 927-4 | |
| Kwik Sil Adhesive | World Precision Instruments, Inc. | KWIK SIL | |
| Imaging Set-up | TILL Photonics | ||
| CCD camera | Imago | ||
| CED | Texas Instruments |
Referencias
- Joerges, J., Küttner, A., Galizia, C. G., Menzel, R. Representations of odors and odor mixtures visualized in the honeybee brain. Nature. 387 (6630), 285-288 (1997).
- Rehder, V. Quantification of the honeybee's proboscis reflex by electromyiographic recordings. J. Insect Physiol. 33, 501-507 (1987).
- Galizia, C. G., Vetter, R. S., Christensen, T. A. Optical Methods for Analyzing Odor-Evoked Activity in the Insect Brain. Methods in Insect Sensory Neuroscience. , 345-388 (2004).
- Mauelshagen, J. Neural correlates of olfactory learning paradigms in an identified neuron in the honeybee brain. J Neurophysiol. 69 (2), 609-625 (1993).
- Kuwabara, M. Bildung des bedingten Reflexes von Pavlovs Typus bei der Honigbiene Apis mellifica, Hokaido Univ. Zool. J. Sci. 13, 458-464 (1957).
- Bitterman, M. E., Menzel, R., Fietz, A., Schafer, S. Classical conditioning of proboscis extension in honeybees (Apis mellifera. Journal of Comparative Psychology. 97 (2), 107-119 (1983).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados