Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Rápido y sensible coloidal Coomassie G-250 La tinción de proteínas en geles de poliacrilamida
En este artículo
Resumen
Este vídeo se popularizar un Coomassie coloidal G-250 protocolo de tinción de acuerdo con Kang Et al. Para la detección de la proteína promedio de 4 ng en geles. La tinción se completa en 2 horas y sin ningún esfuerzo. Nosotros usamos el protocolo de Kang para fines de análisis en gel a base de la proteómica.
Resumen
Coomassie Brilliant Blue (CBB) es un colorante utilizado para la visualización de proteínas separadas por SDS-PAGE, que ofrece un procedimiento de tinción simple y cuantificación de alta. Además, es totalmente compatible con la identificación de proteínas por espectrometría de masas. Pero a pesar de estas ventajas, el BCB se mira para ser menos sensible que la plata y coloraciones de fluorescencia y por lo tanto, rara vez se utiliza para la detección de proteínas en analíticas proteómicas a base de gel.
Mejoras en varios de los originales una Coomassie protocolo se han hecho para aumentar la sensibilidad de la broca. Dos importantes modificaciones fueron introducidas para mejorar la detección de proteínas poco abundantes mediante la conversión de las moléculas de colorante en las partículas coloidales: En 1988, Neuhoff y sus colegas aplicaron 20% de metanol y una mayor concentración de sulfato de amonio en el CBB G-250 basado en solución de tinción 2, y en 2004 al Candiano et. establecido con Blue Silver CBB G-250 con ácido fosfórico en la presencia de sulfato de amonio y metanol 3. Sin embargo, todas estas modificaciones sólo permiten una detección de la proteína de aproximadamente 10 ng. Un protocolo muy fameless para la tinción de Coomassie coloidal fue publicado por Kang et al. En 2002 en el que modificaron coloidal Neuhoff el protocolo de tinción con respecto a la CBB complejantes. En lugar de sulfato de amonio se utiliza sulfato de aluminio y el metanol fue sustituido por el 4 de etanol menos tóxicos. La base de aluminio nuevas manchas en el estudio de Kang mostró mayor sensibilidad que detecta tan bajo como 1 ng / banda (fosforilasa b) con una variación poco de sensibilidad en función de las proteínas.
En este sentido, demostrar la aplicación del protocolo de Kang para la tinción coloidal rápida y sensible de Coomassie de proteínas en la realización de análisis. Vamos a ilustrar el protocolo rápida y sencilla con dos dimensiones geles realizada de forma rutinaria en nuestro grupo de trabajo.
Protocolo
Parte 1: en dos dimensiones (2-D) usando electroforesis en gel de taza de carga
- IPG-tira la rehidratación y el isoelectroenfoque (IEF)
- Rehidratar geles Immobiline DryStrip, pH 6-11 (7 cm) en más de 125 soluciones de rehidratación l [7 M urea, 2 M tiourea, CHAPS 4%, 50 mM hydroxyethyldisulfide y el 2% IPG Buffer pH 6.11] utilizando la bandeja DryStrip Immobiline Reswelling para por lo menos 10 horas.
- Disolver la muestra proteína precipitada en tampón de muestra IEF [7 M urea, 2 M tiourea, CHAPS 2%, 2% de ASB-14, 50 hydroxyethyldisulfide mM y 2% IPG Buffer pH 6.11] correspondiente a la proteína de 60 a 100 mg por cada 100 l .
- Después de la solubilización (por lo menos 30 minutos a temperatura ambiente), aplicar la muestra a través de la proteína anódica taza de carga con copas de muestra. El volumen de la copa es de 100 l (vasos colectores permiten hasta 150 l).
Nota: puede cargar grandes cantidades de muestra si se inserta un paso de baja tensión en el comienzo del protocolo de centrarse y volver a llenar las copas, mientras que todavía hay una película de líquido en la copa! - Realizar isoelectroenfoque de 11.1 KVH en el modo de degradado en la unidad de electroforesis Multiphor II.
- Equilibrio y SDS-PAGE
- Después de IEF, las tiras IPG fueron sometidos a reducción y alquilación, cada vez 15 minutos en un agitador, utilizando el 1% y el 2,5% ditiotreitol yodoacetamida, respectivamente, en solución de equilibrio [50 mM Tris-HCl/pH 8,8, 6 M urea, glicerol al 30% y el 2% SDS].
- Enjuague las tiras de equilibrio con H 2 O y borrar ellas en papel Whatman para eliminar el exceso de tampón de equilibrado. Luego sumergir las tiras en SDS-funcionamiento de amortiguación (1X).
- La segunda dimensión se realiza mediante SDS-PAGE en un sistema de electroforesis vertical con una concentración de acrilamida total del 12%. Las tiras de IPG equilibrio se colocaron en la parte superior de los geles de separación y se fija con calor solución de agarosa [0,5% de agarosa en el funcionamiento de un tampón que contiene azul de bromofenol].
- Las proteínas fueron separadas de 2,5 horas, a partir de 80 V durante 15 minutos seguido de 120 V hasta que el frente tinte llega a la parte inferior de la cassette de gel.
Parte 2: tinción de Coomassie coloidal con CBB G-250
1. Soluciones de tinción
Nota: para la preparación de las soluciones de tinción, utilice productos químicos de alta calidad tales como la calidad analítica (pa) y agua de alta pureza que se obtiene de los sistemas de Millipore (agua Milli-Q).
| Coomassie solución: | ad 2000 ml H 2 O | |
| 0,02% (w / v) | CBB G-250 | 0,4 g |
| 5% (w / v) | sulfato de aluminio (14-18)-hidrato | 100 g |
| 10% (v / v) | etanol (96%) | 200 ml |
| 2% (v / v) | de ácido ortofosfórico (85%) | 47 ml |
- Nota: para la preparación de la solución colorante, la adición secuencial de los componentes en el siguiente orden tiene que ser mantenido:
- primero disolver el sulfato de aluminio en agua Milli-Q
- después añadir etanol, homogeneizar y mezclar CBB G-250 a la solución
- en fecha tan reciente como la solución esté completamente disuelto, añadir ácido fosfórico (la incorporación de los ácidos de los medios de comunicación permite a las moléculas de alcohol Coomassie agregado a su estado coloidal)
- finalmente se llenan de agua Milli-Q
Nota: la solución final tiene una coloración verde oscuro azulado aspecto y está lleno de partículas nadando a su alrededor:
- No filtrado esta solución!
- Si ha cambiado el orden de la preparación, se llega a una solución más violeta-azulado que es menos sensible.
| Decoloración de solución: | ad 2000 ml H 2 O | |
| 10% (v / v) | etanol (96%) | 200 ml |
| 2% (v / v) | de ácido ortofosfórico (85%) | 47 ml |
2. Procedimiento de tinción
- Después de la separación segunda dimensión, retirar con cuidado el gel de las placas de vidrio y transferirlos a un plato lleno de manchas agua Milli-Q.
- Lavado de los geles de tres veces con agua Milli-Q durante 10 minutos en un agitador horizontal (lavado insuficiente hace que la baja sensibilidad ya que el resto de SDS en los geles perturba la delimitación del colorante a la proteína).
- Agite la solución de Coomassie antes de su uso para dispersar las partículas coloidales de manera uniforme.
- Incubar los geles bien cubiertos con la solución de Coomassie por la agitación en un agitador durante 2-12 horas. Esta tinción de fondo genera marginal para que pueda observar el progreso de manchas en el medio.
Nota: después de 10 minutos se pueden ver manchas de proteínas que aparecen primero, dentro de las 2 horas de incubación de manchar el 80% de su máximo nivel se ha completado. Para la tinción de casi el 100%, incubación durante la noche se recomienda. En algunos casos, cuando la cantidad de proteínas que ha manchado es enorme y la solución se convierte en un azul brillante, una actualización de la solución de tinción es necesario. - Después de que el procedimiento de tinción de extraer la solución de Coomassie y enjuague los geles dos veces con agua Milli-Q.
Nota: puede volver a utilizar la solución de tinción, siempre y cuando las partículas están todavía pendientes, de lo contrario, descarte (tenga en cuenta que el laboratorio puede tener una reglamentación especial para la eliminación de residuos). - Eliminar las partículas de colorante se pegue en el plato la tinción con un paño y una toalla de papel destain de 10 a 60 minutos.
Nota: También puede lavar el gel sólo con agua Milli-Q, pero esto se recomienda sólo para los geles de preparación debido a que tendrá una duración de una película irregular, débil Coomassie de los geles que se presentarán durante el proceso de escaneado. - Por último, enjuagar los geles dos veces con agua Milli-Q: los geles llegará a su espesor original (el medio ácido con el alcohol hace que la reducción de gel) y la neutralización en el agua, además, aumenta la intensidad de color de Coomassie.
Parte 3: Los resultados representativos
Si usted sigue el protocolo descrito anteriormente obtendrá en el 2-D gel distintivo resuelto y se tiñen y las manchas oscuras de proteínas azul. Incluso en comparación con un gel 2-D se tiñeron con plata de acuerdo a Shevchenko et al. 5, un protocolo de reclamar una buena sensibilidad y la compatibilidad con la espectrometría de masas, podemos lograr los mismos resultados de tinción.
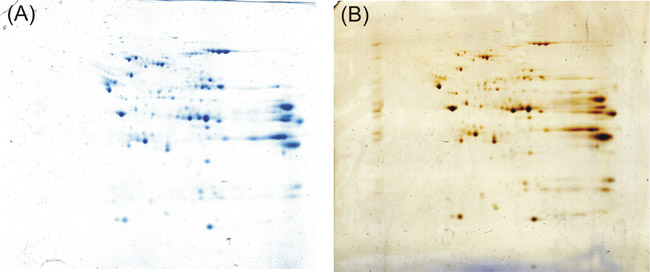
Figura 1: Resultado final de la experimentación se ha descrito anteriormente. Coomassie Kang protocolo (A) lleva a cabo con fuerza, como la tinción de plata de acuerdo a Shevchenko et al. (B) en la detección de las proteínas después de 2-D electroforesis en gel.
Parte 4: Consejos y trucos
- Realizar algunas coloraciones de prueba antes de procesar sus propias muestras. Por razones inexplicables a veces nos informó que una proteína de interés no puede ser detectado con éxito, incluso cuando se han aplicado miligramos. En este caso se recomienda para preparar algunas series de dilución para prueba de sensibilidad.
- Si usted tiene bajos en gel de detección de la proteína (s) en la transferencia general, sin éxito desde el apilamiento a la separación de gel durante la SDS-PAGE, posiblemente, será la razón. Puede comprobar si tales proteínas adhesivas mediante la tinción del gel completo, incluyendo la zona de apilamiento.
- Para una verificación rápida de los resultados de isoelectroenfoque, usted directamente puede manchar las tiras de IPG-sin ninguna separación segunda dimensión adicional.
- De vez en cuando a su vez los geles durante el procedimiento de tinción para que se tiñen uniformemente por ambos lados (si sigues los geles impasible, el tinte sólo se une a un lado del gel).
- Hemos experimentado que el almacenamiento de la solución colorante en un frasco oscuro aumenta su vida útil (en botellas transparentes de hasta 4 meses).
- Después de la tinción y la documentación que pueda mantener los geles en la nevera durante varios años (si se añade una solución ácida que evitar la contaminación por hongos).
- Decoloración de los tapones de gel para un tríptico resumen puede ser acelerado por el calentamiento en un calentador de bloque.
Access restricted. Please log in or start a trial to view this content.
Discusión
Innovadora o simplemente un protocolo de Coomassie?
Por el momento existen varios protocolos para los procedimientos de tinción con Coomassie Brilliant Blue. La mayoría de ellos consecuencia de las modificaciones de menor o mayor de uno de los protocolos más utilizados por Neuhoff y colegas 2. También protocolo Kang está basado en la fórmula de Neuhoff. Pero en realidad es un método alternativo de Coomassie tinción para la investigación proteómica? Vamos a imagen dos cue...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Agradecemos al Dr. Nicola Wiethölter para la preparación y tinción de 1-D geles.
Este trabajo fue financiado por una beca de la Deutsche Forschungsgemeinschaft (GRK 1089/project 5 a ND y SM) y apoyado por una beca de investigación de la Fundación para Manchot Jürgen Key.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Nombre del producto | Empresa | Catálogo N º | Comentarios |
| Para el IEF y SDS-PAGE: | |||
| Immobiline DryStrip geles | GE Healthcare | 17-6001-94 | Se puede utilizar incluso dos años después de la fecha de caducidad. |
| Immobiline DryStrip Reswelling bandeja | GE Healthcare | 80-6371-84 | No utilice disolventes orgánicos. Diseñado para 7-18 cm IPG tiras. |
| Immobiline DryStrip Kit | GE Healthcare | 18-1004-30 | Incluye una bandeja de electrodos, porta-electrodos, un ánodo y el cátodo, alineador y un bar de la Copa de la muestra y copas de muestra. |
| EPS 3501 XL fuente de alimentación | GE Healthcare | 18-1130-05 | Fuentes de voltaje de hasta 3500 V. |
| Multiphor II unidad de electroforesis | GE Healthcare | 18-1018-06 | Electrodos móviles permiten IEF en tiras IPG de toda la longitud (24.07 cm IPG strips) |
| PerfectBlue gel sistema de doble S | Peqlab | 45-1010-C | SDS-PAGE en 10x10 cm mini-gel de formato. Gel de la cámara incluye un sistema de refrigeración. |
| De Coomassie coloidal G-250 tinción: | |||
| tinción con tapas de cierre | VWR | 216-3412 | Se adapta para mini-geles. Apilables en la coctelera. |
| sulfato de aluminio-18-hidrato | Merck | 1.01102.5000 | Hicimos mejor experiencia con Merck. Sólo disponible en el paquete de 5 kg. |
| de ácido ortofosfórico | Prolabo | 20 624.295 | Se vende en botellas de vidrio. |
Referencias
- Fazekas de St Groth, S., Webster, S. R. G., Datyner, A. Two new staining procedures for quantitative estimation of proteins on electrophoretic strips. Biochim. Biophys. Acta. 71, 377-391 (1963).
- Neuhoff, V., Arold, N., Taube, D., Ehrhardt, W. Improved staining of proteins in polyacrylamide gels including isoelectric focusing gels with clear background at nanogram sensitivity using Coomassie Brilliant Blue G-250 and R-250. Electrophoresis. 9, 255-262 (1988).
- Candiano, G., Bruschi, M., Musante, L., Santucci, L., Ghiggeri, G. M., Carnemolla, B., Orecchia, P., Zardi, L., Rigetti, P. G. Blue Silver: A very sensitive colloidal Coomassie G-250 staining for proteome analysis. Electrophoresis. 25, 1327-1333 (2004).
- Kang, D., Gho, S. G., Suh, M., Kang, C. Highly Sensitive and Fast Protein Detection with Coomassie Brilliant Blue in Sodium Dodecyl Sulfate-Polyacrylamide Gel Electrophoresis. Bull. Korean Chem. Soc. 11, 1511-1512 (2002).
- Shevchenko, A., Wilm, M., Vorm, O., Mann, M. Mass spectrometric sequencing of proteins silver-stained polyacrylamide gels. Anal. Chem. 68, 850-858 (1996).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados