Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El trasplante heterotópico traqueal y ortotópico en ratones utilizados como modelos para estudiar el desarrollo de la enfermedad de las vías respiratorias obliterante
En este artículo
Resumen
Este video muestra y se comparan dos modelos experimentales para estudiar el desarrollo de la enfermedad de las vías respiratorias obliterante (OAD) en ratones, el modelo de trasplante heterotópico traqueal y ortotópico.
Resumen
Obliterante las vías respiratorias enfermedad (OAD) es la complicación más importante después de un trasplante de pulmón que los límites de la supervivencia a largo plazo (1-7).
Para el estudio de la fisiopatología, tratamiento y prevención de los modelos de OAD, animales diferentes de trasplante de tráquea en los roedores se han desarrollado (1-7). Aquí, hemos utilizado dos modelos establecidos de transplante de tráquea, el modelo ortotópico y heterotópico y demostrar sus ventajas y limitaciones.
Para el modelo heterotópico, la tráquea del donante se envuelve en el epiplón mayor del receptor, mientras que el donante la tráquea se anastomosa por anastomosis término-a-extremo en el modelo ortotópico.
En ambos modelos, el desarrollo de lesiones histológicas similares a obliterante OAD clínicos se ha demostrado (1-7).
Este vídeo muestra cómo llevar a cabo tanto, el heterotópico, así como la técnica de trasplante ortotópico traqueal en ratones, y se compara la evolución temporal del desarrollo de AOD en ambos modelos con la histología.
Protocolo
- Mujer ratones Balb / C (8-12 semanas) son adquiridos de Charles River Laboratories (Sulzfeld, Alemania). Los ratones se encuentran en condiciones convencionales, alimentados con comida estándar de ratones y agua ad libitum.
- 2% Isofluran se utiliza para la anestesia.
PREPARACIÓN DE LOS DONANTES
- Afeitar el vello abdominal y desinfectar el área con betaisodona.
- Bajo visión microscópica, realizar una incisión cervical desde el nivel de la laringe con el esternón.
- Quitar la grasa subcutánea y los músculos de la correa para obtener una visión clara de la tráquea.
- Disecar la tráquea de los tejidos circundantes, como el esófago, los nervios, arterias y tejido conectivo.
- Retire toda la tráquea (desde la laringe hasta la bifurcación).
- Enjuague bien el trasplante con una solución salina fría y guardar el injerto a 4 ° C.
- El donante es la eutanasia por dislocación cervical después de la cosecha de la tráquea.
BENEFICIARIO: trasplante heterotópico
- Afeitar el vello abdominal en un amplio margen alrededor de la incisión y desinfectar la zona tres veces con betaisodona (betadine), seguido por el alcohol. Los ojos deben ser lubricados con un producto de ungüento oftálmico para evitar que las córneas que se sequen.
- Realizar una laparotomía media y el lugar en el intestino en un guante estéril y humectada.
- Difundir el epiplón mayor cuidado. Coloque el injerto en el centro y fijar con una sola sutura con 8-0 (Prolene, Ethicon, Alemania).
- Cubren totalmente el trasplante con el epiplón mayor y fijar el injerto con una sola sutura 8-0 (Prolene, Ethicon, Alemania).
- Reubicar a los intestinos en el abdomen y lave con solución salina tibia y estéril antes del cierre.
- Cerca de dos capas - pared abdominal y la capa de la piel con un patrón continuo con prolene 7-0 para el músculo y Vicryl 7-0 para la piel.
BENEFICIARIO: trasplante ortotópico
- Afeitar el vello abdominal en un amplio margen alrededor de la incisión y desinfectar la zona tres veces con betaisodona (betadine), seguido por el alcohol. Los ojos deben ser lubricados con un producto de ungüento oftálmico para evitar que las córneas que se sequen.
- Divide los músculos correa para visualizar el complejo laringotraqueal completa.
- Diseccionar cuidadosamente la tráquea de los tejidos circundantes, tenga cuidado para preservar los nervios laríngeos recurrentes.
- Divide la tráquea tres anillos de caudal desde el cricoides. El animal mantiene la respiración fisiológica a través de la traqueotomía.
- Asegúrese de limpiar los bordes de la tráquea en el receptor, así como en el injerto.
- El injerto se interpone entre el receptor defectos traqueal y orientado a mantener la polaridad anatómica.
- Utilizando 8-0 (Prolene, Ethicon, Alemania) anastomosis del injerto donante con la parte distal (mediastino) tráquea. La cara posterior de la anastomosis se realiza en forma continua en funcionamiento. La cara anterior se completa con puntos de sutura interrumpida.
- Eliminar las secreciones de las vías respiratorias.
- La anastomosis proximal se completa en la misma forma que la distal.
- Asegurar la integridad de las vías respiratorias y la respiración adecuada y espontánea.
- La ubicación de la correa de los músculos y cerrar el tejido subcutáneo y la capa de la piel con suturas 6-0 (Vicryl, Ethicon, Alemania) con un patrón continuo.
- El uso de anestesia por inyección para el destinatario, por lo tanto, el animal mantendrá la respiración fisiológica a través de la tráquea. Una combinación de 75/1/0.2 mg / kg de propofol, medetomidina y fentanilo, respectivamente, se utiliza para la anestesia ip en ratones.
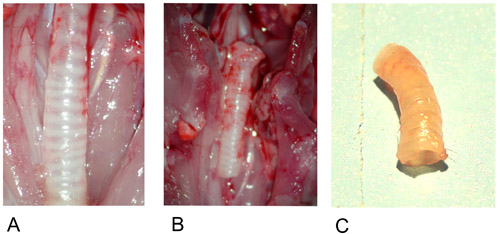
Figura 1: donantes tráquea.
1A: Donantes tráquea in situ después de la preparación.
1B: tráquea extirpada de los donantes.
1C: Donantes tráquea después de la explantación.
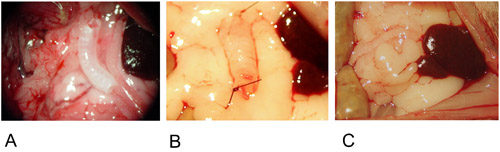
Figura 2: Modelo heterotópico.
2A: El injerto se coloca en el centro del epiplón mayor.
2B: El injerto se fija en ambos extremos con una sutura simple.
2C: El injerto se envuelve en el epiplón mayor y se fija con una sutura simple.
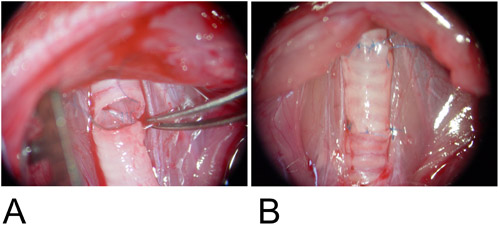
Figura 3: Modelo ortotópico.
3A: El injerto se interpone entre el receptor defectos traqueal y la pared posterior se anastomosa en forma continua en funcionamiento.
3B: La pared anterior se completa con una sola sutura.
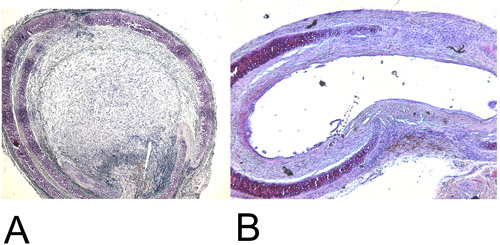
Figura 4: Histología.
4A: Reformado tráquea trasplantada heterotópico después de 28 días en la estación H + Enando (15x). Tenga en cuenta la destrucción del 100% luminal.
4B: Reformado tráquea trasplantada ortotópico después de 60 días en la tinción H + E (15x). Obliteración luminal máximo alcanzado es de aproximadamente 45%.
| Modelo heterotópico trasplante traqueal | Modelo ortotópico de trasplante traqueal | |
| Ventajas | + Fácil para llevar a cabo + Obliteración luminal con oclusión completa las vías respiratorias después de 28 días + No hay afecto físico de los animales por el OAD | + Física ventilación del injerto + Administración de fármacos inhalados posible + Fuertes reacciones inmunológicas como la producción de anticuerpos IgM aloreactivas + Torácica medio fisiológico + Traqueal-traqueal anastomosis imita a la práctica clínica |
| Desventajas | - No había ventilación de la tráquea trasplantada - No hay evaluación de patógenos inhalados posible - La inhibición de la depuración mucociliar y retención de secreciones - Microambiente peritoneal en lugar de medio torácica | - Formación necesaria quirúrgica - Obliteración luminal con aplicación de la oclusión luminal. 45% después de 60 días - Los animales pueden desarrollar síntomas de la OAD |
Tabla 1: Ventajas y desventajas del trasplante heterotópico traqueal y ortotópico.
Discusión
Los ratones están disponibles en diferentes transgeneic y el modelo de octavos de final, y por lo tanto, adecuado para estudiar las cuestiones relacionadas con la mecánica OAD (4).
Ambos modelos de trasplante de tráquea se muestra en este video se puede utilizar como modelos confiables para estudiar el desarrollo OAD.
Sin embargo, cada modelo muestra las ventajas y limitaciones.
El trasplante traqueal heterotópico es fácil de realizar y no requiere de entr...
Divulgaciones
Sonja Schrepfer ha recibido una beca de investigación de la Deutsche Forschungsgemeinschaft (DFG) (SCHR992/3-1).]
Todos los animales recibieron cuidados humanos de conformidad con los Principios de Cuidado de Animales de laboratorio, los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por la Sociedad Nacional de Investigaciones Médicas y la Guía para el Cuidado y Uso de Animales de Laboratorio publicado por la Institutos Nacionales de Salud (National Institutes of Health publicación 85-23, revisado 1985).
Todos los animales se obtuvieron de Charles River Laboratories (Sulzfeld, Alemania) y se mantuvieron en las instalaciones de cuidado de los animales del Hospital Universitario de Eppendorf en Hamburgo. Los animales recibieron comida estándar y agua ad libitum.
Agradecimientos
Los autores agradecen a Christiane Pahrmann (Lab Manager).
Referencias
- Adams, B., Berry, G., Huang, X., Shorthouse, R., Brazelton, T., Morris, R. Immunosuppressive therapies for the prevention and treatment of obliterative airway disease in heterotopic rat trachea allografts. Transplantation. 69, 2260-2266 .
- Adams, B., Brazelton, T., Berry, G., Morris, R. The role of respiratory epithelium in a rat model of obliterative airway disease. Transplantation. 69, 661-665 .
- Deuse, T., Schrepfer, S., Reichenspurner, H., Hoyt, G., Fischbein, M., Robbins, R., Pelletier, M. Techniques for experimental heterotopic and orthotopic tracheal transplantations – when to use which model; Transplant Immunology 17. , 255-261 (2007).
- Hele, D., Yacoub, M., Belvisi, M. The heterotopic tracheal allograft as an animal model of obliterative bronchiolitis. Respiratory Research. 2, 169-183 .
- Hertz, M., Jessurun, J., King, M., Savic, S., Murray, J. Reproduction of the obliterative bronchiolitis lesion after heterotopic transplantation of mouse airways. American Journal of Pathology. 142, (1993).
- McDyer, J. Human and murine obliterative bronchiolitis in transplant. Proceedings of the American Thoracic Society. 4, 37-43 .
- Schrepfer, S., Deuse, T., Hoyt, G., Sheikh, A., Hoffmann, J., Reichenspurner, H., Robbins, R., Pelletier, M. Experimental orthotopic tracheal transplantation: the stanford technique. Microsurgery. 27, 187-189 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados