Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes in vivo de Deep capas corticales con un microprisma
En este artículo
Resumen
En ángulo recto microprismas insertado en la corteza cerebral del ratón permite obtener imágenes profundas de múltiples capas corticales con un punto de vista típicamente se encuentran en el segmento. De un milímetro microprismas ofrecen un campo de visión amplio (~ 900 m) y resolución espacial suficiente para resolver las espinas dendríticas. Demostramos capa de imagen V neuronal y vascular mediante imágenes neocortical microprismas.
Resumen
Se presenta un protocolo de imágenes in vivo del tejido cortical mediante una sonda de imagen cerebral profunda en la forma de un microprism. Microprismas son de 1 mm de tamaño y tienen una capa reflectante de la hipotenusa para que la reflexión interna de la excitación y de emisión de luz. La sonda microprism simultáneamente múltiples imágenes de las capas corticales con una perspectiva general, visto sólo en los preparativos de división. Las imágenes se recogieron con un gran campo de visión (~ 900 m). Además, se proporcionan detalles sobre el procedimiento quirúrgico no la supervivencia y la configuración del microscopio. Los resultados representativos incluyen imágenes de la capa V neuronas piramidales de Thy-1-H YFP ratones que muestran sus dendritas apicales se extiende a través de la capa cortical superficial y se extiende a mechones. Resolución fue suficiente para las espinas dendríticas de imágenes cerca de la soma de la capa de neuronas V. Una inyección de cola vena de un colorante fluorescente revela la intrincada red de vasos sanguíneos en la corteza. De exploración lineal de los glóbulos rojos (GR) que fluye a través de los capilares revela la velocidad de glóbulos rojos y las tasas de flujo se pueden obtener. Esta sonda microprism novela es un método elegante, el nuevo y potente de visualizar profundidad las estructuras celulares y la función cortical en vivo.
Protocolo
Parte 1: Óptica microprismas y configuración del microscopio
- El microprismas que utilizamos son de 1 mm, en ángulo recto a partir de prismas de cristal BK7 comprados a la Corporación Optosigma (Figura 1). Microprismas se manejan con las pinzas siempre que sea posible.
- La hipotenusa del microprism está recubierta con plata mejorado para proporcionar una reflectividad superior a 97% 400 a 2000 nm. Esto proporciona la reflexión interna de los dos la luz de excitación láser y la fluorescencia emitida.
- Microprismas siempre son manejados con pinzas si es posible. Se usan guantes en todo momento para mantener el prisma limpio.
- Utilizamos una costumbre-construido de dos fotones microscopio capaz de pequeños animales de imagen. El animal, que se adjunta al dispositivo de estereotaxia, se coloca en un escenario de 3 ejes motorizados.
- El microscopio está conectado a un PC con Windows con software scanimage. Scanimage es un software de adquisición de imágenes en Matlab por Pologruto et al 1.
- Para obtener imágenes de microprismas, recopilamos las imágenes con una resolución de 1024 x 1024 o 512 x 512 píxeles. Además, típicamente escanean a los 2 ms / línea y 4 ms / línea.
- Hay dos tipos de objetivos son utilizados en los experimentos:
- A la baja apertura numérica (NA) de aire para todo el objetivo de imágenes de campo de visión (ver la tabla de reactivos y equipos).
- Un alto NA objetivo de aire con un collar de corrección de vidrio capaz de minimizar las aberraciones esféricas inducidas por 0-2 mm de vidrio (véase la tabla de reactivos y equipos).
- Cuando el animal está listo para la imagen en un objetivo de bajo aumento, alinear el patrón de trama cuadrada de escaneo de láser con la parte superior de la microprism. Esto le ayudará a orientar a la imagen y hacer un uso eficiente de la potencia del láser.
- El uso de un mayor objetivo de NA con un collar de cristal de corrección, ajuste el collar de corrección para corregir aproximadamente 1 mm de vidrio. Una vez que una imagen fluorescente aparece durante el experimento, un cuidado puede alcanzar en el interior del microscopio con el fin de optimizar el collar de corrección para maximizar la resolución de imagen.
Parte 2: la supervivencia Cirugía Animal e Inserción microprisma
- La duración del procedimiento, desde la incisión inicial hasta la finalización de la imagen, depende de los objetivos del experimento. Sin embargo, la colocación no la supervivencia de procedimiento quirúrgico y microprism se puede esperar que tomará aproximadamente 30 a 40 minutos para completar.
- Ratones (P30-P60) se pesan y se anestesiaron con una inyección adecuada de propiedad intelectual de la ketamina (100 mg / kg) y xilazina (10 mg / kg) a un plano adecuado para procedimientos quirúrgicos.
- A lo largo de todo el experimento, el animal debe ser revisado cada 15-20 minutos para evaluar su nivel de anestesia. Si el animal reacciona a una empresa puntera de sujetador, una dosis suplementaria de ketamina / xilazina es necesario. Normalmente, una dosis suplementaria es de un tercio de la dosis inicial y se puede preparar de antemano en una jeringa para inyección IP inmediata si es necesario.
- Una vez que el ratón está bien anestesiado, la mayoría de los pelos de la cabeza del animal se afeita con un condensador de ajuste con una cuchilla # 40.
- Nair ® se aplica a los pelos que queda en la cabeza para ayudar a crear una superficie libre de pelos que se pueden obtener en el camino de la microprism durante la exploración. Después de 5 minutos, el Nair ® se limpia con un hisopo de algodón.
- El animal anestesiado se coloca correctamente en un dispositivo de estereotaxia ratón. Durante los procedimientos quirúrgicos y sesiones de formación de imágenes del animal se mantiene en un agua llena de almohadilla térmica a 36 grados Celsius.
- Con la cabeza del animal bien colocado en su lugar, una incisión limpia se realiza con un bisturí en la línea media del cráneo para separar la piel.
- Una pequeña cantidad de peróxido de hidrógeno al 3% se coloca en un bastoncillo de algodón y se aplica en el cráneo para eliminar las membranas entre el cráneo y la piel.
- El peróxido de hidrógeno también ayuda a revelar bregma, un hito importante en saber dónde realizar la craneotomía y la inserción microprism.
- Antes de la craneotomía se inicia, las barras de bar morder la oreja y estén debidamente ajustados a la inclinación del cráneo expuesto de tal manera que es, básicamente, al nivel de la mesa. Esto proporciona una mejor plataforma para la craneotomía. Además, esto hace que la superficie superior de la perpendicular de prisma con la luz de excitación de entrada. Esto ayudará a minimizar las aberraciones ópticas, mientras que la imagen.
- Una pequeña fresa dental (~ 0,8 mm tamaño de la cabeza) está conectado a una herramienta Dremel ® utilizando un brazo de extensión flexible. Para craneotomías, que establece la velocidad a aproximadamente entre 7.000 y 10.000 revoluciones por minuto.
- La fresa dental es desnatada a lo largo del cráneo hasta una ranura cuadrada se establece en el hueso. Los lados de la plaza es de aproximadamente 2-3 mm de longitud y caudal centrada 1,5 mm y 1 mm lateral a bregma.
- Continuando con el adelgazamiento del hueso hasta una pequeña abertura se realiza a través del cráneo. Un par de pinzas de can levantar el colgajo óseo fuera del cráneo.
- La duración debe ser eliminado antes de la microprism puede ser insertado en la corteza. El sangrado se controla mejor al permitir que la sangre coagule en la superficie durante varios minutos. Después, la sangre coagulada se retira con una esponja quirúrgica antes de insertar el microprism.
- Para ayudar a ayudar a la alineación del prisma con la corteza, la cara vertical de la microprism es alineadas en paralelo con las asas de las pinzas.
- Con el prisma de considerar adecuadamente, el microprism todo se inserta hasta la parte superior del prisma esté al ras con la superficie neocortical.
- Cuando se inserta correctamente, el microprism debe permanecer en la posición correcta. Cualquier sangrado que se produce es mínima y puede ser absorbido con una esponja quirúrgica pequeña. Una vez que el prisma está en el lugar que el animal está listo para su imagen.
- Después de un microprism se ha utilizado en un animal, se puede volver a utilizar varias veces. Sin embargo, tiene que ser limpiado para eliminar cualquier resto de material biológico. Esto se puede lograr mediante la inmersión del prisma en un pequeño volumen de HCl ácido, seguido de un baño en metanol. El microprism limpieza puede ser envuelto en papel de la lente hasta su uso futuro.
Parte 3: Resultados de Representante

Figura 1: Imágenes de la microprism en ángulo recto. Prismas utilizados en este experimento son de un milímetro, prismas de vidrio BK7 con una capa de plata mejora de la hipotenusa para que la reflexión interna de la excitación y de emisión de luz.

Figura 2: Imagen de la capa de neuronas piramidales V YFP. Amplio campo de visión de imágenes con la microprism revela una gran población de cuerpos de las células piramidales ~ 800 a 900 m de profundidad desde la superficie cortical. Además, las dendritas apical se extiende hacia la capa I también se puede resolver. Barra de escala = 200 micras.
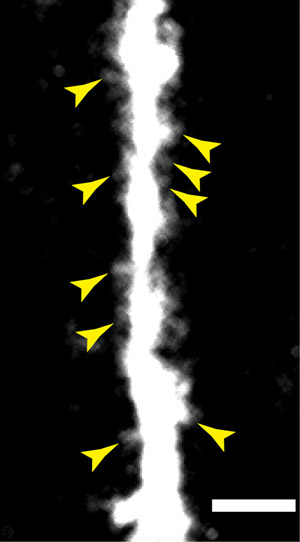
Figura 3: Un objetivo mayor apertura numérica que se utiliza en conjunción con el microprismas ofrece una resolución espacial suficiente para resolver las espinas dendríticas en las dendritas apicales en la capa V neuronas piramidales. Barra de escala = 10 micras.
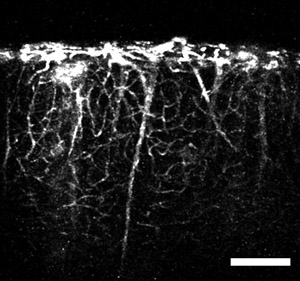
Figura 4: Una imagen obtenida con el microprism y una inyección de cola vena de un colorante fluorescente. La imagen muestra los vasos vertical, de gran calibre que se extiende desde las regiones profundas del cerebro y pequeños capilares se desvía a través del volumen cortical. Barra de escala = 200 micras.

Figura 5: El uso de un objetivo de mayor apertura numérica, la red de capilares en la neocorteza se pueden crear imágenes con mayor detalle. Barra de escala = 50 micras.
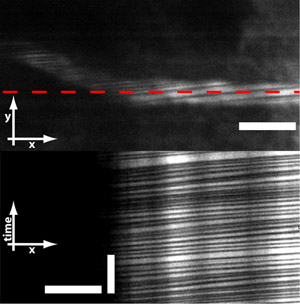
Figura 6: microprismas también permite que las células de imágenes rojos (GR) que fluye por los vasos. Los glóbulos rojos no absorben el colorante fluorescente y por lo tanto se ven como rayas oscuras en todo el buque. Por línea de exploración a través de la nave, se pueden obtener mediciones de flujo de glóbulos rojos y la velocidad. Barra de escala = 10 micras (barra horizontal en la imagen superior e inferior) y 250 ms (barra vertical en la imagen inferior).
Discusión
El uso de un microprism en un experimento de imágenes es relativamente sencillo y ofrece muchas ventajas para los estudios in vivo en el neocórtex. Ejemplos representativos de esta técnica incluyen imágenes tomadas de ratones transgénicos que expresan la proteína amarilla fluorescente en la capa de neuronas corticales V. Usando microprismas se puede ver una colección de grandes cuerpos de las células piramidales de la capa V, cerca de 1 mm por debajo de la superficie cortical. También se ve son las dendritas ap...
Divulgaciones
Los experimentos con animales se realizaron de acuerdo con las directrices y normas establecidas por IACUC la Universidad de Yale.
Agradecimientos
Damos las gracias a Anthony J. Koleske, PhD de proporcionar a los ratones YFP.
Materiales
| Name | Company | Catalog Number | Comments |
| With enhanced silver reflective coating-(R77) | OptoSigma Corp. (Santa Ana, CA) | 055-0010 | With enhanced silver reflective coating-(R77) |
| Fluorescein-dextran | Sigma-Aldrich | FD70 | 70 kDa |
| 0.28 NA, 4x air objective | Olympus Corporation | XLFLUOR 4x/340 | |
| 0.60 NA, 40x air objective | Olympus Corporation | LUCPLFLN | With 0-2 mm coverglass correction |
Referencias
- Pologruto, T. A., Sabatini, B. L., Svoboda, K. ScanImage: flexible software for operating laser scanning microscopes. Biomed Eng Online. 2, 13-13 (2003).
- Feng, G. Imaging neuronal subsets in transgenic mice expressing multiple spectral variants of GFP. Neuron. 28 (1), 41-41 (2000).
- Kleinfeld, D., Mitra, P. P., Helmchen, F., Denk, W. Fluctuations and stimulus-induced changes in blood flow observed in individual capillaries in layers 2 through 4 of rat neocortex. Proc Natl Acad Sci U S A. 95 (26), 15741-15741 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados