Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Imágenes en directo de Drosophila melanogaster Migraciones hemocitos embrionarias
En este artículo
Resumen
Hemocitos Drosophila se dispersan sobre la totalidad del embrión en desarrollo. Este protocolo demuestra cómo montar y la imagen de estas migraciones el uso de embriones con hemocitos marcados con fluorescencia.
Resumen
Estudios de dirección de muchas células de migración que utilizan
Protocolo
Preparación
- Obtener líneas apropiadas Drosophila contiene una hemocitos específicos Gal4 conductor (por ejemplo, SRP-Gal4 2) y un reportero codificada genéticamente fluorescente bajo el control de UAS (por ejemplo, UAS-GFP). Las moscas homocigóticas para SRP-Gal4, UAS-GMA 3 o CRQ Gal4, UAS-GFP 4, 5 son particularmente útiles para fines de imagen (Nota: GMA es GFP fusionada al dominio de unión a la actina moesina), ver más abajo para una discusión de el rango de los conductores y Gal4 UAS construcciones disponibles (el Centro de Bloomington archivo contiene una gran variedad).
- Cruces genéticos normalmente se llevan a cabo de tal manera que los alelos mutantes se equilibran con fluorescentes balanceadores CTG o TTG 6, con los conductores y Gal4 UAS construcciones realizadas en la alternativa de los cromosomas homólogos. Esto hace que sea posible seleccionar mutantes homocigotos sobre la base de la ausencia de CTG / TTG-asociados fluorescencia de GFP (esto se hace en la etapa de 2.11).
- Amplificar las acciones y las moscas de lugar en una jaula por la que se con una placa de agar de jugo de manzana 7. Las moscas se necesitan por lo menos dos días para aclimatarse a la jaula por la que se embriones antes de comenzar a ser lo suficientemente establecidas. En general dos mil moscas de cada sexo debe ser suficiente para generar embriones suficiente para obtener imágenes, pero hay que señalar que las diferentes líneas tienen diferentes grados de fertilidad. Utilizamos placas de Petri de 55 mm que se ajusten a la parte inferior de un vaso de plástico, han sido perforados en su base para permitir el flujo de aire. Los medios exactos de recogida de embriones no es importante, pero los tiempos son críticos con el fin de recoger correctamente organizado embriones.
- Recoger los embriones de una placa de agar durante la noche de jugo de manzana mantiene a 25 ° C o de una placa de tiempo. En este último caso se suelen permitir a las moscas para poner en un plato precalentado durante 4 horas, antes de retirar la placa y colocarlo a 18 ° C durante 15-16 horas antes del montaje de los embriones, lo que proporciona los embriones de etapa tardía de 12 a de la etapa 15 del desarrollo. Una placa de noche a la mañana contiene una mayor diversidad de etapas, pero ofrece la ventaja de niveles más altos de expresión reportero fluorescente en los hemocitos debido a un período de tiempo más largo a 25 ° C ya que el sistema Gal4-UAS es sensible a la temperatura.
Procedimiento
- Desalojar a los embriones de la placa de agar de jugo de manzana con una pequeña cantidad de agua y un pincel de punta blanda. Embriones desalojados se pueden ver fácilmente a simple vista.
- La transferencia de embriones a un colador celular (Fisher) o de fabricación casera cesta 7 vertiendo el agua de la placa de agar de jugo de manzana en la canasta a cabo durante un vaso para recoger las aguas residuales.
- Repita el paso 2.2 hasta que esté satisfecho tiene suficiente embriones transferidos de la placa de agar de jugo de manzana.
- Lavado de los embriones en células colador / cesta con agua.
- Coloque la celda filtro / canasta en la tapa una placa de Petri de la placa de agar de jugo de manzana y añadir suficiente cloro puro para suspender los embriones en el filtro de la célula / cesta.
- Siga dechorionation de los embriones en un microscopio de disección en campo claro: dechorionation se completa cuando los apéndices dorsales se han disuelto, lo que debe ocurrir dentro de dos minutos.
- Eliminar células filtro / canasta de embriones que contienen el cloro y cloro residual lavar con agua. Todos los rastros de cloro deben ser retirados antes de proceder al paso 2.8. Un truco para evaluar si todo el cloro se ha eliminado es para borrar el agua residual en los tejidos de laboratorio de color azul - si hay cloro residual el color azul se blanquea blanco / rosa.
- Borrar los restos de agua con los tejidos de laboratorio / mediwipes aplicado a la parte inferior de la celda de filtro / canasta.
- Coloque una gota de agua en una tapa de caja de Petri. Con un pincel fino, recoge todos los embriones dechorionated de la cesta de embriones y resuspender en la gota. A continuación secar los embriones por aspiración de agua utilizando una micropipeta o cuidado absorber con un pañuelo desechable de laboratorio / mediwipes.
- Una vez que los embriones se han secado, agregue una gota de aceite de voltalef para cubrir todos los embriones. Ponga una gota pequeña de aceite de segundo junto a la gota que contiene los embriones. Nota: no hemos sido capaces de encontrar un proveedor del Reino Unido de aceite voltalef; Halocarbono 700 (Sigma) se puede utilizar en su lugar.
- Bajo un microscopio de disección fluorescente seleccionar apropiadamente los embriones de las etapas genotipo deseado usando un par de pinzas de relojero (número 5) de la gota de aceite. Estas pinzas deben ser doblada hacia adentro (Figura 1) con el fin de recoger los embriones sin perforar la membrana vitelina. La transferencia de embriones seleccionados para la gota de aceite. Es importante que usted es capaz de ver hemocitos fluorescente en el microscopio de disección con el fin de ser capaz de recoger buenas imágenes en el microscopio confocal (Figura 2). Por lo general la etapa de montaje embriones 13/14 a la migración de imagen lateral de hemocitos en la línea media ventral o la etapa 15 embrionesa la imagen de la motilidad de los hemocitos siguientes dispersión sobre el embrión.
- Palo de dos cubreobjetos (18x18mm, espesor 1) en la parte inferior de un plato Petriperm / Lumox (Sarstedt), con 2 gotas de aceite de voltalef, dejando aproximadamente 1 cm entre ellos (Figura 3), que serán utilizados para apoyar un cubreobjetos colocado sobre los embriones, para no aplastarlos. Platos Petriperm (50 mm de diámetro) contienen un hidrófobo, permeable a los gases de la membrana. Nos encontramos con que los platos son más fáciles de utilizar, una vez que se han utilizado varias veces (los platos se pueden limpiar con un 70% de etanol y reutilizar).
- En campo claro en el microscopio de disección, recoger embriones seleccionados uno a uno con las pinzas y la línea inclinada que parte ventral y en paralelo al borde del cubreobjetos (Figura 3). Es posible alinear un máximo de 15 embriones de esta manera, dependiendo de su destreza y su paciencia. Es importante para manipular los embriones con cuidado ya que tanto los embriones y la membrana plato Petriperm son frágiles y se pueden romper fácilmente.
- Una vez que los embriones se alinean agregar una pequeña gota de aceite y deje que se extiende para formar una capa homogénea entre los dos cubreobjetos. Después de que el aceite se ha extendido (esto puede tardar unos minutos) comprobar que los embriones siguen siendo parte ventral hacia arriba. Si los embriones se han rodado un poco, a cambiar la posición de nuevo con las pinzas.
- Por último, con unas pinzas (número 3) colocar un cubreobjetos (18x18mm, espesor 1) sobre los embriones, que descansa sobre los dos cubreobjetos previamente adherido. Pegue esta cubreobjetos para el cubreobjetos admite el uso de esmalte de uñas (Figura 3).
- Sacar la fuente Petriperm con embriones montado en el microscopio confocal o de campo amplio y montar el plato Petriperm en el escenario con un adaptador apropiado. Ya sea un microscopio vertical o invertida se pueden utilizar, con la lente del objetivo a través del enfoque cubreobjetos (en oposición a través de la membrana).
Representante de Resultados:
Este protocolo describe cómo montar embriones de Drosophila para imágenes en vivo de hemocitos en la parte ventral del embrión. Si se hace correctamente, será fácil para generar tanto imágenes fijas o películas de hemocitos. El determinante principal es el microscopio usado la imagen de los hemocitos (en particular el objetivo), pero la naturaleza de las imágenes adquiridas también dependerá de la etapa de desarrollo, la temperatura de los embriones se levantó y se utiliza en las líneas Gal4 y UAS.
Mayores niveles de expresión de la proteína fluorescente permitirá hemocitos para obtener imágenes con mayor facilidad, por lo tanto, es importante ser capaz de ver hemocitos, cuando los embriones están en la etapa del protocolo de 2.11 (Figura 2 contiene ejemplos de hemocitos claro dentro de los embriones, tomadas con una cámara equipada con un microscopio de disección). Por lo tanto, el número cada vez mayor de Gal4 y construcciones UAS permitir una mayor relación señal-ruido. Además, este reduce la necesidad de láser de alta intensidad o tiempos de aumento de la exposición cuando la imagen, que a su vez permite que el comportamiento de hemocitos a seguir por períodos más largos de tiempo.
Niveles muy elevados de expresión de GFP se mostrarán los detalles finos de la morfología de hemocitos, especialmente la delgada hoja-como láminas que rodean el cuerpo de la celda circular (Figura 4-B). Regiones circulares excluyendo las buenas prácticas agrarias representan fagosomas (Figura 4-C). Dedo-como filopodios también se puede ver que salen de las láminas (Figura 4). Dos conductores Gal4 siguen siendo suficientes para ver estos procesos (Figura 4C), especialmente si uno o más es SRP-Gal4 (véase la discusión), sin embargo las velocidades más lentas de exploración o de mayor potencia del láser en el microscopio confocal puede ser requerida. Como disminuir los niveles de expresión se hace más difícil a la imagen de las protuberancias de hemocitos, sin embargo, aún es posible hacer un seguimiento de la migración de hemocitos en estas condiciones, como el cuerpo de la célula sigue siendo evidente, incluso cuando las protuberancias son menos claros (Figura 4).
En las primeras etapas de desarrollo (hasta la 13 ª etapa) hemocitos migrar en estrecho contacto entre sí y con frecuencia es difícil distinguir las células individuales. Al final de la 13 ª etapa hemocitos han formado una sola línea hasta la línea media ventral (Figura 5), entonces, cada vez más móviles, migran lateralmente a los bordes del cordón nervioso ventral (Figura 5). El citoesqueleto de actina en las protuberancias dinámica de hemocitos se puede observar directamente a través de la expresión de la GMA (Figura 5) o el cerezo moesina.
Montaje de los embriones de esta manera permite el intercambio de gases y evita la deshidratación y los embriones siguen siendo imágenes siguientes viable. Si el embrión es dañado durante el montaje es generalmente obvio que el contenido de embriones se fuga a través de su membrana vitelina. Si un embrión se inicia a deshidratarse entonces esto a menudo se puede ver por las deformaciones de la membrana vitelina. De vez en cuando un embrión rodará durante el curso de una película de intervalo, sin embargo, esto sólo tiende a ser problemático para las películas de más largo plazo de tiempo. Ultimoly, de montaje de varios embriones al mismo tiempo le da al experimentador la mejor oportunidad de obtener un embrión en la orientación ideal para su experimento.

Figura 1. Pinzas para la manipulación de embriones dechorionated.
Las puntas de los relojeros de fórceps (número, tamaño 5) debe ser doblada hacia adentro con el fin de diseñar una herramienta para recoger los embriones como se muestra aquí. La superficie externa de la región se inclinó también es útil para manipular embriones al colocar en la membrana Petriperm ya que no poseen bordes afilados que puedan perforar el embrión.
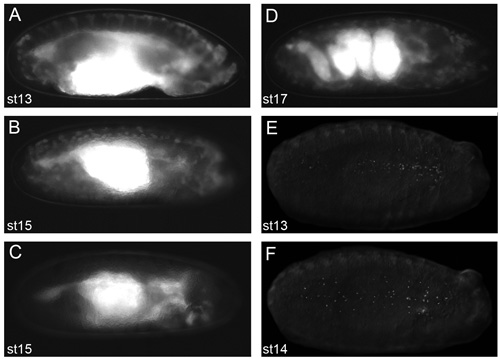
Figura 2. Imágenes representativas de los embriones que darán buenos resultados de las imágenes en vivo.
Las imágenes de embriones en el aceite de dechorionated voltalef (en la etapa de 2,11 del protocolo) tomadas en un microscopio de fluorescencia de disección. Vistas laterales de la 13 ª etapa (A) y la etapa 15 (B) srp-Gal4, UAS-GFP, CRQ-Gal4, UAS-GFP embriones. Vista lateral de una etapa de 15 SRP-Gal4, UAS-GFP / +; CRQ-Gal4, embrión uas-GFP/uas-N17Rac (C) en el que hemocitos no han podido migrar de la cabeza, lo que demuestra lo que los embriones verá como cuando hemocitos no son evidentes a lo largo de sus rutas migratorias. Vista lateral de una etapa de 17 SRP-Gal4, UAS-GFP, CRQ-Gal4, UAS-GFP embrión que muestra la estructura intrincada de la tripa en esta etapa de desarrollo (D), el inicio de la contracción muscular impide la formación de imágenes en vivo de los embriones más allá de este etapa de desarrollo. Puntos de vista ventral de la etapa 13 (E) y la etapa 14 (F) srp-Gal4, UAS-roja embriones aguijón que muestra la dispersión de los hemocitos con núcleos marcados con fluorescencia. La observación de hemocitos por fluorescencia en la etapa de 2,11 del protocolo es un requisito previo para obtener imágenes excelentes, anterior a la derecha para todas las imágenes.

Figura 3. Montaje de los embriones en un plato Petriperm / Lumox.
Dos cubreobjetos 18x18mm (espesor 1) se pegan a la cara inferior del plato Petriperm una gota pequeña de aceite, separadas por alrededor de 1 cm, como se muestra. Embriones son alineados con la parte ventral con su eje paralelo de longitud (anterior-posterior) de los bordes del cubreobjetos y se cubre con una pequeña gota de aceite. Una vez que el aceite se ha extendido para cubrir la brecha entre los dos cubreobjetos es suavemente un cubreobjetos tercera (grosor de 18x18mm 1) colocado en la parte superior de los embriones cubiertos de petróleo utilizando los dos cubreobjetos previamente adherido como un puente para evitar que los embriones se aplasten. Este portaobjetos se pega a los dos puentes cubreobjetos utilizando dos pequeñas gotas de esmalte de uñas. Una vez establecidos, los embriones se pueden visualizar en un microscopio en posición vertical o invertida, con la lente del objetivo centrado a través de los cubreobjetos (en oposición a través de la membrana Petriperm).
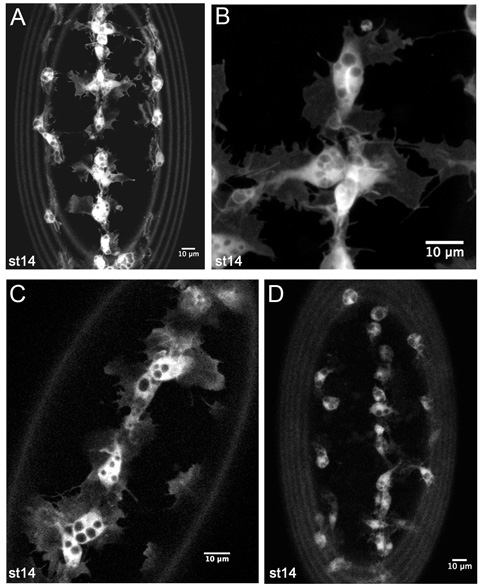
Figura 4. Los resultados representativos de la imagen en vivo de hemocitos GFP etiquetados.
Z-proyecciones de hemocitos en la parte ventral de una etapa de 14 SRP-Gal4, UAS-GFP, CRQ-Gal4, UAS-GFP embriones (AB). (A) es una imagen de menor aumento, como las utilizadas para controlar las migraciones en el desarrollo de hemocitos en las películas timelapse. (B) es un aumento aún mayor de hemocitos en la línea media ventral, mostrando los detalles finos de su morfología. (C) es un solo un trozo m de hemocitos en la línea media ventral en una etapa de 14 SRP-Gal4, UAS-GFP / +; CRQ-Gal4, UAS-GFP / + embrión, que revela que menor número de copias de los conductores y Gal4 UAS construcciones también son suficientes para generar buenas imágenes. (D) muestra un z-proyección de hemocitos en una etapa de 14 CRQ-Gal4, UAS-GFP embrión. Aquí salientes hemocitos son menos evidentes debido a la menor expresión de la GFP, pero aún es posible hacer cine y seguir la migración de hemocitos con esta combinación de Gal4 conductor y UAS construir. Las imágenes fueron tomadas con un microscopio confocal Leica LSM510; anterior es en todas las imágenes, los anillos en la periferia de las imágenes son causados por la autofluorescencia membrana vitelina.

Figura 5. Los resultados representativos de la imagen en vivo de hemocitos GMA expresa.
Z-proyecciones de hemocitos en la línea media ventral de la etapa 13 (A) y la 14 ª etapa (B) srp-Gal4, UAS-GMA embriones, tomadas de películas timelapse para mostrar las migraciones en el desarrollo de hemocitos. Información detallada sobre la dinámica de actina se puede obtener imágenes de mayor aumento de hemocitos GMA expresar (C). GMA se compone de GFP fusionada al dominio de unión a la actina de los filamentos de actina moesina y etiquetas. Anterior es en todas las imágenes, las imágenes fueron tomadas con un microscopio confocal.
Discusión
Los elementos más importantes de este procedimiento son la selección de embriones sanos con hemocitos claramente etiquetados y montarlos con cuidado, sin dañarlos. Una vez que los embriones se encuentran en el aceite de halocarbonos son resistentes a la deshidratación y una vez montado se pueden obtener imágenes durante varias horas. En nuestras manos podemos hemocitos imagen durante tres horas, con la deshidratación insignificante del embrión o del obvio foto-daño, teniendo un z-stack de imágenes cada tres min...
Agradecimientos
Este protocolo ha sido desarrollado a través de nuestro trabajo dentro y en colaboración con los laboratorios de Pablo Martín y Jacinto Antonio. Damos las gracias al Centro de archivo Bloomington por su excelente servicio y la comunidad de Drosophila para seguir compartiendo las líneas de vuelo. BS está financiado por una subvención para el proyecto BBSRC. WW es financiado por una beca de Wellcome Trust de Desarrollo Profesional.
Materiales
| Name | Company | Catalog Number | Comments |
| Cell strainer | BD Biosciences | 352350 | 70μm pores |
| Halcarbon oil 700 | Sigma-Aldrich | H8898 | |
| Lumox/Petriperm dish | Sarstedt Ltd | 96077305 |
Referencias
- Brand, A. H., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118, 401-415 (1993).
- Bruckner, K. The PDGF/VEGF receptor controls blood cell survival in Drosophila. Dev Cell. 7, 73-84 (2004).
- Dutta, D., Bloor, J. W., Ruiz-Gomez, M., VijayRaghavan, K., Kiehart, D. P. Real-time imaging of morphogenetic movements in Drosophila using Gal4-UAS-driven expression of GFP fused to the actin-binding domain of moesin. Genesis. 34, 146-151 (2002).
- Stramer, B. Live imaging of wound inflammation in Drosophila embryos reveals key roles for small GTPases during in vivo cell migration. J Cell Biol. 168, 567-573 (2005).
- Wood, W., Jacinto, A. Drosophila melanogaster embryonic haemocytes: masters of multitasking. Nat Rev Mol Cell Biol. 8, 542-551 (2007).
- Halfon, M. S. New fluorescent protein reporters for use with the Drosophila Gal4 expression system and for vital detection of balancer chromosomes. Genesis. 34, 135-138 (2002).
- Sullivan, W., Ashburner, M., Hawley, R. S. . Drosophila protocols. , (2000).
- Tepass, U., Fessler, L. I., Aziz, A., Hartenstein, V. Embryonic origin of hemocytes and their relationship to cell death in Drosophila. Development. 120, 1829-1837 (1994).
- Millard, T. H., Martin, P. Dynamic analysis of filopodial interactions during the zippering phase of Drosophila dorsal closure. Development. 135, 621-626 (2008).
- Doerflinger, H., Benton, R., Shulman, J. M., St Johnston, D. The role of PAR-1 in regulating the polarised microtubule cytoskeleton in the Drosophila follicular epithelium. Development. 130, 3965-3975 (2003).
- Olofsson, B., Page, D. T. Condensation of the central nervous system in embryonic Drosophila is inhibited by blocking hemocyte migration or neural activity. Dev Biol. 279, 233-243 (2005).
- Paladi, M., Tepass, U. Function of Rho GTPases in embryonic blood cell migration in Drosophila. J Cell Sci. 117, 6313-6326 (2004).
- Vlisidou, I. Drosophila embryos as model systems for monitoring bacterial infection in real time. PLoS Pathog. 5, e1000518-e1000518 (2009).
- Jacinto, A. Dynamic actin-based epithelial adhesion and cell matching during Drosophila dorsal closure. Curr Biol. 10, 1420-1426 (2000).
- Wood, W., Jacinto, A. Imaging cell movement during dorsal closure in Drosophila embryos. Methods Mol Biol. 294, 203-210 (2005).
- Kunwar, P. S. Tre1 GPCR initiates germ cell transepithelial migration by regulating Drosophila melanogaster E-cadherin. J Cell Biol. 183, 157-168 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados