Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
A reversible, método no invasivo para las mediciones de resistencia de las vías y Toma de Muestras Líquido del Lavado broncoalveolar en ratones
En este artículo
Resumen
Mediciones repetidas de la fisiología respiratoria y el muestreo de roedores de las células de las vías respiratorias inflamatorias son deseables, pero en general no es factible. A continuación se describe un método reproducible para la intubación por vía oral ratones que permite mediciones repetidas de la hiperreactividad de las vías respiratorias y el muestreo de las células de las vías respiratorias inflamatorias.
Resumen
Las vías respiratorias hiperreactividad (AHR) las mediciones y el lavado broncoalveolar (LBA), un muestreo de fluidos son esenciales para los modelos de asma experimental, pero los procedimientos repetidos para obtener estas mediciones en el mismo animal generalmente no son factibles. Este sentido, demuestran los protocolos para la obtención de ratones mediciones repetidas de la AHR y muestras de líquido del lavado broncoalveolar. Los ratones fueron retados por vía intranasal en siete ocasiones en 14 días con un potente alergeno o falso tratamiento. Antes de que el desafío inicial, y dentro de las 24 horas siguientes a cada desafío intranasal, los mismos animales fueron anestesiados por vía oral intubados y ventilados mecánicamente. AHR, evaluada mediante la comparación de las curvas de dosis-respuesta de la resistencia del sistema respiratorio (RRS) inducida por el aumento de las dosis intravenosa de acetilcolina (ACh) de cloruro de entre el simulacro y alergeno-desafió animales, se han determinado. Posteriormente, ya través de la intubación mismo, el pulmón izquierdo se lavaged modo que la enumeración diferencial de las vías aéreas se pudo realizar. Estos estudios revelan que las mediciones repetidas de la AHR y acumulación de líquido del LBA son posibles a partir de los mismos animales y que la hiperreactividad bronquial y eosinofilia vías respiratorias máximas se alcanzan en 7-10 días de iniciar la exposición al alérgeno. Esta nueva técnica reduce significativamente el número de ratones requerido para la experimentación longitudinal y se aplica a diversas especies de roedores, los modelos de la enfermedad de las vías respiratorias y los instrumentos de la fisiología.
Protocolo
Alérgenos:
- Ratones C57BL / 6, 4-8 semanas de edad, son anestesiados en una cámara de plexiglás hermético purgado con isoflurano 3,2% en la mezcla de oxígeno de vapor durante 10 minutos para conseguir una anestesia general profunda.
- Desafíos intranasal alergeno (45μL OVA (22,5 mg) y 7μL A. oryzae (7 g), en PBS) se administran todos los martes, jueves y domingos, para un total de siete aplicaciones consecutivas.
Anestesia:
- Antes de cada exposición al alérgeno, y como consecuencia del recurso séptimo, los ratones se administran una inyección intraperitoneal de 48 mg / kg de etomidato (2 mg / ml), antes de colocarlo en un recipiente de luz con exclusión.
- Sujeto permanece en un recipiente hasta que la falta de respuesta neurológica observable se detecta en la aplicación de presión a las patas traseras (5-10 min).
Intubación:
- Una lámpara de calor radiante, mantenido a una distancia para asegurar el mantenimiento de ~ 37 ° C la temperatura central del cuerpo, debe centrarse en el tema durante todo el procedimiento para prevenir la hipotermia. Un termómetro rectal se debe utilizar por lo menos inicialmente para confirmar euthermia independientemente de la fuente de calor.
PASOS CRÍTICOS Todos los líquidos y los instrumentos recibidos por los animales de experimentación deben ser estériles, los procedimientos deben realizarse bajo estrictas condiciones de asepsia. Hipotermia prolongada mientras está bajo anestesia llevará a datos aberrantes y / o muerte de animales. Competencia con todos los procedimientos invasivos deben ser desarrolladas con animales procedentes de cadáveres antes de intentar trabajar con animales vivos. Lubricante oftálmico se debe utilizar para evitar abrasiones en la córnea de los animales bajo anestesia general. - Ratones anestesiados se retiran del receptáculo y se coloca en posición de decúbito (hasta la parte ventral), en la mesa de pletismógrafo, ajustado a un ángulo de 45 °.
- Una banda de goma que rodea la tabla se inserta detrás de la fila superior de los incisivos para conseguir el tema en su lugar. Con pinzas en la mano derecha, agarrar, extender y levantar la lengua de la boca antes de asegurar que en su lugar con un metal depresor en la mano izquierda, lo que permite una vía sin obstáculos para la intubación.
- Un hilo de 0,8 mm de diámetro de fibra óptica, conectada a una fuente de luz, es insertado a través de la angiocatéter y ampliado 10 mm más allá de la punta. A medida que el depresor se estabilizó con la mano izquierda, el extremo iluminado de la rosca de fibra óptica es guiado a través de la cavidad oral y faringe, de la mano derecha hasta que las cuerdas vocales se visualizan. El hilo se pasa bajo visualización directa a través de las cuerdas vocales en movimiento y en la tráquea, programada para ocurrir cuando los cables están al máximo abierto.
- El angiocatéter se pasa el hilo de fibra óptica dentro de la tráquea hasta la punta del catéter se encuentra dentro de la porción media de la tráquea. De 17 a 22 gramos de ratones, esto corresponde a un segmento del catéter de 10 mm que permanecen visibles entre el conector y el extremo craneal de la mandíbula inferior del sujeto s. El importe real por el cual se pasa el catéter debe ser determinado por la inspección directa de la tráquea de 2-3 ratones por sondaje del tamaño relevante y la herencia genética.
- El hilo de fibra óptica se quita y la intubación exitosa se confirma mediante la observación regular de respiraciones profundas (excursiones rítmica del tórax y el abdomen), que resolver de modo inmediato la oclusión después de la conexión con el pulgar. Una respuesta de asfixia, independientemente de la oclusión del pulgar, respiración irregular, u otros signos de dificultad respiratoria son indicativos de angiocatéter mala posición y por lo general indican la intubación esofágica.
Si no paso fundamental para revertir rápidamente una intubación esofágica puede ser letal. Si se sospecha de intubación esofágica, el catéter debe ser removido rápidamente y volver a introducir una vez el animal ha vuelto a un patrón de respiración normal. El etomidato es el anestésico de elección, de todos los anestésicos roedores disponibles, este agente provoca la menor toxicidad cardiovascular (hipotensión, arritmia, paro cardíaco). - Mesa inferior pletismógrafo hasta el paralelo con el banco de trabajo y a su vez sujeto frente a 180 ° hasta el puerto de aire del ventilador. A su vez los animales en su lado antes de conectar el ventilador.
- Una intubación exitosa se confirma aún más cuando, después de obtener una conexión hermética y la activación del ventilador (funcionando a 150 respiraciones / minuto, 9 ml / g del volumen corriente, oxígeno al 100%), excursión toracoabdominal se observa que el ritmo del ventilador.
Vía intravenosa:
- A 10 mm, aguja 27ga se retira de su conector de jeringa a través de la fusión es libre, y doblar la aguja 90 ° en el punto medio usando pinzas estériles y pinza hemostática para que el bisel se enfrenta en el ángulo. El extremo no biselado está conectado a la tubería PE10 que conduce al puerto de inyección IV.
- Para evitar posiblesLa embolización de aire fatal, el tubo y la aguja se purgan con 37 ° C, 0,9% de NaCl a través de la jeringa de 1 ml. El punto de inyección consiste en una aguja 27ga, empujado a través de un agujero perforado en la tapa de un tubo de centrífuga de 15 ml. La tapa está llena de tales solución salina que al final de la aguja es constantemente sumergida, reduciendo así la probabilidad de que el aire será arrastrado por la aguja y se inyecta por vía intravenosa.
- Con el ratón que permanecen bajo la lámpara de calor, la aguja se alinea en el extremo caudal de la cola en paralelo y sobre la vena lateral. La aguja se ejecuta un poco debajo de la piel, mientras dirige cranealmente a lo largo de la longitud de la vena s y empujado por vía subcutánea a la curva. El éxito de la colocación IV se confirma al observar el reflujo de sangre en el tubo IV con una ligera tracción del émbolo de la jeringa. Además, debe haber soplado a través de la vía IV después de la inyección de solución salina 50-100 l en la vena de la cola. Venas ocasionalmente la cola no puede ser estable canulado. En estos casos, el ratón se puede girar 180 grados hacia el otro lado y la otra cola IV suele acceder sin dificultad.
- Después de retirar la lámpara de calor a partir de la instalación, el tema se incluye en el pletismógrafo, a partir de entonces asegurado como hermética con la aplicación de las 4 abrazaderas.
Paso crítico para permitir que la lámpara de calor para permanecer en el aire se calienta en la cámara de pletismógrafo y potencialmente alterar las mediciones posteriores de R RS esterilidad de agujas intravenosas y las soluciones deben ser mantenidos. Esterilización de las agujas se realiza por inmersión y lavado con etanol al 70% seguido de lavado y enjuague con solución salina estéril antes de la inserción intravenosa. Por otra parte, la cola se debe limpiar con un 70% de etanol o alcohol isopropílico antes de la inserción iv.
Las vías respiratorias medidas de resistencia:
- Resistencia máxima es determinada por cuantificación continua de la DPT cociente de A / V (donde DPT es el cambio en la presión traqueal y V es el flujo de aire) en los puntos de igual volumen pulmonar (70% del volumen corriente). DPT se determina mediante el uso de un transductor de presión conectado a la angiocatéter traqueal. Para determinar V, las variaciones pletismógrafo de presión se calibran a los cambios de volumen en los rangos fisiológicos estudiados. El diferencial de volumen pletismógrafo con el tiempo, calculado por el módulo de preamplificación, es V. Después de establecer una línea base estable R RS (variación <5% más de 3 minutos), cinco dosis sucesivas (volumen = 2 l / g de peso corporal) de aumentar concentraciones de cloruro de acetilcolina (0,058, 0,18, 0,59, 1,58 y 5,8 mg / kg de peso corporal, en 0,9% a pH 7.4, mantiene en el hielo y calienta a mano antes de cada inyección) se inyectan más de un segundo a través de la IV, con cada dosis administrada a su regreso de R RS a la línea base, hasta una triplicación de la resistencia de base (aproximadamente 12 cm H 2 O x ml -1 x seg, es decir, un aumento del 200% en la resistencia de las vías respiratorias por encima de la línea de base típica de aproximadamente 4 cm H 2 O x ml -1 x seg) se logra. La concentración de provocación de Ach, en mg / g de peso corporal, que provoca un aumento del 200% en R RS a los valores basales (llamado PC 200), se calcula por interpolación matemática de la Ach-R RS curvas dosis-respuesta.
- Una vez que PC 200 valores se han alcanzado, de fijación de desenganche, y desmantelar el pletismógrafo. Un máximo de 5 dosis crecientes de acetilcolina se da. El rango de concentración de Ach dado anteriormente es adecuado para el logro de PC 200 valores de las cepas de ratón más ingenuo.
Paso crítico Cuando una línea de base de aproximadamente 4 cm H 2 O x ml -1 x segundos se establece sobre la vigilancia de la resistencia durante 30 segundos, un 60 l de solución salina normal puede ser inyectado IV para confirmar que el avión adecuado de anestesia que se ha logrado. Con la anestesia completa, no habrá ningún cambio significativo en la resistencia, un aumento de la resistencia o el movimiento de las extremidades o de la cola representa un signo de sufrimiento físico y señala la necesidad de anestésico adicional. - Quitar IV de la vena de la cola y luego desconectar el animal del ventilador, el mantenimiento de una vía aérea permeable al mantener la cánula traqueal en su lugar. Animales ocasionales no debe reanudar la respiración espontánea de inmediato. En estos casos, la respiración se puede fomentar mediante un ligero masaje en el tórax.
Respiración espontánea PASO crítico debe ser establecida antes de la transferencia a la cámara de recuperación, de lo contrario se producirán muertes. - Tras la reanudación de la respiración espontánea, los ratones se transfieren con cánulas traqueales en su lugar, a una cámara de purga con el 100% de O 2 y mantener a 37 ° C con una lámpara de calor. Dentro de 15-20 minutos, los ratones son la respiración fuerte y comienza a mover sus extremidades, y en ese momento la sonda traqueal se puede quitar y los animales safely transferidos a las jaulas regular.
El paso crítico para las vías respiratorias es fácilmente obstruidos en el ratón inconsciente debido a la inducida por la acetilcolina hiper salivación y es la razón principal de muerte relacionada con la asfixia en ratones anestesiados después de las mediciones de las vías respiratorias fisiológicas. Por esta razón, la cánula traqueal debe permanecer en su lugar, incluso en los ratones no sometidos a lavado broncoalveolar, hasta que se puede despertar y no se debe quitar hasta la hiper-salivaton ha cesado.
El lavado broncoalveolar:
- Colección de líquido de lavado broncoalveolar es seguro cuando los ratones se recuperen lo suficiente su reflejo nauseoso (~ 20 min después de la colocación en la cámara de recuperación). El reflejo de la mordaza se evalúa haciendo deslizar suavemente el angiocatéter interior y exterior, tos o dificultades obvias indican que el reflejo nauseoso.
Paso crítico para permitir demasiado prolongado tiempo de recuperación se reducirá mucho la eficiencia de rendimiento de BAL de ratones individuales, por lo que el reflejo nauseoso debe ser monitoreado cada pocos minutos, tras el período de 20 min de descanso sugerido. Si los ratones son incapaces de tolerar el procedimiento de lavado debido al despertar parcial, un 3,2% isoflurano vapor puede ser utilizado. - Un cable de la intubación guía metálica (0,5 mm de diámetro exterior), con una curva continua de ~ 30 ° dirigida al lóbulo izquierdo del pulmón, se inserta en el angiocatéter. La guía de alambre y se angiocatéter avanzada juntos en el lóbulo izquierdo del pulmón, de tal manera que el catéter (hub excluidos) se extiende más allá de los dientes frontales por sólo 1 mm.
Si no paso crítico para aislar el pulmón izquierdo reducirá en gran medida el rendimiento, al tiempo que mejora la probabilidad de muerte de los animales. Se debe tener cuidado para asegurarse de que la punta de la guía no pasa por el extremo abierto de la angiocatéter. Avanzar en la angiocathether con la punta metálica que sobresale podría llevar a un desgarro traqueal y la muerte debido a la rotura traqueal. - Mantener el angiocatéter en su lugar, la guía se retira y 300 l de PBS (pH 7.4, estéril) es vertido en el pulmón izquierdo a través de una jeringa de 1 ml. Inmediatamente después, mientras que la elaboración del émbolo de la jeringa para crear una presión negativa, el angiocatéter poco a poco (3 s) eliminado, mientras que el masaje intenso del pulmón. El retorno de BAL 100 a 200 l se espera.
- Inmediato a los ratones lavaged a los 37 ° C, el 100% de O 2, mientras que la cámara de forma continua el masaje del tórax. Ratones lugar en su lado izquierdo hasta que esté completamente recuperado (~ 20 min). Los animales se colocan de nuevo en sus jaulas.
TIEMPO:
Por ratón, todo el procedimiento no debería tomar más de 1 hora para llevar a cabo: Paso 3-4 min, 5.10, 5.21 Pasos, 10 min; Paso 22, 20-30 min; Pasos 23-24,... 10 min. Con mayor competencia y por los sujetos asombrosa en el protocolo, hasta 3 ratones / hora puede ser procesado.
Los resultados representativos:
Hiperreactividad de vía aérea en ratones, según lo determinado por las medidas de PC 200 valores, es una consecuencia de la activación y reclutamiento de los pulmones de las células T y la secreción de la citoquina IL-135-7. Por lo tanto, hiperreactividad de vía aérea no es la consecuencia inevitable de las vías respiratorias reto con alérgenos, sino que depende de un compartimento de células T inmunes intactos y el tiempo necesario para que las respuestas de células T para desarrollar en el marco de la exposición al alergeno repetidas. Como se muestra en la figura. 2a, la hiperreactividad de las vías respiratorias, que se define como PC 200 valores que son significativamente más bajos en comparación con los valores basales, desarrollada después de cinco desafíos alergeno sin aumento significativo después de que el sexto desafío. Por razones que no se entienden completamente, la reactividad vía aérea disminuyó (PC 200 valores de mayor) después de la primera exposición al alérgeno (Fig. 2a). Tendencias similares se observan al comparar las curvas de dosis-respuesta de Ach de los mismos ratones (Fig. 2b). Sin embargo, es evidente que aquí se desarrolla hiperreactividad completo abruptamente después de la exposición al alérgeno quinto, de tal manera que los ratones se hacen más de 30 veces más sensibles a la Ach entre los retos cuarto y sexto. En conjunto, estos hallazgos indican que las mediciones más confiables de la AHR se obtienen después de seis desafíos alergeno (12 días), las mediciones en los puntos de tiempo antes es probable que el rendimiento de datos muy variables. Los ratones con el vehículo varias veces cuestionado por vía intranasal (solución salina) no desarrollan hiperreactividad, y, en todas las dosis de Ach dado, R RS mediciones no varían significativamente de los valores basales (Fig. 3 y datos no presentados).
Antes de la aparición de la AHR robusto, el tipo celular predominante de las vías respiratorias inducida por alergenos fue el de neutrófilos (Fig. 4). Similar a la tendencia de AHR, sin embargo, eosinofilia reforzado gradualmente con la exposición al alérgeno repetidas y los eosinófilos se convirtió en el tipo de célula numéricamente dominante en el LBA after el sexto desafío, coincidiendo con una marcada disminución en el número de neutrophis (Fig. 4). Macrófagos, que aumentó en número con el alergeno primeros desafíos y fluctuó en abundancia a partir de entonces. La abundancia de linfocitos no variaron significativamente con independencia del número de retos alérgeno y, paradójicamente, dada su importancia para el modelo, suelen ser los menos numerosos de células en el líquido de BAL.
Mediciones de las vías respiratorias de resistencia en los ratones que recibieron ni la exposición al alérgeno, ni muestras BAL no varió durante los 17 días de experimentación. Muestreo repetido LBA, en ausencia de las vías respiratorias mediciones fisiología o la exposición al alérgeno se realizaron también, y sólo mostró una mejora de neutrófilos y macrófagos a la contratación de las vías respiratorias que no persisten más allá de 5 días (datos no mostrados). Estos hallazgos demuestran que el destacado neutrofilia observada en los ratones alergeno impugnada es en gran medida el resultado del procedimiento y no el antígeno.
En el control, PBS-desafió ratones, las mediciones de las vías respiratorias también la resistencia no varió significativamente con el tiempo. Mejorado los macrófagos y neutrófilos, eosinófilos, pero no, a LBA también fue visto en estos ratones, similares a los cambios observados en los ratones que recibieron sólo repetir la toma el líquido de BAL (Fig. 4 b, d). En conjunto, estos datos ponen de relieve la importancia de los alérgenos, y no las diferentes manipulaciones de la vía aérea, a la inducción de la inflamación alérgica, tanto la vía aérea (eosinófilos) y AHR.
Resultados similares se pueden esperar con alergenos intranasal análoga a la proteinasa que hemos utilizado aquí. Sin embargo, muchos investigadores utilizan la ovoalbúmina para inducir la enfermedad pulmonar alérgica. Después de un período adecuado de cebado intradérmica o intraperitoneal (1-2 semanas) con ovoalbúmina precipitó en una sal de aluminio, un fenotipo de asma resistente, incluyendo la hiperreactividad de las vías respiratorias, se puede esperar un plazo de 24 horas después de que un único desafío intranasal con ovoalbúmina soluble.
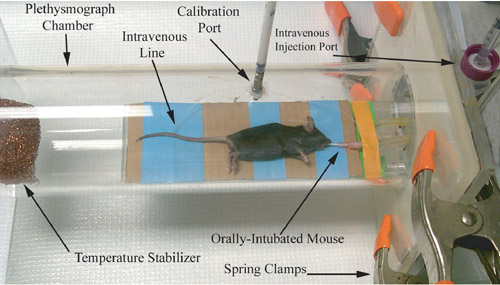
Figura 1. Representación fotográfica de un pletismógrafo de roedores, inmediatamente antes de la grabación de las vías respiratorias de medición fisiología.

Figura 2. Vías respiratorias medidas de resistencia. A) A efectos estadísticos, antilog PC 200 valores son reportados. Tenga en cuenta el gran aumento en el PC antilog 200 después de primer reto, y la consiguiente disminución siguientes desafíos. B) la resistencia del sistema respiratorio (RRS): Tenga en cuenta la inclinación de la Ach-RRS curvas dosis-respuesta después de los retos sexto y séptimo. Las barras de error representan el SEM.
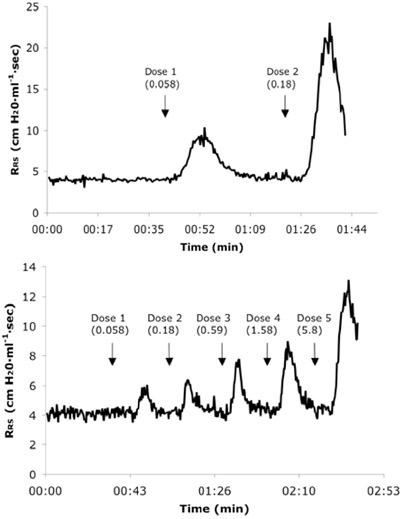
Figura 3. Representante en tiempo real de la resistencia del sistema respiratorio (R RS) los trazos de un alergeno ingenuo (A) y 6 veces cuestionado ratón (B) que recibieron dosis consecutivas IV de Ach. Valores de dosis se presentan en unidades de mg / kg.

Figura 4. Diferencial recuento de células inmunes en las muestras de lavado broncoalveolar derivados de los pulmones izquierdo de los ratones tratados con siete desafíos consecutivos intranasal. Por ciento (%) abundancia de células del sistema inmune en los ratones tratados con el alérgeno (A) o PBS (B). El número total de células del sistema inmune de los ratones tratados con el alérgeno (C) o PBS (D). Los valores representan como media + / - sem.
Discusión
El estudio del asma y otras enfermedades pulmonar obstructiva, constituye un campo activo y en expansión de la investigación biomédica. Un componente importante del asma relacionada con la investigación experimental es la capacidad para medir los cambios en el tamaño de las vías respiratorias en diversas condiciones. Estrechamiento de las vías respiratorias excesivas en respuesta al desafío provocador, una función canónica de asma y enfermedades relacionadas con el pulmón y una propiedad de la hiperreactivida...
Agradecimientos
Agradecemos al Dr. W. Mintzer a la sugerencia de realizar la intubación orotraqueal de fibra óptica. Apoyado por becas U19AI070973, R01AI057696, K02HL75243 y R01HL082487 de los Institutos Nacionales de Salud.
Materiales
Las vías respiratorias fisiología de software de medición (Rescomp) era la costumbre de preparar (Millennium Premier Group, 415-519-4371).
Los datos fueron analizados utilizando una estación de trabajo PC con Windows XP equipado con una CPU Pentium III (Intel, Inc. Santa Clara, CA) y un análogo de 17-pin de señal digital (National Instruments, # PC-LPM16).
Un animal pequeño vías respiratorias estación de trabajo fisiología era la costumbre de montar (Milenio Premier Group) con transductores de presión disponible en el mercado (parte # TRD5700 y TRD4510), módulos de preamplificación (parte # MAX2270), chasis (pieza # MAX1320, todos de Buxco Wilmington, Inc., Carolina del Norte ) y un pletismógrafo personalizado de pequeños animales.
0,5 mm de diámetro exterior de fibra óptica de hilo, conectado a la fuente de luz (Iluminador Cole Palmer, 41722 series)
Ventilador (Harvard Apparatus Ratón Ventilador, # 687)
10 mm, aguja 27ga (BD Biosciences, cat.. 309 602)
Lámpara de calor
Jeringa de 1 ml (BD Biosciences, cat.. 305 109)
4 abrazaderas (Pony 3200 abrazadera de resorte)
0,5 mm, el alambre externo para guiar la intubación
Hemocitómetro
Superfrost / más portaobjetos de microscopio (gato de Fisher. No. 12-550-15)
Shandon filtro de tarjetas (Thermo cat.. 5991022)
Diapositivas diferencial de las células mancha (gato de Fisher. No. 122911)
Microscopio óptico (Leica)
Cytospin 3 (Shandon)
Calibre 20, de 1,25 pulgadas catéteres intravenosos ProtectIV (Smith Medical)
0,5 mm de fibra óptica de polímero (Edmund Optics # NT02-532).
Referencias
- Hamelmann, E. Noninvasive measurement of airway responsiveness in allergic mice using barometric plethysmography. Am. J. Respir. Crit. Care Med. 156, 766-775 (1997).
- Adler, A., Cieslewicz, G., Irvin, C. G. Unrestrained plethysmography is an unreliable measure of airway responsiveness in BALB/c and C57BL/6 mice. J. Appl. Physiol. 97, 286-292 (2004).
- Bates, J. The use and misuse of penh in animal models of lung disease. Am. J. Respir. Cell Mol. Biol. 31, 373-374 (2004).
- Lundblad, L. K., Irvin, C. G., Adler, A., Bates, J. H. A reevaluation of the validity of unrestrained plethysmography in mice. J. Appl. Physiol. 93, 1198-1207 (2002).
- Grunig, G. Requirement for IL-13 independently of IL-4 in experimental asthma. Science. 282, 2261-2263 (1998).
- Corry, D. B. Requirements for allergen-induced airway hyperreactivity in T and B cell-deficient mice. Mol. Med. 4, 344-355 (1998).
- Corry, D. B. Interleukin 4, but not interleukin 5 or eosinophils, is required in a murine model of acute airway hyperreactivity. J. Exp. Med. 183, 109-117 (1996).
- Amdur, M. O., Mead, J. Mechanics of respiration in unanesthetized guinea pigs. Am J Physiol. 192, 364-368 (1958).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados