Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La evaluación de dos dimensiones ensayos de cristalización de proteínas de membrana pequeña de Estudios de Biología Estructural de Cristalografía de electrones
* Estos autores han contribuido por igual
En este artículo
Resumen
La evaluación de dos dimensiones (2D) ensayos de cristalización para la formación de matrices de orden de proteínas de membrana es una tarea muy difícil y crítica de la cristalografía de electrones. A continuación se describe el enfoque en la detección e identificación de cristales 2D de proteínas de la membrana en su mayoría pequeñas en el rango de 15 - 90kDa.
Resumen
Cristalografía de electrones se ha desarrollado como un método que puede ser utilizado como alternativa o en combinación con tres dimensiones de cristalización y cristalografía de rayos X para estudiar la estructura-función de las preguntas de proteínas de membrana, así como proteínas solubles. La detección de dos dimensiones (2D) los cristales mediante microscopía electrónica de transmisión (EM) es el paso crítico en la búsqueda, la optimización y selección de muestras de alta resolución de la recopilación de datos de la crio-ME. A continuación se describen los pasos fundamentales en la identificación de grandes y ordenadas, así como pequeños arreglos en 2D, que potencialmente puede proveer información crítica para la optimización de las condiciones de cristalización.
Al trabajar con diferentes aumentos en la EM, los datos sobre una serie de parámetros críticos se obtiene. Menor aumento suministra datos valiosos sobre la morfología y el tamaño de la membrana. A mayores aumentos, las posibles dimensiones de cristal para 2D y se determinan. En este contexto, se describe cómo las cámaras CCD y se transforma en línea de Fourier se utilizan en mayores aumentos para evaluar proteoliposomas por el orden y el tamaño.
Mientras que los cristales 2D de proteínas de membrana son más cultivadas por la reconstitución por diálisis, la técnica de detección es igualmente aplicable para los cristales producidos con la ayuda de las monocapas, nativo de cristales 2D, y ordenó a las matrices de proteínas solubles. Además, los métodos descritos aquí son aplicables a la detección de cristales 2D de la aún más pequeña, así como proteínas de membrana más grandes, donde los pequeños las proteínas requieren la misma cantidad de atención en la identificación de los ejemplos y la red de proteínas más grandes pueden ser más fácilmente identificables en las primeras etapas de la selección.
Protocolo
1. Preparación de la red de ensayos de cristalización 2D
- Carbono recubiertos de malla de cobre de 400 redes de EM son preparados por tinción negativa. Acetato de uranilo es de uso frecuente y proporciona una mancha de larga duración en términos de almacenamiento de la solución durante varios meses antes de su uso, así como la idoneidad para el almacenamiento a largo plazo de las redes. En contraste, otros negativos, tales como manchas de formato de uranilo, mientras que proporciona una excelente tinción, deben estar recién hecho 1. Para la preparación rápida de un gran número de redes que se utilizan para la detección de los ensayos de cristalización 2D, una versión modificada de tinción negativa se utiliza. Un volumen de 2 l de la muestra es una pipeta en carbono cubierta rejilla EM y se incubó durante 60 s. Esto es seguido por transferencia desde el borde con un trozo de papel Whatman # 4 filtros (Figura 1, video), y luego 2 l de acetato de uranilo al 1% se aplican inmediatamente, que son borrados de nuevo al borde de la parrilla después de 30 s. Tocar la red en el borde con el borde roto del papel de filtro garantiza la eliminación óptima de líquido sin necesidad de retirar proteoliposomas. Además, el secado en el borde de la red asegura la mejor conservación de la película de carbono. Se debe tener cuidado en la preparación y manipulación de las redes, la rotura de la película de carbono delicada previene la adherencia de la muestra y puede resultar en una representación inexacta de la muestra. Si bien tradicionalmente grandes volúmenes de muestra de 5 l se y se utilizan habitualmente para la preparación de la red, preciosas muestras pueden ser salvados por la reducción del volumen de 2 l o menos 2.
- Para producir la mayor membranas es posible, algunas de nuestras muestras requieren altas concentraciones de glicerol o sacarosa (10-20%) para estar presente en el tampón de diálisis. Esto puede tener un efecto negativo en la preparación de la red, como el glicerol o sacarosa es muy viscosa y el acetato de uranilo previene de penetrar adecuadamente el buffer, y por lo tanto incompleta tinción de las membranas. En consecuencia, una posible red se oscurecerán. El búfer se pueden intercambiar por centrifugación de las muestras y su sustitución por glicerol / sacarosa sin buffer (no se muestra), o las rejillas se pueden lavar con tampón o glicerol / sacarosa sin búfer en uno o varios ciclos antes de la tinción negativa similar a la una técnica utilizada para la crio-ME 3,4.
2. La evaluación de los ensayos de cristalización 2D por EM
- Dependiendo del tipo de soporte de la muestra, ya sea una o varias redes se cargan. Un aumento de 2-10K, que se hace referencia aquí como ampliación intermedia, permite una primera impresión de la distribución de media y el grado de dispersión de las membranas, la morfología y tamaño, que es tomado en consideración en el cuaderno de laboratorio 5. Zonas adecuadas se registran como una visión general representativa con la ayuda de una cámara CCD, o si una cámara CCD no está disponible, en la película.
- Bajo aumento en el rango de alrededor de 400-800x se utiliza en momentos en que una visión general de toda la muestra / red que se desea. Aunque no todos los empleados con la red, bajo aumento da información valiosa de ayudar en la evaluación de la preparación de la red en cuanto a varios aspectos: tanto en tinción negativa y la rotura parcial del potencial de carbón, concentración de la muestra en la parrilla, y la distribución proteoliposoma posiblemente irregular. Cuadrados individuales de la red puede ser visto con los prismáticos o una cámara CCD. Con algunos mercados emergentes, es posible guardar las posiciones de interés particular, que pueden ser llamadas para una inspección posterior a mayores aumentos.
- Una vez que el área de la cuadrícula de interés ha sido identificado, ya sea en aumento bajo o intermedio, la ampliación se cambia a aproximadamente 50K-60K. En función de la membrana, el cristal y el tamaño de la celda unitaria, si se conoce, aumentos tan bajo como 30K y 80K tan alto como se utilizan. El rango de aumento de 30-80K se conoce como una gran ampliación a los efectos de la detección de cristales 2D. Centrándose se produce ya sea en el ajuste del enfoque de la dosis baja de puesta en marcha, con el interruptor posterior a la creación de imagen / foto, o en las proximidades de la zona de interés.
- En los casos de ambigüedad en si el área de interés es de hecho una membrana, se efectúa una prueba de carbono-film en el tamaño de proteoliposomas, mica, o de otros artefactos. Para ello, los bordes revelan plegables y morfología típicos.
- Ahora el área de interés es inspeccionado con una cámara CCD. Una imagen CCD se recoge en el 30K-80K ampliación, dependiendo del tamaño de la membrana, proteínas o el tamaño de la celda unitaria, o zona conocida como cristalino. El entramado de una proteína de membrana más pequeño y / o hidrófobos en su mayoría no es necesariamente visible mediante la evaluación visual de la imagen CCD de sí mismo. Ya sea toda la imagen se utiliza para transformar una línea de Fourier (FT, o rápido FT-FFT). Esta FT contienen una cantidad significativa de ruido, sin embargo, si el arreglo ordenado es pequeño. Por lo tanto, una reducción del tamaño de imagen en caja va a permitir una mejor relación señal-ruido de un Smaller de cristal y una identificación más fácil. Para ello, la caja se mueve sobre la imagen y una M en directo se evalúa.
La intensidad de brillo / de la viga se ajusta teniendo en dosis bajas condiciones de la muestra, así como los ajustes de cámara CCD en mente. Dependiendo de la cámara CCD utilizada, la gamma de la FT en vivo se ajusta para la identificación óptima de arreglos ordenados. Un valor demasiado alto puede ocultar manchas debido a las contribuciones de ruido, y un valor de gamma excesivamente baja evitará más débiles manchas de ser identificados. Estos puntos débiles puede ser debido a pequeños arreglos cristalinos con manchas en el Financial Times apenas por encima del nivel de ruido.
Si bien los datos de mayor resolución que se ha recogido de un pequeño número de muestras de 6, normalmente la resolución de los cristales 2D con tinción negativa se limita o no se debe esperar a ser mejor que la resolución de aproximadamente 15 bis. Con un desenfoque de aproximadamente -400 nm, no más de 1-3 órdenes de los puntos se espera que sean fáciles de identificar. Las muestras generalmente no están evaluados para su resolución, como la crio-ME de recopilación de datos le dará una indicación correcta de la más alta resolución posible. Nitidez de las manchas y mosaicidad posibles señalar, no obstante.
- Diferentes membranas, así como la morfología de la membrana, son evaluados por el orden a gran aumento. Esto es especialmente importante al principio o etapas intermedias de los ensayos de cristalización en 2D, como proteoliposomas más pequeños en vez de más grande o más parches de membrana puede contener las áreas más prometedoras. Porcentajes muy bajos de cristales 2D requerirá la adquisición de imágenes y el FT, o la difracción óptica, de un gran número de imágenes desde la identificación inicial de arreglos ordenados con frecuencia conducen a una rápida mejora de su tamaño y calidad de 2,4,7.
3. Resultados representante
Proteoliposomas Lo ideal sería que ordenó la pantalla fácilmente reconocibles, los puntos fuerte. Los cristales grandes y bien ordenada son identificados fácilmente por Internet-FT de imágenes CCD o la difracción óptica de microfotografías.
El ejemplo muestra cristales 2D de una proteína de membrana pequeña de 18kDa que son de hasta varias micras de tamaño. Las manchas en el FT son fáciles de identificar y nítidas. El movimiento de la caja de vivir-M demuestra que la red es continuo, sin mosaicidad. El enrejado de una proteína más grande, con un dominio más amplio soluble se pueden identificar en la pequeña pantalla de la EM. Colección de imágenes CCD y FT es necesario para proporcionar un medio para mejorar la evaluación y para obtener información sobre, por ejemplo, mosaicidad, es posible (mostrar FT). En el cálculo de una FT de un proteoliposoma que no se impone, el ruido puede ser inicialmente confundido con manchas. Mientras que la caja para el live-M se mueve, sin embargo, las manchas desaparecerán. Por otro lado, arreglos pequeños, con cristalinidad cuestionable, tendrá sus puntos restantes inmóvil cuando el live-M se mueve ligeramente sobre el área de la imagen. Además, estos pequeños cristales se pueden reconocer por lo general tienen el tamaño de la misma unidad celular, y las distancias entre los puntos en diferentes FTS se puede medir de varias maneras, como con un círculo de un tamaño específico. Cristales de lípidos mostrar una morfología de red distintas y FT.
No es raro encontrar la precipitación en los ensayos iniciales. Aquí la precipitación de proteínas sin reconstitución debe distinguirse de lípidos agregados pequeña sin embargo. Las muestras que parecen ser precipitados a bajo aumento con frecuencia resultan ser agregados de lípidos cuando se ve a mayor aumento. Tras la inspección a 30-50K, los bordes de estas estructuras oscuras revelan que se compondrá de las membranas sin precipitación de la proteína. Estas observaciones son importantes como los agregados de lípidos podría ser mayor en tamaño a las membranas grandes en los siguientes experimentos.
Los pobres resultados obtenidos en las muestras de la evaluación a veces se conecta a una concentración baja de membrana que impide la adecuada selección y rápido. Con frecuencia, esto se puede superar con el uso de una concentración de proteína más alto para la cristalización 2D mediante diálisis. Por otra parte, las membranas se deja reposar durante unos días en la parte inferior del tubo de Eppendorf durante el almacenamiento. En algunos casos la solución rápida, o casi instantánea de las membranas se produce y pipeteo de la parte inferior del tubo se traducirá en una mayor densidad de la membrana de la parrilla. Otra opción más rápida es la centrifugación (en 3000-8000 rpm durante 1-3 minutos) de las muestras con un muestreo posterior de la parte inferior del tubo.
Muestras en condiciones óptimas se contienen un gran porcentaje de cristales 2D. No es necesario apuntar a una apariencia más homogénea de las membranas, como la colección más grande y bien ordenada cristales 2D son seleccionados visualmente los datos. Estos tipos de muestras se reconoce fácilmente cuando los ensayos de cristalización se repiten, así como cuando las muestras se utilizan paracrio-ME de recopilación de datos, resultando en un número máximo de imágenes de alta resolución.
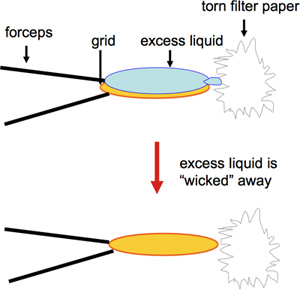
Figura 1. Esta figura muestra borrar el borde de la parrilla con un trozo de papel Whatman # 4 filtro.
Discusión
Evaluación adecuada de las muestras requiere una evaluación cuidadosa de un número suficiente de las membranas. Por ejemplo, las muestras con precios tan bajos como 2% de las matrices cristalinas de más de 180 proteoliposomas imágenes dieron la información crítica para la optimización rápida de las condiciones de cristalización 2D 7.
Cuando la precipitación de la proteína se produce, una red puede ser abandonada a partir de una mayor búsqueda después de la inspecció...
Agradecimientos
Agradecemos a nuestros colaboradores para proporcionar valiosas muestras de proteínas, lo que contribuyó a algunas de nuestras experiencias relacionadas con los métodos y observaciones. Günther Schmalzing amablemente ofreció la oportunidad de FR a unirse a este proyecto. Barbara Armbruster, Brink y Jacob Mills Deryck se les agradece por su gran ayuda y de entrada en el equipo. El financiamiento fue proporcionado por el NIH subvención HL090630.
Materiales
| Name | Company | Catalog Number | Comments |
| 400-mesh copper TEM grids coated with carbon film | |||
| forceps: regular and anti-capillary | Dumont #5 and Dumont N5AC or similar | ||
| Micropipette and pipette tips | |||
| Whatman #4 filter paper | |||
| 1% uranyl acetate | |||
| Dialysis sample to be screened for 2D crystals | |||
| Glycerol/sucrose-free dialysis buffer | Optional | ||
| JEOL-1400 transmission electron microscope (TEM) | similar 80 – 120kV TEM equipped with an Lab6 or tungsten filament and film and/or CCD cameras (Gatan Orius SC1000 and/or UltraScan1000 CCD cameras and Gatan Digitial Micrograph software package or Tietz cameras (TVIPS)) |
Referencias
- Johansen, B. V. Bright field electron microscopy of biological specimens V. A low dose pre-irradiation procedure reducing beam damage. Micron. 7, 145-156 (1976).
- Schmidt-Krey, I. Electron crystallography of membrane proteins: Two-dimensional crystallization and screening by electron microscopy. Methods. 41, 417-426 (2007).
- Wang, D. N., Kühlbrandt, W. High-resolution electron crystallography of light-harvesting chlorophyll a/b-protein complex in three different media. J Mol Biol. 217, 691-699 (1991).
- Schmidt-Krey, I., Rubinstein, J. L. Electron cryomicroscopy of membrane proteins: specimen preparation for two-dimensional crystals and single particles. Micron. , (2010).
- Schmidt-Krey, I., Mutucumarana, V., Haase, W., Stafford, D. W., Kühlbrandt, W. Two-dimensional crystallization of human vitamin K-dependent γ-glutamyl carboxylase. J Struct Biol. 157, 437-442 (2007).
- Trachtenberg, S., DeRosier, D. J., Zemlin, F., Beckmann, E. Non-helical perturbations of the flagellar filament: Salmonella typhimurium SJW117 at 9.6 Å resolution. J Mol Biol. 276, 759-773 (1998).
- Zhao, G., Johnson, M. C., Schnell, J. R., Kanaoka, Y., Irikura, D., Lam, B. K., Austen, K. F., Schmidt-Krey, I. Two-dimensional crystallization conditions of human leukotriene C4 synthase requiring a particularly large combination of specific parameters. J Struct Biol. 169, 450-454 (2010).
- Cheng, A., Leung, A., Fellmann, D., Quispe, J., Suloway, C., Pulokas, J., Abeyrathne, P. D., Lam, J. S., Carragher, B., Potter, C. S. Towards automated screening of two-dimensional crystals. J Struct Biol. 160, 324-331 (2007).
- Vink, M., Derr, K. D., Love, J., Stokes, D. L., Ubarretxena-Belandia, I. A high-throughput strategy to screen 2D crystallization trials of membrane proteins. J Struct Biol. 160, 295-304 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados