Method Article
Electrofusión de células visualiza con microscopía de fluorescencia
En este artículo
Resumen
En este video se demuestra electrofusión eficiente de las células In vitro Por el método de adhesión modificar mediante electroporación y la posterior detección de la visualización de células fusionadas con microscopía de fluorescencia.
Resumen
Electrofusión de células es un método seguro, no-virales y no químicas que pueden ser utilizados para la preparación de células híbridas para la terapia humana. Electrofusión implica la aplicación de corta pulsos de alta tensión eléctrica a las células que están en contacto cercano. Aplicación de corto y de alta tensión de los impulsos eléctricos provoca la desestabilización de las membranas de las células plasmáticas. Desestabilizado las membranas son más permeables a las moléculas diferentes y también son propensos a la fusión con cualquier membrana vecinos desestabilizado. Electrofusión es, pues, un método conveniente para lograr una fusión no específicos de células muy diferentes
Protocolo
I. Carga de las células con células seguidores CMFDA y CMRA
- Los experimentos se realizaron en células previamente preparada de la línea celular de ratón melanoma (B16-F1). Las células se cultivan en dos separados 25 frascos de cultivo cm 2 (TPP, ZDA) al 70-80% de confluencia en medio de cultivo DMEM (Dulbecco modificado de Eagle), complementado con suero fetal bovino al 10%, 0,15 mg / ml de L-glutamina, 16 mg / ml de gentamicina (todos de Sigma-Aldrich, Alemania), 200 unidades / ml crystacillin (Pliva, Croacia), y se incubaron en el 5% de CO 2 a 37 ° C.
- Preparar dos soluciones madre 10 mM de seguidores celular (Invitrogen, EE.UU.) mediante la adición de 10,76 l y 9 l (para el verde y CMFDA de Orange CARM, respectivamente) de DMSO (Sigma-Aldrich, Alemania) a 50 mg de colorante en el original Invitrogen vial. La solución madre se pueden almacenar en un refrigerador a 4 º C durante unos pocos meses. Antes de comenzar los experimentos, calentar la solución hasta que los cristales se disuelven de DMSO.
- Prepare bicarbonato sin Krebs-Hepes buffer (130 mM NaCl, 4,7 mM KCl, 1,2 mM MgSO 4, 1,2 mM KH 2 PO 4, 11,7 mM D-glucosa, 1,3 mM CaCl 2, 10 mM HEPES, pH 7,4). En dos de 15 ml tubos Eppendorf separado mezclar 2,1 l de cada solución madre (10 mM CMFDA o CARM, respectivamente) en 3 ml de bicarbonato libre de Krebs-Hepes buffer. Esto produce una "solución de carga", que contiene aproximadamente 7 M CMFDA (o CARM).
- Enjuague las células dos veces con bicarbonato sin Krebs-Hepes buffer y luego insertar la carga de soluciones en los frascos. Se incuban las células durante 30 minutos en el 5% de CO 2 a 37 ° C. Durante esta primera incubación reactivos pasar libremente a través de las membranas celulares, pero una vez dentro de la célula, los reactivos se transforman en células impermeable productos de reacción fluorescente.
- Después de la incubación primera vez, aclarar e incubar las células con medio de cultivo por otras dos horas en el 5% de CO 2 a 37 ° C.
- Trypsinize células en ambos frascos (cargado con CMFDA y CARM) y la mezcla de glóbulos rojos y verdes, unidos en una proporción de 1:1 en un tubo de centrífuga de 50 ml (TPP, ZDA). Ajustar la concentración de células a 5 x 10 6 células / ml por dilución con medio DMEM o por la concentración de centrífuga. Lugar una caída de 20 l de suspensión celular en cada pocillo de 24 pocillos de la placa (TPP, ZDA). Se incuban las células en el 5% de CO 2 a 37 ° C durante 20 minutos para que puedan colocar un poco a la superficie del pozo y establecer contactos de la célula.
II. Electrofusión
- Prepare el buffer de isoosomolar fosfato de potasio (10 mM KH2PO4, 10 mM K 2 HPO 4, 1 mM MgCl 2, 250 mM de sacarosa) y tampón fosfato de potasio hipoosmolar (10 mM KH2PO4, 10 mM K 2 HPO 4, 1 mM de MgCl2, 75 mM de sacarosa) .
- Coloque el multipocillo con células en el microscopio, la posición de los electrodos en la parte inferior del pozo y conectarlos al generador de pulsos.
- Lavan las células con 1 ml de solución tampón fosfato de potasio isoosomolar. Añadir 350 l de tampón fosfato de potasio hipoosmolar con el fin de inducir la inflamación celular. El tampón debe cubrir los electrodos.
- Salir de las células en tampón hipoosmolar durante 2 minutos antes de la aplicación de pulsos eléctricos. Durante este tiempo de llegada de las moléculas de agua en las células debido a un desequilibrio osmótico entre el interior y el exterior de las células causar un aumento del volumen celular. Impulsos eléctricos se debe aplicar cuando las células están cerca de su volumen máximo, antes de comenzar a disminuir el volumen de regulación.
- Para lograr óptimos de electrofusión y mantener la viabilidad celular, los parámetros óptimos de los impulsos eléctricos se debe utilizar. Estas dependen de la línea celular utilizada [1]. En este experimento, un tren de 8 pulsos rectangulares (cada uno con duración de 100 ms a 1 Hz) se aplica a cada muestra, con dispositivo de electroporación (en nuestro caso Cliniporator, IGEA, Italia). Los pulsos son entregados a dos electrodos paralelos Pt / Ir con un diámetro de 0,8 mm y 5 mm de distancia entre ellos, creando un campo eléctrico de aproximadamente 1200 V / cm entre los electrodos en cada pozo, a excepción del control de pozos.
- Salen de las células en reposo durante 10 minutos después de la entrega de pulso. Determinar el rendimiento de fusión mediante microscopía de contraste de fase y fluorescencia.
III. De adquisición de imágenes y la determinación del rendimiento de la fusión
- Las células se observan con un microscopio de fluorescencia (en nuestro caso Zeiss Axiovert 200, Zeiss, Alemania) equipado con un objetivo (x20) y una cámara CCD enfriado (VisiCam 1280, Visitron, Alemania). Las imágenes se adquieren en MetaMorph 7.1.1 (Molecular Devices, EE.UU.), pero otro software de adquisición similar también se puede utilizar. CMFDA se excita con un monocromador (policroma IV, Visitron, Alemania) a 492 nm y 548 nm en la CARM. La fluorescencia de CMFDA y CMRA se realiza a través de dos filtros de emisión, uno centrado en 535 nm (HQ535/30m, por CMFDA) y el otro centrado en 510 nm (D605/55m, por CMRA, tanto Chroma, EE.UU.). El uso de espejo dicroico (Q515LP) que impidan la diafonía canal.
- La adquisición de tres imágenes (contraste de fases, de color rojo y la fluorescencia verde) durante cinco campos elegidos al azar en cada pozo. Crear tres imágenes de canales de cada triplete de la imagen. En dicha imagen citoplasma fluorescentes pueden verse, junto con las membranas celulares. Células fusionadas por lo tanto se puede determinar fácilmente [Figura 1].
- Contar con los tres tipos de células (rojo, verde y fluorescente dual) en cada imagen de tres canales. Determinar el porcentaje de células fluorescentes doblemente dividiendo el número de células doblemente fluorescente con el número de todas las células en cada imagen. Rendimiento de fusión se define como el porcentaje de células fluorescentes doblemente multiplicado por 2, ya que la mitad de las células fusionadas no se detectan (cuando las células de la mecha del mismo color).
Resultados representante
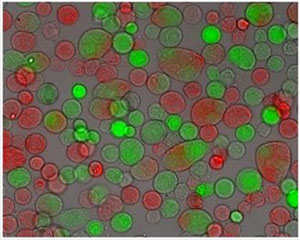
Figura 1 Imagen de microscopía tres canales de B16F1 células después de electrofusión:. Contraste de fases, CMRA fluorescencia (excitación a 548 nm) y CMFDA fluorescencia (excitación a 492 nm), aumento del objetivo 20x
Discusión
La capacidad de las membranas celulares de fusionar de forma no específica, por ejemplo, por campos eléctricos externos, es importante para la biotecnología, la medicina y la investigación en la biología. Fusión inespecíficos, permite la producción de células híbridas de gran valor y sus productos, como los anticuerpos monoclonales, y proporciona información sobre los mecanismos fundamentales de la fusión [2]. Electrofusión es un método potencialmente muy eficaz ya que puede ser ajustado correctamente a diferentes tipos de células. Electrofusión se logra cuando las células en contacto físico se ponen en su estado fusogénica (predisposición a la fusión) por medio de pulsos de alta tensión eléctrica. La eficiencia de electrofusión depende de varios parámetros que afectan a dos partes del proceso de electrofusión. Primera parte del proceso de electrofusión es el logro de un estrecho contacto físico entre las células, que pueden ser obtenidos con diferentes métodos [3-8]. Método de adherencia (las células que crecen a la confluencia) se puede utilizar de manera eficiente gracias a los contactos de manera espontánea de células establecidas en zonas grandes entre las células, sin embargo, que produce células fusionadas muy grandes con muchos núcleos. Estamos utilizando el método de adherencia modificado, en células más pequeñas (de 2 a 5 núcleos), que tienen más probabilidades de sobrevivir y proliferar, se obtienen (Figura 1). Contacto entre las células también se benefician de la hinchazón osmótica de las células, debido al tratamiento osmótico utilizado en el experimento [9]. Segunda parte del proceso de electrofusión es el logro del estado fusogénica de las membranas celulares. Estado fusogénica se correlaciona bien con el estado electropermeabilized de la membrana (células no son específicamente permeabilized a las moléculas que normalmente no pueden pasar a través de la membrana intacta) y se rige por los mismos parámetros de los pulsos eléctricos (amplitud, duración, número y frecuencia) [10] . Los valores de los parámetros eléctricos necesarios para la electroporación óptima [1] y electrofusión difieren entre las distintas células y depende del tamaño de las células y sus propiedades biológicas. Parámetros eléctricos tanto, deben ser optimizados para diferentes líneas celulares, que se utilizan como socios de la fusión, para obtener la fusión.
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por la Agencia de Investigación de Eslovenia (proyecto J2-9764 y el programa P2-0249). Este video representa el material complementario para la "base de electroporación, tecnologías y tratamientos" taller científico y postgrado, organizado por la Facultad de Ingeniería Eléctrica de la Universidad de Ljubljana, en Eslovenia.
Materiales
| Name | Company | Catalog Number | Comments | |
| CMRA | Reagent | Invitrogen | C34551 | Cytosolic fluorescent dye |
| CMFDA | Reagent | Invitrogen | C7025 | Cytosolic fluorescent dye |
| DMSO | Reagent | Sigma-Aldrich | D2650 | |
| DMEM | Reagent | Sigma-Aldrich | D5671 | Dulbecco’s modified Eagle’s medium |
| Fetal calf serum | Reagent | Sigma-Aldrich | F4135 | |
| L-glutamine | Reagent | Sigma-Aldrich | G7513 | |
| crystacillin | Reagent | Pliva | 625110 | antibiotic |
| gentamicin | Reagent | Sigma-Aldrich | G1397 | antibiotic |
| Hepes | Reagent | Sigma-Aldrich | H0887 | |
| KH2PO4 | Reagent | Merck & Co., Inc. | A124873 927 | |
| KH2PO4 | Reagent | Sigma-Aldrich | 4248 | |
| MgCl2 | Reagent | Sigma-Aldrich | M-8266 | |
| NaCl | Reagent | Fluka | 71382 | |
| KCl | Reagent | Merck & Co., Inc. | A154336 908 | |
| MgSO4 | Reagent | Sigma-Aldrich | M2643 | |
| D-glucose | Reagent | Sigma-Aldrich | G8270 | |
| CaCl2 | Reagent | Sigma-Aldrich | C4901 | |
| sucrose | Reagent | Sigma-Aldrich | 16104 | |
| Electric pulse generator | Tool | IGEA | Cliniporator VITAE | |
| Multiwell plate | Tool | Techno Plastic Products | 92424 | |
| 50 ml centrifuge tube | Tool | Techno Plastic Products | 91050 | |
| 15 ml centrifuge tube | Tool | Techno Plastic Products | 91015 | |
| 25 cm2 culture flask | Tool | Techno Plastic Products | 90026 | |
| Electrodes | Tool | Custom Made | Pt/Ir |
Referencias
- Čemazar, M., Jarm, T., Miklavčič, D., Maček-Lebar, A., Ihan, A., Kopitar, N. A., Serša, G. Effect of electric-field intensity on electropermeabilization and electrosensitivity of various tumor-cell lines in vitro. Electro. Magnetobiol. 17, 263-272 (1998).
- Trontelj, K., Reberšek, M., Kandušer, M., čurin šerbec, V., Miklavčič, D. Optimization of bulk cell electrofusion in vitro for production of human-mouse heterohybridoma cells. Bioelectrochemistry. 74, 124-129 (2008).
- Rols, M. -. P., Teissié, J. Modulation of electrically induced permeabilization and fusion of Chinese hamster ovary cells by osmotic pressure. Biochemistry. 29, 4561-4567 (1990).
- Neil, G., Zimmermann, U. Electrofusion. Methods in Enzymology. 220, 174-196 .
- Abidor, I. G., Li, L. -. H., Hui, S. W. Studies of cell pellets: II. Osmotic properties, electroporation, and related phenomena: Membrane interactions. Biophysical journal. 67, 427-435 (1994).
- Jaroszeski, M. J., Gilbert, R., Fallon, P. G., Heller, R. Mechanically facilitated cell-cell electrofusion. Biophys J. 67 (4), 1574-1581 (1994).
- Ramos, C., Bonefant, D., Teissié, J. Cell hybridization by electrofusion on filters. Analytical biochemistry. 302, 213-219 (2002).
- Cao, Y., Yang, J., Yin, Z. Q. Study of high-throughput cell electrofusion in a microelectrode-array chip. Microfluid Nanofluid. 5, 669-675 (2008).
- Ušaj, M., Trontelj, M., Kandušer, M., Miklavčič, D. Cell size dynamics and viability of cells exposed to hypotonic treatment and electroporation for electrofusion optimization. Radiol. Oncol. 43, 108-119 (2009).
- Teissié, J., Ramos, C. Correlation between electric field pulse induced long-lived permeabilization and fusogenicity in cell membranes. Biophys. J. 74, 1889-1898 (1998).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados