Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Aislamiento, enriquecimiento y mantenimiento de las células madre meduloblastoma
En este artículo
Resumen
Este protocolo describe el aislamiento, el enriquecimiento y mantenimiento de las células madre tumorales meduloblastoma derivados de ratones mutantes con ectópico actividad de la vía sonic hedgehog.
Resumen
Los tumores cerebrales se ha sugerido que posee una pequeña población de células madre que son la causa principal de la tumorogénesis. Neuroesfera ensayos han sido generalmente adoptado para estudiar la naturaleza de las células madre neuronales, incluyendo los derivados de los tejidos normales y tumorales. Sin embargo, cantidades apreciables de diferenciación y muerte celular son comunes en neuroesferas cultivadas probablemente debido a la sub-óptimas condiciones tales como la accesibilidad de todas las células dentro de los agregados ámbito de medio de cultivo.
Meduloblastoma, el tumor infantil más común del SNC, se caracteriza por su rápida progresión y tendencia a expandirse por todo el cerebro-espinal eje con el resultado clínico deprimente. El meduloblastoma es un tumor neuroepitelial del cerebelo, que representan el 20% y 40% de los tumores de fosa intracraneal y posterior en la infancia, respectivamente 1. Es bien sabido ahora que la señalización de Shh estimula la proliferación de los precursores del cerebelo gránulo neurona (CGNPs) durante el desarrollo del cerebelo 2-4. Numerosos estudios utilizando modelos de ratón, en el que es constitutivamente la vía de Shh activa, han relacionado la señalización de Shh con meduloblastoma 5-9.
Un informe reciente ha demostrado que un subgrupo de células derivadas de meduloblastoma Patched1 ratones LacZ / + son las células madre del cáncer, que son capaces de iniciar y propogating tumores 10. A continuación se describe un método eficiente para aislar, enriquecer y mantener las células madre tumorales derivadas de varios modelos de ratones de meduloblastoma, con la vía activada constitutivamente Shh debido a una mutación en el alisado (11, en adelante nos referiremos como SmoM2), un GPCR que es fundamental para Shh vía de activación. En todos los tejidos meduloblastoma aislados, hemos sido capaces de establecer numerosas colonias que se reproducen más. Estas células expresan varios marcadores con firmeza las células madre neurales, como Nestin y Sox2, pueden someterse a los pases en serie (más de 20) y se clonación. Mientras que estas células madre tumorales cultivadas eran relativamente pequeñas, a menudo con bipoar nucleares de alta relación núcleo: citoplasma cuando se cultivan en condiciones que favorecen el crecimiento de células madre, que alteró dramáticamente su morfología, extendió múltiples procesos celulares, aplanado y se retiró del ciclo celular al cambiar a una celda medio de cultivo suplementado con suero fetal bovino al 10%. Más importante aún, estas células madre tumorales diferenciadas en Tuj1 + o + NeuN neuronas, GFAP + astrocitos y oligodendrocitos CNPase +, destacando así sus múltiples potencia. Además, estas células eran capaces de propagar meduloblastomas secundaria cuando ortotópicamente trasplantadas a ratones de acogida.
Protocolo
1. Microdisección de portadores de tumores del cerebelo, la disociación del tejido del tumor y de las planchas
- Recuperación del tejido tumoral
- Meduloblastoma enfermos ratones portadores se runted a menudo, muestran hidrocefalia y típicos síntomas neurológicos, incluyendo parálisis posterior y el fracaso para recuperar la posición en caso de vuelco. Para recuperar el tejido tumoral, la eutanasia a los ratones por inhalación de dióxido de carbono. Es importante no realizar la dislocación cervical, un procedimiento que genera una presión en el cráneo y posterior pueden poner en peligro la integridad del tejido tumoral.
- La decapitación se realiza inmediatamente después de la muerte con un par de tijeras, quitar el pelo y el tejido muscular tanto como sea posible para una buena visualización del cráneo. Limpie la superficie del cráneo con Kimwipe empapado con etanol al 95%.
- Use tijeras finas para cortar una abertura a lo largo de la línea media del cráneo, y eliminar el tejido del cráneo con unas pinzas finas, momento en el que todo el cerebro incluyendo el cerebelo con tumores está expuesto.
- Mientras que el cerebelo de los adultos sanos pantalla bien definida hemisferios y el vermis, el cerebelo de ratones portadores de tumores a menudo son ampliadas, amorfa con una superficie lisa y los vasos sanguíneos visibles. El uso de técnicas estériles, recuperar el tumor cerebeloso con unas pinzas y colocar en helado de PBS sin Mg 2 + y Ca 2 +.
- La disociación del tejido tumoral
- Transferir el tejido tumoral de PBS al 50% Accutase (diluido en PBS), que es de aproximadamente 4 veces el volumen del tejido del tumor, el picadillo de tejido con tijeras finas durante 3 minutos a temperatura ambiente, seguido de incubación a 37 ° C durante 4 minutos , tras lo cual el tejido se somete a pipetear repetitivo con un Pipetman de 1 ml durante 3 minutos. Este método se debe dar una mezcla de células individuales y pequeños agregados celulares.
- Diluir la suspensión celular 3 veces con PBS y centrifugar durante 5 minutos a 1000 g para precipitar las células. Resuspender el botón celular en medio fresco cultura neural de células madre y la placa en un gelatinizada 60 mm Primaria plato de cultivo de tejidos. Utilizamos platos Primaria para la fijación de placas mejoradas primera pasajes posteriores pueden ser sembradas en platos de cultivo de tejido normal.
Nota: todos los instrumentos se esterilizan en etanol al 95% antes de su uso.
Nota: platos Escudo cultura con 0,1% de gelatina durante al menos 30 minutos. Prepare frescos de células madre neurales medio de cultivo sobre el medio Neurobasal con la glutamina, la pluma Strep-, N2, B27, EGF humano (25 ng / mL) y el FGF básico (25 ng / mL).
2. Enriquecimiento, mantenimiento y expansión de las células del tumor meduloblastoma por pases seriados
Por lo general, obtener muchas colonias después de 1 semana de la siembra inicial (Figura 1). Estas colonias pueden ser disociados y replated en nuevos platos gelatinizada para el enriquecimiento de la población de células tumorales. Primer cambio de medio de cultivo nuevo, basta con utilizar un Pipetman de 1 ml para separar mecánicamente las colonias seguido por pipeta repetitiva durante 4 minutos para obtener una suspensión celular (no Accutase es necesario). Compruebe bajo un microscopio para asegurarse de que grupos de células grandes se han disociado. Entonces prescindir de la suspensión de células en nuevos platos gelatinizada para el cultivo de más y pasar por el mismo procedimiento para pasajes adicionales. Las células tumorales sin ataduras, las células sanguíneas y otros tipos de células son eliminadas por serie re-chapados, dejando a las células tumorales unido a una rápida expansión. Cambio medio de cultivo en el segundo día después de la siembra inicial, y cada dos días después.
3. La tinción de inmunofluorescencia y el examen de las células cultivadas
1. Crecen las células tumorales en cubreobjetos de vidrio
El día 1, un lugar cubreobjetos de vidrio en cada uno de una placa de 6 pocillos, a continuación, agregar 0,1% de gelatina durante 30 minutos a 37 ° C. Semillas de aproximadamente 2-4X 10 5 células tumorales por ml. Las células deben adjuntar toda la noche y el medio de células madre neurales cambiado el día 3. Tinción se lleva a cabo el día 4.
2 tinción de inmunofluorescencia
Retire el medio de cultivo y las células se lavan dos veces con helado de PBS. Fijar las células con el recién hechas el 4% PFA durante 15 minutos. En pocas palabras lavar las células dos veces con PBS y permeablize con 0,3% Triton (en PBS) durante 5 minutos. En pocas palabras lavar las células dos veces con PBS y se bloquea con suero de cabra al 10% durante 40 minutos. Se incuban las células con el anticuerpo primario durante 90 minutos, luego lavar las células tres veces con PBS, durante 5 minutos cada uno. Se incuban las células con el anticuerpo secundario durante 60 minutos, luego lavar tres veces con PBS, 5 minutos cada uno. Monte cubreobjetos en diapositivas con 5 ml de un medio de montaje acuoso y realizar microscopía confocal.
4. La diferenciación de las células tumorales
Quitar medio de células madre neurales y brevemente lavar las células con PBS dos veces. Añadir medio de diferenciación en el día 1, el cambio medio en el día 4 y determinar el nivel de diferenciación por inmunofluorescencia en el día 7. El medio de diferenciación consiste en DMEM, Pen Strep-y el 10% de suero fetal bovino.
5. Resultados representante
Resultados de la morfología
Después del tratamiento Accutase y pipeta repetitiva suave, el tejido del tumor debe ser en su mayoría se disocian en pequeños agregados celulares y células individuales. Muchas colonias considerable se puede observar a los 5 días después de placas inicial, como se muestra en la Figura 1. Las células tumorales de proliferación a menudo son bi-polar con una alta tasa núcleo / citoplasma. Estas células se ven normalmente irradia de pequeños agregados celulares adheridos a la superficie gelatinizada. Células de la sangre, pequeño y redondo, generalmente se retiran los medios de comunicación por los cambios posteriores y revestimientos de serie. Después de varios pasajes, se puede observar uniformemente distribuidos, de proliferación Ki67 + en las células tumorales y poca contaminación con otros tipos de células (Figura 2).
Expresión de marcadores de células madre neuronales, análisis clonal y diferenciación en múltiples linajes
Para determinar si las células de proliferación derivado de disociar las características del tumor del cerebelo muestra de tejido de células madre tumorales, se realizó una caracterización adicional por la expresión de marcadores de células madre, el análisis clonal y la potencia de diferenciación. Hemos encontrado que estas células tumorales aisladas altamente expresar marcadores de células madre neurales, como Sox2 y Nestin (Figura 3). Como se recuperaron los tejidos de SmoM2-YFP tumor, todas las células tumorales expresan YFP. De acuerdo con un estudio reciente informa que los cilios primarios son importantes para el desarrollo de Shh vía dependiente de meduloblastoma 12, SmoM2-YFP expresión fue localizado con claridad a los cilios de las células tumorales Sox2 + (Figura 3). Cuando se siembran a una densidad clonal de 300 células por ml de medio de cultivo, se observó la expansión clonal de una célula tumoral única a una colonia importante (Figura 4). Además, estas células fueron capaces de diferenciarse en diversos tipos de células neuronales y gliales cuando se cultiva en condiciones de diferenciación a favor de (Figura 5).
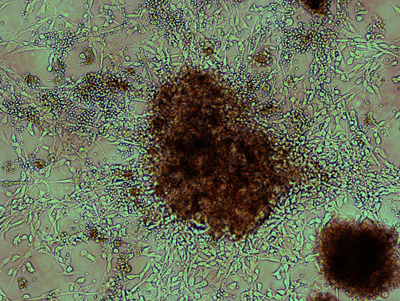
Figura 1. Morfología de una colonia de proliferación después de la siembra de primera de tejido meduloblastoma disociados. Por lo general, se forma una colonia importante dentro de 5 días después de la siembra inicial de tejido tumoral disociado, y un representante se ilustra aquí, en campo claro. Bi-polar, células alargadas irradian de un agregado de núcleo de célula denso. Unido a las células tumorales son células pequeñas, redondas rojas de la sangre, que el agotamiento gradual de recubrimientos de serie.

Figura 2. Morfología de las células de meduloblastoma establecido más allá de los tres pasajes. Esta imagen de campo claro se muestra el aspecto típico de las células de meduloblastoma establecido después de varios pasajes. Las células permanecen en su mayoría bi-polar de alta nuclear / citoplasma. Nos muestran una tinción tubulina acetilada de las células tumorales, la mayoría de los cuales son el ciclismo como lo demuestra una fuerte expresión de Ki67.
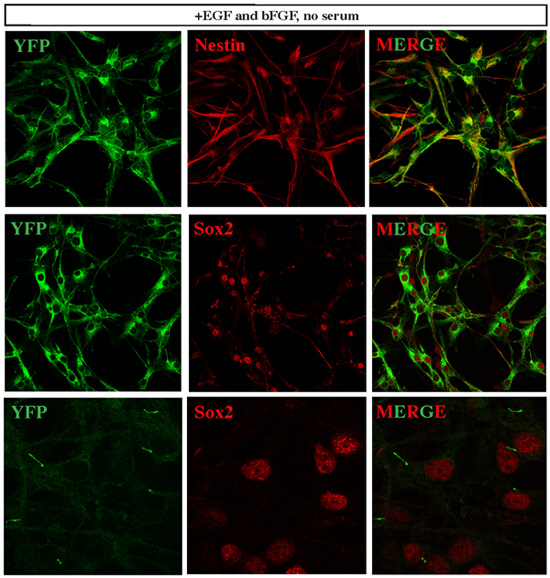
Figura 3. Establecido células de meduloblastoma expresan marcadores de células madre neurales. SmoM2-YFP marca las células que expresan constitutivamente activa Smo, por lo tanto, actividad de la vía de Shh. Todas las células de las líneas celulares establecidas meduloblastoma expresó YFP, y la mayoría de ellos co-expresaron altos niveles de varios marcadores de células madre neurales, como Nestin y Sox2. Curiosamente, cuando se realizó la detección YFP señal con la potencia del láser durante un mínimo de microscopía confocal, se detectó la señal concentrada YFP en los cilios de las células Sox2 +. Esta observación es consistente con un reciente informe de 12 que se describe el papel esencial de los cilios en el desarrollo de Shh vía dependiente de meduloblastoma.
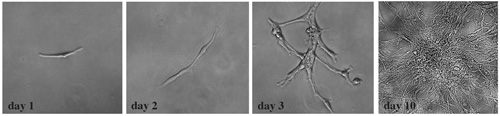
Figura 4. Estableció las células tumorales experimentar expansión clonal. Después de la disociación en suspensión de células individuales, las células tumorales se sembraron en una placa de 24 pocillos a una densidad clonal de 300 células por ml de medio de cultivo. En cada pozo se observó colonias clonal ampliado. Esta serie de imágenes de campo claro demostrar cambios típicos durante un período de 10 días de la cultura.

Figura 5. Análisis de la diferenciación de las células de meduloblastoma establecido. Cuando las células tumorales fueron cambiados de EGF / bFGF contiene medio libre de suero para DMEM/10% de SFB, YFP + células tumorales alterado de manera significativa su morphology y diferenciado en varios tipos celulares, incluyendo Tuj1 + o + NeuN las neuronas, las células GFAP + astroglial o CNPase + oligodendrocitos.
Discusión
Se describe una forma eficiente de aislar, enriquecer y mantener las células madre del tejido meduloblastoma tumor primario recuperado de ratones mutantes con constitutivamente activa la señalización de Hedgehog. Hemos encontrado que un paso crítico en el establecimiento exitoso de una madre sana tumor línea celular es el tratamiento Accutase utilizados durante la disociación del tejido del tumor primario. En nuestra experiencia, cuando el tejido del tumor primera disociación del cerebelo, 4 minutos de tratamient...
Divulgaciones
Agradecimientos
Este estudio fue apoyado por subvenciones del Vanderbilt-Ingram Cancer Center de Apoyo Grant (P30 CA068485), la Fundación cerebrales infantiles del tumor y de los Institutos Nacionales de Salud (NS042205).
Materiales
| Name | Company | Catalog Number | Comments |
| Neurobasal medium | Invitrogen | 21103049 | |
| hEGF | Invitrogen | PHG0311 | 25ng/ml |
| bFGF | Invitrogen | PHG0023 | 25ng/ml |
| N2 | Invitrogen | 17502048 | 1X |
| B27(-RA) | Invitrogen | 12587010 | 1X |
| Accutase | Invitrogen | A1110501 | 50% |
| Gelatin | Sigma-Aldrich | G1393 | 0.1% |
| Glutamine | Invitrogen | 25030081 | 2mM |
| Primaria dishes | Fisher Scientific | 087724C | |
| Sox2 antibody | EMD Millipore | MAB4343 | Mouse, 1:1000 |
| Nestin antibody | DSHB | rat401 | Mouse, 1:200 |
| YFP antibody | Molecular Probes, Life Technologies | A11122 | Rabbit, 1:2000 |
| GFAP antibody | Neuromics | CH22102 | Chicken, 1:1000 |
| Tuj1 antibody | Sigma-Aldrich | T5076 | Mouse, 1:2000 |
| NeuN antibody | EMD Millipore | MAB377 | Mouse, 1:2000 |
| CNPase antibody | EMD Millipore | MAB326 | Mouse, 1:1000 |
Referencias
- Rossi, A., Caracciolo, V., Russo, G. Medulloblastoma: From Molecular Pathology to Therapy. Clin Cancer Res. 14 (4), 971-971 (2008).
- Wechsler-Reya, R. J., Scott, M. Control of Neuronal Precursor Proliferation in the Cerebellum by Sonic Hedgehog. P. Neuron. 22 (1), 103-103 (1999).
- Dahmane, N., Ruiz, A., Altaba, I. Sonic hedgehog regulates the growth and patterning of the cerebellum. Development. 126 (14), 3089-3089 (1999).
- Wallace, V. A. Purkinje-cell-derived Sonic hedgehog regulates granule neuron precursor cell proliferation in the developing mouse cerebellum. Curr Biol. 9 (8), 445-445 (1999).
- Fan, X., Eberhart, C. G. Medullablastoma Stem Cells. J Clin Oncol. 26 (17), 2821-2821 (2008).
- Yoon, J. W., Gilbertson, R., Iannaccone, S. Defining a Role for Hedgehog Pathway Activation in Desmoplastic Medulloblastoma by Identifying GLI1 Target Genes. International journal of cancer. 124 (1), 109-109 (2009).
- O'Dorisio, M. S., Khanna, G., Bushnell, D. Combining anatomic and molecularly targeted imaging in the diagnosis and surveillance of embryonal tumors of the nervous and endocrine systems in children. Review. Cancer metastasis reviews. 27 (4), 665-665 (2008).
- Corcoran, R. B., Bachar Raveh, T., Barakat, M. T. Insulin-like Growth Factor 2 Is Required for Progression to Advanced Medulloblastoma in patched1 Heterozygous Mice. Cancer research. 68 (21), 8788-8788 (2008).
- Gilbertson, R. J., Ellison, D. W. The Origins of Medulloblastoma Subtypes. Annual review of pathology. 3, 341-341 (2008).
- Ward, R. J., Lee, L., Graham, K. Multipotent CD15+ Cancer Stem Cells in Patched-1 Deficient Mouse Medulloblastoma. Cancer research. 69 (11), 4682-4682 (2009).
- Mao, J., Ligon, K. L., Rakhlin, E. Y. A Novel Somatic Mouse Model to Survey Tumorigenic Potential Applied to the Hedgehog Pathway. Cancer research. 66, 10171-10171 (2006).
- Han, Y. G., Kim, H. J., Dlugosz, A. A. Dual and opposing roles of primary cilia in medulloblastoma development. Nature medicine. 15 (9), 1062-1062 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados