Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Prueba de Actividad Protozoacidal de ligando-lítica péptidos intestinales contra termitas protozoos In vitro (Cultura protozoos) y In vivo (Microinyección en termitas intestino grueso)
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presentan los procedimientos para demostrar que los ligandos se unen a la membrana de la superficie de la celulosa para digerir estos protozoos en el intestino de las termitas subterráneas de Formosa utilizando microscopía de fluorescencia y los ligandos que, junto con los péptidos líticos matar protozoarios In vitro (Cultivo de anaerobios protozoos) y In vivo (Inyección en el intestino grueso de termitas).
Resumen
Estamos desarrollando un nuevo enfoque para el control de termitas subterráneas que conducirían a una menor dependencia del uso de pesticidas químicos. Las termitas subterráneas son dependientes de los protozoos en el hindguts de los trabajadores para digerir eficientemente la madera. Péptidos líticos se ha demostrado que matar a una variedad de parásitos protozoarios (Mutwiri et al. 2000) y protozoos en el intestino de las termitas subterráneas de Formosa, Coptotermes formosanus (Husseneder y Collier 2009). Péptidos líticos son parte del sistema inmunológico inespecífico de los eucariotas, y destruir las membranas de los microorganismos (Leuschner y Hansel, 2004). La mayoría de los péptidos líticos no pueden perjudicar a los eucariotas superiores, porque no afectan a la eléctricamente neutros que contienen colesterol de las membranas celulares eucariotas superiores (Javadpour et al. 1996). La acción de péptidos líticos pueden ser dirigidos a tipos específicos de células mediante la adición de un ligando. Por ejemplo, Hansel et al. (2007) informó que los péptidos líticos conjugado con ligandos celulares de cáncer receptor de membrana podría usarse para destruir las células de cáncer de mama, mientras que los péptidos líticos solos o conjugados con los no-péptidos específicos no fueron efectivos. Péptidos líticos también se han conjugado con las hormonas humanas que se unen a los receptores en las células tumorales para la destrucción selectiva de la próstata y las células de cáncer de testículo (Leuschner y Hansel, 2004).
En este artículo se presentan las técnicas utilizadas para demostrar la actividad protozoacidal de un péptido lítico (Hécate), junto a un ligando heptapéptido que se une a la membrana de la superficie de los protozoos en el intestino de las termitas subterráneas de Formosa. Estas técnicas incluyen la extirpación del intestino de las termitas obreras, la cultura anaeróbica de los intestinos protozoos (Pseudotrichonympha grassii, Holomastigotoides hartmanni,
Spirotrichonympha leidyi), confirmación microscópica que el ligando marcado con un tinte fluorescente se une al intestino de termitas protozoos y otros protozoos de vida libre, pero no a las bacterias o tejido intestinal. También demuestran que el mismo ligando unido a un péptido lítico eficiente mata termitas protozoos intestinales in vitro (cultivo de protozoos) e in vivo (microinyección en el intestino posterior de los trabajadores), pero es menos bactericida que el péptido lítico solo. La pérdida de protozoos lleva a la muerte de las termitas en menos de dos semanas.
En el futuro, que será genéticamente ingeniero de microorganismos que pueden sobrevivir en el intestino de termitas y la difusión a través de una colonia de termitas como "Caballos de Troya" para expresar ligando-lítica péptidos que matar a los protozoos en el intestino de termitas y posteriormente matar a las termitas en la colonia . Ligando-lítica péptidos también podrían ser útiles para el desarrollo de medicamentos contra los parásitos protozoarios.
Protocolo
Experimento 1: Extracción de la tripa de termitas protozoos en condiciones anaeróbicas
- Use una caja del ventilador (Laboratorios Coy) en una caja de guantes para hacer circular constantemente aire a través de un desecante y el tipo D catalizador Stak Paks-para controlar la humedad y los niveles de oxígeno y eliminar temperaturas irregulares. Llene la caja de guantes con un flujo continuo de nitrógeno de 20 a 30 min. Monitorear los niveles de oxígeno con un sensor de oxígeno (C al cuadrado, Inc.) durante 1 h. El uso de nitrógeno para alcanzar y mantener las condiciones anaeróbicas cuando sea necesario.
- Prepare Trager U medios de comunicación (Trager 1934) y ajustar el pH a 7.0. Aspersión del filtro esterilizado en la guantera con una mezcla de 2,5% de hidrógeno, dióxido de carbono al 5% y el 92,5% de nitrógeno durante 1 h para eliminar los restos de oxígeno.
- Silanizar todos los materiales incluyendo el microscopio, tubos de microcentrífuga, pipetas, vasos, etc utilizados en los experimentos con Sigmacote para evitar la adsorción de los protozoos o los péptidos a las superficies (Sigmacote, Sigma, # SL-2, http://www.sigmaaldrich.com/ etc / mediaLib / docs / Sigma/Product_Information_Sheet/1/sl2pis.Par.0001.File.tmp/sl2pis.pdf).
- Desde el intestino de termitas protozoos son organismos anaerobios estrictos que no debe ser expuesto al oxígeno. Por lo tanto, los siguientes pasos se llevan a cabo en condiciones anaeróbicas en una caja de guantes (ver 1.1). Con una pinza de sumergir todo el cuerpo de un trabajador de termitas en el 70% de etanol y agite suavemente durante unos 10 s para eliminar los contaminantes de la superficie.
- Retire al trabajador de que el etanol y dejar secar en una Kimwipe limpia durante unos 20 s. Use un recipiente estéril de punta fina pinza para sostener el abdomen de los trabajadores y apoderarse de la punta del abdomen con otro par de pinzas para tirar suavemente el intestino hacia arriba o hacia abajo en un ángulo de 45 grados. Si el intestino se tira en un ángulo recto y con mucha fuerza, es probable que se rompan. Lugar 10 en las tripas una caída de 100 medios de comunicación l Trager U sobre un portaobjetos de microscopio.
- Pierce la tripa con un par de sondas estériles fina disección para liberar a los protozoos y suavemente transferir el contenido de los intestinos con una pipeta 200 l en un tubo de microcentrífuga de 1 ml que contiene 900 l Trager U medios de comunicación. Después de permitir la sedimentación de los fragmentos de la pared intestinal (5 s), la transferencia de 900 l del sobrenadante a un tubo nuevo.
- Transferencia de 10 l de la cultura protozoos a un portaobjetos de microscopio sigmacoted y comprobar el estado de los protozoos al microscopio con un aumento de X 200.
- Preparar cultivos de control de la Tetrahymena pyriformis aeróbico protozoos, amebas sp. Euglena sp. Y sp Paramecium. (Carolina Biological Supply Company, Burlington, Carolina del Norte), así como un cultivo de una noche de Escherichia coli en los medios de cultivo recomendados por el proveedor.
Experimento 2: Agregar ligando junto con un colorante fluorescente a los protozoos y las bacterias culturas para la prueba de la unión a la superficie de las membranas y paredes celulares
Antes utilizábamos las bibliotecas de fagos (New England Biolabs Inc, Ipswich, MA) para identificar 19 secuencias heptapéptido que se unen a los protozoos (protocolos disponibles en http://www.neb.com/nebecomm/ManualFiles/manualE8110.pdf). Un ligando con una secuencia de péptidos (ALNLTLH) que mostraba similitudes con las glicoproteínas supuestos conocidos de la membrana del Trypanosoma brucei fue sintetizado y acoplado a una sonda fluorescente C-terminal (Edans, 5 - ((2-aminoetil) amino)-naftaleno-1-sulfónico ácido, λmax = 341 nm, λem = 471 nm) a través de la síntesis de péptidos estado sólido (SSPS), utilizando la resina Edans NovaTag (EMD Biosciences). Aquí demostramos que el ligando se une a los protozoos que fueron aisladas de los intestinos de termitas y otros protozoos de vida libre, pero no a las bacterias.
- La cultura de la protozoos como se describe en el experimento. 1. Fix protozoos con formol al 10% a 4 ° C durante 12 h.
- Centrifugar la solución de los protozoos (30 xg, 10 min), descartar el sobrenadante y lavar el sedimento que contiene los protozoos fija dos veces en 1 ml Trager U medios de comunicación. Vuelva a suspender el precipitado en 1 ml Trager U medios de comunicación. También, fijar otros protozoos y E. bacterias coli para los controles.
- Incubar los microorganismos fijos durante 1-2 h con una solución de ligando sintetizado junto a la Edans tinte fluorescente (preparada en agua) a una concentración final de 50 mM. El ligando se disuelve mejor en agua que los Trager U medios de comunicación.
- Observar los microorganismos en un microscopio de fluorescencia con un aumento de 400 X en un máximo de absorción a 341 nm y una emisión en la región azul a 471 nm.
Experimento 3: Prueba de la actividad protozoacidal del ligando unido a un péptido lítico in vitro (cultivo de protozoos)
Un conjugado del ligando y la lítica Hecate péptido (Mutwiri et al. 2000) fue sintetizado anteriormente en el Fondo para la proteína de LSU.
- Silanizar materiales y preparar cultura termitas protozoos intestinales en la guantera un anaerobios se describe en el experimento. 1.
- Preparar cultivos de microorganismos aerobios de control (por ejemplo, E. coli y pyriformis las especies de vida libre de protozoos T.).
- En el ambiente anaerobio de la caja de guantes, pipetas 6 alícuotas de 198 l de la cultura de los protozoos en 0,5 ml tubos Eppendorf. Añadir 2 l de una solución 100 mM de péptido ligando-lítica de la mitad de las alícuotas (concentración final 1 mM) de la cultura tripa de termitas protozoos. Añadir 2 l de agua a la otra mitad de las alícuotas (controles).
- En el laboratorio, preparar alícuotas similares de E. coli y T. pyriformis con 1 mM de péptido lítico, ligando péptido lítico o el agua.
- Después de 1 h, en 10 l de cada cultura protozoos a las diapositivas. Comparar la supervivencia de los pacientes tratados protozoos a la de los controles con un microscopio con un aumento de X 200.
- Después de 1 h, la placa de 100 l de aprox. 10 -4 dilución de la E. culturas coli en BHI y se incuban a 37 ° C durante la noche. Compare el número de unidades formadoras de colonias en las placas.
Experimento 4: Inyección del ligando unido a un tinte fluorescente en el intestino grueso en las termitas
- Tire las agujas (modelo GD-1, 1 X 900 mm) con un Narishige PC-10 vidrio extractor micropipeta con un nivel de calor de una etapa doble (65 y 48) para obtener un tamaño de la punta de 20-30 micras. Confirmar el tamaño de la punta al medir con un microscopio con un micrómetro.
- Llene una aguja con ca. 30 l de 50 M de ligando marcado con fluorescencia suspendidas en el agua utilizando una jeringa conectada. Llene otra aguja con agua para el control. Adjunte una micropipeta (0,5 l de capacidad y 32 mm de longitud, Drummond Scientific Company) a un titular en un micromanipulador. Coloque una aguja a la titular de sistema de inyección en un micromanipulador segundos. Establezca los parámetros de la inyección inicial de aproximadamente 1 s la duración del impulso y 10-12 psi inyección. Avanzar la aguja lentamente en la micropipeta e inyectar la solución con un pedal impulsados por alta velocidad del sistema de inyección electrónica con una longitud de pulso de control conectado a un flujo de gas nitrógeno controlado, lo que asegura que un volumen constante es reproducible inyectado. Después de la inyección, retirar la micropipeta y registrar la duración de la solución inyectada utilizando un calibrador Vernier. Calcular el volumen inyectado de los parámetros conocidos de la micropipeta. Ajustar la presión de gas nitrógeno y la longitud del pulso para expulsar a 0,3 l solución en una sola inyección.
- Exprima el extremo del abdomen de los trabajadores de termitas con una pinza suave para eliminar las heces presentes en el recto. Inmovilizar a los trabajadores de termitas por el frío en hielo durante 5 min.
- Hacen los receptores para la celebración de las termitas obreras cortando 100 puntas de pipeta l utilizando una hoja de bisturí. Cortar la punta de una longitud de 10 - 12 mm y el uso de acuerdo con el tamaño de las termitas.
- Conecte el receptor a la micromanipulador. Colocar un obrero en una placa de Petri en su lado dorsal y aspirar la cabeza de los trabajadores por primera vez en el receptor con una bomba de succión de nitrógeno de manera que el término de la sobresale de los trabajadores del receptor.
- La celebración de la termita en el receptor, con cuidado avanzar la aguja llena con el micromanipulador para insertarlo en el ano de los trabajadores. Inyectar 0,3 l de la solución (ligando fluorescente marcada o agua para los controles).
- Lugar a los trabajadores inyectado con el ligando o el agua en una cápsula de Petri con papel filtro húmedo y mantenerlos a 26 ± 2 ° C con 78% de HR
- Extirpar las entrañas de las termitas se inyecta y recoger los protozoos después de 24 h como se muestra arriba en el experimento. 1. Fijar y observar los protozoos como se muestra en el experimento. 2.
Experimento 5: Pruebas de la actividad protozoacidal del ligando unido a un péptido lítico en vivo (una inyección en las termitas del intestino grueso)
- Silanizar materiales como se describe en el experimento. 1.
- Prepare una solución de 500 mM del péptido ligando-lítica en el agua.
- Siga los pasos 3.1) a 3.4) para preparar las agujas de vidrio, los receptores y las termitas obreras.
- Siguiendo los métodos descritos en el punto 3.5) se inyecta 0,3 l de solución de péptido ligando-lítico (tratamiento) o agua (control) en el intestino grueso de los 20 trabajadores de termitas.
- Mantenga las termitas durante 24 h, las vísceras extirpar de varios trabajadores y observar el contenido intestinal bajo el microscopio como se describe en 3.6). y 3.7).
- Tan pronto la muerte de los protozoos en el intestino de termitas se confirma, mantener las termitas restantes tratados y los controles en placas de Petri con papel filtro húmedo y observar la mortalidad diaria.
Los resultados representativos:
Experimento 1: Por lo general, intestino anterior, intestino medio y el intestino posterior se obtienen en una sola pieza cuando el procedimiento se sigue correctamente (Figura 1a). Los protozoos viven en alta densidad en las partes anaeróbica del intestino grueso y puede ser liberado por la perforación del intestino grueso con unas pinzas (Figura 1b 1 y 2). La mayor protoespecies zoa en el intestino de las termitas subterráneas de Formosa es la P. en forma de huso grassii, que es de 200-300 micras de largo y 150 micras y se puede ver a simple vista. La segunda especie más grande es el H. en forma de pera hartmanni (50 a 140 micras de largo y 30-80 mm). La especie más pequeña es la S. en forma de cono leidyi (15-50 micras de largo y 8.30 m;. Lai et al, 1983). Las especies de protozoos se muestran en la Figura 2.
En condiciones óptimas de cultivo de las tres especies de protozoarios aislados en el intestino de las termitas subterráneas de Formosa se quedará con vida y saludable por lo menos durante 72 horas en los medios de comunicación anaeróbica Trager U (Figura 3a). Sin embargo, si las condiciones de cultivo no son óptimas protozoos va a morir rápidamente. Si hay residuos de oxígeno en los medios de comunicación, el movimiento de los protozoos se ponga fin de inmediato. Si la presión osmótica es muy alta o la integridad de la membrana se ve comprometida la membrana de la superficie de la protuberancia se protozoos a cabo y la ruptura de las células (Figura 3b). Si la presión osmótica es demasiado bajo o en las membranas se ven comprometidos, los protozoos, se secan y se encogen (Figura 3c).
Experimento 2: Se confirmó que el ligando acoplado a una sonda fluorescente ligado a las tres especies de protozoos del intestino grueso de las termitas subterráneas de Formosa en la densidad detectable. La unión del ligando se produce en la superficie de células enteras (Figura 4). Sitios de unión se concentran en la región anterior de los protozoos en el axostyle (una hoja de microtúbulos) y el núcleo de P. grassii.
Hemos observado algunos autofluorescencia irregular de partículas de madera ingeridos por los protozoos. Sin embargo, la autofluorescencia es generalmente fácil de discernir a partir de la unión específica del ligando, ya que no hay autofluorescencia de la superficie, axostyle y el núcleo (Figura 4).
También se detectó la fluorescencia en todas las bandas de especies de vida libre aeróbica protozoos (Figura 5), lo que sugiere que el ligando se une a las estructuras genéricas de los protozoos. Sin embargo, no se observó la unión del ligando de E. coli.
Experimento 3: Una M de ligando-lítica péptido murieron las tres especies de protozoos en el intestino de las termitas subterráneas de Formosa los trabajadores y de la T. de vida libre pyriformis in vitro en menos de 10 minutos, mientras que los controles se mantuvo con vida. La Figura 6 muestra la pérdida progresiva de la integridad de la membrana de los intestinos de termitas protozoos tratados con péptido ligando-lítico. Membranas de bombeo y de la ruptura, se marchitan y mueren los protozoos. No se observaron diferencias en el número de E. colonias coli entre los tratamientos de ligando-lítica de péptidos y el agua. Péptido lítico sin ligando, sin embargo, redujo el número de E. colonias coli considerablemente (Figura 7). Esto sugiere que la unión del ligando en cierta medida protege los microorganismos no objetivo de la lisis.
Experimento 4: Cuando 0,3 l 50 M del ligando marcado con fluorescencia se inyecta en el intestino grueso de los trabajadores de las termitas, la unión a P. grassii, S. leidyi y H. hartmanni fue confirmado a través de microscopía de fluorescencia similar a Exp. 2 (Figura 4). Tejido intestinal termitas no mostraron fluorescencia.
Experimento 5: La inyección de 0,3 l 500 M péptido ligando-lítica murieron las tres especies de protozoos en el intestino de las termitas subterráneas de Formosa dentro de 24 horas. Las termitas murió dentro de 10 días después de la pérdida de su protozoos simbióticos. Anteriormente, Husseneder y Collier (2009) inyectaron la misma concentración de péptido lítico en las entrañas de termitas. Sin el ligando unido, que tomó más tiempo hasta que los protozoos en el intestino (72 h) y las termitas estaban muertos (seis semanas). Esto sugiere que el ligando aumenta la eficiencia de péptidos protozoacidal lítico, lo más probable por la unión de los péptidos líticos de los protozoos.
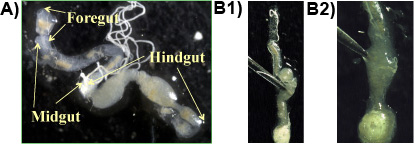
Figura 1. a: Formosa intestino de termitas subterráneas en una diapositiva que muestra las principales secciones del intestino (delanteras, mediados de intestino grueso), b 1 y 2: intestino posterior se perfora con una pinza para liberar el contenido intestinal que contiene los protozoos.

Figura 2. Las tres especies de protozoos flagelados en el intestino grueso de las termitas subterráneas de Formosa: a) Pseudotrichonympha grassii, b) Holomastigotoides hartmanni, y c) leidyi Spirotrichonympha.

Figura 3. Protozoos en la cultura, un sano) protozoos, b) Los protozoos con membranas protuberantes, c) arrugadas protozoos.

Figura 4. La confirmación de la unión del ligando acoplado a una sonda fluorescente a las termitas del intestinoprotozoos (de arriba a abajo: P. grassii, H. hartmanni, S. leydi), tratados con el ligando fluorescente marcado y los controles no tratados (mostrando autofluorescencia).

Figura 5. Unión del ligando a protozoos de vida libre aeróbica, a) Tetrahymena, b) la ameba, c) Euglena y Paramecium d).
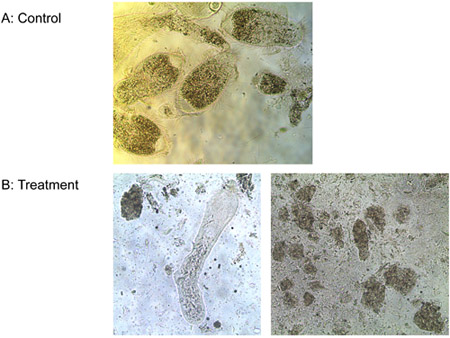
Figura 6. El tratamiento de los protozoos con agua) (control) y b) un ligando M-lítica de péptidos.
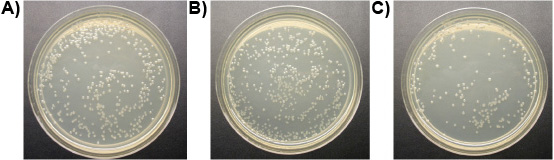
Figura 7. E. colonias coli en las placas (10 dilución -4): a) se trata con agua (control), b) tratados con 1 mM de péptido ligando-lítica, c) tratados con una M péptido lítico.
Access restricted. Please log in or start a trial to view this content.
Discusión
Ligando-lítica péptidos se han utilizado con éxito para hacer frente eficazmente y destruir las células cancerosas (Hansel y Leuschner 2004, Hansel et al. 2007). Basado en este concepto, hemos desarrollado un ligando heptapéptido que se une a la superficie de los protozoos en el intestino de las termitas subterráneas de Formosa y junto a un péptido lítico con el objetivo de destruir estos obligan digerir la celulosa-simbiontes en el intestino de las termitas para conseguir termitas control (Husseneder y...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Agradecemos al Dr. Richard Allison, ex director de la instalación de péptido LSU para la síntesis de ligandos fluorescentes, el Centro de Investigación de Biotecnología Interdisciplinaray, UF para la síntesis del péptido ligando-lítica, y la instalación del microscopio Socolovsky para facilitar el acceso a los microscopios de fluorescencia. El financiamiento fue proporcionado por el Programa de Desarrollo SERDP exploratorio (SEED) del Departamento de Defensa, el Departamento de Energía y la Agencia de Protección Ambiental, el Programa de Biotecnología AgCenter Equipo Interdisciplinario y el estado de Louisiana.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Sigmacote | Sigma-Aldrich | SL-2 | |
| EDANS | Novabiochem, EMD Millipore | ||
| Anaerobic glove box | Coy Laboratories, Inc. | Custom made | |
| Intellus environmental controller | Percival Scientific, Inc. | I36NL | |
| PC-10 Glass micropipette puller | Narishige International | PC-10 | |
| Glass needles (Model GD-1, 1 X 900 mm) | Narishige International | GD-1 | |
| Leitz micromanipulators | Vermont Optechs, Inc. | ACS01 | |
| Microinjector | Tritech Research, Inc. | MINJ-1 | |
| Microcaps | Drummond Scientific | 1-000-0005 | |
| LEICA fluorescence imaging system | Leica Microsystems | DMRxA2 | |
| LEICA dissecting scope | Leica Microsystems | MZ16 | |
| LEICA microscope | Leica Microsystems | DMLB | |
| Olympus dissecting scope | Olympus Corporation | SZ61 |
Referencias
- Hansel, W., Leuschner, C., Enright, F. Conjugates of lytic peptides and LHRH or βCG target and cause necrosis of prostate cancers and metastases. Mol. Cell. Endocrinol. 269, 26-33 (2007).
- Husseneder, C., Collier, R. E. Paratransgenesis for termite control. Insect Symbiosis. Bourtzis, K., Miller, T. A. 3, CRC Press LLC. Boca Raton, Florida. Volume 3 361-376 (2009).
- Husseneder, C., Grace, J. K., Oishi, D. E. Use of genetically engineered bacteria (Escherichia coli) to monitor ingestion, loss and transfer of bacteria in termites. Curr. Microbiol. 50, 119-123 (2005).
- Husseneder, C., Grace, J. K. Genetically engineered termite gut bacteria deliver and spread foreign genes in termite colonies. Appl. Microbiol. Biotechnol. 68, 360-367 (2005).
- Javadpour, M. M., Juban, M. M., Lo, W. C., Bishop, S. M., Alberty, J. B., Cowell, S. M., Becker, C. L., Mc Laughlin, M. L. De novo antimicrobial peptides with low mammalian cell toxicity. J. Med. Chem. 39, 3107-3113 (1996).
- Lai, P. Y., Tamashiro, M., Fuji, J. K. Abundance and distribution of the three species of symbiotic protozoa in the hindgut of Coptotermes formosanus (Isoptera). Proc. Haw. Entomol. Soc. 24, 271-276 (1983).
- Leuschner, C., Hansel, W. Membrane disrupting lytic peptides for cancer treatments. Curr. Pharm. Des. 10, 2299-2310 (2004).
- Mutwiri, G. K., Henk, W. G., Enright, F. M., Corbeil, L. B. Effect of the Antimicrobial Peptide, d-Hecate, on Trichomonads. J. Parasitol. 86, 1355-1359 (2000).
- Trager, W. The cultivation of a cellulose-digesting flagellate, Trichomonas termopsidis, and of certain other termite protozoa. Biol. Bull. 66, 182-190 (1934).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados