Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
En vivo en el infrarrojo cercano fluorescencia (NIRF) imagen intravascular molecular de placa inflamatoria, un enfoque multimodal de imágenes de la aterosclerosis
En este artículo
Resumen
Se detalla una nueva en el infrarrojo cercano fluorescencia (NIRF) catéter de dos dimensiones de imagen intravascular molecular de la biología de la placa In vivo. El catéter NIRF pueden visualizar procesos biológicos clave, como la inflamación de la presentación de informes sobre la presencia de placa-ávido fluorocromos NIR activable y selectiva. El catéter se utiliza requisitos de ingeniería clínica y el poder y está destinada a la aplicación de las arterias coronarias humanas. El estudio de investigación A continuación se describe una estrategia de imagen multimodal que utiliza una novela In vivo NIRF intravascular del catéter a la imagen y cuantificación de placa inflamatoria en atheromata conejo proteolíticamente activos inflamados.
Resumen
The vascular response to injury is a well-orchestrated inflammatory response triggered by the accumulation of macrophages within the vessel wall leading to an accumulation of lipid-laden intra-luminal plaque, smooth muscle cell proliferation and progressive narrowing of the vessel lumen. The formation of such vulnerable plaques prone to rupture underlies the majority of cases of acute myocardial infarction. The complex molecular and cellular inflammatory cascade is orchestrated by the recruitment of T lymphocytes and macrophages and their paracrine effects on endothelial and smooth muscle cells.1
Molecular imaging in atherosclerosis has evolved into an important clinical and research tool that allows in vivo visualization of inflammation and other biological processes. Several recent examples demonstrate the ability to detect high-risk plaques in patients, and assess the effects of pharmacotherapeutics in atherosclerosis.4 While a number of molecular imaging approaches (in particular MRI and PET) can image biological aspects of large vessels such as the carotid arteries, scant options exist for imaging of coronary arteries.2 The advent of high-resolution optical imaging strategies, in particular near-infrared fluorescence (NIRF), coupled with activatable fluorescent probes, have enhanced sensitivity and led to the development of new intravascular strategies to improve biological imaging of human coronary atherosclerosis.
Near infrared fluorescence (NIRF) molecular imaging utilizes excitation light with a defined band width (650-900 nm) as a source of photons that, when delivered to an optical contrast agent or fluorescent probe, emits fluorescence in the NIR window that can be detected using an appropriate emission filter and a high sensitivity charge-coupled camera. As opposed to visible light, NIR light penetrates deeply into tissue, is markedly less attenuated by endogenous photon absorbers such as hemoglobin, lipid and water, and enables high target-to-background ratios due to reduced autofluorescence in the NIR window. Imaging within the NIR 'window' can substantially improve the potential for in vivo imaging.2,5
Inflammatory cysteine proteases have been well studied using activatable NIRF probes10, and play important roles in atherogenesis. Via degradation of the extracellular matrix, cysteine proteases contribute importantly to the progression and complications of atherosclerosis8. In particular, the cysteine protease, cathepsin B, is highly expressed and colocalizes with macrophages in experimental murine, rabbit, and human atheromata.3,6,7 In addition, cathepsin B activity in plaques can be sensed in vivo utilizing a previously described 1-D intravascular near-infrared fluorescence technology6, in conjunction with an injectable nanosensor agent that consists of a poly-lysine polymer backbone derivatized with multiple NIR fluorochromes (VM110/Prosense750, ex/em 750/780nm, VisEn Medical, Woburn, MA) that results in strong intramolecular quenching at baseline.10 Following targeted enzymatic cleavage by cysteine proteases such as cathepsin B (known to colocalize with plaque macrophages), the fluorochromes separate, resulting in substantial amplification of the NIRF signal. Intravascular detection of NIR fluorescence signal by the utilized novel 2D intravascular NIRF catheter now enables high-resolution, geometrically accurate in vivo detection of cathepsin B activity in inflamed plaque.
In vivo molecular imaging of atherosclerosis using catheter-based 2D NIRF imaging, as opposed to a prior 1-D spectroscopic approach,6 is a novel and promising tool that utilizes augmented protease activity in macrophage-rich plaque to detect vascular inflammation.11,12 The following research protocol describes the use of an intravascular 2-dimensional NIRF catheter to image and characterize plaque structure utilizing key aspects of plaque biology. It is a translatable platform that when integrated with existing clinical imaging technologies including angiography and intravascular ultrasound (IVUS), offers a unique and novel integrated multimodal molecular imaging technique that distinguishes inflammatory atheromata, and allows detection of intravascular NIRF signals in human-sized coronary arteries.
Protocolo
En el modelo animal in vivo: La generación de aterosclerosis aortoilíaca Experimental
1) Línea de Base angiografía balón y denudación
- Antes de obtener la angiografía basal balón y denudación, un conejo blanco de Nueva Zelanda se alimenta un colesterol alto (1%), la dieta durante 1 semana. Este animal se utiliza la relevancia de la traducción como: 1) la aorto-ilíacos buques en los conejos son del mismo calibre que las arterias coronarias humanas (2.5-3.5mm) y 2) la hiperlipemia, el globo de la lesión modelo genera inflamación de la aterosclerosis teniendo similares células inflamatorias (macrófagos ) y moléculas (catepsinas) como en la aterosclerosis humana.
- Después de la alimentación de colesterol, el animal se anestesia con propofol y la ketamina. A una pulgada incisión ventral línea media del cuello se realiza mediante el uso de un tamaño de 15 bisturí hoja. Utilizando técnicas de disección roma, los músculos debajo de la fascia en el lado derecho de la tráquea está expuesto. El músculo sternocephalicus izquierda se separa a lo largo de su unión del tejido conectivo, y la arteria carótida común derecha está expuesto. La arteria se separa del nervio vago. Bucles de sutura proximal y distal se colocan en la arteria para permitir la retracción y la oclusión. A 1 a 2 mm biselado arteriotomía se hace a través del cual un 5 franceses (diámetro externo 1.67mm) vaina vascular se inserta y heparina (1000μ/mL, ~ 150units/kg) se administra por vía intraarterial a través de la vaina.
- Medio de contraste (Ultravist) y luego se inyecta (1 a 2 ml) durante un período de dos segundos para obtener una angiografía de control de la aorta distal y ambas arterias ilíacas.
- Las arterias iliofemoral y la aorta son entonces herido por denudación endotelial. Utilizando los métodos estándar de fluoroscopia, un catéter de Fogarty embolectomía 3FR se coloca en la arteria iliofemoral distal y se infla con 0,3 a 0,5 cc de contraste (50% contrast/50% de solución salina) o el aire. El catéter se retira proximal en el estado infla una distancia a lo largo de la ilíaca derecha y la aorta distal hasta el despegue de la arteria renal izquierda. Después de la denudación del globo, se repite la angiografía para documentar la permeabilidad del vaso. Después de la angiografía, todos los catéteres y las vainas se retiran y la porción proximal de la arteria carótida derecha común ligado es, el músculo y la fascia se sutura con una sutura 4 / 0 absorbible, y la incisión de la piel se cerró con un 4 / 0 sutura no absorbible.
- El animal se deja recuperar con la administración de una dosis de antibióticos (cefazolina, 0,5 gramos de mensajería instantánea). Medicamentos para el dolor incluyendo IM 0,01 mg / kg de buprenorfina (dos veces al día, según sea necesario). Los animales son luego continuó el 1% de colesterol durante 4 semanas post-globo denudación. En la semana 5, los animales son la transición a la dieta de colesterol al 0,3%.
Integrada multi-modal de imágenes de Rabbit Atheromata
2) El etiquetado de placa inflamada proteolíticamente activa con nanosensor inyectables, angiografía, ultrasonido intravascular (IVUS), y en vivo intravascular NIRF imágenes de ateroma de conejo
- Ocho semanas después de la lesión con balón y 24 horas antes de la imagen, el conejo se inyecta por vía intravenosa con 500 nmol / kg Prosense/VM110 (PerkinElmer) a través de vena de la oreja.
- Veinticuatro horas después de la inyección, los animales son anestesiados y el acceso arterial se obtiene a través de la arteria carótida común (véase el paso 1.2). Intraarterial se administra heparina (150 U / kg). De referencia la angiografía se obtiene que el anterior.
- Un catéter de IVUS se carga en una clínica coronaria capaz 0,014 pulgadas de alambre y se inserta en la vaina. Usando la guía fluoroscópica, la punta del hilo radiopaco se coloca distal a la arteria ilíaca derecha. El catéter de IVUS se avanzó entonces en la arteria ilíaca proximal utilizando una técnica estándar clínico monorraíl.
- Un retroceso de 100 mm se inicia y las imágenes se registran. Reconstrucción longitudinal del buque se obtiene y la placa luminal se identifica.
- El catéter NIRF 11,12 cargado en el alambre de 0,014 pulgadas (monorraíl del sistema), y el catéter se inserta cuidadosamente en la vaina y el cabezal de exposición está situado distalmente en la arteria ilíaca derecha.
- Múltiples retrocesos automatizado (1 mm / seg retroceso longitudinal, 30 disparos por minuto) se llevan a cabo y las señales de fluorescencia dentro de las zonas de la aterosclerosis es anotada. Las imágenes se graban y el tratamiento posterior con la escala adecuada y ventanas en función del alcance de la señal se logra.
3) La eutanasia y el aislamiento de los ex vivo aorto-ilíacos tejido
- La eutanasia se lleva a cabo con 1 cc de agente de la eutanasia (solución de fenitoína sódica 390mg de sodio pentobarbital y 50 mg), la inyección intravenosa, sola.
- El árbol arterial es perfundido con solución salina normal al 0,9% hasta la vena cava inferior es de la sangre. Las arterias ateroscleróticas aorta e ilíaca se identifican y se diseca de los tejidos circundantes. Además, las pequeñas piezas de 2 x 2 cm de liver, los riñones, el bazo y el corazón también se obtienen.
- Ex vivo NIRF de imágenes con el catéter intravascular NIRF imágenes se puede hacer en esta etapa. El buque es alargada y el catéter NIRF se reinserta en la aorta proximal hasta que la cabeza de imágenes se coloca en la arteria ilíaca derecha o bifurcación. Múltiples retrocesos automatizados se llevan a cabo como anteriormente (véase 2.6).
4) ex vivo de fluorescencia de reflectancia de imágenes (FRI) de la aorta disecada y las arterias ilíacas
- Los tejidos disecados está situado en el 10-20 cc de solución fisiológica y se transportan para el análisis de vie (Kodak Image Pro Estación de 4000mm, Carestream Health, Inc.).
- Aorta, vasos ilíacos son alargadas para aproximar en tiempo real longitudes y se obtienen imágenes en varias longitudes de onda [luz blanca, el canal verde fluorescente (ex 495 nm, em 515 nm), Cy5 (ex 565 nm, em 670 nm) y Cy7 (ex 650 nm, 760 nm em)] canales. Una serie de tiempos de exposición se utilizan para cada longitud de onda (0.1-30seg) y las imágenes obtenidas se exportan como DICOM o 16-bit TIFF sin escala para otros análisis. Como controles positivos y negativos, los órganos (hígado, bazo, riñón y corazón) son fotografiados en canales similares y tiempos de exposición.
- Áreas de aumento de la señal en el canal infrarrojo cercano (780nm +) se observan en las arterias ateroscleróticas.
5) Incorporación de tejidos para el análisis de sección y de inmunohistoquímica
- Áreas de la normalidad (sin lesiones de tejidos, es decir, la arteria ilíaca izquierda) y zonas de la placa de identificación y pequeños anillos de 5-10 mm de tejido están incrustadas en octubre (la temperatura óptima de corte) los medios de comunicación. Los bloques se almacenan a -80 C hasta el corte.
- Técnicas estándar para el análisis inmunohistoquímico de seccionamiento y se llevan a cabo. Hematoxilina y eosina, Ram-11 y la tinción de la catepsina B se llevan a cabo.
Los análisis e integración de multi-modal imágenes (angiografía, IVUS, NIRF y FRI)
6) El procesamiento de imágenes NIRF y el FRI
- Archivos DICOM contienen datos de imágenes de NIRF y el FRI (tomada en cerca del canal infrarrojo 780 nm) retiradas se procesan utilizando MATLAB y software Osirix, respectivamente. Ventanas adecuado para mostrar amplia gama de intensidad de la señal se logra. Las imágenes finales se exportan como archivos TIFF.
- Los archivos se importan en el software estándar de procesamiento de imágenes (Keynote se puede utilizar). Las imágenes se alinean sobre la base de puntos de referencia (es decir, las vértebras en la angiografía, la bifurcación ilíaca y la arteria renal). Las áreas de vaso normal y la placa se identifican.
- Las regiones de interés (ROI) de forma manual trazado (por el tejido normal y áreas de la placa) y la media de intensidad de la señal son adquiridos mediante Osirix y MATLAB, respectivamente, para ambos vie e imágenes NIRF. Para guiar el seguimiento adecuado, la imagen IVUS longitudinal del buque se utiliza y la identificación de vaso normal y la placa son fácilmente identificables.
- Al objetivo de fondo (RBT) ratios se calculan para las zonas de la placa.
Los resultados representativos:
Una vez finalizado el protocolo anterior, podemos identificar y caracterizar las áreas de la actividad aumentada de la proteasa catepsina en la placa inflamatoria en la aorta y los vasos ilíacos. La inyección de un nanosensor activable (Prosense/VM110) que nos permite identificar la placa proteolíticamente activa. Estos aparecen como zonas brillantes o señal intensa en imágenes utilizando vie en el canal infrarrojo cercano (750 nm). Los retrocesos NIRF se correlacionan con la intensidad de la señal aumentó FRI y alineaciones con IVUS que permiten el registro de las señales anatómicas NIRF. TBR calcula la placa, obtenidos a partir de vie y NIRF fueron similares (véase la Figura 3: media NIRF TBR 4.2, significa vie TBR 2,9). El análisis inmunohistoquímico de la placa brillante confirma la presencia intensa de RAM-11 y la actividad de la catepsina B en las áreas de la placa (datos no mostrados).
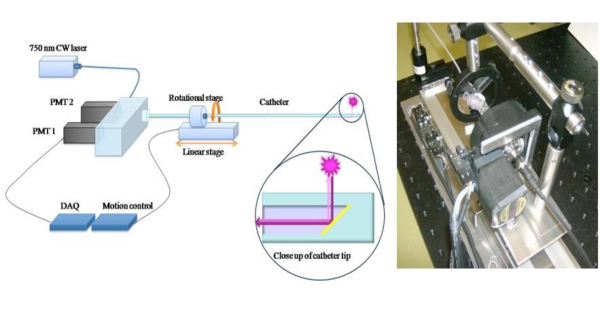
Figura 1. Esquemática de 2D catéter NIRF Para ampliar el potencial clínico de un enfoque 1D NIRF detección 6, se construyó una novela en 2-D NIRF-catéter intravascular para la imagen. 11,12 El catéter costumbre-construido consta de una fibra óptica (125 micrones de diámetro ubicado en tubería de polietileno: 2.9F) que se ilumina con un láser de 750 nm fuente de excitación. La luz del láser es emitida en un ángulo de 90 grados respecto al eje de la fibra. El sistema utiliza dos motores automatizados (rotación y de traslación) para permitir imágenes concomitante de 360 grados y retroceso longitudinal para obtener imágenes 2D verdad. Imágenes que se utilizan con permiso de referencia 11.
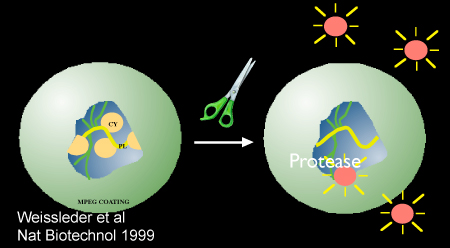
Figura 2. Esquemático que demuestra la activación mediada por la proteasa del nanosensor, Prosense/VM110. Imagen que se utiliza con permiso de referencia 10.

Figura 3. En vivo y ex vivo TBRs placa (meta-a las relaciones de fondo)
Discusión
Inflamado placas de alto riesgo o vulnerables son probablemente responsables de la mayoría de los infartos de miocardio. La identificación de estas placas antes de la aparición de los síntomas tiene importantes implicaciones clínicas, tanto en la predicción de los resultados y guiar el tratamiento médico. Modalidades convencionales de imagen coronaria arterial, tales como la angiografía de rayos X normalmente se centran en la caracterización de estrechamiento luminal en lugar de iluminar los perfiles biológico...
Divulgaciones
FAJ - Ex consultora, VisEn médica; honorarios, Boston Scientific
Agradecimientos
Apoyo a este trabajo fue proporcionado por los Institutos Nacionales de Salud de subvención R01 HL # 108229, Asociación Americana del Corazón de Desarrollo Científico Subvención # 0830352N, Howard Hughes Medical Career Institute Premio al Desarrollo, empresas Broadview, Séptimo Programa Marco de la Comunidad Europea (FP7/2007-2013 cargo a la subvención acuerdo # 235 689), y el MGH William Schreyer Comunidad.
Materiales
| Name | Company | Catalog Number | Comments |
| Prosense 750 | Visen Medical | VM110 | 500 nmol/kg IV injection |
| Heparin Sodium | APP Pharmaceuticals | 401586D | |
| Cephazolin | NovaPlus | 46015683 | |
| Lidocaine HCL 2% | Hospira Inc. | NDC 0409-4277-01 | |
| Buprenorphine | Bedford Laboratories | NDC 55390-100-10 | |
| Ketamine | Hospira Inc. | NDC 0409-2051-05 | |
| High Cholesterol Diet 1% | Research Diets | C30293 | |
| HIgh Cholesterol Diet 0.3% | Research Diets | C30255 |
Referencias
- Andersson, J., Libby, P. Adaptive immunity and atherosclerosis. Clin Immunol. 134, 33-46 (2010).
- Calfon, M. A., Vinegoni, C. Intravascular near-infrared fluorescence molecular imaging of atherosclerosis: toward coronary arterial visualization of biologically high-risk plaques. Journal of Biomedical Optics. 15, 011107-011107 (2010).
- Chen, J., Tung, C. -. H. In Vivo Imaging of Proteolytic Activity in Atherosclerosis. Circulation. 105, 2766-2771 (2002).
- Jaffer, F. A., Libby, P. Molecular Imaging of Cardiovascular Disease. Circulation. 116, 1052-1061 (2007).
- Jaffer, F. A., Libby, P. Optical and Multimodality Molecular Imaging: Insights Into Atherosclerosis. Arterioscler Thromb Vasc Biol. 29, 1017-1024 (2009).
- Jaffer, F. A., Vinegoni, C. Real-Time Catheter Molecular Sensing of Inflammation in Proteolytically Active Atherosclerosis. Circulation. 118, 1802-1809 (2008).
- Kim, D. -. E., Kim, J. -. Y. Protease Imaging of Human Atheromata Captures Molecular Information of Atherosclerosis, Complementing Anatomic Imaging. Arterioscler Thromb Vasc Biol. 30, 449-456 (2010).
- Libby, P. Inflammation in atherosclerosis. Nature. 420, 868-874 (2002).
- Naghavi, M., Libby, P. From Vulnerable Plaque to Vulnerable Patient: A Call for New Definitions and Risk Assessment Strategies: Part I. Circulation. 108, 1664-1672 (2003).
- Weissleder, R., Tung, C. -. H. In vivo imaging of tumors with protease-activated near-infrared fluorescent probes. Nat Biotech. 17, 375-375 (1999).
- Razansky, R. N., Rosenthal, A. Near-infrared fluorescence catheter system for two-dimensional intravascular imaging in vivo. Optics Express. 18, 11372-11381 (2010).
- Jaffer, F. A., Calfon, M. A. Two-Dimensional Intravascular Near-Infrared Fluorescence Molecular Imaging of Inflammation in Atherosclerosis and Stent-Induced Vascular Injury. Journal of the American College of Cardiology. 57, 2516-2526 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados