Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Los métodos para la manipulación experimental después de la transección del nervio óptico en el SNC de los mamíferos
* Estos autores han contribuido por igual
En este artículo
Erratum Notice
Resumen
Transección del nervio óptico es un modelo ampliamente utilizado de la lesión en el SNC adulto. Este modelo es ideal para llevar a cabo una serie de manipulaciones experimentales que se dirigen a la retina a nivel mundial o directamente dirigidos a la población heridos neuronal de las células ganglionares de la retina.
Resumen
Las células ganglionares de la retina (CGR) son las neuronas del SNC que la producción de información visual desde la retina hasta el cerebro, a través del nervio óptico. El nervio óptico se puede acceder dentro de la órbita del ojo y completamente seccionado (axotomized), el corte de los axones de la población RGC todo. Transección del nervio óptico es un modelo reproducible de la muerte apoptótica de las células neuronales en el SNC adulto 1-4. Este modelo es particularmente atractivo debido a que la cámara vítrea del ojo actúa como una cápsula para administración de fármacos a la retina, lo que permite manipulaciones experimentales a través de inyecciones intraoculares. La difusión de los productos químicos a través del humor vítreo se asegura de que actúan sobre la población RGC todo. Vectores virales, los plásmidos o corto RNAs de interferencia (siRNA) también puede ser entregado a la cámara vítrea para infectar o transfectar células de la retina 05.12. El tropismo de alta de virus adeno-asociado (AAV) vectores es beneficioso para la CGR de destino, con una tasa de infección cercana al 90% de las células cerca del sitio de la inyección 6, 7, 13-15. Por otra parte, la CGR puede ser selectiva transfectadas mediante la aplicación de siRNAs, plásmidos o vectores virales para el extremo del corte del nervio óptico o vectores 16-19 inyectar en su objetivo el colículo superior 10. Esto permite a los investigadores a estudiar los mecanismos de apoptosis en la población de neuronas lesionadas, sin factores de confusión en las neuronas o glía espectador otras circundantes. RGC apoptosis tiene una característica de tiempo-por supuesto por el que se retrasa la muerte celular postaxotomy 3-4 días, después de que las células degeneran rápidamente. Esto proporciona una ventana para la manipulación experimental dirigida contra los involucrados en la apoptosis. Manipulaciones que afectan directamente a la CGR del tronco del nervio óptico seccionado se llevan a cabo en el momento de axotomía, inmediatamente después de cortar el nervio. Por el contrario, cuando las sustancias son entregados a través de una vía intraocular, que puede ser inyectada antes de la cirugía o durante los primeros 3 días después de la cirugía, antes de la iniciación de la apoptosis en CGR axotomized. En el presente artículo, demostramos varios métodos para la manipulación experimental después de la transección del nervio óptico.
Protocolo
1. Técnica quirúrgica
- Los experimentos deben llevarse a cabo utilizando una técnica aséptica y siguiendo los protocolos de uso de los animales de su institución específica. Instrumentos y materiales (soluciones, las sustancias químicas, marcadores, agujas, etc) que entran en contacto con el tejido vivo debe ser estéril para prevenir la infección y los efectos negativos sobre el bienestar animal y los posibles impactos negativos en el estudio.
2. Anestesia
- Las ratas se anestesiaron con un sistema veterinario vaporizador isoflurano. El uso de oxígeno de uso médico a un ritmo de 0,8 L / min para vaporizar el gas isoflurano. Colocar el animal en el cuadro adjunto de anestesia y marcar en una concentración de isoflurano del 4% hasta que la respiración se ha desacelerado y el animal está tranquilo.
- A continuación, cambiar el flujo de gas a la unión máscara de gas para el marco estereotáxico y el lugar del animal en el aparato estereotáxico. A su vez la concentración de isoflurano al 2% y el monitor de anestesia. Los animales más grandes (> 300 g) pueden requerir una mayor concentración de isoflurano. Anestesia deben ser controlados durante la cirugía y la dosis de isoflurano ajustarse en consecuencia. Profundidad y la velocidad de la respiración debe ser constantemente evaluados, y la evaluación de los pies de presión (cada 5 minutos) por la ausencia de dolor profundo se debe realizar.
- Una vez terminada la cirugía, apague el isoflurano y permitir que el animal oxígeno respiración durante varios minutos antes de la remoción del dispositivo estereotáxico. La temperatura del cuerpo se debe mantener al cubrir al animal con una manta quirúrgico y / o el uso de una manta de calefacción regulada durante la cirugía.
3. Preparación para la jeringa inyecciones intraoculares
- En primer lugar, montar el sistema de jeringa para la realización de las inyecciones intraoculares. A 10 l RN hermética 1701 Jeringa Hamilton se utiliza para la inyección. Eliminar cualquier aguja o presente RN tuerca en el extremo de la jeringa.
- Inserte el casquillo PFA en la taza PEEK casquillo de la conexión de compresión. A continuación, inserte la instalación completa en el extremo de la jeringa y sin apretar la tuerca de tornillo de RN sobre la parte superior.
- Inserte un extremo del tubo de PEEK 1 / 16 pulgadas en la conexión de compresión, a través de la apertura de la tuerca de RN. Asegúrese de que el tubo de PEEK está totalmente asentado. Apretar la tuerca de RN para comprimir el manguito, el sellado de la tubería de PEEK.
- Realice el paso 3.2 en ambos extremos del acoplador de vidrio de doble RN. Conecte el extremo libre del tubo PEEK a un extremo del acoplador de vidrio de doble RN apretando la tuerca de RN.
- Una micropipeta de vidrio tirado a la forma de la aguja y el barril para el sistema de inyección. El uso de 1,5 mm de espesor OD tubo capilar de vidrio de paredes para la fabricación de las pipetas de vidrio, e insertar la pipeta de vidrio en el extremo libre del acoplador de vidrio de doble RN. Apretar la tuerca de RN para fijar la pipeta en el lugar.
- La fina punta de pipetas de vidrio tirado suele ser demasiado pequeña para la realización de inyecciones intraoculares. Con el fin de crear una punta de diámetro apropiado, romper la punta de la pipeta de vidrio bajo la guía visual, utilizando un microscopio quirúrgico. El extremo esmerilado de un portaobjetos de vidrio muestra es muy adecuado para romper la pipeta. Mantener la pipeta en un ángulo y frote la punta a lo largo de la escarcha de cristal para crear un salto. Idealmente, la punta final debe ser ligeramente biselados. Puede tomar varios intentos para producir un buen consejo, así que tire pipetas múltiples antes de su uso.
- El sistema de inyección es hidráulico. Por lo tanto, la jeringa, tubo conector PEEK, doble enganche RN de vidrio y la micropipeta de vidrio debe ser llenado con aceite mineral antes de su uso. Utilizando el kit de cebado de Hamilton jeringa Co. (PRMKIT), llenar la jeringa imprimación con aceite mineral. Use una aguja de gran diámetro para permitir el paso de la aceite viscoso. Vuelva a colocar la aguja con el Hamilton 90030 aguja que encaja dentro del cuerpo de la jeringa de 10 l Hamilton. A continuación, coloque un tapón de goma sobre el Hamilton 90030 aguja, con el fin de proporcionar un sellado mientras se inyecta el aceite mineral.
- Inserte el Hamilton 90030 aguja de la jeringa de cebado en la parte posterior del barril de la jeringa de 10 l Hamilton del sistema de inyección. Pulse el tabique firmemente contra el extremo de la jeringa para crear un sello.
- Lentamente el émbolo. Usted verá el paso de aceite mineral a través de los elementos de cristal del sistema de inyección y, finalmente, llenar la pipeta de vidrio. Expulsar todo el aceite a través del sistema de inyección con el fin de eliminar cualquier burbuja de aire a lo largo de las vías. Si la jeringa de llenado se está quedando sin aceite mineral, extraiga lentamente la aguja mientras que constantemente distribución de aceite para evitar la formación de burbujas de aire. Vuelva a llenar la jeringa de cebado y se inyecta de nuevo.
- Cuando el sistema está lleno de aceite mineral y sin burbujas, inserte el émbolo de la jeringa original de 10 l Hamilton. El émbolo hasta el final de su recorrido con el fin de eliminar el aceite mineral adicional del sistema. Limpie el cristal micropipeta limpio y el final de la jeringa limpia con etanol al 70%.
- Las retiradasw el émbolo de la jeringa hasta la marca de 2 l en el barril. El final de la micropipeta de vidrio se llenan de aire que proporciona una zona de amortiguación entre el aceite mineral y el fluido que se desea inyectar. El barril de pipeta de ahora puede ser llenado por la colocación de la final de la micropipeta en la solución deseada y retirar el émbolo de la jeringa Hamilton. No inyecte más de 5.4 L de solución en un ojo de la rata adulta.
4. Procedimiento de inyección intraocular: Orientación de la Retina A nivel mundial
- Con el animal anestesiado y asegurado en el marco estereotáxico (como se describe en la Sección 2), use los ojos Alcaine gotas para anestesiar tópicamente la córnea. Abra los párpados con los dedos y coloque una gota de la solución anestésica en la superficie de la córnea.
- Inyección se necesitan dos personas: una para insertar la pipeta de vidrio en la cámara vítrea y mantener la posición de la pipeta, y otro para el émbolo de la jeringa que ofrece la solución deseada.
- Bajo un microscopio quirúrgico agarre, el vidrio micropipeta y el acoplador de doble vidrio RN con los dedos. Difusión de los párpados con los dedos de su mano libre, formando una "V" frente al sitio de la inyección. Mediante la aplicación de la tracción para los párpados, el ojo se eleva fuera de la órbita, la exposición de la superficie posterior detrás del limbo. Mediante la creación de una "V" con los dedos frente al sitio de la inyección, una cuna está formado por el ojo que proporciona estabilidad al inyectarse.
- Introduzca suavemente la punta de la micropipeta de vidrio a través de la conjuntiva, en una zona desprovista de vasos sanguíneos, ya través de la esclerótica, en un ángulo hacia abajo. Usted debe sentir un pequeño "pop" cuando la pipeta atraviesa la esclerótica. Inserción de la pipeta en un ángulo ligeramente hacia abajo, reduce la posibilidad de alcanzar el objetivo al insertar la aguja.
- La persona que sostiene la jeringa ahora debe inyectar el l 4 de solución al presionar el émbolo hasta la marca de los 2 l de la jeringa. La inyección debe tener aproximadamente entre uno y dos segundos en total. La inyección a un ritmo muy lento> 3 segundos reduce la propagación inicial de la solución a través de la cámara vítrea. Usted será capaz de ver la solución que se inyecta a través de la limpieza de la cámara vítrea bajo el microscopio, por lo tanto verificar el éxito del procedimiento.
- Mantener la micropipeta constante durante unos 5 segundos y luego se retiran, en la misma dirección que la aguja se inserta. La conjuntiva se solapa en la pequeña abertura, lo que ayuda a sellar la perforación escleral.
- Cubra la superficie de la córnea del ojo con el ungüento oftálmico (Tears Naturale PM) con el fin de evitar que se seque la córnea durante la recuperación, y devolver el animal a una jaula de recuperación.
- Post-quirúrgica analgésicos deben ser administrados de acuerdo a las directrices de las autoridades de su cuidado de los animales y los animales deben ser controlados cuidadosamente después de la cirugía.
5. Selectivamente en las células ganglionares de la retina del tronco del nervio óptico
- La aplicación de los marcadores, las drogas, los plásmidos, siRNAs o vectores virales para muñón del nervio óptico, después de axotomía, apunta directamente a las células ganglionares de la retina a través del transporte retrógrado. Esto se logra, en primer lugar la realización de una transección del nervio óptico de acuerdo con el "Protocolo de transección del nervio óptico" 22.
- Hay dos métodos principales para llevar a cabo este procedimiento: el uso de espuma de gel o de inyección directa en el nervio óptico.
- El método es similar a la espuma de gel retrógrada localización, sin embargo, cuando la entrega de los tratamientos experimentales en el nervio óptico que es conveniente que las células ganglionares de la retina antes de la etiqueta mediante la inyección de trazadores retrógrados en el colículo superior 1 semana antes de axotomía. Esto es importante para la célula de seguimiento, ya que, en algunos casos, los marcadores neuronales pueden interferir con el transporte retrógrado de sustancias experimentales o viceversa.
- Inmediatamente después de que el nervio óptico se corta, un pequeño pedazo de espuma de gel empapada en la solución experimental se coloca sobre el muñón del nervio óptico seccionado. El contenido de la órbita se devuelven a su ubicación anterior. Cuando el ojo se devuelve a una posición neutral, es necesario el uso de fórceps para empujar la pieza de espuma de gel hacia abajo en la órbita, asegurando que ésta permanezca por encima del extremo del nervio óptico.
- La técnica de inyección es más eficaz para la entrega de las sustancias que deben tener acceso al citoplasma del axón para ser transportados por vía retrógrada flujo de axoplasma. Esto incluye siRNAs y plásmidos, y en algunos casos, los vectores virales. Una jeringa de 5-10 l Hamilton se utiliza para inyectar la solución deseada en el nervio óptico seccionado.
- Agarre el borde del nervio óptico con punta fina pinza de Dumont. Inserte el extremo de la aguja en el nervio óptico, en paralelo con el nervio, hasta que el bisel ya no es visible. La aguja que se inserta a ser encerrado por todos lados por el nervio. Una aguja con un bisel corto es deseable.
- Una vez que el nEedle se inserta en el nervio, apriete suavemente los lados de los nervios con las pinzas de punta fina y se inyecta una cuarta parte de la solución mientras se gira la jeringa un cuarto de vuelta en sentido horario o antihorario.
- Seguir repitiendo el paso 5.7 hasta que haya completado una rotación completa de la aguja y se inyecta todo el contenido de la jeringa. Para obtener los mejores resultados de inyectar un total de 10 l de la solución mediante un hermético 10 l jeringa Hamilton.
- Retire la punta de la jeringa del nervio. Deje el exceso de líquido por vía parenteral que tiene reflujo de los nervios dentro de la órbita, ya que esto forma una reserva adicional para su absorción por los extremos de los axones.
- Devolver el contenido de la órbita a su posición original, cerca de la herida, y permitir que el animal pueda recuperarse.
- Post-quirúrgica analgésicos deben ser administrados de acuerdo a las directrices de las autoridades de su cuidado de los animales y los animales deben ser controlados cuidadosamente después de la cirugía.
6. Los resultados representativos:
Inyecciones intraoculares objetivo de todas las células de la retina a nivel mundial, y funcionan bien para las sustancias de entrega de CGR heridos desde las células ganglionares se encuentran en la capa más interna neuronal de la retina, adyacente a la cámara vítrea. CGR también pueden ser blanco directo de la entrega de las sustancias en el muñón del nervio óptico seccionado. CGR Fluorogold retrógrada etiquetado puede ser objetivo con los péptidos, las drogas, los vectores, plásmidos o siRNAs del tronco del nervio, como se ilustra en la Figura 1. Figura 1A-C muestra la localización de un péptido marcado Cy3 en el somata de la CGR que se pre-etiquetados mediante la inyección de Fluorogold en el colículo superior. Cy3 péptidos marcados fueron inyectados en el nervio óptico inmediatamente después de axotomía, y la retina fue fotografiado con vida con el fin de evitar que los péptidos de la lixiviación de los tejidos durante la fijación. Figura 1D-F demuestra la localización de Cy3 siRNAs etiquetado y el trazador retrógrado Fluorogold en CGR axotomized. Cy3 etiquetados siRNAs fueron inyectadas en el tronco del nervio óptico inmediatamente después de axotomía, y la retina fue fotografiado con vida.
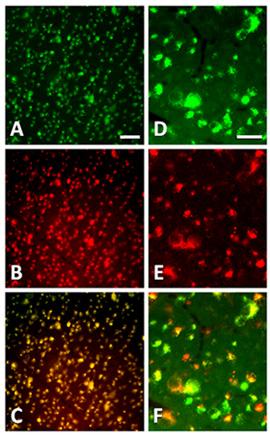
Figura 1. Micrografías epifluorescencia de la CGR en las retinas de flatmounted menos 1 día después de axotomía y la inyección de cualquiera de los péptidos etiquetados o siRNAs en el tronco del nervio óptico. (A) Fluorogold retrógrada etiquetado en CGR axotomized menos 1 día postaxotomy (B) Cy3 fluorescencia en CGR siguiente transporte retrógrado de péptidos marcados, un día después de axotomía y la inyección de péptido en el nervio óptico. (C) Superposición de (A) y (B) que demuestra la localización selectiva de Cy3 péptidos marcados en CGR Fluorogold etiquetados. (DF) Los cuerpos celulares de Fluorogold CGR etiqueta (D) también están llenos de Cy3 etiquetados siRNAs (E) inyecta en el tronco del nervio óptico 24 horas antes, como se muestra en la plantilla (F). Barra de escala en la AC es de 50 micras. Barra de escala en el DF es de 20 micras.
Discusión
Transección del nervio óptico es un modelo altamente reproducible de la apoptosis de las neuronas del SNC adulto. Las manipulaciones experimentales demostraron en este manuscrito permite el estudio de los mecanismos de apoptosis RGC después de la lesión.
Inyecciones intraoculares son útiles para la orientación global de la retina. Este procedimiento requiere una cierta práctica, ya que es fundamental para no dañar la lente con la punta de la pipeta de vidrio. Daños en el objetivo ha...
Divulgaciones
Agradecimientos
PDK es apoyado por una subvención de funcionamiento CIHR (MOP 86523)
Materiales
| Name | Company | Catalog Number | Comments |
| Stereotaxic Frame | Stoelting Co. | ||
| Rat Gas Mask | Stoelting Co. | ||
| Anesthesia System | VetEquip | 901806 | |
| Isoflurane (PrAErrane) | Baxter Internationl Inc. | DIN 02225875 | |
| Surgical Microscope | WPI, Zeiss, Leica | ||
| Alcaine Eye Drops | Alcon | ||
| Tears Naturale P.M. | Alcon | ||
| Fine tip Dumont forceps | Fine Science Tools | 11252-00 | |
| 10 μl Hamilton Syringe (1701RN; 26s/2”/2) | Hamilton Co | 80030 | |
| 1/16 inch Compression Fittings | Hamilton Co | 55751-01 | |
| 1/16 inch OD, 0.010 inch ID, PEEK Tubing | Supelco, Sigma-Aldrich | Z226661 | |
| Dual RN Glass Coupler | Hamilton Co | 55752-01 | |
| Mineral Oil Priming Kit: includes syringe, needles, rubber septa | Hamilton Co | PRMKIT |
Referencias
- Bahr, M. Live or let die - retinal ganglion cell death and survival during development and in the lesioned adult CNS. Trends Neurosci. 23, 483-4890 (2000).
- Isenmann, S., Kretz, A., Cellerino, A. Molecular determinants of retinal ganglion cell development, survival, and regeneration. Prog Retin Eye Res. 22, 483-543 (2003).
- Koeberle, P. D., Bahr, M. Growth and guidance cues for regenerating axons: where have they gone. J Neurobiol. 59, 162-180 (2004).
- Weishaupt, J. H., Bahr, M. Degeneration of axotomized retinal ganglion cells as a model for neuronal apoptosis in the central nervous system - molecular death and survival pathways. Restor. Neurol. Neurosci. 19, 1-2 (2001).
- Arai-Gaun, S. Heme oxygenase-1 induced in muller cells plays a protective role in retinal ischemia-reperfusion injury in rats. Invest Ophthalmol Vis Sci. 45, 4226-4232 (2004).
- Bainbridge, J. W., Tan, M. H., Ali, R. R. Gene therapy progress and prospects: the eye. Gene Ther. 13, 1191-1197 (2006).
- Polo, A. D. i. Prolonged delivery of brain-derived neurotrophic factor by adenovirus-infected Muller cells temporarily rescues injured retinal ganglion cells. Proc Natl Acad Sci U S A. 95, 3978-3983 (1998).
- Herard, A. S. siRNA targeted against amyloid precursor protein impairs synaptic activity in vivo. Neurobiol Aging. 27, 1740-1750 (2006).
- Koeberle, P. D., Bahr, M. The upregulation of GLAST-1 is an indirect antiapoptotic mechanism of GDNF and neurturin in the adult CNS. Cell Death Differ. 15, 471-483 (2008).
- Koeberle, P. D., Gauldie, J., Ball, A. K. Effects of adenoviral-mediated gene transfer of interleukin-10, interleukin-4, and transforming growth factor-beta on the survival of axotomized retinal ganglion cells. Neuroscience. 125, 903-920 (2004).
- Naik, R., Mukhopadhyay, A., Ganguli, M. Gene delivery to the retina: focus on non-viral approaches. Drug Discov Today. 14, 306-315 (2009).
- van Adel, B. A. Delivery of ciliary neurotrophic factor via lentiviral-mediated transfer protects axotomized retinal ganglion cells for an extended period of time. Hum Gene Ther. 14, 103-115 (2003).
- Alexander, J. J., Hauswirth, W. W. Adeno-associated viral vectors and the retina. Adv Exp Med Biol. 613, 121-128 (2008).
- Allocca, M. AAV-mediated gene transfer for retinal diseases. Expert Opin Biol Ther. 6, 1279-1294 (2006).
- Surace, E. M., Auricchio, A. Versatility of AAV vectors for retinal gene transfer. Vision Res. 48, 353-359 (2008).
- Garcia-Valenzuela, E. Axon-mediated gene transfer of retinal ganglion cells in vivo. J Neurobiol. 32, 111-122 (1997).
- Koeberle, P. D., Wang, Y., Schlichter, L. C. Kv1.1 and Kv1.3 channels contribute to the degeneration of retinal ganglion cells after optic nerve transection in vivo. Cell Death Differ. 17, 134-144 (2010).
- Kugler, S. Transduction of axotomized retinal ganglion cells by adenoviral vector administration at the optic nerve stump: an in vivo model system for the inhibition of neuronal apoptotic cell death. Gene Ther. 6, 1759-1767 (1999).
- Lingor, P. Down-regulation of apoptosis mediators by RNAi inhibits axotomy-induced retinal ganglion cell death in vivo. Brain. 128, 550-558 (2005).
- Leon, S. Lens injury stimulates axon regeneration in the mature rat optic nerve. J Neurosci. 20, 4615-4626 (2000).
- Mansour-Robaey, S. Effects of ocular injury and administration of brain-derived neurotrophic factor on survival and regrowth of axotomized retinal ganglion cells. Proc Natl Acad Sci U S A. 91, 1632-1636 (1994).
- D'Onofrio, P. M., Magharious, M. M., Koeberle, P. D. Optic Nerve Transection: A Model of Adult. J Vis Exp. , .
Erratum
Formal Correction: Erratum: Methods for Experimental Manipulations after Optic Nerve Transection in the Mammalian CNS
Posted by JoVE Editors on 5/31/2011. Citeable Link.
null
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados