Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Combinación de adhesivo basado en cinta de muestreo y de fluorescencia In situ La hibridación para la detección rápida de Salmonella En los productos frescos
En este artículo
Resumen
Este protocolo describe un simple adhesivo cinta enfoque basado en el muestreo de tomate y otras superficies de los productos frescos, seguido por la rápida detección de células enteras de Salmonella Mediante fluorescencia In situ Hibridación (FISH).
Resumen
Este protocolo describe un método sencillo para que el adhesivo, la cinta basada en el muestreo de tomate y otras superficies de los productos frescos, seguido por fluorescencia en cinta de hibridación in situ (FISH) para un rápido cultura independiente de la detección de Salmonella spp. Cintas cargadas de células también puede ser colocado boca abajo en agar selectivo para la fase sólida de enriquecimiento antes de la detección. Por otra parte, bajo volumen de enriquecimiento líquido (miniculture superficie del líquido) se puede realizar en la superficie de la cinta en el no selectivo caldo, seguidos por el pescado y el análisis mediante citometría de flujo. Para comenzar, cinta adhesiva estéril se pone en contacto con productos frescos, se aplica presión leve, y de retirar la cinta, de extraer físicamente los microbios presentes en estas superficies. Las cintas están montadas pegajoso hacia arriba en portaobjetos de vidrio y las células de la muestra se fijan con formol al 10% (30 min) y deshidratados mediante una serie gradual de etanol (50, 80, y 95%, 3 min cada concentración). A continuación, las células cargadas las cintas se han manchado con un tampón que contiene un cóctel de ADN de Salmonella objetivo de la sonda y se hibridaron durante 15 - 30 min a 55 ° C, seguido de una breve aclaración en un tampón de lavado para eliminar la sonda no unido. Adherente, PESCADO marcado células se contrastados con el ADN tinte 4 ',6-diamidino-2-phenylindole (DAPI) y los resultados se ven usando la microscopía de fluorescencia. Para la fase sólida de enriquecimiento, las células cargadas las cintas se colocan boca abajo sobre una superficie de agar selectivo adecuado y se incuban para permitir el crecimiento in situ de microcolonias Salmonella, seguidos por el pescado y la microscopia como se describió anteriormente. Para miniculture superficie del líquido, las células cargadas las cintas se colocan lado pegajoso hacia arriba y una cámara de perfusión de silicona se aplica para que la cinta y la forma del portaobjetos del microscopio la parte inferior de una cámara hermética en la que un pequeño volumen (≤ 500 l) de tripticasa de soja caldo (TSB) se introduce. Los puertos de entrada están cerrados y las cámaras se incuban a 35 - 37 ° C, permitiendo que el crecimiento basado en la amplificación de extraer la cinta-microbios. Después de la incubación, los puertos de entrada son sin sellar, las células se separan y se mezclan con la espalda vigorosa y pipeteo adelante, cosechadas por centrifugación y se fija en 10% neutros formalina tamponada. Finalmente, las muestras se hibridan y se examina a través de citometría de flujo para revelar la presencia de Salmonella spp. Como se describe aquí, nuestra "cinta-FISH" enfoque puede proporcionar un muestreo simple y rápida y la detección de Salmonella en las superficies de tomate. También hemos utilizado este enfoque para el muestreo de otros tipos de productos frescos, como la espinaca y chiles jalapeños.
Protocolo
1. Superficie de muestreo con cinta adhesiva estéril
- Seleccione una cinta a utilizar para el muestreo. Disponibles en el comercio Hongos-Tape o póngase en contacto-Es cintas de muestreo son estériles y envasadas especialmente para la facilidad de uso. Sin embargo, hemos encontrado que la transparencia (ópticamente transparente) cinta de la oficina de genéricos también se puede utilizar.
- Use un marcador permanente para dibujar 1 cm 2 plazas en el lado no pegajosa de una pieza de 10 cm de cinta adhesiva (una plantilla de papel se puede utilizar). Esto servirá como una guía visual para destacar que parte de la cinta se ha utilizado para probar la superficie del alimento o del medio ambiente.
- Formar una "C" en forma de lazo de cinta, con el lado adhesivo hacia la superficie a muestrear. Para ello, mantenga los extremos pegajosos con el pulgar y el dedo medio y la posición del dedo índice contra el cuadrado dibujado en la espalda (no pegajosa lado) de la cinta (Figura 1).
- Coloque la cinta en la superficie para tomar muestras y presionar suavemente el área marcada sobre la superficie. Sin soltar los bordes de la cinta, utilice el dedo índice para asegurarse de que el lado pegajoso de la cinta llega en pleno contacto con la superficie de la muestra, evitando las burbujas.
- El uso de un movimiento, incluso, lentamente tire de la cinta fuera de la muestra, de extraer físicamente unidas a la superficie, los microbios. Fije la cinta de células con carga, lado pegajoso hacia arriba, sobre un portaobjetos de vidrio con cinta transparente genérico de oficina. Asegúrese de que la tensión adecuada / estiramiento de la cinta para que un piso, no arrugada superficie se crea. Esto ayudará a minimizar los problemas con la deformación / curling de la cinta durante el calentamiento posterior durante la hibridación.
2. En fase sólida de enriquecimiento y Miniculture superficie del líquido
- En fase sólida de enriquecimiento se realiza mediante la colocación de la cinta boca abajo en la xilosa-lisina-Tergitol 4 (XLT-4) placas de agar, para que las células de la muestra se ponen en contacto directo con la superficie del agar. La plantilla parte / muestra el contacto de la cinta se coloca al ras con la superficie del agar y un extremo de la cinta está ligeramente adherida a la pared lateral de la placa de Petri para facilitar una fácil extracción de la cinta de la superficie del agar después del enriquecimiento.
- Las placas son invertidas (para evitar la condensación) y se incubaron a 35 - 37 ° C para permitir el crecimiento suficiente de Salmonella spp. La duración del período de incubación necesario para enriquecer a las células a un nivel detectable dependerá de los niveles iniciales de contaminación por Salmonella. Hemos observado la formación de microcolonias excelente a partir de inóculos iniciales de baja después de las 8 h de enriquecimiento.
- Tras el periodo de enriquecimiento deseado, abra la placa de agar. La cinta mantendrá su adherencia durante la incubación. Presione suavemente la cinta contra el agar usando el dedo índice para asegurar la recuperación máxima de microcolonias formado en la interfaz de cinta-agar. Sujete la cinta desde el borde pegado a la pared de la cápsula de Petri y retírela con un lento, incluso movimiento. Montar la cinta de células cargadas, el lado pegajoso arriba, sobre un portaobjetos como se describe en el punto 1.5. Proceder a la "fijación y deshidratación" un paso adelante.
- Para miniculture superficie del líquido, comience por la fijación de la cinta utilizada para el muestreo sobre un portaobjetos como se describe en el punto 1.5. A continuación, cubrir la parte de plantilla / muestra el contacto de la cinta con una cámara de silicona no estéril de perfusión (Coverwell, Grace Bio-Labs, Inc.), formando una cámara sellada, cuyo fondo está compuesto por células de la cinta cargada, mirando hacia arriba. Firmemente pero con cuidado de prensa de la cámara en su lugar para asegurar un sello hermético.
- El uso de un gel flexible de carga punta de la pipeta, transferir ≤ 500 l de caldo de tripticasa de soja u otro medio de enriquecimiento necesario a través de uno de los puertos de entrada de la cámara pequeña. Sello de los dos puertos con cinta transparente para evitar que la oficina de diapositivas evaporación e incubar a 35 -37 ° C, según sea necesario para el enriquecimiento suficiente. A pesar de todas las operaciones deben realizarse de acuerdo a buenas prácticas de muestreo y la manipulación, la esterilidad del puerto cinta aislante o cámaras de perfusión no es necesario durante miniculture superficie del líquido. La combinación de FISH y citometría de flujo permitirá una clara discriminación de Salmonella spp. a partir de bacterias que no son objeto de que puedan estar presentes, con la mayor contribución de la flora no objetivo espera que provenga de la propia muestra. Proceder a la "fijación y deshidratación" un paso adelante.
3. La fijación y deshidratación
- Para el muestreo de superficie directa o para el enriquecimiento de la fase sólida de Salmonella spp. en XLT-4 agar, lleve a cabo en la cinta de fijación de células durante 30 min a 25 ° C, cubriendo el área de contacto de la muestra con 500 l 10% de formol tamponado neutro.
- Deseche fijador en un recipiente hermético (bajo una campana de productos químicos para minimizar la exposición a irritantes / vapores tóxicos).
- Deshidratar en una serie de etanol (50%, 80% y 95%, 300 l / min 3 cada concentración). Proceder a la "hibridación" un paso adelante.
- Para la fijación de 500 l de muestra de líquido miniculture superficies, cámaras de perfusión son abiertos, flexibles y un gel de carga punta de la pipeta se utiliza para extraer la enrichate. Pipeteo rápido arriba y hacia abajo se utiliza para ayudar a asegurar la eliminación efectiva de los restantes obligados cinta de las células.
- A continuación, todo el volumen de 500 l miniculture se transfiere a un tubo de microcentrífuga y centrifuga a 2.000 xg (5 min). Se desecha el sobrenadante, el pellet se agita vigorosamente durante 30 a 60 s, luego resuspendido en un volumen igual de 10% de formol tamponado neutro. Se fijan las células durante 30 min a 25 ° C.
- Fijador A continuación, se retira y la muestra se resuspendió en tampón de celda de almacenamiento, de la siguiente manera. La muestra se centrifuga a 2.000 xg (5 min, 25 ° C) se desecha el sobrenadante, el pellet se agita vigorosamente durante 30 - 60 s, la volvieron a suspender en un volumen igual de 50%, no desnaturalizado, etanol 50% de fosfato solución salina tamponada. Las células fijadas se pueden almacenar por tiempo indefinido (año) a -20 ° C. Nota: Cuando se cambian los líquidos (por ejemplo, al introducir un buffer de fijador o diferentes), es importante para volver a suspender completamente (con agitación) el sedimento celular en una mínima parte (~ 10 a 20 l) del sistema de "salida" líquido . Esto ayudará a prevenir el agrupamiento y asegurar que las suspensiones de células individuales, incluso se obtienen. Proceder a la "hibridación" un paso adelante.
4. Hibridación
- Prepare la hibridación / tampón de lavado con el comercial grado biología molecular de soluciones indica en la Tabla de Materiales. Final de las concentraciones de componentes de amortiguación son 0,7 M NaCl, 0,1 M TRIS [pH 8.0], 10 mM EDTA, 0,1% dodecilsulfato de sodio, hasta alcanzar el volumen final deseado con molecular calidad del agua y se filtra con una jeringa de 0,22 micras o filtro de la taza. El mismo tampón, sin la adición de sondas (ver más abajo) se utiliza como un tampón de lavado. Precaliente la hibridación y tampones de lavado a 55 º C.
- Añadir fluorescente marcada con Sal3 (Nordentoft et al, 1997;. 5'-AAT CAC TTC CAC TAC GTG-3 ') y Salm-63 (Kutter et al, 2006;. 5'-GAC TCG ACT TTC TCC AGC-3' ) sondas de oligonucleótidos (Tabla de Materiales) de tampón de hibridación precalentada. La concentración total de la sonda de 5 ng l -1 se utiliza (por ejemplo, 2,5 ng l -1 de cada sonda, Bisha y Brehm-Stecher, 2009a).
- Para las muestras de directo-a-cinta y sólida fase de enriquecimiento, cubrir el área de contacto de la muestra de plantilla de la cinta con 300 L de tampón de hibridación que contiene el cóctel de hibridación de la sonda y atado de cintas de las células en una cámara húmeda, la incubación sellada ajustado a 55 ° C. Si una incubadora de contacto directo, como el instrumento Foso de diapositivas (Tabla de Materiales) se utiliza, las muestras se hibridó durante 15 min y> 20 diapositivas se pueden procesar de forma simultánea. Si un horno de hibridación giratorio al estilo, como el instrumento Bambino (Tabla de Materiales) se utiliza, las diapositivas se colocan en tubos de 50 ml de centrífuga de polipropileno para la hibridación, una diapositiva por tubo. Debido a la transferencia de calor no es directa, estas muestras se hibridó durante períodos más largos (hasta 30 min).
- Tras la hibridación, las diapositivas se eliminan y la sonda que contienen superposición de tampón de hibridación se descarta. Portaobjetos se sea breve y suave enjuagarse con buffer de lavado precalentado pipeteando un pequeño volumen de tampón sobre un portaobjetos inclinado (3 enjuagues de 300 cada l), o el agua de manera formal (hasta 30 min), ya sea con una capa de tampón de lavado precalentado o inmersión en un tubo de polipropileno de centrífuga de 50 ml que contiene el buffer de lavado precalentado. En nuestra experiencia, a pesar de un lavado formales proporcionará los mejores resultados (menos neblina de la sonda no unido), un simple enjuague es adecuado para la detección inequívoca de Salmonella spp. A continuación, los portaobjetos se secaron al aire antes de pasar a la "detección" un paso adelante.
- La hibridación de muestras de la superficie líquida miniculture se realiza girando por las muestras (recién fija o se mantiene en el buffer de almacenamiento a -20 ° C) durante 5 min a 2.000 xg seguido por agitación vigorosa de la pastilla y resuspensión en buffer de 100 l de hibridación precalentada que contiene el cóctel de la sonda. Las muestras se hibridó a 55 ° C durante 30 minutos en un bloque de calor o de otra estación de incubación adecuado (Tabla de Materiales), seguido por la adición de 500 l buffer de lavado precalentado. Al igual que con la cinta con destino las muestras, estas muestras pueden ser formalmente lavado de hasta 30 minutos con incubación a 55 ° C en el tampón de lavado, con agitación intermitente. Por otra parte, las muestras pueden ser completamente vortex después de la adición de 500 l buffer de lavado precalentado, seguido de la cosecha inmediata para el análisis (abajo).
- En preparación para la detección de Salmonella spp. mediante citometría de flujo, líquido muestras miniculture superficie se centrifuga a 2.000 g durante 5 min, se desecha el sobrenadante y las muestras se resuspenden en 300 l temperatura ambiente (~ 25 ° C) PBS. Si las muestras requieren transporte a una instalación a distancia, o si el retraso se espera entre la hibridación y el análisis, las muestras se pueden refrigerar o mantenidos en hielo antes de analisis. Por otra parte, las muestras podrán ser transferidos a buffer de almacenamiento de células (una mezcla de 50:50 de la PBS y etanol absoluto) y se mantiene a -20 ° C hasta una semana sin pérdidas apreciables en la sonda confiere fluorescencia (Bisha y Brehm-Stecher, 2009b) .
5. Detección
- Para la detección en la cinta de Salmonella spp. a través de microscopía de fluorescencia, directo a cinta o sólidas muestras de enriquecimiento fase se superpone con aproximadamente 10 l Vectashield H-1200 montaje de soporte de la nuclear de contraste 4 ',6-diamidino-2-phenylindole (DAPI), montado con una hoja de cubierta, después se incuban en la oscuridad durante 10 min.
- Aceite de inmersión se coloca en la hoja de la cubierta, y las muestras se analizan utilizando un objetivo de gran aumento (63x o 100x). El filtro de DAPI se utiliza para transportar la muestra en el foco, el microscopio se cambia entonces con el filtro correspondiente (verde o rojo, dependiendo del medio de contraste utilizado para las sondas de la etiqueta final) y las células de Salmonella se anotó visualmente de acuerdo con su fluorescencia (Figuras 2 y 3).
- Para la detección por citometría de líquido muestras de la superficie miniculture, diversos instrumentos se pueden utilizar, dependiendo de la disponibilidad local. En nuestro laboratorio, PBS-suspendido muestras se transfieren a 5 ml de tubos redondos de muestreo inferior (BD Falcon) y se examinaron con un citómetro de flujo FACSCanto con excitación a 647 nm (Tabla de Materiales). Para las muestras enriquecidas que contienen un alto número de bacterias totales, la "baja tasa de flujo" de ajuste (10 min l -1) se utiliza y 5.000-50.000 eventos se recogen. Los datos se analizaron mediante FlowJo software (versión 8.8.6, Árbol Star, Inc., Ashland, Oregón) u otro software de análisis adecuado (Figura 4, los grupos A y B).
6. Resultados representante
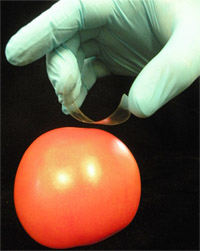
Figura 1. El uso de cinta adhesiva para el muestreo de Salmonella spp. de la superficie de un tomate contaminado artificialmente.

Figura 2. Los resultados típicos de muestreo directo a cinta y de detección de peces de Salmonella Typhimurium ATCC 14028 de la superficie de un tomate (100 objetivo de aceite X). Un cóctel de dos sondas de Texas Red marcado con sondas (Sal3/Salm-63) se utilizó para etiquetar estas células.

Figura 3. Microcolonias de Salmonella Typhimurium ATCC 14028 forman en la superficie de la xilosa lisina Tergitol-4 (XLT-4) agar después de 8 h en cinta de enriquecimiento a 37 ° C. El inóculo inicial se tomaron muestras de la superficie de un tomate contaminado artificialmente. En fase sólida de enriquecimiento aumenta el número de células disponibles para la detección y también mejora el contenido celular rRNA.

Figura 4. El uso de cinta adhesiva para recoger muestras de S. enterica serovar Typhimurium en la superficie de un tomate contaminadas artificialmente, seguido por el análisis directo mediante FISH y citometría de flujo (panel A) o después de 5 h no selectivo de enriquecimiento líquido miniculture superficie en una cámara de perfusión llena con 500 l de caldo de soja tripticasa (panel B ).
Discusión
Métodos sencillos y rápidos para la detección de patógenos en las superficies de los productos pueden ayudar a mitigar las enfermedades transmitidas por los alimentos, proporcionando información oportuna y procesable. Adhesivo a base de cinta de métodos de muestreo se han utilizado en el medio ambiente, clínica y microbiología de los alimentos desde la década de 1950 e implican apremiantes de "Scotch" al estilo de la cinta a la superficie para la eliminación de microorganismos, seguido por el examen ...
Divulgaciones
Agradecimientos
La financiación de este trabajo fue proporcionado por un premio del Fondo de crecer Iowa Valores de BFBS.
Materiales
| Name | Company | Catalog Number | Comments |
| Fungi-Tape sampling tape | Scientific Device Laboratory | 745 | http://www.scientificdevice.com/ |
| Con-Tact-It sampling tape | Birko Corporation, Denver, CO | http://www.birkocorp.com/ | |
| Clear office tape, generic | Various | Should be optically clear, have low intrinsic fluorescence | |
| Food surface | Local Grocery Store | Tomat–s (red tomat–s on the vine, not waxed or oiled) used here | |
| Trypticase Soy Broth | Difco Laboratories | 211768 | For non-selective liquid surface miniculture enrichment |
| Xylose-lysine-Tergitol 4 agar base | Difco Laboratories | 223420 | For Salmonella-selective agar (XLT-4) |
| Xylose-lysine-Tergitol 4 agar supplement | Difco Laboratories | 235310 | For Salmonella-selective agar (XLT-4) |
| Formalin solution | Sigma-Aldrich | HT5011 | 10% solution, neutral, buffered (cell fixative) |
| Absolute ethanol | Sigma-Aldrich | E7023 | Molecular biology grade (pre-hybridization dehydration) |
| 1.5 ml microcentrifuge tubes | Various | RNase- and DNase-free | |
| Microscope slides and cover slips | Thermo Fisher Scientific, Inc. | ||
| NaCl solution | Sigma-Aldrich | S5150 | Molecular biology grade, 5M solution (hybridization buffer component) |
| Tris-EDTA buffer solution (100X concentrate) | Sigma-Aldrich | T9285 | 1M Tris [pH 8.0], 0.1M EDTA (hybridization buffer component) |
| Sodium dodecyl sulfate solution | Sigma-Aldrich | L4522 | 10% solution in 18 megohm water (hybridization buffer component) |
| Sal3 and Salm-63 oligonucleotide probes | Integrated DNA Technologies | 5’-labeled with 6-carboxyfluorescein (FAM) or Texas Red (for microscopy) or Cy5 (for cytometry), HPLC-purified | |
| Variable speed microcentrifuge | Various | Use rotor diameter to calculate RPM needed for RCF values described in protocol | |
| CoverWell perfusion chamber | Grace Bio-Lab Inc. | PC1R-2.0 | Non-sterile |
| Gel loading pipette tips (FS MultiFlex) | Thermo Fisher Scientific, Inc. | 05-408-151 | Long, thin tips for easy access to small sampling ports and maneuverability within chamber |
| Aluminum heat block or precision-controlled heating station | Various | Eppendorf Thermomixer R dry block heating and cooling shaker used here | |
| Bambino mini hybridization oven | Boekel Scientific | Model 230300 | Slides are placed in 50 ml polypropylene centrifuge tubes for hybridization, heat transfer not direct |
| Slide Moat slide hybridizer | Boekel Scientific | Model 240000 | Provides rapid, direct transmission of heat through glass slide |
| Vectashield H-1200 mounting medium with 4’,6-diamidino-2-phenylindole (DAPI) | Vector Laboratories | H-1200 | Minimizes quenching of fluorescence during microscopy, provides DAPI counterstain |
| Fluorescence microscope | Various | Leitz Laborlux S used here | |
| Digital camera | Various | Canon PowerShot A640 camera used here | |
| Image acquisition software | Various | Axiovision software v. 4.6 (Carl Zeiss) used | |
| Adobe Photoshop | Adobe | For minimal processing of images (overlay of images taken in different channels) | |
| Flow cytometer | Various | FACSCanto flow cytometer (BD Biosciences, San Jose, CA) with red (647 nm) excitation used | |
| Flow cytometry analysis software | Various | FlowJo software v. 8.7.1 (Tree Star, Inc.) used |
Referencias
- Almeida, C., Azevedo, N. F., Fernandes, R. M., Keevil, C. W., Vieira, M. J. Fluorescence in situ hybridization method using a peptide nucleic acid probe for the identification of Salmonella spp. in a broad spectrum of samples. Appl. Environ. Microbiol. 76, 4476-4485 (2010).
- Barnetson, R. S., Milne, L. J. R. Skin sampling for Candida with adhesive tape. Br. J. Dermatol. 88, 487-491 (1973).
- Bisha, B., Brehm-Stecher, B. F. Simple adhesive-tape-based sampling of tomato surfaces combined with rapid fluorescence in situ hybridization for Salmonella detection. Appl. Environ. Microbiol. 75, 1450-1455 .
- Bisha, B., Brehm-Stecher, B. F. Flow-through imaging cytometry for characterization of Salmonella subpopulations in alfalfa sprouts, a microbiologically complex food system. Biotechnol. J. 4, 880-887 (2009).
- Edwards, R. W., Hartman, E. A simple technique for collecting fungus specimens from infected surfaces. Lloydia. 15, 39-39 (1952).
- Evancho, G. M., Sveum, W. H., Moberg, L. J., Frank, J. F., Pouch Downes, F., Ito, K. Microbiological monitoring of the food processing environment. Compendium of Methods for the Microbiological Examination of Foods. , (2001).
- Fung, D. Y. C., Lee, C. Y., Kastner, C. L. Adhesive tape method for estimating microbial load on meat surfaces. J. Food. Prot. 43, 295-297 (1980).
- Kutter, S., Hartmann, A., Schmid, M. Colonization of barley (Hordeum vulgare) with Salmonella enterica and Listeria spp. FEMS Microbiol. Ecol. 56, 262-271 (2006).
- La Cono, V., Urz, C. Fluorescent in situ hybridization applied on samples taken with adhesive tape strips. J. Microbiol. Meth. 55, 65-71 (2003).
- Lakshmanan, C., Schaffner, D. W. Understanding and controlling microbiological contamination of beverage dispensers in university foodservice operations. Food Prot. Trends. 26, 27-31 (2005).
- Langvad, F. A simple and rapid method for qualitative and quantitative study of the fungal flora of leaves. Can. J. Microbiol. 26, 666-670 (1980).
- Nordentoft, S., Christensen, H., Wegener, H. C. Evaluation of a fluorescence-labelled oligonucleotide probe targeting 23S rRNA for in situ detection of Salmonella serovars in paraffin-embedded tissue sections and their rapid identification in bacterial smears. J. Clin. Microbiol. 35, 2642-2648 (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados