Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La producción de C. elegans Los transgenes a través de recombinería con la GALK Marcador seleccionable
En este artículo
Resumen
La capacidad de producir transgenes de Caenorhabditis elegans Utilizando ADN genómico realizado por fosmids es particularmente atractivo ya que todos los elementos de regulación nativos se mantienen. Descrito es un procedimiento sencillo y robusto para la producción de transgenes a través de recombinería con la GALK Marcador de selección.
Resumen
La creación de animales transgénicos se utiliza ampliamente en C. elegans de investigación, incluyendo el uso de proteínas de fusión GFP para estudiar la regulación y el patrón de expresión de genes de interés o de generación de purificación por afinidad en tándem (TAP) etiquetados versiones de genes específicos para facilitar su purificación. Normalmente, los transgénicos son generados por la colocación de un promotor aguas arriba de un gen reportero GFP o cDNA de interés, y esto a menudo produce un patrón de expresión representativa. Sin embargo, los elementos críticos de la regulación génica, tales como elementos de control en la región 3 'no traducida o promotores alternativos, podría perderse por este enfoque. Además sólo una variante de empalme solo puede ser estudiado por lo general por este medio. En contraste, el uso del ADN del gusano genómico realizado por clones de ADN fosmid probablemente incluye a la mayoría si no todos los elementos que intervienen en la regulación génica in vivo que permite la mayor capacidad de capturar el patrón de expresión genuina y el calendario. Para facilitar la generación de transgenes utilizando ADN fosmid, se describe una E. coli procedimiento basado en recombinería para insertar las buenas prácticas agrarias, un TAP-tag, u otras secuencias de interés en cualquier lugar en el gen. El procedimiento utiliza el gen GALK como el marcador de selección, tanto para los pasos de selección positiva y negativa en recombinería lo que se traduce en la obtención de la modificación deseada con gran eficiencia. Además, los plásmidos que contienen el gen GALK flanqueado por los brazos de homología con las buenas prácticas agrarias de uso común y TAP genes de fusión están disponibles que reducen el costo de oligos en un 50% cuando se genera una proteína de fusión GFP o TAP. Estos plásmidos utilizar el origen de replicación R6K que se opone a la necesidad de purificación extensa producto de la PCR. Por último, también demuestra una técnica para integrar el marcador unc-119 a la columna vertebral fosmid que permite que el fosmid que se inyecta directamente o bombardeados en gusanos para generar animales transgénicos. Este video muestra los procedimientos involucrados en la generación de un transgén por recombinería usando este método.
Protocolo
Información general
Transgenes muchas utilizados en la generación de transgénicos C. elegans consisten en secuencias de promotor y tal vez un gen de ADNc clonado en uno de los vectores generados por el laboratorio del Dr. Andy Fuego 1. Si bien estos transgenes a menudo son exitosos en lo que respecta a la producción de un gen reportero GFP o expresar un ADNc en un modelo deseado, los transgenes pueden carecer de los promotores alternativos, elementos potenciadores, y 3 'región sin traducir (UTR) los elementos que juegan un papel importante en el control de la expresión génica in vivo 2. Por ejemplo, tanto los genes daf-12 y 1-fah tienen importantes elementos potenciadores que se encuentran fuera del promotor proximal que se perdieron en el promotor sólo construye 3,4,5. Más construcciones de transgenes que muchos utilizan la 3'UTR unc-54 que impide la regulación de los genes microARN apropiado 6,7,8. En consecuencia, la generación de transgénicos con grandes segmentos de ADN genómico de gusano sería ideal para la captura de todos los promotores, las variantes de empalme, y 3 'UTR elementos de control. Recientemente, un C. elegans fosmid biblioteca que consta de ~ 40 kb regiones de ADN genómico y cubre casi todo el genoma se ha construido. El uso del ADN del gusano genómico realizado por estos clones fosmid ADN da lugar a la mayor capacidad de capturar el patrón de expresión genuina y el momento de genes específicos 2,8,9,10,11.
Sin embargo, trabajar con grandes regiones de ADN genómico plantea problemas prácticos tales como las grandes dificultades en el uso de las técnicas de biología molecular 12. Para superar estas limitaciones, las técnicas para modificar fosmids o cromosomas artificiales bacterianos mediante recombinación homóloga en E. coli se han desarrollado y se denominan recombinería 12,13. Recombinería permite la inserción perfecta de las buenas prácticas agrarias, una purificación de la afinidad en tándem (TAP)-etiqueta, u otras secuencias de interés en cualquier lugar en el gen llevado por el C. elegans fosmid clon 2,10,14. La recombinación homóloga se produce entre un producto de PCR flanqueado por 50 pb regiones de homología con el sitio de destino y la meta de ADN en especialmente modificado E. coli.
Recientemente hemos descrito un procedimiento de dos etapas para la modificación de la C. elegans fosmids por recombinería que consiste en insertar el gen GALK en el lugar deseado y luego sustituir este gen con la secuencia deseada 2. El gen GALK sirve como un marcador de selección efectiva de los dos pasos en el proceso, ya que pueden ser seleccionados favor y en contra a través de la utilización de un medio de crecimiento selectivo 15. En la primera etapa de la modificación fosmid, el gen se inserta GALK mediante recombinación homóloga en el lugar deseado, y el fosmids modificó correctamente identificados por la selección positiva de la capacidad de utilizar galactosa como fuente de carbono 2,15. En la segunda etapa, el gen GALK se sustituye por la secuencia deseada, y el fosmids correctamente modificados son identificados a través de la selección negativa en contra del gen GALK a través del uso de los tóxicos derivados de la galactosa deoxygalactose que mata a las bacterias GALK + 2,15. Una de las ventajas de la GALK es la capacidad de un único gen que se utilizará para los pasos de selección positiva y negativa, en lugar de otros marcadores de genes que se han separado para cada paso, y los resultados en la obtención de la modificación deseada con una alta eficiencia 2,15.
Para facilitar la aplicación de esta técnica a C. elegans investigación, hemos hecho varios cambios en los recursos disponibles. En primer lugar, las etiquetas de las buenas prácticas agrarias y TAP se utilizan para generar transgenes gusano, por lo que hemos construido en 50 pb las regiones de homología con cada una de estas etiquetas en el pMOD4 GALK-G y pMOD4 GALK-GT plásmidos que sirven como la fuente del gen GALK 2. Estas regiones permiten a un solo conjunto de oligos que se utilizará para las dos etapas de la modificación fosmid lo que ahorra la necesidad de ordenar un segundo conjunto de oligos un poco caro. En segundo lugar, estos plásmidos utilizar el origen de replicación R6K que se opone a la necesidad de digerir la purificación padre producto de PCR del plásmido o extensa como el padre plásmido no es capaz de replicarse en las bacterias utilizadas en recombinería, y sólo puede replicarse en cepas especiales, tales como EC100 2 , 16 (Tabla 1 y Tabla 2). Finalmente, una forma común de la generación de transgénicos C. elegans es mediante el uso de bombardeos biolística seguido por la selección de los gusanos transgénicos a través del rescate de la mutación unc-119 17. Para hacer el fosmids compatible con el bombardeo, se desarrolló la pLoxP unc-119 plásmido que puede ser utilizado para integrar el marcador unc-119 a la columna vertebral fosmid 2.
I. Oligo Diseño
Con recombinería las secuencias deseadas se pueden insertar en cualquier sitio dentro del gen. Los sitios más comunes se encuentran en el extremo 5 'o 3' en función de los dominios funcionales, las variantes de empalme, o modificaciones post-traduccionales tales como el corte por proteasas. La GFP pMOD4 plásmido creado por nuestro laboratorio se puede utilizar para insertar una bandera de etiquetado GFP en cualquier sitio ya que el plásmido incluye un codón de iniciación y carece de un codón de tres 'stop (Figura 1). Por el contrario, la etiqueta de TAP tiene versiones específicas para 5 'y 3' fusiones, debido a la división VET utilizado durante la purificación 18,19.
- Plan del sitio de inserción de etiquetas dentro del gen. Considere la posibilidad de promotores alternativos, dominios funcionales, alternativa corte, y las modificaciones posteriores a la traducción al considerar el sitio de inserción. Diferentes sitios de inserción podría ser utilizado para etiquetar todos, uno, o algunas isoformas de un gen específico. Identificar 50 regiones pb aguas arriba y aguas abajo del punto de inserción.
- Diseño de los oligos (Tabla 1). Ya sea de 100 nM escala - gel oligos purificados o oligos Ultramer de Tecnologías de ADN integrados pueden ser utilizados para el procedimiento.
Para llevar a cabo recombinería GALK, es necesario el diseño de cebadores GALK con 50 pb homología a un área que flanquean el sitio que se desea modificar y el extremo 3 'de los cebadores se unen a la gaveta de GALK, que está presente tanto en pMOD4 GALK-G y pMOD4 GALK-GT (Figura 1). El delantero se oligo 5 '50 ------- ------- CCTGTTGACAATTAATCATCGGCA homología pb-3' y al revés, como una 5'------- 50 pb en la homología de la cadena complementaria - ------ TCAGCACTGTCCTGCTCCT-3 '.
Para llevar a cabo recombinería GALK con las buenas prácticas agrarias, que necesita para diseñar pMOD4 GALK-G o pMOD4 primers GALK-GT con 50 pb homología a un área que flanquean el sitio que se desea modificar (Figura 1). Asegúrese de mantener la proteína de fusión en el marco. El ATG se puede descartar si se desea. El extremo 3 'de los cebadores se unen a las regiones de homología de las buenas prácticas agrarias que flanquean el casete GALK. Nota: Los codones primera y la última de las buenas prácticas agrarias están subrayadas para demostrar el marco de lectura. El oligo adelante se 5'------- ------- 50 pb homología ATG GATTACAAGGACGATGACGATAAGATGAG -3 '3' y 5 'a la inversa una ------- 50 pb en la homología complementarias ------- cadena CAA AGCTTGTGGGCTTTTGTATAG-3 '
Para llevar a cabo GALK C plazo recombinería TAP, que necesita para diseñar pMOD4 GALK-GT cebadores con 50 pb homología a un área que flanquean el sitio que se desea modificar (Figura 1). Asegúrese de mantener la proteína de fusión en el marco. El extremo 3 'de los cebadores se unen a las regiones de homología TAP que flanquean el casete GALK. Nota: Los codones primera y la última de TAP están subrayadas para demostrar el marco de lectura. El oligo adelante se 5'------- ------ 50 pb homología ATG GAAAAGAGAAGATGGAAAAAG - 3 'y 5' a la inversa una ------- 50 pb en la homología de la cadena complementaria - ------ GGT TGACTTCCCCGC -3 '
Para llevar a cabo GALK N plazo recombinería TAP, que necesita para diseñar pMOD4 GALK-GT cebadores con 50 pb homología a un área que flanquean el sitio que se desea modificar (Figura 1). Asegúrese de mantener la proteína de fusión en el marco. El extremo 3 'de los cebadores se unen a las regiones de homología TAP que flanquean el casete GALK. Nota: Los codones primera y la última de TAP están subrayadas para demostrar el marco de lectura. El oligo adelante se 5'------- ------ 50 pb homología ATG GCAGGCCTTGCGC - 3 'y 5' a la inversa una ------- 50 pb en la homología de la cadena complementaria - ------ AAG TGCCCCGGAGGATGAGATTTTCT -3 ' - Generar un conjunto de acompañamiento oligos para PCR en los pasos posteriores, así como para la secuenciación de la fosmid. Estos son estándar oligos PCR que debe vincular a ~ 100 pb aguas arriba y aguas abajo del sitio de inserción.
II. Transferencia Fosmid a SW016 bacterias
El fosmids de la C. elegans fosmid biblioteca se proporcionan en la cepa bacteriana EPI300 (F-MCRA Δ (TMR-hsdRMS-mcrBC) φ80dlacZΔM15 ΔlacX74 recA1 endA1 araD139 Δ (ara, leu) 7697 Galu GALK λ-rpsL nupG trfA toná) (biotecnologías Epicentro, Madison, WI ), que permite la expresión fosmid ser aumentado por encima de una sola copia por célula para mejorar el rendimiento durante la purificación de ADN (Tabla 2). Para recombinería, el fosmid tendrá que ser transferido a la cepa bacteriana SW106 (MCRA Δ (TMR-hsdRMS-mcrBC) ΔlacX74 Deor endA1 araD139 Δ (ara, leu) 7697 rpsL recA1 nupG φ80dlacZΔM15 [λc1857 (cro-bioA) <> Tet ] (cro-bioA) <> araC-pBAD Cre ΔgalK) (NCI-Frederick) cepa que lleva el λred recombinación homóloga genes bajo el control de un λ represor sensible a la temperatura y una arabinosa inducible de la recombinasa Cre (Tabla 2) 15.
- Para el clon fosmid del gen de interés (GOI) de GeneService (Cambridge, Reino Unido), utilizando Wormbase como una guía. Cuando la selección de clones, elegimos las que tienen el Gobierno de la India en el centro de la secuencia. Los que excluyen a los genes vecinos podría ser preferible, pero podría ser difícil de encontrar.
- La cultura del clon fosmid del Gobierno de la India en LB que contenía 12,5 mg / ml de cloranfenicol a 37 ° C.
- Cultivar una cultura de 1,5 ml de la noche a la mañana fosmid, y mini-prep el ADN fosmid con el Epicentro fosmid prep kit (Biotecnología Epicentro, Madison, WI). Seguimos el protocolo alternativo descrito en las instrucciones que implica la adición de la mezcla Riboshredder en un trámite anterior.
- Determinar la concentración de ADN fosmid con un espectrofotómetro.
- Preparar el electrocompetentes SW106 células al crecer una cultura de 5 ml de la noche a la mañana SW106 en un 14 ml con tapa del tubo con el caldo LB con 12,5 mg / ml de cloranfenicol a 32 ° C.
- Inocular 1 ml en 100 ml de LB con cloranfenicol en un frasco de L 2. Crecen las bacterias SW106 a un OD 600 0,6 a 0,8. NO choque térmico.
- Pellet por centrifugación a 5000xg durante 5 minutos, resuspender el precipitado por agitación suave, y añadir 50 ml de helado de glicerol al 10%. Repita este paso de lavado una vez.
- El precipitado por centrifugación y SW106 aspirar todos, pero ~ 500 l de cada sobrenadante
- Resuspender los pellets por agitación suave. Congelar 100 alícuotas en nitrógeno líquido o en hielo seco y almacenar a -80 ° C para su uso futuro.
- Transformar el ADN en fosmid electrocompetentes SW106 células de las bacterias con electroporating ~ 50 ng de DNA fosmid mediante un Eppendorf 2510 a 1350 voltios electroporador en 0,1 cm cubetas vacío.
- Recuperar las bacterias en 1 ml de LB durante 1 hora a 32 ° C.
- Alícuotas de la placa en placas de LB con cloranfenicol (12,5 mg / mL) y se incuba a 32 ° C durante la noche.
- Verificar la presencia del Gobierno de la India por PCR colonia. Cultivar una cultura de la noche en 5 ml de LB con 12,5 mg / ml de cloranfenicol a 32 ° C. Añadir 0,5 l de la cultura a un nivel de reacción de PCR con los oligonucleótidos que flanquean, y el aumento inicial de 95 ° C de incubación de 5 minutos para lisar las bacterias antes de la PCR.
- Preparar un stock de glicerol para almacenamiento a largo plazo.
III. La inserción de genes GALK por recombinería
En la primera etapa de la modificación fosmid, el gen GALK se inserta en el fosmid por recombinación homóloga, y la fosmids correctamente modificados son seleccionados por el crecimiento en medios mínimos que contienen galactosa como única fuente de carbono (Figura 2A). El SW106 bacterias crecen lentamente en los medios de comunicación y un mínimo de 3-5 días se requieren para ver las colonias.
- Prepare platos MOPS medio mínimo que contenía 0,2% de galactosa. Los medios de comunicación MOPS mínima está disponible en Teknova Inc. (Hollister, CA) (Catálogo # M2106), pero no utilizar la glucosa incluidos.
MOPS medio mínimo con 0,2% de galactosa (1 L)
Autoclave de 15 gramos de agar en 870 ml de agua
Enfriar a 55 ° C y añadir:100 ml MOPS 10X medios mínimos 5 ml 0,2 mg / ml d-biotina (filtrado estéril) 4,5 ml 10 mg / ml de L-leucina (1%, se calienta, luego se enfría y se filtra estéril) 10 ml 20% de galactosa (autoclave) 1 mL 12,5 mg / ml de cloranfenicol en EtOH 2,55 ml 20% de NH 4 Cl 10 ml 0,132 M de fosfato de potasio dibásico - Amplificar por PCR el pMOD4 GALK-G o pMOD4 GALK GT-cassettes, utilizando los cebadores diseñados anteriormente. Hemos utilizado Phusion (New England Biolabs, Ipswich, MA) o GoTaq (Promega, Madison, WI).
- Gel purificar la banda resultante. Cuantificar el rendimiento en un gel o un espectrofotómetro Nanodrop. Este producto de PCR está listo para el paso 3.14.
- Inocular un cultivo de una noche de SW106 células que contienen el ADN fosmid en 5 ml de LB con cloranfenicol (12,5 mg / l). Crecer a 32 ° C.
- Establecer sacudiendo baño de agua a 42 ° C para el calentamiento con un matraz aforado de 250 estéril en el soporte. El uso de un baño de agua agitando es fundamental para conseguir una alta eficiencia.
- Añadir 1 ml de cultivo de una noche a 100 ml de LB y el cloranfenicol en un frasco de L 2. Creciendo a un OD 0.6-0.8. Esto suele tardar entre 3-4 horas.
- Transferir 50 ml de células SW106 en el matraz de 250 ml y choque térmico a 42 ° C durante exactamente 20 minutos. en un baño de agua agitando a 100 rpm Deje el resto de las bacterias a 32 ° C como el control no inducido.
- Enfriar la bacteria inducido y no inducido en hielo durante 10 minutos.
- Transferencia de las muestras de dos tubos de centrífuga estéril y pellets a ~ 5000xg durante 5 minutos.
- Retirar todo el sobrenadante y resuspender el precipitado en 1 ml de helado de glicerol al 10% por agitación suave (es decir, establecer 3-4).
- Cuando volvieron a suspender, añadir otro 49 ml de hielo frío 10% de glicerol, y el precipitado de las muestras a ~ 5000xg durante 5 minutos.
- Repita el paso 3.9, 3.10, 3.11 y otra vez.
- Eliminar todos los sobrenadante invirtiendo los tubos y resuspender el precipitado en el líquido restante (aproximadamente 500 l cada uno). Alícuota en 100 muestras de l, la congelación en hielo seco y almacenar a -80 ° C. Estos son buenos para semanas o meses. (Por lo general, deténgase aquí y realizar la electroporación del día siguiente).
- Electroporar del inducido y no inducido SW106 células con 150 ng de producto de PCR utilizando cubetas de 0,1 cm de distancia en un conjunto de electroporador Eppendorf 2510 a 1350 voltios.
- Recuperar las bacterias en 1 ml de LB en un tubo Falcon de 14 ml. Se incuba a 32 ° C durante 4,5 horas.
- Pellet las bacterias en una microcentrífuga a 13.200 rpm durante 15 segundos. Las bacterias se resuspendieron en M9 y luego se lavan dos veces quitar cualquier medio rico (ver más abajo para obtener la receta).
- Medio M9 (1 L)
- 6 g Na 2 HPO 4
- 3g KH 2 PO 4
- 1 g de NH4Cl
- 0,5 g de NaCl
- AUTOCLAVE
- Tras el segundo lavado, se retira el sobrenadante y el sedimento se resuspende en 1 ml de M9 de las placas, diluciones seriadas en M9 (100 l, 100 l de una dilución 1:10 y 1:100 100 L) en los medios de comunicación MOPS mínimo.
- Incubar 3-5 días a 32 ° C en una incubadora. Nota: Tenga paciencia mientras los verdaderos positivos crecen lentamente.
- Racha de algunas colonias en placas de agar MacConkey indicador (BD # 281 810), complementado con 1% de galactosa y cloranfenicol 12,5 mg / ml. Todas las colonias que aparecen después de que el último paso debe ser + GALK, pero con el fin de deshacerse de cualquier GALK - contaminantes, es importante para obtener colonias aisladas, de color rosa brillante antes de proceder al segundo paso. El GALK - colonias serán de color blanco / incoloro y las bacterias + GALK será de color rojo / rosado debido a un cambio de pH resultantes de la galactosa fermentado después de una noche de incubación a 32 ° C.
- Elija una sola colonia e inocular un ml de LB 5 + cultivo de una noche de cloranfenicol para el crecimiento a 32 ° C.
- Confirmar la inserción del gen GALK en el lugar correcto a través de PCR usando los oligos de acompañamiento. Añadir 0,5 l de la cultura a un nivel de reacción de PCR y el aumento inicial de 95 ° C de incubación de 5 minutos para lisar las bacterias. El producto de PCR se debe upshifted de tamaño debido a la presencia del gen GALK.
- Preparar un stock de glicerol para su almacenamiento.
IV. Sustitución de GALK con secuencias de etiquetas por recombinería
En esta etapa el gen GALK se sustituye por las secuencias de etiqueta que desee y el fosmids correctamente modificados son seleccionados por la selección contra el gen GALK por el tóxico galactosa analógica deoxygalactose (DOG) (Figura 2B).
- Prepare platos MOPS medio mínimo que contiene 0,2% deoxygalactose (DOG) y el 0,2% de glicerol. Los medios de comunicación MOPS mínima está disponible en Teknova Inc. (Hollister, CA) (Catálogo # M2106), pero no utilizar la glucosa incluidos.
MOPS medio mínimo con 0,2% DOG y glicerol (1 L)
Autoclave de 15 gramos de agar en 860 ml de agua
Enfriar a 55 ° C y añadir:100 ml MOPS 10X medios mínimos 5 ml 0,2 mg / ml d-biotina (filtrado estéril) 4,5 ml 10 mg / ml de L-leucina (1%, se calienta, luego se enfría y se filtra estéril) 10 ml 20% deoxygalactose (filtrado estéril) 10 ml 20% de glicerol (autoclave) 1 mL 12,5 mg / ml de cloranfenicol en EtOH 2,55 ml 20% de NH 4 Cl 10 ml 0,132 M de fosfato de potasio dibásico - Amplificar por PCR los fragmentos de la etiqueta de pMOD4 GFP, pBS1761 (N-término TAP), o pBS1479 (C-término TAP), utilizando los oligos mismo que se utiliza en la primera ronda o el uso de buenas prácticas agrarias más corto o TAP específicos oligos (las secuencias de interior en el paso 1.2 ). Si usted está haciendo las construcciones múltiples, es especialmente útil el uso de los oligos cortos como el mismo producto de PCR se puede utilizar para todas las construcciones.
- Gel de purificar el producto de PCR y medir la concentración a través de gel o espectrofotometría.
- Generar inducido y no inducido competente SW106 llevar el fosmid con el gen insertado GALK siguientes pasos 3.4-3.13 arriba.
- Electroporar del inducido y no inducido SW106 células con ~ 100 ng de producto de PCR utilizando cubetas de 0,1 cm de distancia en un conjunto de electroporador Eppendorf 2510 a 1350 voltios.
- Recuperar en 1 ml de LB en un 14 ml con tapón del tubo y se incuba en un agitador de 32 ° C durante 4,5 horas.
- Lavar y diluir las bacterias que en los pasos 3.16 y 3.17. Bacterias en las placas de la placa de MOPS medio mínimo que contenía 0,2% de 2-desoxi-galactosa (DOG) y el 0,2% de glicerol.
- Se incuba a 32 ° C durante tres días.
- Cuatro colonias se usan para hacer 5 mlcultivos de una noche en LB con 12,5 mg / ml de cloranfenicol. Estos se utilizan para la colonia PCR como antes para confirmar que el cassette se inserta. Nosotros utilizamos tanto las buenas prácticas agrarias más corto / TAP oligos específicos y los oligos de acompañamiento para demostrar la Derecha y el sitio correcto. GFP es de ~ 800 pb y TAP es de ~ 550 pb, mientras que GALK es de 1,4 kb.
- Preparar un stock de glicerol.
V. La adición de UNC-119 genes por recombinación Cre-loxP
Un método común de la generación de animales transgénicos con el fosmids modificado mediante el uso de bombardeos biolística. Esta técnica utiliza el ADN recubierto de partículas de oro para introducir ADN en fosmid C. elegans. Los animales transgénicos se identifican generalmente por medio de rescate de los mutantes unc-119 con un transgén unc-119. En este paso, la UNC-119 genes se añade a la columna vertebral fosmid en cis por Cre-loxP recombinación con el pLoxP unc-119 plásmido (Fig. 2C).
- Prepare competente SW106 bacterias portadoras de la fosmid modificado a partir del paso 4.9 siguiendo los pasos 2.5-2.9. NO induzca a 42 ° C.
- Electroporar con 50 ng. pLoxP unc-119 de un mini-prep utilizando cubetas de 0,1 cm de distancia en un Eppendorf 2510 electroporador fijado en 1.350 voltios.
- Recuperar las bacterias en LB que contenía 0,1% de arabinosa durante 1 hora a 32 ° C.
- Alícuotas de placa en placas LB con ampicilina y 50μg/mL 12,5 mg / ml de cloranfenicol. Se incuba a 32 ° C durante la noche. que selecciona para la integración de pLoxP unc-119 en el fosmid.
- Crecer un cultivo de una noche en LB con ampicilina y 50μg/mL mg 12,5 / ml de cloranfenicol. Use 0,5 l de PCR verificar la presencia del gen unc-119 con la unc-119 F (5'-CAAATCCGTGACCTCGACAC-3 ') y unc-119 R (5'-CACAGTTGTTTCTCGAATTTGG-3') oligos (Tabla 1).
- Hacer un depósito de glicerina de la fosmid final.
VI. A gran escala Preparación Fosmid
Para facilitar la obtención de las cantidades más grandes de ADN fosmid necesarios para el bombardeo, en esta etapa, el fosmid se transfiere a la EPI300 bacterias. Esta cepa tiene la capacidad de aumentar el número de copias fosmid para aumentar el rendimiento durante la preparación de ADN.
- Cultivar una cultura de la noche 5 ml de la bacteria de paso de 5,5 en LB con ampicilina y el cloranfenicol a 32 ° C. Use Epicentro fosmid kit de preparación para aislar el fosmid de 1,5 ml de la cultura.
- Electroporar ~ 50 ng en el EPI300 bacterias utilizando cubetas de 0,1 cm de distancia en un conjunto de electroporador Eppendorf 2510 a 1350 voltios. El EPI300 las bacterias pueden ser adquiridos por medios biotecnológicos Epicentro (Madison, WI).
- Recuperar las bacterias en LB durante 1 hora a 37 ° C. Alícuotas de la placa de agar LB que contiene 50 mcg / ml y 12,5 mg / ml de cloranfenicol.
- Crecer y producir la bacteria que contiene el EPI300 fosmid modificado siguiendo las instrucciones incluidas. A 50 ml de cultivo inducido dará> 10 ug de ADN purificado fosmid. Purificar el fosmid con el Epicentro fosmid preparación kit.
VII. Bombardeo
- Utilizar 10 mg. de ADN fosmid para bombardear la cepa gusano DP38 como se describe (D. Hochbaum, Ferguson A., y A. Fisher, Júpiter, en prensa).
VIII. Resultados representante
La modificación de fosmids través recombinería robusto y las tasas de éxito de> 90% en la etapa de selección negativa se observa habitualmente 2. Este protocolo también se lleva alrededor de 2 semanas para completar lo que hace que la preparación de los transgenes bastante rápido. El protocolo también ha sido probado por otros laboratorios con éxito 20.
| Oligo | Secuencia |
| C-término TAP F | ATGGAAAAGAGAAGATGGAAAAAG |
| C-término TAP R | GGTTGACTTCCCCGC |
| F FLAG-GFP | ATGGATTACAAGGACGATGACGATAAGATGAG |
| FLAG-GFP R | CAAAGCTTGTGGGCTTTTGTATAG |
| N plazo TAP F | ATGGCAGGCCTTGCGC |
| N plazo TAP R | AAGTGCCCCGGAGGATGAGATTTTCT |
| GALK F | CCTGTTGACAATTAATCATCGGCA |
| GALK R | TCAGCACTGTCCTGCTCCT |
| unc-119 F | CAAATCCGTGACCTCGACAC |
| unc-119 R | CACAGTTGTTTCTCGAATTTGG |
Tabla 1. Oligonucleótidos utilizados para la PCR.
| Plásmidos | Fuente | Disponible en |
| Fosmid clon | Geneservice Ltd. | Geneservice |
| pGalK | 15 | NCI-Frederick |
| pMOD4-RT-G | 2 | Addgene |
| pMOD4-GALK-G | ||
| pMOD4-GALK-GT | ||
| pLoxP-UNC-119 | ||
| pMOD4-GFP | ||
| Las bacterias | ||
| SW106 | 15 | NCI-Frederick |
| EPI300 | Epicentro Biotecnologías | Epicentro |
| EC100D pir-116 | ||
Tabla 2. Colar y disponibilidad vector.
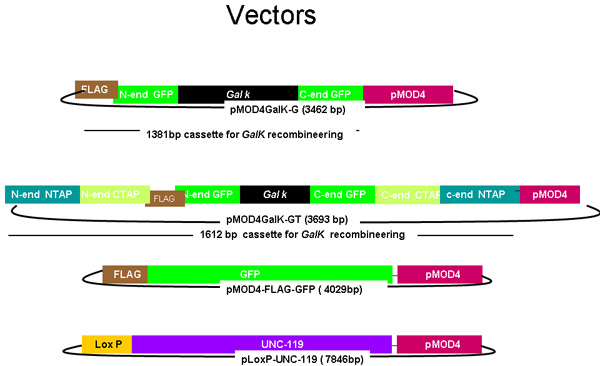
Figura 1.
Diagrama de pMOD4-GALK-G, y pMOD4 GALK-GT-, pMOD4 GFP, pLoxP-UNC-119
El plásmido pMOD4-GALK-G consiste en la cinta GALK (negro), flanqueada por 50 regiones de nucleótidos idénticos a los 5 'y 3' de la Bandera (Brown)-GFP (verde), mientras que PMOD 4 GALK-GT se compone de la GALK casete, flanqueada por dos de las regiones de homología GFP-FLAG y 50 regiones de nucleótidos idénticos a los 5 'y 3' de la N-terminal y C-terminal TAP (azul y naranja, respectivamente). pMOD4-FLAG-GFP consiste en el cassette GFP completa con una etiqueta FLAG 5 'y pLoxP unc-119 consiste en la UNC-119 secuencia genómica (púrpura) en un plásmido que contiene un sitio loxP. Todos los plásmidos utilizar el R6K basado pMOD4 (rojo) columna vertebral que es incapaz de replicarse en SW106.
Figura 2.
Descripción general del proceso de recombinería GALK
Figura 2A-2C cifras separadas mostrando los pasos y el tiempo empleado en recombinería de utilizar la cinta GALK. Estas son las mismas figuras que se funden en la figura 2d, pero siempre por separado para mayor claridad y facilidad de lectura. A fosmid de interés es la primera modificación en un procedimiento en dos etapas que implica la inserción de la cinta GALK flanqueado por 50 pb regiones de homología con bandera de las buenas prácticas agrarias o TAP (Figura 2A), seguido por el reemplazo de este casete por bandera-GFP o TAP ( Figura 2B). Más adelante en el marcador unc-119 para su uso en la generación de animales transgénicos se inserta en el sitio loxP en la columna vertebral fosmid (Figura 2C).
La figura 2D muestra una cifra combinada de procedimiento recombinería GALK.
Esquema del procedimiento recombinería GALK como se describe en el tiempo anterior, incluyendo el necesario para cada paso de la fusión de la figura 2A-2C.
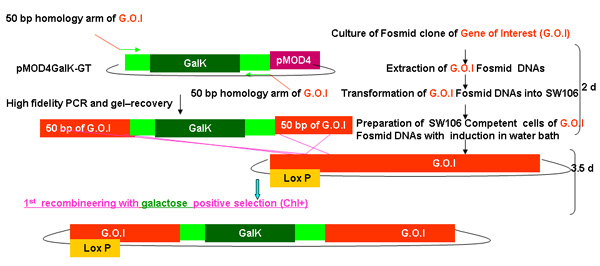
Figura 2a. La inserción GALK en recombinería GALK.
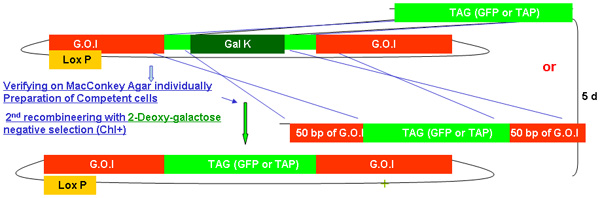
La figura 2b. El TAG (GFP / TAP) de inserción en recombinería GALK.
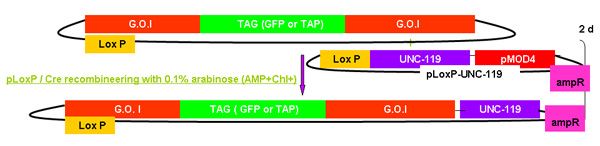
Figura 2c. La adición de UNC-119.
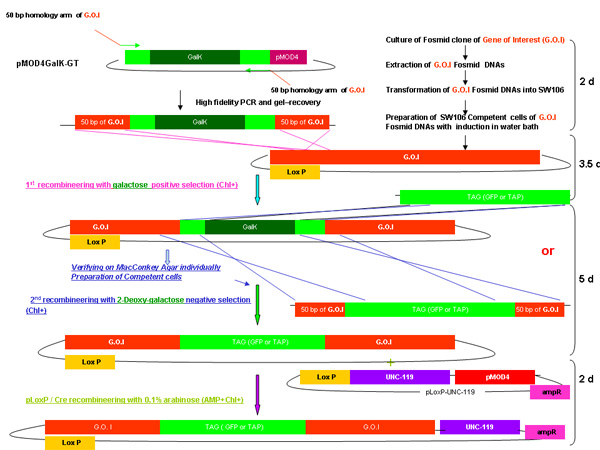
Figura 2d. La visión combinada de recombinería GALK.
Discusión
La generación de los transgenes de fosmids ofrece la ventaja de conservar todos los elementos promotor nativo, las variantes de empalme, y 3 'UTR elementos reguladores. Esto puede conducir a la construcción de un transgén que es más un reflejo de los patrones de expresión nativa, o la construcción de un transgén funcional cuando otros métodos fallan 5. Los transgenes resultante puede llevar a una variedad de etiquetas epítopo incluyendo GFP o una etiqueta de TAP.
La c...
Divulgaciones
Agradecimientos
Los autores desean agradecer a Lindsey Nash en busca de ayuda con el desarrollo de la técnica. Este trabajo fue financiado por el NIH subvención AG028977 a ALF, una subvención para el proyecto piloto de la Universidad de Pittsburgh OAIC (AG024827), y los fondos de las semillas de la Universidad de Pittsburgh.
Materiales
| Name | Company | Catalog Number | Comments |
| FosmidMAX kit | Epicentre Biotechnologies | FMAX046 | |
| GoTaq | Promega Corp. | M7122 | |
| MOPS Media | TEKnova, Inc. | M2120 | |
| 0.132 M Potassium phosphate solution | TEKnova, Inc. | M2102 | |
| D-galactose | Sigma-Aldrich | G0750 | |
| 2-deoxygalactose | Sigma-Aldrich | D4407 | |
| Biotin | Sigma-Aldrich | B4639 | |
| Leucine | Sigma-Aldrich | L8000 | |
| NH4Cl | Sigma-Aldrich | A9434 | |
| Phusion DNA polymerase | New England Biolabs | F-530S | |
| MacConkey agar base | BD Biosciences | 281810 | |
| Arabinose | Sigma-Aldrich | A3131 | |
| Chloramphenicol | Sigma-Aldrich | C1919 | |
| Sodium phosphate dibasic | Sigma-Aldrich | S5136 | |
| Potassium phosphate monobasic | Sigma-Aldrich | P5655 | |
| Sodium chloride | Sigma-Aldrich | S5886 | |
| Glycerol | Sigma-Aldrich | G2025 | |
| Bacto Agar | BD Biosciences | 214010 |
Referencias
- Mello, C., Fire, A. DNA transformation. Methods Cell Biol. 48, 451-482 (1995).
- Zhang, Y., Nash, L., Fisher, A. L. A simplified, robust, and streamlined procedure for the production of C. elegans transgenes via recombineering. BMC Dev Biol. 8, 119-119 (2008).
- Antebi, A., Yeh, W. H., Tait, D., Hedgecock, E. M., Riddle, D. L. daf-12 encodes a nuclear receptor that regulates the dauer diapause and developmental age in C. elegans. Genes and Development. 14, 1512-1527 (2000).
- Snow, M. I., Larsen, P. L. Structure and expression of daf-12: a nuclear hormone receptor with three isoforms that are involved in development and aging in Caenorhabditis elegans. Biochim. Biophys. Acta. 1494, 104-116 (2000).
- Fisher, A. L., Page, K. E., Lithgow, G. J., Nash, L. The Caenorhabditis elegans K10C2.4 Gene Encodes a Member of the Fumarylacetoacetate Hydrolase Family. A CAENORHABDITIS ELEGANS MODEL OF TYPE I TYROSINEMIA. J Biol.Chem. 283, 9127-9135 (2008).
- Wightman, B., Ha, I., Ruvkun, G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C. elegans. Cell. 75, 855-862 (1993).
- Lehrbach, N. J. LIN-28 and the poly(U) polymerase PUP-2 regulate let-7 microRNA processing in Caenorhabditis elegans. Nat Struct Mol Biol. 16, 1016-1020 (2009).
- Tursun, B., Cochella, L., Carrera, I., Hobert, O. A toolkit and robust pipeline for the generation of fosmid-based reporter genes in C. elegans. PLoS One. 4, e4625-e4625 (2009).
- Bamps, S., Hope, I. A. Large-scale gene expression pattern analysis, in situ, in Caenorhabditis elegans. Brief. Funct. Genomic. Proteomic. , (2008).
- Dolphin, C. T., Hope, I. A. Caenorhabditis elegans reporter fusion genes generated by seamless modification of large genomic DNA clones. Nucleic Acids Res. 34, e72-e72 (2006).
- Sarov, M. A recombineering pipeline for functional genomics applied to Caenorhabditis elegans. Nat. Methods. 3, 839-844 (2006).
- Yang, X. W., Model, P., Heintz, N. Homologous recombination based modification in Escherichia coli and germline transmission in transgenic mice of a bacterial artificial chromosome. Nat Biotechnol. 15, 859-865 (1997).
- Court, D. L., Sawitzke, J. A., Thomason, L. C. Genetic engineering using homologous recombination. Annu.Rev.Genet. 36, 361-388 (2002).
- Westenberg, M., Bamps, S., Soedling, H., Hope, I. A., Dolphin, C. T. Escherichia coli MW005: lambda Red-mediated recombineering and copy-number induction of oriV-equipped constructs in a single host. BMC Biotechnol. 10, 27-27 (2010).
- Warming, S., Costantino, N., Court, D. L., Jenkins, N. A., Copeland, N. G. Simple and highly efficient BAC recombineering using galK selection. Nucleic Acids Res. 33, e36-e36 (2005).
- Penfold, R. J., Pemberton, J. M. An improved suicide vector for construction of chromosomal insertion mutations in bacteria. Gene. 118, 145-146 (1992).
- Praitis, V., Casey, E., Collar, D., Austin, J. Creation of low-copy integrated transgenic lines in Caenorhabditis elegans. Genetics. 157, 1217-1226 (2001).
- Puig, O. The tandem affinity purification (TAP) method: a general procedure of protein complex purification. Methods. 24, 218-229 (2001).
- Rigaut, G. A generic protein purification method for protein complex characterization and proteome exploration. Nat.Biotechnol. 17, 1030-1032 (1999).
- Achilleos, A., Wehman, A. M., Nance, J. PAR-3 mediates the initial clustering and apical localization of junction and polarity proteins during C. elegans intestinal epithelial cell polarization. Development. 137, 1833-1842 (2010).
- Maduro, M., Pilgrim, D. Identification and cloning of unc-119, a gene expressed in the Caenorhabditis elegans nervous system. Genetics. 141, 977-988 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados