Method Article
Nucleofection y cultivos primarios de neuronas del hipocampo de embriones de ratón y corticales
* Estos autores han contribuido por igual
En este artículo
Resumen
Este protocolo describe los pasos necesarios para analizar, a través de la electroporación y transfectar neuronas del hipocampo del ratón y la cultura cortical. Corto plazo, las culturas pueden ser utilizados para los estudios del axón y la orientación, mientras que a largo plazo las culturas pueden ser utilizados para estudios de la sinaptogénesis y el análisis espina dendrítica.
Resumen
Las neuronas del hipocampo y la corteza se han utilizado ampliamente para estudiar el sistema nervioso central (SNC) la polarización neuronal, axón / dendrita y la formación de sinapsis y la función. Una de las ventajas del cultivo de estas neuronas es que fácilmente se polarizan, la formación de los axones y las dendritas distintivo, sobre un sustrato de dos dimensiones en densidades muy bajas. Esta propiedad les ha hecho extremadamente útil para la determinación de muchos aspectos del desarrollo neuronal. Además, al proporcionar acondicionado gliales de estas neuronas van a seguir para desarrollar, formar conexiones sinápticas funcionales y sobrevivir durante varios meses en la cultura. En este protocolo se plantean una técnica de disecar, la cultura y transfectar neuronas embrionarias de ratón del hipocampo y la corteza. Transfección se lleva a cabo electroporating ADN en las neuronas de las placas, a través de nucleofection. Este protocolo tiene la ventaja de expresar la fluorescencia de etiquetado proteínas de fusión en el desarrollo temprano (~ 4 8 horas después de la siembra) para estudiar la dinámica y función de las proteínas durante el axón de polarización, y la ramificación. También hemos descubierto que la transfección de las placas, solo mantiene la expresión fluorescente marcada con la proteína de fusión en los niveles apropiados para la imagen durante toda la vida de la neurona (> 2 meses en la cultura). Por lo tanto, esta metodología es útil para el estudio de la localización y función de proteínas durante el desarrollo del SNC, con poco o ningún trastorno de la función neuronal.
Protocolo
1. Preparación de cubreobjetos y Cámaras
- Preparación de cubreobjetos limpio y las cámaras es esencial para las culturas saludables. Los accesos directos no se debe tomar en cualquiera de estos pasos.
- Lave el cubreobjetos (12 mm o 22 mm redondo, vidrio alemán - Carolina Marca auxiliar) durante la noche en ácido nítrico concentrado (HNO3) en un frasco de vidrio dedicado o un vaso.
- Quitar los cubreobjetos de ácido nítrico y lavar ampliamente (5-7x) en agua destilada.
- Separar el cubreobjetos y seca en una campana de flujo laminar o gabinete de bioseguridad. Una vez seco, esterilizarlos con luz UV durante 30 minutos. Lugar esterilizados cubreobjetos en placas de Petri estéril para su almacenamiento. Si las neuronas chapado en cubreobjetos de 12 mm directamente lugar cubreobjetos en una placa de 35 mm estériles y proceder a la Sección 2.
- Cámaras de imágenes están construidas mediante la perforación de un agujero de 15 mm en la parte inferior de 35 mm placas de Petri (eliminar todas las rebabas) y adjuntar los cubreobjetos de limpiar con una mezcla de 3:1 de parafina y vaselina.
- Derrita la parafina / mezcla de vaselina en un tubo cónico en un baño de agua hirviendo. Utilice un pincel pequeño y cubrir la parte inferior de la placa alrededor del agujero de 15 mm. Asegúrese de seguir revolviendo la parafina / mezcla de vaselina, ya que se separarán. Esto usualmente resulta en cámaras pegadas entre sí con una mayor concentración de la jalea de petróleo, que se convertirá en viscosa cuando los platos se colocan en la incubadora, lo que resulta en el desprendimiento de cubreobjetos. El resto de parafina / vaselina se puede almacenar a temperatura ambiente.
- Coloque el plato boca abajo sobre una bandeja plana y colocar el cubreobjetos sobre el agujero. Calor en el horno 80 ° C hasta que la mezcla de parafina se funde (~ 10 minutos). Quite los platos sobre una superficie plana y dejar que el conjunto de la mezcla de parafina.
- A su vez los platos una y esterilizar tanto el interior de las tapas y los fondos de las cámaras con luz UV.
- Cubreobjetos de abrigo o regiones de vidrio de las cámaras con 1.0mg/mL poli-D-lisina (30kDa) en tampón de borato (borato de sodio 0.1 M, pH 8,5) durante una hora. Enjuague 3-5 veces con abundante cantidad de agua de grado de cultivo de tejidos desionizada. Asegúrese de eliminar todos los rastros de tampón borato. Seco y utilizar inmediatamente o almacenar cámaras / cubreobjetos para su uso posterior. Por lo general, el uso cubreobjetos limpiar el plazo de un mes de preparación.
2. Preparación de la disección neuronal y medio de cultivo
- Preparar el medio de la disección (DM) mediante la adición de cantidades adecuadas de HBSS 10x y 100x HEPES al agua de grado de cultivo de tejidos. Almacenar a 4 ° C. Mantener en hielo durante la disección.
- El día antes de la disección de preparar el medio de chapado (PM) y el medio libre de suero (SFM). PM se compone de medio Neurobasal, suplemento de B27, 2 mM de glutamina, un 0,3% de glucosa, 37,5 mM de NaCl y 5% de suero fetal bovino (SFB). SFM se compone de medio Neurobasal, suplemento de B27, 2 mM de glutamina, un 0,3% de glucosa y 37,5 mM NaCl.
- Haz sólo lo suficiente para la disección y guardar en un cultivo de tejido durante la noche con la tapa de la incubadora entreabierta para que la temperatura y el contenido de CO 2 del medio se equilibra. Añadimos la glucosa extra y aumentar la osmolaridad de aproximadamente 310mOsm con NaCl. Nos encontramos con las culturas de hacerlo mejor en una osmolaridad más fisiológica (osmolalidad Neurobasal suele ser de 205 245mOsm).
3. Cortical alimentador gliales Preparación de capas de los cultivos a largo plazo
- Si a largo plazo, las culturas se han de preparar, realizar esta parte del protocolo de dos a tres semanas antes de continuar con las disecciones cortical o del hipocampo.
- Preparar el medio gliales (GM) con el MEM, el 0,3% de glucosa, penicilina / estreptomicina y 10% suero de caballo.
- Eutanasia P1-P3 crías de ratón de un enfriamiento en hielo durante 5 minutos. Eliminar a las crías en el hielo y gas con 70% de etanol. Rápidamente decapitar con unas tijeras. Quite todo el cerebro a un plato que contiene frío DM (paso 2.1).
- Retire los dos hemisferios cerebrales y las meninges. Impuestos Especiales de la corteza cerebral y trasladarlo a un nuevo plato que no contiene los medios de comunicación. Prepare las cortezas de cuatro cerebros total.
- Picar la corteza con un cuchillo limpio, maquinilla de afeitar estéril tan fina como sea posible y eliminar el tejido picado con una pipeta de plástico a un tubo cónico de 50 ml que contienen 12 ml de frío DM. Añadir la tripsina y DNasa a la concentración final de 0,25% (1,5 ml) y 0,1% (1,5 ml), respectivamente. Incubar en un baño de agua a 37 ° C durante 10 minutos con agitación intermitente.
- Retire el tubo que contiene el tejido cortical y limpiar a fondo con etanol al 70% antes de la puesta en el capó de cultivo de tejidos. Tejido cortical pipeta de arriba y abajo con una pipeta de 10 ml aproximadamente 10-15 horas, o hasta que la mayoría de los trozos de desaparecer.
- Devuelva el tubo a 37 ° C en un baño de agua durante 10 minutos con intermitentes remolino.
- Limpiar a fondo el tubo con etanol al 70% y traerlo de vuelta a la campana de cultivo de tejidos. Pipeta el tejido cortical de arriba a abajo con un 5 mL pipeta de aproximadamente 10-15 horas, o hasta que los trozos de desaparecer.
- Agregar 15 ml de agua tibia GM y centrifugar a 200xg (1000 rpm) durante 10 minutos.
- Desechar el sobrenadante, resuspender las células sedimentadas en 20 ml de agua dulce GM y contar con un hemocitómetro. Lámina 5-7.5x10 6 células en 15 ml de GM por 75 cm 2 matraz.
- Después de un día y cada 2-3 días posteriores en la cultura, separar las células sueltas, golpeando el frasco contra su mano. Eliminar el medio junto con las células desalojados y reemplazar con 15 ml de agua dulce GM.
- Glía se puede cosechar después de 1-2 semanas de crecimiento en los frascos, cuando están a punto 70-100% confluente. Para preparar cada cubreobjetos recubiertos con células gliales, lugar ácido nítrico 6 limpiar y esterilizar 25 mm cubreobjetos redondo en un plato de 10 cm, y el lugar 3 puntos de la mezcla de 3:1 de parafina / vaselina en cada portaobjetos en un patrón triangular con un pincel pequeño . El tratamiento de platos abiertos con luz UV durante 30 minutos. Cubra el cubreobjetos con 0,1 mg / ml de poli-D-lisina (30kDa) en tampón borato durante una hora, luego lave exhaustivamente (3 a 5 veces) con agua estéril de grado de cultivo de tejidos desionizada y dejar secar.
- Retirar el frasco que contiene la glía de la incubadora, se elimina el medio y enjuague con 5 ml de pre-calentado tripsina / EDTA. Retire la solución de tripsina / EDTA en el matraz y pipeta de 3 ml de agua dulce precalentado tripsina / EDTA en el matraz. Incubar el matraz durante 1 minuto a 37 ° C antes de añadir 5 ml de GM para detener la tripsina.
- Retire la glia del frasco por las reiteradas pipeteado 10-15 veces, y luego transferir los medios de comunicación a un tubo cónico de 15 ml. Centrifugar a 200xg (1000 rpm) durante 8 minutos. Eliminar el sobrenadante y agregar 10 ml de GM, cuentan las células, y la placa de 5x10 células 5 en 12,5 ml de GM por plato de 10 cm que contiene el cubreobjetos.
- Intercambio con el medio fresco precalentado GM cada 2-3 días. El día antes de la disección de las neuronas, retire la GM y reemplazar con la ordenación forestal sostenible (sección 2.2). Utilice esta SFM gliales acondicionado en el paso 4.12, cuando las inundaciones cultivos corticales o del hipocampo.
4. Disección cortical y / o del hipocampo y la electroporación
- Eliminar la cantidad adecuada de soluciones nucleofection (Lonza), combinar, y la temperatura ambiente antes de comenzar la disección. Ya que la solución Nucleofection tiene una vida útil limitada cuando se combinan, sólo se combinan la cantidad necesaria para cada preparación (100 l por transfección).
- La eutanasia a un ratón embarazadas en E15.5 con CO 2 (día de enchufe E0.5) y extraer el útero de una placa de Petri de 10 cm. Eliminar los fetos y decapitar al frío DM (sección 2.1).
- Quite todo el cerebro en un plato aparte de frío DM y con una aguja de tungsteno dobladas, eliminar tanto neocortices. Quite la meninges con microforceps y cortezas lugar en nuevo plato frío de DM. Con una tijera pequeña iris o Wecker, quitar la corteza o el hipocampo y el lugar en un tubo Eppendorf de 1,5 ml lleno con 1,0 ml de frío DM. Mantenga este tubo en hielo.
- Después de la disección de todas las cortezas o hipocampos, añadir 110 l de 2,5% de tripsina al tubo Eppendorf que contiene el tubo de tejido y colocarlo en una incubadora a 37 ° C durante 20 minutos.
- Quitar la corteza sobrenadante y lavar o hipocampos con 1,0 mL PM (sección 2.2) suavemente invirtiendo el tubo Eppendorf. Repita el lavado dos veces, dejando 1 ml de la tarde en el tubo.
- Triturar los trozos de 15 veces con una pipeta P1000, y eliminar las células sobrenadante / a un nuevo tubo de 15 mL cónico que contiene 4 ml de la tarde, dejando a los trozos que quedan en el tubo Eppendorf.
- Girar el tubo de 15 ml en 20xg (350rpm) durante 7 minutos con el freno de apagado. Descartar el sobrenadante y añadir 100 ml de premezcla, la solución de sala de nucleofection temperatura (Lonza) para cada uno de transfección. Triturar 5 veces con un suave movimiento hacia arriba y abajo de la pipeta P1000.
- Eliminar 100 L de la solución nucleofection / célula mezcla a cada nuevo tubo Eppendorf y añadir la cantidad apropiada de ADN. A largo plazo las culturas que utilizan generalmente 1-2μg de ADN por la transfección. Sin embargo, esta etiqueta sólo una pequeña proporción <10% de las neuronas en la cultura. Por lo general, el uso de 5-10μg de DNA por transfección si desea una mayor eficiencia de transfección de la cultura a corto plazo. Hemos utilizado hasta un total de 40μg de ADN cuando la transfección con dos plásmidos diferentes. Los plásmidos son almacenados en buffer TE a 1 g / mL.
- Añadir la suspensión de células / ADN a la cubeta (Lonza) y electroporar las células en el Nucleofector (Lonza), mediante el programa S-005 (sistema nervioso central del ratón neuronas).
- Trabajando rápidamente, añadir 500 l de PM pre-calentado y equilibrada a la cubeta y remover la solución / células a un nuevo tubo Eppendorf de 1,5 ml. Añadir PM suficiente para reducir el volumen de cada transfección de 1,0 ml. Contar las células con un hemocitómetro y la placa en 3-5x10 3 células / cm 2 para los cultivos jóvenes, o 5-10x10 3 células / cm 2 para los cultivos a largo plazo.
- A corto plazo las culturas, las inundaciones las placas de cultivo de 35 mm con 2,0 ml de calentado, CO 2-equilibrio SFM después de una hora de la siembra. Si se utiliza cubreobjetos, se elimina la mitad de la PM y reemplazarla con la ordenación forestal sostenible, y luego repetir dos veces más. Cualquiera de las inundaciones de las cámaras de imagen o el lavado de los resultados cubreobjetos en un contenido muy bajo en suero (<0,5%). A corto plazo las culturas no necesitan ser cultivadas con una capa de alimentación gliales y no necesitan volver a ser alimentado.
- De cultivos a largo plazo, eliminamos las células de un cubreobjetos cubiertos con tres puntos de parafina / vaselina e invertirlo en el agujero de 15 mm en la placa de 35 mm, una hora después de la siembra inicial. Dos mililitros de la ordenación forestal sostenible acondicionado en el plato gliales se añade a la cámara de imágenes. Para alimentar a los cultivos de largo plazo, se elimina un tercio de la ordenación forestal sostenible, cada 2-3 días y sustituirla por nueva, previamente calentada y CO 2-equilibrada ordenación forestal sostenible.
5. Los resultados representativos:
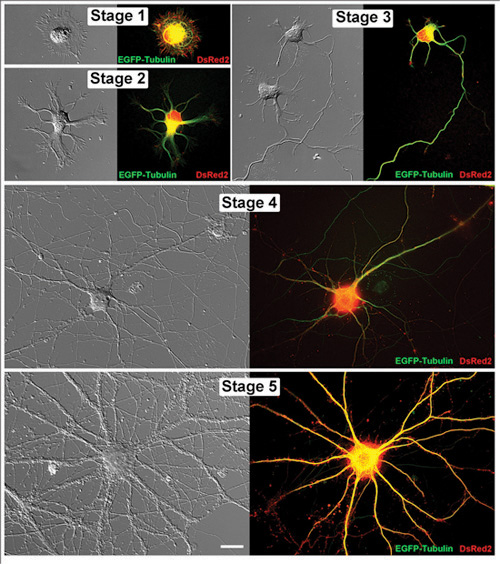
Figura 1. Que viven las neuronas del hipocampo en las sucesivas etapas de desarrollo. Imágenes pareadas de representante vivo las neuronas del hipocampo se muestran tanto como una imagen de contraste de interferencia diferencial y una micrografía fluorescente correspondiente. Cada una de estas células ha sido transfectadas con EGFP-tubulina y DsRed2 en vectores pCAX. Las neuronas fueron estudiados en los próximos días in vitro (DIV): Etapa 1 (1DIV), nivel 2 (1DIV), Etapa 3 (2DIV), Etapa 4 (11DIV) y Etapa 5 (32DIV). Barra de escala es 20μm.
Discusión
Este protocolo para el cultivo de neuronas de ratón embrionario del hipocampo y la corteza se desarrolló como una modificación del protocolo de Banker, que utiliza ratas 1,2 neuronas. Hemos utilizado este protocolo para el ratón y el cultivo de neuronas de hámster, así 3,4,5,6,7. Este protocolo funciona igualmente bien para las neuronas del hipocampo y el neocórtex tanto y es similar a un protocolo publicado por Meberg y Miller 8. En general, usamos las neuronas del hipocampo a largo plazo la cultura, ya que están bien caracterizados y un sistema de modelo más establecido. Además, es probable que contienen una población más homogénea de las neuronas de la neocorteza. Sin embargo, las neuronas neocortical cultivadas usando este protocolo también sobreviven y se diferencian de manera similar (datos no publicados). Nosotros usamos las neuronas del hipocampo y el neocórtex para el cultivo a corto plazo. La disección del neocórtex también da lugar a neuronas mucho más (1.5x10 6 neuronas por cada par de cortezas) que la disección del hipocampo (2.5x10 5 neuronas por cada par de hipocampo), que hace que sea una mejor elección de material para el Western Blot, por ejemplo.
Como con cualquier otro cultivo primario, es esencial para minimizar el tiempo que se tarda desde la muerte del animal para el revestimiento de las células. Por lo general, se llevará a 20.10 disecciones para convertirse en rápido y consistente en la disección y de las planchas. Además, cuando se trabaja con la Nucleofector Lonza, es fundamental trabajar con rapidez durante el proceso de electroporación, como la viabilidad de las neuronas disminuye rápidamente si se dejan en la memoria nucleofection.
Gran parte de nuestra imagen se lleva a cabo con un total de microscopía de fluorescencia de reflexión interna (TIRFM). Este tipo de microscopio es sólo capaz de obtener imágenes de varios cientos de nanómetros más allá de los cubreobjetos. Por lo tanto, las áreas de las neuronas que con frecuencia la imagen, el cono de crecimiento axonal y las espinas dendríticas, es necesario adherirse directamente a la cubreobjetos. Por lo tanto, utilizar cultivos de baja densidad que requieren alimentación gliales a largo plazo de la cultura. Hemos utilizado la más alta densidad de cultivos (> 2x10 4 células / cm 2), sin capas de alimentación gliales de cultivos a largo plazo y encontró que sobreviven muy bien con la alimentación poco. Sin embargo, las espinas dendríticas de las neuronas son a menudo muy lejos de la imagen en el sustrato de TIRFM, a pesar de que se puede detectar fácilmente con un amplio campo de la microscopia o microscopía confocal.
En la mayoría de nuestros estudios nos transfectar neuronas de las placas, y se han fotografiado las proteínas fluorescente marcada con un máximo de tres meses en la cultura. Esta expresión a largo plazo de las proteínas marcadas con fluorescencia nos da confianza en que mediante el uso de bajas concentraciones de ADN (1-2μg) no estamos produciendo artefactos sobreexpresión en las neuronas. Sin embargo, este procedimiento también se puede utilizar para estudiar si la sobreexpresión de las proteínas de grandes cantidades de ADN se utilizan (10-20 microgramos). Los plásmidos que se utiliza para transfectar neuronas suelen contener proteínas EGFP o mCherry de fusión, aunque también marca el citoplasma neuronal con DsRed2 o EGFP solo. Esta técnica de electroporación trabaja bien con un número de vectores. Nosotros preferimos los plásmidos que contienen un promotor β-actina con un potenciador de CMV y β-globina cola poli-A (pCAGGs o plásmidos pCAX) 9, debido a los relativamente altos niveles de expresión, y el hecho de que son bien tolerados por las neuronas tanto en la cultura de corto y largo plazo. En general, las proteínas comienzan a expresarse dentro de unas 4 horas de la siembra y alcanzar niveles suficientes para obtener imágenes de un plazo de 10-24h 10. Hemos utilizado con éxito por CMV impulsada por el promotor de plásmidos en corto plazo, las culturas, pero han encontrado que pueden provocar altos niveles de sobre-expresión que matan a las neuronas en el largo plazo la cultura. Sin embargo, hemos encontrado que el condicionamiento gliales de cultivos de baja densidad ayuda a la supervivencia de las neuronas transfectadas con plásmidos promotor CMV impulsada, en comparación con una mayor densidad (no gliales Fed) culturas.
Divulgaciones
Agradecimientos
Todos los procedimientos fueron aprobados por la Universidad de Wisconsin Comité de Cuidado de Animales y estaban en conformidad con las directrices del NIH. Agradecemos a la Dra. Katherine Kalil para el uso generoso de su dispositivo Nucleofector. También queremos agradecer a los miembros del laboratorio de Dent para comentarios sobre el protocolo. Este trabajo fue apoyado por subvenciones del NIH R01-NS064014, Fundación Dana y la Fundación de Whitehall EWD
Christopher Viesselmann, Ballweg Jason y Derek Lumbard contribuyeron igualmente a este trabajo.
Materiales
* La mayoría de los reactivos que se almacenan a -80 ° C se puede almacenar a -20 ° C también. El almacenamiento a -80 ° C se alarga su vida útil y los resultados en las culturas un poco más consistente.
Referencias
- Goslin, K., Asmussen, H., Banker, G., Goslin, K., Banker, G. Chapter 13. Culturing Nerve Cells. , 339-370 (1998).
- Kaech, S., Banker, G. Culturing hippocampal neurons. Nat Protoc. 1, 2406-2415 (2006).
- Dent, E. W., Callaway, J. L., Szebenyi, G., Baas, P. W., Kalil, K. Reorganization and movement of microtubules in axonal growth cones and developing interstitial branches. J Neurosci. 19, 8894-8908 (1999).
- Dent, E. W., Kalil, K. Dynamic imaging of neuronal cytoskeleton. Methods Enzymol. 361, 390-407 (2003).
- Dent, E. W. Filopodia are required for cortical neurite initiation. Nat Cell Biol. 9, 1347-1359 (2007).
- Hu, X., Viesselmann, C., Nam, S., Merriam, E., Dent, E. W. Activity-dependent dynamic microtubule invasion of dendritic spines. J Neurosci. 28, 13094-13105 (2008).
- Lebrand, C. Critical role of Ena/VASP proteins for filopodia formation in neurons and in function downstream of netrin-1. Neuron. 42, 37-49 (2004).
- Meberg, P. J., Miller, M. W., Hollenbeck, P. J., Bamburg, J. R. Chapter 7. Neurons: Methods and Applications for the Cell Biologist. , 112-129 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Zeitelhofer, M. High-efficiency transfection of mammalian neurons via nucleofection. Nat Protoc. 2, 1692-1704 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados