Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Expansión ex vivo de células T tumor-reactiva por medio de la 1/Ionomycin briostatina y la formulación de la cadena gamma común de citoquinas
En este artículo
Resumen
Un protocolo eficiente para la Ex vivo Expansión de las células T tumor-reactiva de los ganglios linfáticos que drenan tumores u otros tejidos linfoides secundarios, de los portadores de tumores anfitriones se describe. Este protocolo se expande de forma selectiva del tumor de células T específicas para el uso de la inmunoterapia adoptiva del cáncer de mama.
Resumen
Se informó que los pacientes de cáncer de mama se han pre-existentes respuesta inmune contra los tumores 1,2. Sin embargo, como la respuesta inmune no pueden proporcionar una protección completa contra el desarrollo o recurrencia del cáncer de mama. Para superar este problema mediante el aumento de la frecuencia de células T tumor-reactiva, la inmunoterapia adoptiva ha sido empleado. Una gran variedad de protocolos han sido utilizados para la expansión de células T específicas del tumor. Estos protocolos, sin embargo, están restringidos a la utilización de ex vivo tumor antígenos para la activación de los antígenos específicos de células T. Muy recientemente, las citoquinas cadena gamma común, como la IL-2, IL-7, IL-15 e IL-21 se han utilizado solo o en combinación para la mejora de la anti-tumor respuesta inmune 3. Sin embargo, no está claro cuál es la formulación que mejor funciona para la expansión de las células T tumor-reactiva. Aquí se presenta un protocolo para la activación selectiva y la expansión del tumor, las células T reactivas a partir del modelo de ratón transgénico FVBN202 de carcinoma de mama positivo de Her-2/neu para su uso en la terapia adoptiva de células T del cáncer de mama. El protocolo incluye la activación de células T con bryostatin-1/ionomycin (B / I) e IL-2 en ausencia de antígenos tumorales durante 16 horas. B / I imita la activación de señales intracelulares que dan lugar a la activación de células T, al aumentar la actividad de la proteína quinasa C y el calcio intracelular, respectivamente 4. Este protocolo se activa específicamente el tumor de células T específicas, mientras que matar a las células T irrelevantes. Las células B / I-T activadas son cultivadas con IL-7 e IL-15 durante 24 horas y luego pulsadas con IL-2. Después de 24 horas, las células T se lavan, se divide, y cultivadas con IL-7 + IL-15 por más de 4 días. Tumor de la especificidad y la eficacia antitumoral de la expansión ex vivo de células T se determina.
Protocolo
1. Aislamiento de linfocitos 5
- Aislar el tumor ganglios linfáticos de drenaje o el bazo de los portadores de tumores FVBN202 ratones transgénicos y preparar la suspensión de células individuales en el helado RPMI1640 suplementado con FBS al 10%. B / I de activación en 50 ml de polipropileno tubos cónicos de resultados en una mayor producción de células T en comparación con los tubos de poliestireno. La ketamina y xilazina se inyectan ip para la anestesia. Dislocación cervical se utiliza como un método de eutanasia.
- Cultivo de las células (10 6 células / ml) en medio completo que contenía 15% de SFB con briostatina-1 (5 nM) y ionomicina (1 M) junto con 80 U / mL de IL-2 (Peprotech) durante 16 h.
- Se lavan las células tres veces con medio caliente (37 ° C) y la cultura a 10 6 células / ml en medio completo con IL-7 (10 ng / ml) e IL-15 (10 ng / mL) (Peprotech) durante 24 h .
- Pulso de las células con IL-2 (40 U / ml) durante 24 h.
- Dividir las celdas y la cultura con IL-7 e IL-15 (10 ng / ml) durante 4 días más. Cambio de medio y dividir las celdas si es necesario cada 2 días.
2. Determinar la expansión de las células T Doble por recuento de células y citometría de flujo 5
- Los recuentos de células por microscopía de luz
- Preparar la dilución celda apropiada (1:100) en azul tripán y añadir l pocos en hemocitómetro
- Contar con 9 plazas y determinar el número total de células dividiendo los recuentos de células con el número de cámaras, multiplicado por el factor de dilución. Los resultados se presentan un número x 10 4 células / ml.
- Determinar la proporción de CD8 + y CD4 + células T en las células ampliado por citometría de flujo
- Bloquear la unión no específica de anticuerpos a los receptores Fc mediante el cultivo de las células con anticuerpos anti-CD16/CD32 (Biolegend) durante 20 minutos en hielo y luego se lavan las células dos veces con 2 ml de helado de PBS suplementado con azida de sodio al 1% .
- Tinción de las células por cultivo con FITC-CD4 y anticuerpos PE-CD8 durante 20 minutos en hielo y luego se lavan las células dos veces con 2 ml de helado de PBS suplementado con FBS al 1% y 0,1% de azida de sodio.
- Fijar las células con paraformaldehído al 1% y ejecutar las muestras en un Beckman Coulter FC 500 y analizar con la versión 4.3 del software Cumbre.
3. Determinar el tumor especificidad de la ex vivo ampliado las células T
- La cultura de la expansión ex vivo de linfocitos en medio completo en una proporción de 10:1 con irradiación neu positivas las células tumorales MMC (15.000 rad) durante 24 h. 5
- Sobrenadantes de cosechar y almacenar a -80 ° C hasta su uso. 5,6
- Detección de IFN-γ utilizando un ratón IFN-γ ELISA Set (BD Pharmingen) según el protocolo del fabricante. 5,6
4. Determinar antitumoral función de las células T ex vivo Ampliado 5,6
- Incubar las células T con las células tumorales en un efector 10:01: ratios objetivo durante 48 horas en medio completo en el medio de 3 mL completo (RPMI-1640 suplementado con 100 U / mL de penicilina, 100 microgramos / ml de estreptomicina, 10% de FBS, glutamina y β - mercaptoetanol) y 20U / mL de IL-2 (Peprotech) en seis placas de cultivo y 37 ° CO C / 5% 2.
- Realizar tres la tinción de anticuerpos color de neu (anti-c-Erb2/c-neu, clon-4, Calbiochem), seguido de PE-anti-ratón IgG, anexina V-FITC y yoduro de propidio (PI) de acuerdo con el protocolo del fabricante (BD Pharmingen)
- Puerta de las células tumorales neu positivo y analizar la viabilidad (Anexina V-/PI-) de las células tumorales
5. Modelo de ratón de cáncer de mama
FVBN202 ratones transgénicos hembra (Charles River Laboratories) se puede utilizar para la fuente de las células T tumor-reactiva. Estos ratones no activados sobreexpresan una rata neu transgén en la regulación del promotor de MMTV y como resultado el desarrollo espontáneo de carcinoma de mama entre 4-10 meses de edad de 7 años. Estos ratones desarrollan hiperplasia premalignas de mama similar al carcinoma ductal in situ (CDIS) antes de la aparición espontánea de carcinoma8. Espontánea ratones portadores de tumores son utilizados como donantes de células T.
6. Los resultados representativos:
La activación de células T con B / I durante 16 horas resulta en la muerte de células T ingenuas, que no están sensibilizadas con el tumor in vivo. Después de la selectividad de B / I de tumor células T reactivas que se expanden hasta 2,8 veces dentro de una cultura de 6 días con las citoquinas de cadena gamma (Figura 1). Tanto CD8 + y CD4 + en las células T son igualmente ampliado con las citoquinas de cadena gamma (Figura 2). El ex vivo-ampliado las células T muestran alta capacidad de respuesta frente a los tumores que los ratones se sensibilizó a los donantes, según la evaluación de la producción de IFN-γ en la presencia de un carcinoma de mama positivo neu ratón (MMC) células tumorales (Figura 3). La expansión ex vivo de células T puede inducir la apoptosis en la neu positivo cel tumor MMCls de tal manera que la viabilidad de las células del tumor disminuye de 92% a 61% en 48 horas (Figura 4).
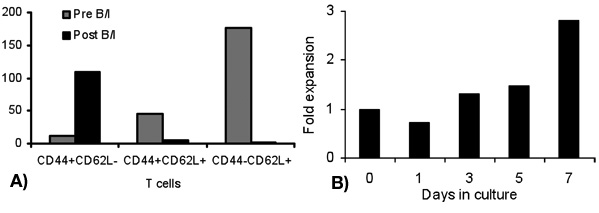
Figura 1. Dobla la expansión de los linfocitos en diferentes momentos después de B / I activación (día 1) y la expansión ex vivo de las citoquinas de cadena gamma (días 3, 5, y 7)
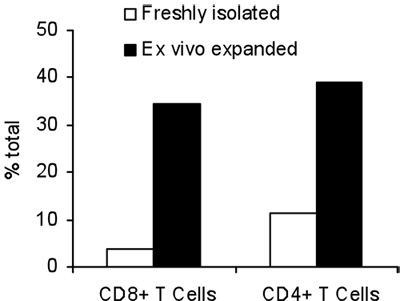
Figura 2. Porcentaje del total de linfocitos CD4 + y CD8 + T antes y después de una expansión de 7 días con las citoquinas gamma de la cadena.
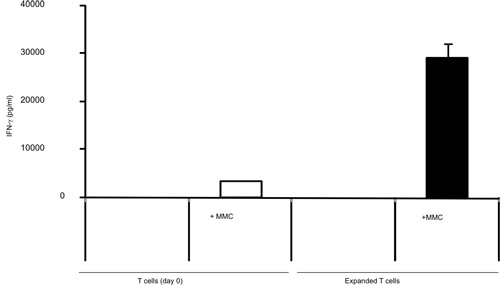
Figura 3. Tumor estimulada por IFN-γ por las células T aisladas de ratones portadores de tumores antes y después de una expansión de 7 días con las citoquinas gamma de la cadena, el uso de IFN-γ ELISA
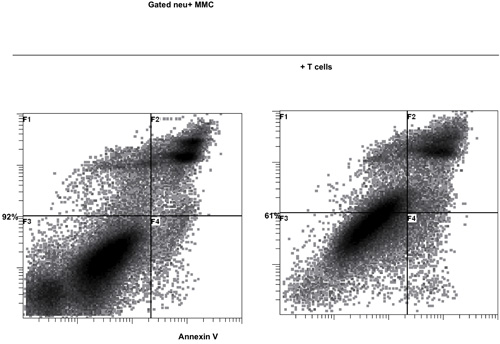
Figura 4. Función citotóxica de las ex vivo ampliado las células T con las citoquinas gamma de la cadena contra el carcinoma de mama positivo neu ratón (MMC) las células tumorales
Discusión
Expansión selectiva de las células T tumor-reactiva con efectores anti-tumor función se puede lograr mediante el protocolo propuesto con B / I activación y expansión ex vivo de las citoquinas gamma de la cadena de IL-2, IL-7 e IL-15. Mientras que la IL-2 es un factor de crecimiento de las células T que pueden apoyar la diferenciación y la expansión de las células T antígeno-específicas, IL-7 puede inhibir la apoptosis de las células T y apoyar su viabilidad durante la expansión. IL-15 puede soporta...
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por el NIH Grant R01 CA104757 (MH Manjili). Agradecemos el apoyo de VCU Massey Cancer Center y la Fundación del Commonwealth para la Investigación del Cáncer.
Materiales
| Name | Company | Catalog Number | Comments |
| Bryostatin 1 | Sigma-Aldrich | B7431-10ug | |
| Ionomycin | Calbiochem | 407950 | |
| Mouse IL-7 | PeproTech Inc | 217-17 | |
| Mouse IL-15 | PeproTech Inc | 210-15 | |
| Human IL-2 | PeproTech Inc | 200-02 | |
| RPMI1640 | Invitrogen | 11875 | |
| FBS | Gemini Bio Products | 100-106 | |
| Penicillin/Streptomycin | Cellgro | 30-002-CI | |
| L- glutamine | Invitrogen | 25030081 | |
| β- mercapt–thanol | Sigma-Aldrich | M7522 | |
| anti-CD16/32 antibody | Biolegend | 101302 | |
| Annexin V-FITC Apoptosis Detection Kit | BD Biosciences | 556547 | |
| FITC-CD4 | Biolegend | 100406 | |
| PE-CD8 | Biolegend | 100708 | |
| anti-c-Erb2/c–Neu | Calbiochem | OP16 | |
| PE- anti mouse IgG | Biolegend | 405307 | |
| formaldehyde | Polysciences, Inc. | 04018 | |
| Hemocytometer | Hycor | 87144 | |
| Light microscope | VWR international | V200073 | |
| Mouse IFN-γ ELISA set | BD Biosciences | 555138 | |
| Cell culture flasks | Greiner Bio-One | 658175 |
Referencias
- Goodell, V., Waisman, J., Salazar, L. G., de la Rosa, C., Link, J., Coveler, A. L., Childs, J. S., Fintak, P. A., Higgins, D. M., Disis, M. L. Level of HER-2/neu protein expression in breast cancer may affect the development of endogenous HER-2/neu-specific immunity. Mol Cancer Ther. 7, 449-454 (2008).
- Disis, M. L., Knutson, K. L., Schiffman, K., Rinn, K., McNeel, D. G. Pre-existent immunity to the HER-2/neu oncogenic protein in patients with HER-2/neu overexpressing breast and ovarian cancer. Breast Cancer Res Treat. 62, 245-252 (2000).
- Liu, S., Riley, J., Rosenberg, S., Parkhurst, M. Comparison of common gamma-chain cytokines, interleukin-2, interleukin-7, and interleukin-15 for the in vitro generation of human tumor-reactive T lymphocytes for adoptive cell transfer therapy. J. Immunother. 29, 284-293 (2006).
- Bear, H. D., Roberts, J., Cornell, D., Tombes, M. B., Kyle, B. Adoptive immunotherapy of cancer with pharmacologically activated lymph node lymphocytes: a pilot clinical trial. Cancer Immunol Immunother. 5, 269-274 (2001).
- Morales, J. K., Kmieciak, M., Graham, L., Feldmesser, M., Bear, H. D., Manjili, M. H. Adoptive transfer of HER2/neu-specific T cells expanded with alternating gamma chain cytokines mediate tumor regression when combined with the depletion of myeloid-derived suppressor cells. Cancer Immunol Immunother. 58, 941-953 (2009).
- Cha, E., Graham, L., Manjili, M. H., Bear, H. D., Guy, C. T., Webster, M. A., Schaller, M., Parsons, T. J., Cardiff, R. D. IL-7 + IL-15 are superior to IL-2 for the ex vivo expansion of 4T1 mammary carcinoma-specific T cells with greater efficacy against tumors in vivo. Breast Cancer Res Treat. 89, 10578-10582 (2009).
- Kmieciak, M., Morales, J. K., Morales, J., Bolesta, E., Grimes, M., Manjili, M. H. Danger signals and nonself entity of tumor antigen are both required for eliciting effective immune responses against HER-2/neu positive mammary carcinoma: implications for vaccine design. Cancer Immunol Immunother. 57, 1391-1398 (2008).
- Stern, J. B., Smith, K. A. Interleukin-2 induction of T-cell G1 progression and c-myb expression. Science. 233, 203-206 (1986).
- Kittipatarin, C., Khaled, A. R. ex vivo expansion of memory CD8 T cells from lymph nodes or spleen through in vitro culture with interleukin-7. J Immunol Methods. 344, 45-57 (2009).
- Kokaji, A. I., Hockley, D. L., Kane, K. P. IL-15 transpresentation augments CD8+ T cell activation and is required for optimal recall responses by central memory CD8+ T cells. J Immunol. 180, 4391-4401 (2008).
- Le, H. K., Graham, L., Miller, C. H., Kmieciak, M., Manjili, M. H., Bear, H. D. Incubation of antigen-sensitized T lymphocytes activated with bryostatin 1 + ionomycin in IL-7 + IL-15 increases yield of cells capable of inducing regression of melanoma metastases compared to culture in IL-2. Cancer Immunol Immunother. 58, 1565-1576 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados