Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Dispositivo de microfluidos para volver a crear un microambiente tumoral
* Estos autores han contribuido por igual
En este artículo
Resumen
Se presenta el procedimiento para la fabricación y el funcionamiento de un dispositivo de microfluidos que recrea heterogéneos microambientes tumorales In vitro. La variabilidad en la apoptosis en el tejido tumoral se cuantificó utilizando tinciones fluorescentes y el coeficiente de difusión eficaz del fármaco quimioterapéutico doxorrubicina en el tejido tumoral se evaluó.
Resumen
Hemos desarrollado un dispositivo de microfluidos que imita la entrega y el aclaramiento sistémico de fármacos para heterogéneos tejidos tridimensionales tumorales in vitro. Nutrientes suministrados por la vasculatura no llegan a todas las partes de los tumores, dando lugar a microambientes heterogéneo que consiste en tipos de células viables, quiescentes y necróticas. Muchos fármacos de cáncer no logran penetrar con eficacia y tratar todos los tipos de células, debido a esta heterogeneidad. Las monocapas de células de cáncer no imitan esta heterogeneidad, por lo que es difícil de probar fármacos contra el cáncer con un adecuado modelo in vitro. Nuestros dispositivos de microfluidos se fabricaron fuera de PDMS mediante litografía blanda. Esferoides multicelulares tumorales, formadas por el método de la gota colgante, se insertaron y constreñido en cámaras rectangulares en el dispositivo y se mantiene con perfusión del medio continuo en un lado. La forma rectangular de cámaras en el dispositivo creado gradientes lineales dentro del tejido. Manchas fluorescentes se utilizan para cuantificar ªe variabilidad en la apoptosis en el tejido. Los tumores en el dispositivo fueron tratados con el fármaco quimioterapéutico doxorrubicina fluorescente, el tiempo transcurrido microscopía se utilizó para controlar su difusión en el tejido, y el coeficiente de difusión efectiva se estimó. El método de la gota colgante permite rápida formación de esferoides uniformes a partir de varias líneas celulares de cáncer. El dispositivo de activar el crecimiento de esferoides de hasta 3 días. Las células en la proximidad del medio que fluye fueron mínimamente apoptótica y los alejados del canal eran más apoptótica, con lo que precisa que imitan las regiones de los tumores adyacentes a los vasos sanguíneos. El valor estimado del coeficiente de difusión doxorrubicina mostró de acuerdo con un valor previamente en el cáncer de mama humano. Debido a que la penetración y la retención de las drogas en los tumores sólidos afecta a su eficacia, creemos que este dispositivo es una herramienta importante en la comprensión del comportamiento de los medicamentos y el desarrollo de nuevas terapias contra el cáncer.
Protocolo
1. Fabricación de los dispositivos
La réplica de características de microfluidos en materiales elastoméricos se basó en el método descrito por Duffy et al. 1
- Elastómero Mix (polidimetilsiloxano; PDMS) y agente de curado del Kit de elastómero de silicona (Dow Corning, Midland, MI) en una proporción en peso 9:1 y se vierte sobre el maestro para formar una capa de 4 mm de espesor. Degas para eliminar burbujas de aire y curar la mezcla a 60 ° C durante 5 horas. Pelar PDMS curado del molde para obtener un sello de características de flujo en el elastómero.
- Haga agujeros para las entradas y salidas de 1,5 mm usando un punzón de biopsia (Miltex, York, PA) montado en una prensa de taladro. Sacar los residuos.
- Se somete el lado de características del sello y de un portaobjetos de vidrio limpio para plasma de oxígeno durante 8 minutos en un grabador de plasma de oxígeno. Traiga las superficies tratadas en contacto inmediatamente para formar un enlace entre ellos. Mantener el conjunto a 60 º C en un portaobjetos caliente durante al menos 5 horass para fortalecer el vínculo.
- Conectar 0,032 "ID tubos de PTFE (Cole Parmer, Vernon Hills, IL) a las entradas y salidas mediante una interfaz de cierre luer macho conectores conectados al púas conectores luer hembra de bloqueo (Qosina, Edgewood, NY).
- Instale el ensamblaje de flujo utilizando válvulas de cierre y un conector (Upchurch Scientific, Oak Harbor, WA; Figura 1). Montar el dispositivo en el microscopio. Coloque jeringas para mangueras mediante 20G 1,5 "agujas (BD Bioscience, Rockville, MD).
2. Formación de esferoides uniformes
Esferoides fueron formados por el método de la gota colgante 2,3.
- Tripsinizar las células bajo una campana de cultivo celular estéril.
- Centrifugar las células tratadas con tripsina a 2000 rpm durante 5 minutos y se resuspenden en medio fresco ml 6. Diluir la solución madre a una concentración final deseada (Tabla 1).
- Retire la tapa de una placa de 48 pocillos y colocarlo boca abajo en el sterilized capucha. Regiones circulares correspondientes a cada pocillo son evidentes en la cubierta. Llenar cada pocillo de la placa con 1 ml de agua esterilizada para mantener la humedad. Poner una gota de 20 ml de la solución diluida de células en cada región circular con una micropipeta. Invierta cuidadosamente la tapa y colóquela sobre la placa bien, asegurando que las gotas no toque los bordes de los pozos.
- Incubar la placa de pocillos a 37 º C durante un número especificado de días (Tabla 1). Un esferoide se formará en cada gota colgante.
3. Introducción de esferoides en el dispositivo
Consulte la Figura 1 y la Tabla 2 de esta sección.
- Esterilizar el dispositivo por el lavado con 70% de etanol introducido a través de la entrada de flujo. Posteriormente, lavar con PBS seguido de tampón HEPES medio de cultivo celular. Deja F la jeringa medio S conectado a la tubería.
- Empate 2-3 esferoides en P S jeringa, presione la jeringa para eliminar las burbujas de aire, yadjuntar a la entrada de embalaje del dispositivo.
- Abra la válvula de entrada V Pin y cerca Fin V. Abra la válvula de salida Pout V y cerca Fout V. Mantenga la jeringa envasado vertical con la aguja apuntando hacia abajo; ver como esferoides depositan en el fondo de la jeringa en el conector de cierre luer de la aguja. Empujar el émbolo de la jeringa de embalaje y esferoides reloj entrar en el tubo y el flujo en el dispositivo. Debido a que sólo la válvula de salida del embalaje es abierto, un esferoide entrará en la cámara del dispositivo y ser retenido por los puestos en la parte de atrás (Fig. 2).
- Cerrar la válvula de entrada y de salida V Pin Pout válvula V. Montar la jeringa F S en una bomba de jeringa. Abra la válvula y la válvula de aleta V V Fout. Flujo del medio en el dispositivo en 3 l / min.
4. Introducción de Agente de Detección de Apoptosis (CaspGLOW)
Después de la colocación de cámaras de esferoides, para permitir el equilibrio up a 24 horas para establecer gradientes de nutrientes y los microambientes, antes de la introducción de la apoptosis o la detección de agentes terapéuticos. Debido a que los tejidos en las cámaras están en contacto con las paredes impenetrables de arriba y abajo, no hay gradientes de nutrientes a lo largo del espesor (0,15 mm) del tejido. Después de 24 horas de incubación, todas las capas de células a lo largo del espesor del tejido son por lo tanto equivalentes y la heterogeneidad es sólo en una dirección lejos del canal de flujo.
- Apague V Fin, parar la bomba de jeringa, retire la jeringa F S de la bomba y reemplazarlo con una jeringa que tiene un medio que contenía 0,25 l / ml de CaspGLOW Red activa la caspasa-3 marcador (Red-DEVD-FMK; Biovision, Mountain View, CA).
- Enjuagar manualmente 0,7 ml de esta solución a través del dispositivo para asegurar el desplazamiento de más medio. Montar la jeringa en la bomba, a restablecer el flujo, y Fin de V abierta. Durante un período de 5-8 horas, la apoptosis detectar difunde agente en tél tejido y emite fluorescencia más brillante en regiones apoptóticas. Agente apoptosis detectar en esta concentración se mantiene en todas las soluciones de flujo subsiguiente en el dispositivo.
Nota:
- Heterogeneidad del tejido puede ser confirmado mediante la obtención de perfiles lineales de intensidad de fluorescencia como se describe en la Sección 6. Los perfiles deben mostrar gradientes espaciales de la apoptosis, lo que confirma que el tejido es heterogénea con respecto a la viabilidad celular.
- CaspGLOW verde activa la caspasa-3 marcador (Fluoresceína-DEVD-FMK; Biovision) también se puede utilizar para detectar la apoptosis. Este marcador contiene el fluoróforo fluoresceína verde en lugar de la rodamina fluorocromo rojo.
5. Introducción de agente terapéutico
- Siga el procedimiento de los pasos 4.1-4.2 para introducir 10 mM clorhidrato de doxorrubicina (DOX, Sigma-Aldrich, St. Louis, MO), que contiene el reactivo apoptosis.
- Continuar flujo de la therapesolución de agente UTIC por un período fijo de tiempo. Cierre la válvula de aleta V y apague la bomba de jeringa. Reemplazar la jeringa tratamiento con una jeringa medio fresco que contiene el reactivo apoptosis. Permitir el flujo de medio fresco durante 24 -36 horas, mientras que supervisar continuamente el tejido bajo un microscopio.
6. Time-lapse microscopía y estimación de los coeficientes de difusividad de drogas
Para la obtención de los datos de fluorescencia más limpias, adquirir todas las imágenes del microscopio, centrándose en las capas inferiores de los tejidos. Debido a que no hay gradientes de nutrientes en la dirección vertical (véase la Sección 4), las capas inferiores de células son buenos representantes de todas las demás capas anteriores.
- El proceso de adquisición fue automatizado mediante un script personalizado en IPLab (BD Bioscience, Rockville, MD). Adquirir imágenes de transmisión de luz y la fluorescencia de la esferoide embalado con un aumento de 10 veces cada 30 minutos (Fig. 3A). Acquire una imagen de la fluorescencia de fondo antes de la introducción de Dox. Para acomodar el gran tamaño de la cámara (1000 micras x 300 micras), adquieren dos imágenes contiguas y azulejos y baldosas juntos 4.
- Para la estimación matemática de coeficientes de difusividad de drogas, el primer paso es para generar perfiles de intensidad promediados lineales de Dox fluorescencia usando ImageJ. Seleccione una región rectangular de interés (ROI) que abarca el tejido en la cámara. Utilice el comando Perfil Parcela para generar un perfil de intensidades promedio como una función de la distancia desde el canal de flujo. Repita el procedimiento para hasta 3 puntos de tiempo diferentes.
- Obtener una imagen de fondo de fluorescencia antes de la introducción de Dox para medir la autofluorescencia del tejido. Restar la intensidad media de fluorescencia de fondo de los perfiles de intensidad obtenidos y normalizar cada perfil por la intensidad máxima correspondiente para obtener
 (X, t) (Fig. 3B).
(X, t) (Fig. 3B). - El siguiente paso es evaluar la eficacia coeficiente de difusión D de Dox dentro del tejido tumoral. Dox difusión puede ser representado por la siguiente ecuación 5

donde erfc es la función de error complementaria, x es la distancia en el tejido desde el canal, y t es el tiempo después de la introducción de Dox (véase la fig. 3). Utilice el siguiente esquema iterativo en cada punto de tiempo considerado:- Adivina un valor para D
- Calcular lado derecho de la ecuación en cada ubicación x
- Calcular la suma de los errores cuadráticos (residual) entre las dos partes
- Modificar D para minimizar el residual
- Promedio de los valores óptimos de D obtenidos en cada punto de tiempo para estimar el coeficiente medio de difusión efectivo de Dox en el tejido.
7. Los resultados representativos:
Los dispositivos de microfluidos proporcionado 1mm x 0,3 mm x 0,15 mm ópticamente cámaras accesibles de cultivo para el crecimiento de tejido del tumor en tres dimensiones. Esferoides multicelulares tumorales fueron trasladados a estas cámaras y fueron retenidos por dos puestos de filtro en la parte posterior. El método de la gota colgante permite rápida formación de esferoides de tamaño uniforme y la forma de varias líneas celulares. Esferoides fueron cultivadas con éxito en el dispositivo durante un máximo de 3 días. El crecimiento en las cámaras se asoció con una modificación reproducible de microambientes dentro de esferoides. La apoptosis se produjo menos en las células en la proximidad del canal de flujo y mayor más profundamente en el tejido. El dispositivo se utilizó para estimar el coeficiente de difusión de la doxorrubicina en el tejido tumoral. El valor obtenido de 8,75 x 10 -7 cm -1 2 s de acuerdo con el valor de 9,1 x 10 -7 cm 2 s -1 informó anteriormente 6 en cáncer de mama humano.| Línea celular | Requiere concentración celular | Tiempo de incubación |
| LS174T | 300 células / l | 2-3 días |
| T47D | 750 células / l | 3-4 días |
| MDA-MB-231 | 150 células / l | 5-6 días |
Tabla 1. Parámetros para Spheroids gota colgante
| Parte | Descripción |
| S F | Flujo Jeringa |
| S P | Embalaje Jeringa |
| V Fin | Flujo de la válvula de entrada |
| V Pin | Embalaje válvula de entrada |
| V Fout | Flujo de salida de la válvula |
| V Pout | Embalaje válvula de salida |
Tabla 2. Las jeringas y válvulas en configuración de flujo

Figura 1 Esquema de la configuración de flujo de aleta V y V Fout:. Entrada de flujo y válvulas de salida; V Pin y Pout V: Embalaje de entrada y válvulas de salida, S y F S P: Flujo y jeringas de embalaje. La jeringa de preparación y envasado de entrada y válvulas de salida se utilizan cuando un esferoide se vuela en la cámara. La jeringa y el flujo de entrada de flujo y válvulas de salida se utilizan para fluir medio posteriormente.
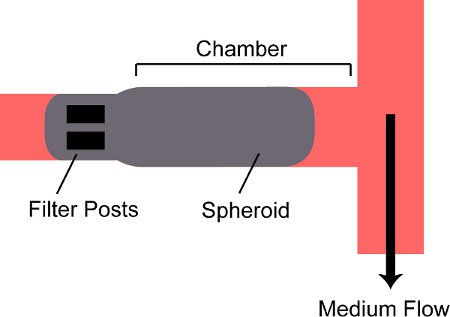
Figura 2. Esquema de un esferoide atrapado en una cámara en el dispositivo. Un esferoide se hace fluir en la cámara en el dispositivo y está bloqueado por dos pos filtrots en la parte posterior de la cámara.

Figura 3. Doxorrubicina difusión en el tejido tumoral en el dispositivo. A. Fusionada imagen transmitida luz fluorescente y rojo de tejido, que muestra la ubicación y concentración de doxorrubicina (en rojo). La barra de escala representa a 250 micras. B. Normalizado perfil de intensidad de fluorescencia lineal de doxorubicina.
Discusión
La vascularización de los tumores son escasas y mal desarrollados 7,8. Hay regiones situadas lejos (> 100 mm) de los vasos sanguíneos que son inaccesibles para los nutrientes y medicamentos suministrados aunque la vasculatura 9. El microambiente heterogénea resultante contribuye a la eficacia limitada de muchos agentes quimioterapéuticos 10. El dispositivo microfluídico desarrollado aquí recrea un microambiente tumoral heterogénea que se caracteriza por la proliferación, las c...
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Salud de subvención # 1R01CA120825-01A1, la investigación en colaboración Biomédica (CBR) Programa de la Universidad de Massachusetts Amherst, y la Beca J. Isenberg para Bhushan Toley. Agradecemos la valiosa contribución de James Schafer, el camarógrafo, narrador y editor de este video.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre de reactivo | Empresa | El número de catálogo | Comentarios |
|---|---|---|---|
| Kit de silicona elastómero | Ellsworth Adhesives | 184 Sil Elast Kit | |
| Miltex biopsia en sacabocados | MedexSupply | MTX-33-31AA | 1,5 mm |
| PTFE tubería | Cole Parmer | EW-06.417-31 | 0,032 "ID |
| Hombre luer lock | Qosina | 65111 | |
| Púas conector hembra luer lock | Qosina | 11556 | |
| Válvula de cierre | Idex Salud y Ciencia | P-721 | |
| Y-conector | Idex Salud y Ciencia | P-513 | |
| 20G 1,5 "agujas | BD Bioscience | 305176 | |
| Tripsina-EDTA | Invitrogen | 25300-054 | |
| HEPES | Sigma | H-4034 | |
| CaspGLOW fluoresceína | Biovision | K183-25 | |
| CaspGLOW Red | Biovision | K193-25 | |
| Clorhidrato de doxorubicina | Sigma | 44583 | |
| LS174T | ATCC | CCL-188 | Carcinoma de colon humano línea celular |
| T47D | ATCC | HTB-133 | Carcinoma ductal Humanos línea celular |
| MDA-MB-231 | ATCC | HTB-26 | Adenocarcinoma mamario humano línea celular |
Referencias
- Duffy, D. C., McDonald, J. C., Schueller, O. J., Whitesides, G. M. Rapid Prototyping of Microfluidic Systems in Poly(dimethylsiloxane). Anal. Chem. 70, 4974-4984 (1998).
- Kelm, J. M., Timmins, N. E., Brown, C. J., Fussenegger, M., Nielsen, L. K. Method for generation of homogeneous multicellular tumor spheroids applicable to a wide variety of cell types. Biotechnol. Bioeng. 83, 173-180 (2003).
- Timmins, N. E., Nielsen, L. K. Generation of multicellular tumor spheroids by the hanging-drop method. Methods. Mol. Med. 140, 141-151 (2007).
- Kasinskas, R. W., Forbes, N. S. Salmonella typhimurium specifically chemotax and proliferate in heterogeneous tumor tissue in vitro. Biotechnol. Bioeng. 94, 710-721 (2006).
- Walsh, C. L. A multipurpose microfluidic device designed to mimic microenvironment gradients and develop targeted cancer therapeutics. Lab. Chip. 9, 545-554 (2009).
- Lankelma, J., Fernandez Luque, R., Dekker, H., Schinkel, W., Pinedo, H. M. A mathematical model of drug transport in human breast cancer. Microvasc. Res. 59, 149-161 (2000).
- Less, J. R., Skalak, T. C., Sevick, E. M., Jain, R. K. Microvascular architecture in a mammary carcinoma: branching patterns and vessel dimensions. Cancer. Res. 51, 265-273 (1991).
- Brown, J. M., Giaccia, A. J. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer. Res. 58, 1408-1416 (1998).
- Thomlinson, R. H., Gray, L. H. The histological structure of some human lung cancers and the possible implications for radiotherapy. Br. J. Cancer. 9, 539-549 (1955).
- Minchinton, A. I., Tannock, I. F. Drug penetration in solid tumours. Nat. Rev. Cancer. 6, 583-592 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados