Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un ensayo Cortar organotípicos de alta resolución de imágenes a intervalos de tiempo de la migración neuronal en el cerebro postnatal
En este artículo
Resumen
Este protocolo describe un ensayo de corte organotípicos optimizado para el cerebro postnatal y de alta resolución de imágenes a intervalos de tiempo de la migración de los neuroblastos en la corriente migratoria rostral.
Resumen
Neurogénesis en el cerebro postnatal depende del mantenimiento de los tres eventos biológicos: la proliferación de las células progenitoras, la migración de los neuroblastos, así como la diferenciación y la integración de nuevas neuronas en circuitos neuronales ya existentes. Para la neurogénesis postnatal en los bulbos olfatorios, estos eventos están separados en tres áreas anatómicamente diferentes: la proliferación en gran medida se produce en la zona subependimaria (ZEE) de los ventrículos laterales, la migración de los neuroblastos recorrer a través de la corriente migratoria rostral (RMS), y las nuevas neuronas se diferencian y integrar dentro de los bulbos olfatorios (OB). Los tres dominios de servir como plataformas ideales para estudiar los mecanismos celulares, moleculares y fisiológicos que regulan cada uno de los eventos biológicos claramente. Este artículo describe un ensayo de corte organotípicos optimizado para el tejido cerebral post-natal, en el que las condiciones extracelular imitan el ambiente in vivo para la migración de los neuroblastos. Se demuestra que nuestro ensayo permite el movimiento uniforme, orientado y rápida de los neuroblastos en el RMS. Este ensayo será muy adecuado para el estudio de la regulación de las células autónomas y no autónomas de la migración neuronal mediante el uso de trasplante cruzado enfoques de ratones en diferentes fondos genéticos.
Protocolo
I. Procedimientos
Las siguientes técnicas se debe realizar bajo condiciones estériles, en una campana de flujo laminar, utilizando herramientas de esterilización.
Preparación de platos con fondo de cristal para rebanadas organotípicos
- Los platos deben estar preparados en un ambiente estéril y el uso de herramientas esterilizadas.
- Una caída de 150μL de medio de corte (ver recetas) se coloca en el centro de la parte de fondo de cristal de la placa con cuidado para evitar burbujas de aire en el medio.
- Con una jeringa desechable equipada con un 23 aguja, múltiples puntos de pegamento (goma de cemento -, Elmer cat # E904) se colocan en los bordes cuadrados adyacente a la cubreobjetos circular que ocupa el centro de la placa de cultivo, dejando a un lado sin pegar para el intercambio de fluidos (Figura 1). El tipo de lista de la cola no es tóxico para los cortes o las células que se aplican en este protocolo. Hay que tener cuidado de no poner ninguna pega en la hoja de cubierta de vidrio, ya que esto afectan e impedir imágenes de los cortes más tarde. Una membrana Nucleopore (25 mm de diámetro, tamaño de poro 8.0μm - Whatman, cat # 110614) se coloca en la parte superior de la cubreobjetos de vidrio, con las manchas de pegamento para fijarlo en su lugar. Esto se debe hacer con una pinza de micro, garantizando al mismo tiempo que las burbujas de aire no se encuentran atrapados entre el cubreobjetos y la membrana.
- Añadir un medio de corte ml en la parte superior de la membrana. Los platos se colocan en una incubadora durante 30 minutos y luego sobre el hielo, hasta que esté listo para su uso.
Extracción de los primeros cerebros post-natal
Los mejores resultados se obtienen cuando las rebanadas son preparados a partir de ratones jóvenes postnatal (P1-P10).
- Los cachorros son bajo anestesia (sobredosis) por los métodos aprobados isofluorano o de otro tipo. La cabeza puede ser rociada con un 70% de etanol para aumentar la esterilidad, seguido por decapitación rápida usando unas tijeras afiladas.
- La cabeza es estabilizado por la unión de la mandíbula con una pinza de micro. La piel se reseca longitudinal desde el cuello hasta el hocico. El cráneo se corta longitudinalmente y hacia delante a partir de la cisterna magna, haciendo una media y dos cortes laterales (una a cada lado - Figura 2A). Se debe tener cuidado para minimizar el contacto con el tejido cortical subyacente como las aletas del cráneo se eliminan fuera del cerebro.
- Para mejorar la estabilidad de los tejidos durante el corte vibratome, los laterales más del cerebro se eliminan haciendo dos cortes sagital. El aspecto caudal del cerebro también se elimina mediante una incisión en la base rostral del cerebelo (Figura 2B).
- Los dos hemisferios están separados por hacer un corte liso a lo largo de la fisura línea media, y los dos hemisferios están cuidadosamente excavado del cráneo y se coloca, la superficie media hacia abajo, en un molde de incrustación (Fig. 2C-D).
La sección del cerebro de acogida
- Los dos hemisferios en el molde de la incrustación se cubren inmediatamente con derretida 3% bajo punto de fusión del ADN en gel de agarosa de grado (Fisher, cat # BP1360-100) disuelta en tampón de preparación del tejido que se mantiene a 37 ° C (ver recetas). Después de 2 minutos de la estabilización sobre una superficie plana y horizontal para asegurar un endurecimiento de la agarosa, los moldes se colocan en hielo para completar el ajuste.
- Una vez que el gel que contiene los hemisferios se encuentra, se retira del molde y se recorta, dejando 2 a 3 mm de gel en todo el tejido cerebral.
- El gel embebido en el tejido se monta sobre la platina de la vibratome, con la superficie medial, y asegurado con adhesivo de cianoacrilato (pegamento Krazy o equivalente). Se debe tener cuidado de aplicar únicamente una mínima cantidad de pegamento, como mucho tendrá efectos tóxicos en rodajas y migración de las células. El exceso de pegamento en los lados de la manzana también se impedirá el corte, causando posibles daños en el tejido.
- El disco se instala en la bandeja de muestras vibratome lleno de helado de medio de preparación de tejidos.
- El tejido se secciona con un espesor de 150μm, con la velocidad vibratome conjunto en una serie lenta y medianas (dependerá de la vibratome utilizado, y por lo tanto se debe determinar de forma independiente para obtener resultados óptimos). En nuestras manos, la frecuencia de vibración es óptima cuando se establece un máximo. Las rebanadas primeras pueden ser descartados.
- Tan pronto como el RMS que contienen los segmentos están liberados de la hoja (el RMS es visible a simple vista como un color gris en forma de U que se extiende desde la estructura de la zona económica especial para el OB), que son cuidadosamente extraer de la molde de gel, y recogió con una pequeña espátula plana. Las rebanadas se colocan en la membrana Nucleopore de los platos de fondo de cristal que contienen medio de corte (Figura 3-B). Un típico temprano del cerebro del ratón postnatal rendirá aproximadamente 3.2 partes por RMS hemisferio cuando se corta a 150 micras. Es muy importante que el manejo de los cortes es reducido al mínimo, ya que son muy frágiles. Los platos con las rebanadas se transfieren a una incubadora.
Donantes cerebroseccionamiento y el trasplante de RMS
- Los cerebros de los donantes (el cerebro a los periodistas que expresan fluorescentes en la migración de los neuroblastos) se seccionan con un espesor de 250 micras y los segmentos están recogidos en el helado de amortiguación preparación del tejido.
- Los sectores se incluyan inmediatamente en un microscopio de disección con capacidad de epifluorescencia, y el RMS es suavemente microdissected, el uso de fórceps micro. Una pinza se utiliza para estabilizar el corte mientras que el otro se utiliza para hacer pequeños cortes en todo el RMS hasta que se libera de la división. El RMS es eliminado luego se corta en pequeños explantes (alrededor de 200-500 micras de diámetro) antes del trasplante.
- Con fondo de cristal platos que contienen rodajas de acogida situados en los filtros Nucleopore son retirados de la incubadora y colocado bajo el microscopio de disección. Con la luz visible, el RMS está claramente identificado y una pequeña incisión en el segmento inicial de la RMS.
- Utilizando una pipeta equipado con una punta de 20 l, un solo donante RMS explante se transfiere al sitio una incisión en el RMS de acogida. El explante se empuja suavemente en la incisión para establecer contacto entre los dos tejidos. Para asegurar este contacto se mantiene estable, los explantes se empujan un poco en medio de la división y la membrana Nucleopore.
- Una vez que todos los cortes de acogida con el RMS se trasplantan, los platos se devuelven a la incubadora por lo menos 1 hora para permitir que las secciones para resolver sobre la membrana. Neuroblastos debe comenzar a migrar desde el explante en el huésped RMS después de aproximadamente 1-2 horas.
Time-lapse de imágenes de la migración neuronal
- Los platos de fondo de cristal-se transfieren de la incubadora a la cámara se incubaron en el microscopio (Figura 3C). Neuroblastos fluorescentes se pueden obtener imágenes en intervalos de entre 0 a 10 minutos dependiendo del tipo de análisis deseado. Por ejemplo, tenemos la imagen dinámica del citoesqueleto durante el ciclo migratorio de los neuroblastos individuales estableciendo nuestros intervalos de menos o igual a 2,5 minutos. Sin embargo, la dinámica de la población tales como la orientación y la velocidad de la migración son más capturadas en intervalos de entre 5 a 10 minutos. La elección de los objetivos es muy variable dependiendo de la marca del microscopio. De un microscopio confocal Nikon C1, nos encontramos con que la lente de 20x en seco (Nikon Pan Fluor, NA 0,75, WD 0.35mm) es el más adecuado para nuestro análisis. Para obtener los mejores resultados en este sistema confocal, el agujero se abre a un tamaño medio (60μm de diámetro). De comportamiento migratorio más apropiadas, las imágenes se limita a las células profundas dentro del espesor de la RMS, por lo menos 20 m de distancia de cualquiera de las superficies de corte de la loncha. Potencia del láser debe ser optimizado para que sea como mínimo, pero que los detalles de los neuroblastos individuales siguen siendo visibles.
- Una vez que la imagen se completa rodajas puede ser fijado por el frío de hielo, y recién preparada paraformaldehido al 4%, immunostained, y montadas sobre portaobjetos para obtener imágenes más. Dado que no abrigo nuestras membranas con ningún sustrato adherente como la laminina, los cortes suelen flotar fuera de la membrana, una vez que se sumergen en los buffers de tinción. Las secciones son imágenes, manteniendo sus 150 micras de espesor. También es posible criopreservar y la congelación de los cortes y el uso de un criostato para obtener secciones más delgadas de los cortes originales. Sin embargo, esto se traducirá en el aumento de la incidencia de los artefactos de tinción, así como alterar la integridad de los tejidos.
II. Materiales / equipo
Preparación de platos con fondo de cristal para rebanadas organotípicos
- Jeringuillas (1 ml)
- 23 agujas de calibre
- Nucleopore pista Etch membrana - 25 mm de diámetro, tamaño de poro 8.0μm - Whatman, cat # 110614
- Los platos de fondo de cristal Cultura - una caja de petri de 35 mm, 14 mm de micropocillos, No. 1.5 cubre objetos - MATTECH, cat # P35G-1.5-14-C
- Goma de cemento -, Elmer cat # E904
- Basal medio de Eagle - Gibco, cat # 21010
- Hepes 1M (pH 7,4)
- 1M D-glucosa
- 100 mM de CaCl2
- 100 mM MgSO 4
- 1M de NaHCO3
- dH 2 O
- 200 mM L-glutamina
- Penicilina-estreptomicina
Extracción del cerebro y la inclusión
- Anestesia (isofluorano, etc)
- Microondas
- Agarosa de bajo de fusión - Fisher, cat # BP1360-100
- Krazy Glue - cat # KG585
- Pele-A-Way Moldes incrustación desechables (R-40) - 22mmx40mm rectangular, 20 mm de profundidad - Polysciences, cat # 18646C
Seccionar el cerebro y el trasplante de RMS
- Vibratome - Leica VT1000S y todos los componentes de accesorios para la preparación del corte
- Solución salina equilibrada de Hank 10X - Gibco, cat # 14185
- Fórceps Microdissecting # 5 - Roboz, cat # RS-4976
- Microespátula - Fisher, cat # 21-401-15
- Estereomicroscopio
Time-lapse de imágenes derebanadas organotípicos
- Incubadora humidificada, 5% de CO 2
- Microscopio invertido equipado con incubadora de cámara y de larga distancia los objetivos de trabajo (NA de 0,6 o superior)
III. Recetas
Solución tampón para la disección de los tejidos y la preparación rebanada (buffer tejido preparación)
| Solución madre | Volumen | Concetration final |
| HBSS 10 veces | 50 ml | 1X |
| Hepes 1M (pH 7,4) | 1,25 ml | 2,5 mm |
| 1M D-glucosa | 15 ml | 30 mM |
| 1M CaCl2 | 0,5 ml | 1 mM |
| 1M MgSO4 | 0,5 ml | 1 mM |
| 1M de NaHCO3 | 2 mL | 4mM |
| dH 2 O | 430,75 ml |
Filtro de esterilizar con un filtro de 0,2 micras y se almacenan a 4 ° C.
Medio de cultivo para las rebanadas organotípicos, transplante de tejidos y de imagen (media rebanada)
| Solución madre | Volumen | La concentración final |
| Basal medio de Eagle | 35 ml | |
| Tejido buffer preparación | 12.9 mL | |
| 1M D-glucosa | 1,35 ml | 20 mM |
| 200 mM L-glutamina | 0,25 ml | 1 mM |
| Penicilina-estreptomicina | 0,5 ml | 100units / ml penicilina y la estreptomicina 0,1 mg / mL |
Filtro de esterilizar con un filtro de 0,2 micras y se almacenan a 4 ° C.
Preparación de bajo punto de fusión en gel de agarosa al punto
Bajo punto de fusión de agarosa se diluyó en tampón de tejido en la preparación de 0,3 g / ml en un tubo cónico de 50 ml (ver recetas). El tubo es calentado con microondas en incrementos de 5-10 segundos en alta potencia. Número de incrementos depende del volumen total; de 10 ml, tres incrementos (10-8-5 segundos cada uno) debería ser suficiente. La tapa del tubo es cuidadosamente desenroscar entre los incrementos de calefacción para liberar la presión del aire y evitar la explosión del tubo. Se debe tener cuidado ya que el contenido del tubo estará muy caliente. Una vez que la agarosa se disuelva por completo, el tubo se mantiene en un baño de agua a 37 ° C durante al menos 5 minutos para permitir que la temperatura se estabilice antes de su uso. La exposición prolongada a la temperatura ambiente se endurece el gel. Aunque esto se debe evitar tanto como sea posible, gel endurecido puede ser recalentada y re-fundido para su uso inmediato dentro de las 24 horas de preparación inicial.
Inmunohistoquímica en cortes organotípicos
Después de imágenes en el microscopio confocal, rodajas puede ser fija la noche a 4 ° C con formaldehído al 4% en PBS. Secciones se bloquean durante la noche a 4 ° C, en el suero de cabra al 10% con Triton X 1% (Sigma, cat. # S26-36-23) en PBS, seguido de incubación durante la noche con anticuerpos primarios a 4 ° C. Fluorescencia etiquetados anticuerpos de cabra secundaria se utilizan para la visualización (todos diluido 1:1000, 1 hora de incubación a temperatura ambiente). Rebanadas de etiquetado se lavan 5-6 veces con PBS enfriado con hielo antes de su montaje en portaobjetos de vidrio y cubreobjetos.
IV. Resultados representante
Nuestro protocolo organotípicos cultura cortes ha sido probado y optimizado a través de que los últimos años para mantener la coherencia en el patrón de la migración y la orientación. Análisis de las células que emigran de explantes obtenidos a partir de ratones en los que se induce la expresión de la proteína fluorescente de color rojo, Td-tomate, bajo el promotor Nestin (Nestin-Td tomate), revela la migración altamente orientado y rápido de tdTomato + neuroblastos en el huésped RMS ( Figura 4). Gran aumento de lapso de tiempo de análisis se muestra una excelente resolución de toda la longitud de un neuroblastos emigran durante una sesión de imágenes de 20 minutos (Figura 4).
Rebanadas con donantes Td-tomate + células fueron fijadas y immunostained para los diferentes componentes celulares dentro de la RMS. GFAP + astrocitos y CD31 + vasos sanguíneos se dieron a conocer mediante inmunohistoquímica fluorescentes (Figura 5). Análisis de gran aumento de cortes teñidos para los filamentos de actina y las proteínas del citoesqueleto tubulina revelan falta de uniformidad de expresión de estos componentes de una célula en medio de la migración (Figura 5).
Los anticuerpos utilizados enestos ejemplos: conejo anti-RFP (Abcam, 1:250), conejo anti-GFAP (Dako, 1:1000), la rata anti-CD31 (BD Pharmigen, 1:100), el ratón anti-actina (Santa Cruz, 1: 500), de conejo anti-tubulina (Sigma, 1:1000), de cabra anti-ratón Cy3 (Chemicon, 1:1000), de cabra anti-conejo AlexaFluor 647 (Invitrogen, 1:1000), de cabra anti-rata AlexaFluor 488 (Invitrogen , 1:1000), de cabra anti-conejo AlexaFluor 488 (Invitrogen, 1:1000).
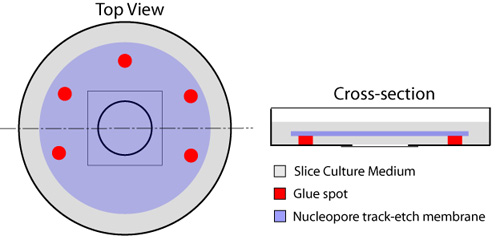
Figura 1. Preparación de platos con fondo de cristal para rebanadas organotípicos. Múltiples zonas de la cola se colocan alrededor de la circular con fondo de vidrio componente del plato (rojo), dejando a un lado abierto para el intercambio de medio de debajo del filtro. Una caída de 150μL de medio rebanada se coloca en el centro del cubreobjetos. Una membrana Nucleopore (azul) se aplica, el lado brillante hacia abajo, al tiempo que garantiza que no queden burbujas de aire atrapadas entre el cubreobjetos y la membrana. Un mililitro de medio de corte (en gris) se extiende en la parte superior de la membrana, y los platos se incubaron a 37 º C antes de su uso.
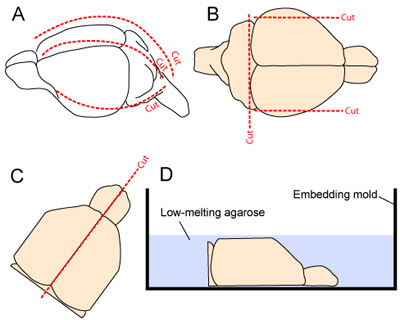
Figura 2. Cerebro de extracción y preparación para el corte. (A) El cráneo está expuesto por una incisión en el cuero cabelludo desde el cuello hasta el hocico (línea de puntos a lo largo de la línea media). El cráneo se corta longitudinalmente y hacia delante a partir de la cisterna magna, haciendo una media y dos cortes laterales (una a cada lado, 2A). (B) Los aspectos más lateral de la corteza y la parte caudal del sistema nervioso central son resecado para mejorar la estabilidad de los tejidos durante el corte vibratome. (CD) Los dos hemisferios se separan y se colocan boca abajo en medio de un molde incorporación antes de la aplicación del 3% en gel de agarosa disuelta en un tampón de tejido preparación.
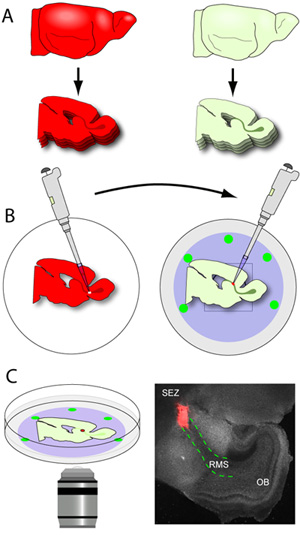
Figura 3. Cerebro y el corte transversal del trasplante. (A) El tejido del huésped se secciona con un espesor de 150μm, y las secciones de RMS que contienen son cuidadosamente colocados planos sobre la membrana Nucleopore de frío con fondo de cristal platos. (B) los cerebros de los donantes (los cerebros de los periodistas que expresan fluorescentes en el RMS) se realizaron cortes espesor de 250 micras, y las rebanadas son recogidos en el helado de amortiguación preparación del tejido. El RMS es microdissected donantes y se corta en pequeños explantes. Utilizando una pipeta equipado con una punta de 20 l, individuales RMS explantes se transfieren a un sitio de una incisión en el huésped RMS. (C) Después de 1-2 horas de incubación, los platos son transferidos a una etapa se incubó en un microscopio confocal y la migración es capturado el uso de imágenes a intervalos de tiempo. La microfotografía es un representante de baja magnificación de la imagen de un sector típico (gris) establecer una hora después del trasplante (explante rojo de tdTomato + RMS de un ratón de los donantes; contorno de color rojo las líneas punteadas de la RMS en la porción de host).
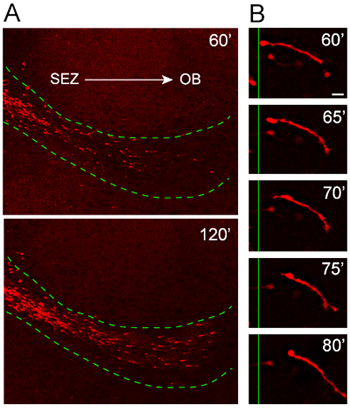
Figura 4. La migración de los neuroblastos a partir de explantes en el RMS de acogida. (A) Nestin-tdTomato neuroblastos + (rojo) la migración de los explantes en el huésped RMS (línea verde de puntos) 1 hora después del trasplante. tdTomato + células que invaden el RMS de la máquina rebanadas organotípicos mueven de una manera altamente orientado y rápido fuera de la ZEE y hacia el OB. (B) El ciclo migratorio se puede observar en el lapso de tiempo de alta potencia de las imágenes de un neuroblasto lo largo de aproximadamente un período de 20 minutos. Barra de escala = 10 micras.
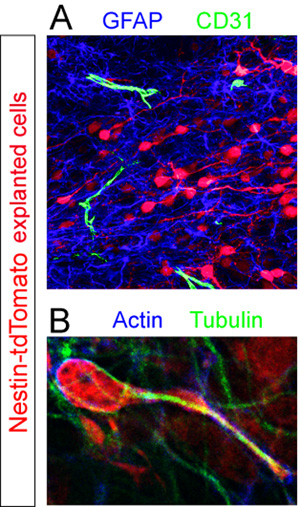
Figura 5. Evaluación inmunohistoquímica de cortes organotípicos. Neuroblastos explantados (rojo) se fija en medio de la migración de 12 horas después del trasplante. (A) tinción fluorescente inmunohistoquímica de la corte pone de manifiesto un conjunto denso de GFAP + astrocitos (azul) y dispersos CD31 + vasos sanguíneos (en verde) en el RMS de la rebanada de acogida. (B) El citoesqueleto de un hecho aislado tdTomato + célula en migración (rojo) en una serie de RMS se revela por la co-inmunotinción con anticuerpos contra la actina (azul) y la tubulina (verde).
Discusión
La migración neuronal en el RMS es un componente esencial de la neurogénesis postnatal en los bulbos olfatorios 1. La migración a través de la RMS se produce en un plano tangente a la superficie del cerebro. Neuroblastos tangencialmente la migración son diferentes de forma radial migración de las células basadas en la ubicación de la fuente de progenitores, así como el destino divergente de sus productos finales neuronal 1, 2, 3. La población relativamente pura de células que migran tang...
Divulgaciones
Agradecimientos
Damos las gracias a Dan McWhorter para narrar el protocolo en el video. Este trabajo es apoyado por el NIH subvención 5R01NS062182, una beca de la Federación Americana para la Investigación sobre el Envejecimiento, y los fondos institucionales otorgados a HTG.
Referencias
- Ghashghaei, H. T., Lai, C., Anton, E. S. Neuronal migration in the adult brain: are we there yet. Nat. Rev. Neurosci. 8, 141-151 (2007).
- Valiente, M., Marin, O. Neuronal migration mechanisms in development and disease. Curr. Opin. Neurobiol. 20, 68-78 (2010).
- Rakic, P. Evolution of the neocortex: a perspective from developmental biology. Nat. Rev. Neurosci. 10, 724-735 (2009).
- Jaglin, X. H., Chelly, J. Tubulin-related cortical dysgeneses: microtubule dysfunction underlying neuronal migration defects. Trends Genet. 25, 555-566 (2009).
- Carro, M. S. The transcriptional network for mesenchymal transformation of brain tumours. Nature. 463, 318-325 (2010).
- Wu, W. Directional guidance of neuronal migration in the olfactory system by the protein Slit. Nature. 400, 331-336 (1999).
- Hu, H., Tomasiewicz, H., Magnuson, T., Rutishauser, U., U, . The role of polysialic acid in migration of olfactory bulb interneuron precursors in the subventricular zone. Neuron. 16, 735-743 (1996).
- Shapiro, E. M., Gonzalez-Perez, O., Garcia-Verdugo, M. a. n. u. e. l., Alvarez-Buylla, J., &, A., Koretsky, A. P. Magnetic resonance imaging of the migration of neuronal precursors generated in the adult rodent brain. Neuroimage. , (2006).
- Vreys, R. MRI visualization of endogenous neural progenitor cell migration along the RMS in the adult mouse brain: validation of various MPIO labeling strategies. Neuroimage. 49, 2094-2103 (2010).
- Davenne, M., Custody, C., Charneau, P., Lledo, P. M. In vivo imaging of migrating neurons in the mammalian forebrain. Chem. Senses. 30, 115-116 (2005).
- Mirzadeh, Z., Doetsch, F., Sawamoto, K., Wichterle, H., Alvarez-Buylla, A. The subventricular zone en-face: wholemount staining and ependymal. J. Vis. Exp. , (2010).
- Shen, Q. Adult SVZ stem cells lie in a vascular niche: a quantitative analysis of niche cell-cell interactions. Cell Stem Cell. 3, 289-300 (2008).
- Tavazoie, M. A specialized vascular niche for adult neural stem cells. Cell Stem Cell. 3, 279-288 (2008).
- Mirzadeh, Z., Merkle, F. T., Soriano-Navarro, M., Garcia-Verdugo, J. M., Alvarez-Buylla, A. Neural Stem Cells Confer Unique Pinwheel Architecture to the Ventricular Surface in Neurogenic Regions of the Adult Brain. Cell Stem Cell. 3, 265-278 (2008).
- Polleux, F. &. a. m. p. ;. a. m. p., Ghosh, A. The slice overlay assay: a versatile tool to study the influence of extracellular signals on neuronal. Sci. STKE. , L9-L9 (2002).
- Murase, S. &. a. m. p. ;. a. m. p., Horwitz, A. F. Deleted in colorectal carcinoma and differentially expressed integrins mediate the directional migration of neural precursors in the rostral migratory stream. J. Neurosci. 22, 3568-3579 (2002).
- Suzuki, S. O. &. a. m. p. ;. a. m. p., Goldman, J. E. Multiple cell populations in the early postnatal subventricular zone take distinct migratory pathways: a dynamic study of glial and neuronal progenitor migration. J. Neurosci. 23, 4240-4250 (2003).
- Ghashghaei, H. T. The role of neuregulin-ErbB4 interactions on the proliferation and organization of cells in the subventricular zone. Proc. Natl. Acad. Sci. U. S. A. 103, 1930-1935 (2006).
- Khodosevich, K., Seeburg, P. H., Monyer, H. Major signaling pathways in migrating neuroblasts. Front Mol. Neurosci. 2, 7-7 (2009).
- Jacquet, B. V. Analysis of neuronal proliferation, migration and differentiation in the postnatal brain using equine infectious anemia virus-based lentiviral vectors. Gene Ther. 16, 1021-1033 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados