Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Celular imagen Cambiar forma de vida Drosophila Los embriones
En este artículo
Resumen
El desarrollo temprano de la mosca de la fruta, Drosophila melanogaster, se caracteriza por una serie de cambios en la forma de células que se presta a los enfoques de imagen. En este artículo se describen las herramientas básicas y los métodos necesarios para la imagen confocal en vivo de embriones de Drosophila, y se centrará en un cambio de forma de la célula llamado cellularization.
Resumen
El desarrollo de Drosophila melanogaster embrión sufre una serie de cambios en la forma de células que son muy susceptibles de imagen confocal en vivo. Cambios en las células de la mosca de la forma son análogos a los de organismos superiores, y conducen la morfogénesis de tejidos. Por lo tanto, en muchos casos, su estudio tiene implicaciones directas para la comprensión de enfermedades humanas (Tabla 1) 1-5. En la escala sub-celular, cambios en la forma celular son el producto de actividades que van desde la expresión de genes de transducción de señales, la polaridad celular, la remodelación del citoesqueleto y el tráfico de la membrana. Por lo tanto, el embrión de Drosophila no sólo proporciona el contexto para evaluar cambios en las células la forma como se relacionan con la morfogénesis de tejidos, sino que también ofrece un entorno totalmente fisiológica para estudiar las actividades sub-celular que las células de forma.
El protocolo aquí descrito está destinado a la imagen de un cambio de células forma específica llamada cellularization. Cellularization es un proceso de crecimiento espectacular membrana plasmática, y en última instancia, convierte el embrión sincitial en el blastodermo celular. Es decir, en la interfase del ciclo mitótico 14, la membrana plasmática al mismo tiempo se invagina alrededor de cada uno de los núcleos de ~ 6000 cortical anclado para generar una hoja de primaria células epiteliales. En contra de las sugerencias anteriores, cellularization no está impulsado por la miosina-2 contractilidad 6, sino que está impulsada en gran parte por la exocitosis de la membrana interna de las tiendas 7. Por lo tanto, cellularization es un excelente sistema para estudiar el tráfico de membrana durante los cambios de forma de la célula que requieren invaginación de la membrana plasmática o de expansión, como la citocinesis o transversal de túbulos (T-túbulo) morfogénesis en el músculo.
Tenga en cuenta que este protocolo se aplica fácilmente a las imágenes de otros cambios en las células forma en el embrión de la mosca, y sólo requiere de pequeñas adaptaciones como el cambio de la etapa de recolección de embriones, o el uso de "pegamento embrión" para montar el embrión de una orientación específica (Tabla 1) 19.8. En todos los casos, el flujo de trabajo es básicamente el mismo (Figura 1). Los métodos estándar para la clonación y la transgénesis Drosophila se utilizan para preparar acciones mosca de establo que expresan una proteína de interés, fusionado a la proteína verde fluorescente (GFP) o sus variantes, y las moscas son una fuente renovable de los embriones. Por otra parte, las proteínas fluorescentes / sondas se introducen directamente en embriones de la mosca a través de técnicas sencillas de micro-inyección de 9-10. Entonces, dependiendo del evento de desarrollo y cambio en las células de forma para obtener imágenes, los embriones y puesta en escena por la morfología de un microscopio de disección, y finalmente colocado y montado para time-lapse en un microscopio confocal.
Protocolo
1. Ensamble Copas de recogida de embriones
- Corta el fondo de 100 ml de Tri-maíz vaso con una navaja, por lo que el borde lo más suave posible. Las copas son más fáciles de manejar si usted también recortar las tres esquinas fuera de la parte superior, aunque esto no es absolutamente necesario.
- Corte un cuadrado de tela metálica (6 cm x 6 cm). En un plato caliente precalentada, en el interior de una campana de extracción de capas, la plaza de malla de alambre en la parte superior de una hoja de papel de aluminio de alta resistencia. Empuje el borde inferior de corte de la taza bien caliente sobre la malla. Espere unos segundos, y levantar la copa con la malla que ahora se atribuye. Si la hoja también se adhiere, al igual que se desprenda.
- Enfriar la copa durante la noche. Retire el exceso de malla con unas tijeras, y la arena de los bordes afilados con papel de lija de grano fino.
2. Que Apple Placas de Agar Jugo
- En un matraz de 6L, combinar 100 g de agar Bacto BD y agua destilada 3L. Autoclave el agar durante 30 minutos en el ajuste de escape lento.
- En un matraz de 2 litros con una barra de agitación, se combinan 100 g de sacarosa, jugo de manzana 1 litro, y 6 g de ácido p-hidroxibenzoico. Calentar la solución a ebullición mientras se agita en un plato caliente. No deje que hierva durante más de 2 minutos. Dejar que la mezcla de jugo de manzana que se enfríe, y luego añadir con barra de agitación con el agar. Mezclar bien.
- Deje que la solución combinada a enfriar en un baño de agua a 60 ° C antes de verter en 60x15 mm placas de Petri. Por otra parte, una bomba peristáltica puede ser utilizado para dispensar el agar. Permita que las placas se enfríe a temperatura ambiente durante al menos 4 horas. Pila de contenedores Rubbermaid con una capa de toallas de papel húmedo y se almacenan a 4 ° C.
Notas:
- En el otoño o el invierno, puede ser necesario agregar un adicional de 100 ml de agua para el agar.
- La marca de placas de Petri es importante! Sólo los platos BD Falcon encajar los vasos Tri-maíz. Información específica pedido se puede encontrar en la tabla de Materiales a continuación.
3. Añadir moscas GFP a las Copas de recogida de embriones
- Ampliar las poblaciones de las buenas prácticas agrarias de acuerdo a las necesidades de su colección mediante la creación de botellas de moscas alrededor de dos semanas antes de la imagen. Una botella de moscas es más que suficiente para llenar una taza de recogida de embriones con un mínimo de 50 hembras y los machos 30. Para ver los mejores ponedoras, las moscas deben ser nuevos eclosed (es decir, menos de 5 días después de la eclosión).
- Haga una pasta de levadura por llenar una taza pequeña con partes iguales de levadura seca activa Estrella Roja y el agua destilada, y revuelva hasta que la levadura se disuelva. La pasta debe aproximarse a la consistencia de la mantequilla de maní húmedo. Más levadura o el agua se puede agregar a alterar la consistencia. Pasta de levadura puede ser utilizado por varios días, y se deben almacenar, cubierto, a 4 ° C.
- Una vez que la pasta de levadura está listo, retirar las placas de jugo de manzana de 4 ° C en almacenamiento. Pasar la manzana jugo de placas con la pasta de levadura, y permitir que se caliente a 22-25 º C, lo que impulsará la puesta de huevos.
- Doble un papel de filtro circular por la mitad, y luego nuevamente a la mitad. Recorte de 8-9 cm de diámetro, y hacer los pliegues de acordeón en el cuarto de círculo. Despliegue del círculo, invertirlo, y la inserta en un vaso de colección hasta que toque la malla. Asegúrese de que el trabajo es seguro en la taza para que no se caiga y aplaste a las moscas. El papel de filtro es opcional, pero nos da un ambiente acogedor para el apareamiento, y mantiene la humedad en la copa.
- Etiqueta de una taza con el nombre de archivo y fecha. Transferencia de las moscas de la botella a la copa de recolección agitando suavemente la botella invertida sobre el vaso, y cubrir inmediatamente la taza con un plato preparado de jugo de manzana. Fije la placa de la copa con una banda elástica. Set vasos laterales de malla en una zona con luz directa. Asegúrese de que ninguna sombra caiga sobre la taza, como las moscas no estaba bien en la oscuridad.
- Cambiar la placa de jugo de manzana, según sea necesario. Dos horas de las colecciones, a temperatura ambiente, funciona bien para cellularization imágenes.
4. Preparar una cámara de montaje
- Para preparar una cámara de montaje para los embriones, cortar un trozo de cinta de doble cara 2.3 cm de largo y colocarlo en una diapositiva, alineando el eje longitudinal de la cinta y diapositivas. Corte un segundo 2-3 cm de largo trozo de cinta de doble cara y una capa en la parte superior de la otra pieza de la cinta, asegurándose de que los bordes estén alineados.
- Usando una hoja de afeitar, hacer dos cortes de aproximadamente 3 mm en el centro de la cinta y perpendicular al eje longitudinal de la diapositiva. Retire la cinta entre los cortes para hacer un canal. Pipeta una gota de aceite de halocarbonos 27 en el canal. Este canal es donde los embriones se montarán.
Notas:
- Sólo el de ½ pulgada Scotch cinta de doble cara es el espesor de la derecha para dar cabida a los embriones.
- Halocarbonos 27 El petróleo es permeable al oxígeno, por lo que permite el intercambio de oxígeno, mientras que la prevención de la deshidratación del embrión. Debido a su índice de refracción, halocarbonos 27 El petróleo es también ideal para celebrare imágenes de los embriones.
5. Los embriones Dechorionate
- Para recoger y embriones dechorionate, vierta suficiente el 50% de cloro en la placa de agar de jugo de manzana para sumergir completamente toda la superficie. Utilizando un microscopio de disección, como el V8 Zeiss Discovery con luz transmitida, esté pendiente de los embriones a la liberación de su corion. Tan pronto como el corion se afloja y se libera a partir de unos pocos embriones (30-60 segundos), se vierte la lejía y los embriones en un colador de la célula.
- Lavado de los embriones en el filtro de forma inmediata y enérgicamente con el agua destilada de una botella con atomizador. DAB colador sobre toallas de papel. Si alguna de color rosa que se ve en la toalla después de pequeños toques, y seguir lavando los embriones con el agua.
- Utilice una brocha húmeda para la transferencia de embriones 10-50 a una placa de jugo de manzana limpia (sin pasta de levadura). Evacuación de la agua con el borde roto de una toalla de papel y cubrir inmediatamente los embriones con una pequeña cantidad de aceite de halocarbonos 27.
Notas:
- No utilice lejía Clorox. En su lugar, utilice una marca como A-1 Bleach Comercial de Austin, que es <6% de hipoclorito de sodio.
- El exceso de blanqueo o lavado insuficiente dará lugar a embriones con puré cellularization irregular.
6. Etapa y el Monte embriones
- Usando el microscopio de disección con luz transmitida, siga las pautas morfológicas de Bownes 20 a la etapa de embriones en el plato. Con unas pinzas, la transferencia de 5 mitosis ciclo de 11 o 12 embriones, que corresponde a Bownes la etapa 4, el canal de la cámara de montaje. Organizar los embriones en una línea, con la cara de las partes dorsal y ventral y lateral visible hacia abajo. Los embriones son fácilmente accesibles en esta orientación en el petróleo por sí solo. No embriones se amontonan ya que privar a sus vecinos de oxígeno una vez que la hoja de la cubierta se aplica a continuación. (Deje aproximadamente la mitad de una longitud de embriones entre ellos).
- Ponga un extremo de una cubierta de 25x25 mm de deslizamiento de la cinta de doble cara en un lado del canal. La caída de la hoja de cubierta que cubra el canal. Si el aire está atrapado debajo, aplique una pequeña cantidad de aceite de halocarbonos 27 en el borde de la hoja de la cubierta. La acción capilar se tire el aceite en el canal para que expulse el aire.
Notas:
- Otro recurso excelente para los embriones de etapa es el siguiente: Campos-Ortega, JA y Hartenstein, V. (1985). El desarrollo embrionario de Drosophila melanogaster. Springer-Verlag, de Berlín. Aunque este libro ya no está publicada, las copias se utilizan regularmente disponible en Amazon.com.
- Utilice siempre el aceite de halocarbonos 27 con moderación. Esto hará que el montaje sea más fácil. También evitará que accidentalmente la exudación del aceite en el objetivo del microscopio en los pasos siguientes imágenes.
7. Los embriones de la imagen
- ¿Cómo se procede aquí, por supuesto, ser dictado por el cambio de forma de la célula que está la imagen, y la pregunta que se dirige. Para cualquier cambio de forma, coloque la cámara de montaje a ambos un microscopio vertical o invertida, encontrar embriones al trasluz, y luego cambiar a la imagen confocal para centrarse en una región de interés. Se adhieren a las mejores prácticas de microscopía confocal, tales como los discutidos en MicroscopyU de Nikon ( http://www.microscopyu.com/articles/confocal ). Extremar el rigor en la exposición de los embriones vivos para que la potencia del láser poco como sea posible, para evitar que photobleaching y fototoxicidad.
- Para cellularization, que la imagen en un Zeiss 710 microscopio confocal de barrido láser, usando un C-Apochromat 40x/1.2 W objetivo Corr. Este microscopio se encuentra en una habitación con temperatura controlada, con temperaturas que oscilan entre 18-20 º C. Aunque el control de la temperatura no es absolutamente necesario, es mejor para el microscopio y hace que la imagen más consistente. Regularmente la imagen en un solo plano, cerca de la mitad del embrión, a seguir las invaginaciones membrana plasmática en la sección transversal (Figura 2). Para simplemente seguir la dinámica de la invaginación, 30-60 segundos de intervalo son suficientes para time-lapse, y los embriones deben soportar imágenes de> 90 minutos sin signos evidentes de falta de oxígeno.
- Tras la adquisición de las imágenes, que pueden ser analizadas utilizando cualquier número de paquetes de análisis de imagen, incluyendo software gratuito de los Institutos Nacionales de Salud, llamado ImageJ ( http://rsbweb.nih.gov/ij ). Los datos pueden ser presentados como películas (Movie 1), secuencias (Figura 2), o kymographs 21.
Nota:
- La inmersión en agua C-Apochromat 40x/1.2 W Corr. objetivo es muy adecuado para la imagen cerca de la mitad de la sección de embriones debido a su gran apertura, lo que limita las aberraciones de imágenes de tejidos profundos en muestras acuosas, y ofrece una alta resolución y alta señal fluorescente. Además, este objetivotiene una distancia muy larga (220 mm). Sin embargo, otros objetivos de inmersión en agua o glicerina funcionará bien, sobre todo si el cambio de la forma celular de interés se pueden obtener imágenes cerca de la superficie del embrión.
8. Método alternativo: Montar con embriones "embrión-cola"
- A la imagen de un cambio de forma de la célula que no sea cellularization, puede ser necesario para montar los embriones en una orientación específica que no es fácil de mantener en el petróleo por sí solo. Para ello, utilice un método alternativo de montaje en el que se describe anteriormente. Comience por hacer "embrión-cola" mediante la combinación de 20 cm de cinta de doble cara, con 250 l de heptano en un vial de centelleo. Coloque el vial de centelleo en un nutator o plataforma giratoria, y la mezcla durante la noche.
- Sumerja una punta de la pipeta amarilla en la cola del embrión, y luego traza la punta a lo largo de una diapositiva, dejando un rastro de pegamento. Mientras que el heptano se está evaporando, alinear sus etapas de embriones en la posición indicada en un bloque de agar. (Recuerde que la superficie de embriones para obtener imágenes debe estar mirando hacia el agar. Por ejemplo, para cambiar la forma de imágenes de células durante la formación del surco ventral, montaje de embriones con su lado ventral hacia el agar.)
- Invertir en la diapositiva con el pegamento, y presione suavemente la pista de goma contra los embriones en el bloque de agar. Ahora invertimos la diapositiva otra vez. Los embriones serán atrapados en la orientación adecuada. Añadir dos capas de cinta de doble cara en ambos lados de los embriones, cúbralos con halocarbonos 27 de aceite, y colocar un cubreobjetos. Proceder a la imagen como se describe anteriormente.
9. Los resultados representativos:
Si los embriones son saludables y la imagen es óptima, entonces cellularization debe tomar 50-60 minutos, y la membrana plasmática invaginaciones que la entrada de cerca de 40 micrones. Sin embargo, si los embriones son más de blanqueada, el oxígeno privados o dañados por fototoxicidad, a continuación, invaginación o se retrasará, particularmente en el área observada. Este deterioro de la salud del embrión a menudo resulta en alteraciones del desarrollo, y la falta de eclosión de larvas. Así, por una rigurosa prueba de ensayo para la salud del embrión después de la filmación, mantener las diapositivas en una cámara húmeda y mirar para incubar al día siguiente.
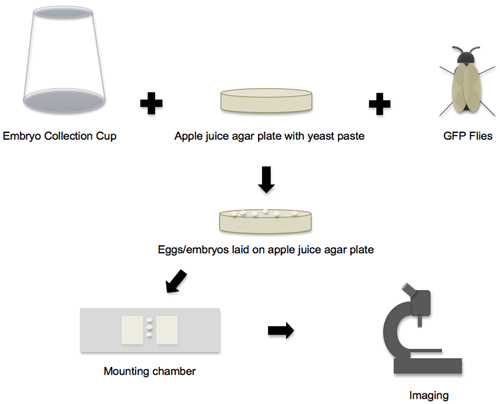
Figura 1. Flujo de trabajo de recogida de embriones a las imágenes. El flujo de trabajo del protocolo se pueden dividir en cuatro fases principales. En la primera fase, todos los materiales y componentes están preparados, y luego vuela la taza de recolección de embriones, jugo de manzana placa de agar y las buenas prácticas agrarias se unen para crear el ambiente de embriones de huevos. En la segunda fase, los huevos y los embriones que se colocan en las placas de agar de jugo de manzana se recogen. En la tercera fase, los embriones se retira de la placa, puesta en escena y trasladado a la sala de montaje. En la cuarta fase, los embriones son expuestas en un montaje de un microscopio confocal.
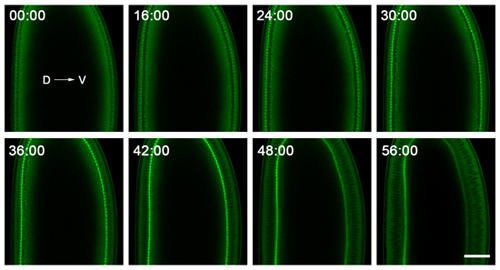
Figura 2. Datos representativos de time-lapse de cellularization. Embriones se montan con dorsal (D) y ventral (V) partes claramente visible, y se crean imágenes de cerca de su centro para seguir la membrana plasmática invaginaciones en la sección transversal. El embrión se muestra aquí expresa GFP-miosina-2 sonda de 6, que se concentra en las puntas de las invaginaciones membrana plasmática. Por lo tanto, el seguimiento el ingreso de este frente con el tiempo da la velocidad a la que la membrana plasmática se invagina. El punto en el tiempo 0:00 minutos corresponde a la aparición de cellularization. Poco después de que el punto de minutos de tiempo de 56:00, la gastrulación comienza en la parte ventral del embrión. Bar es de 40 micras.
Movie 1. Película representante de time-lapse de cellularization. Esta película corresponde a la Figura 2. Para grabar todo el proceso de cellularization, imágenes comenzó en el ciclo mitótico antes de 13, la captura de regresión pseudocleavage surco, y continuó hasta los movimientos de gastrulación se ve en la cara ventral del embrión. Las imágenes se recogieron a intervalos de un minuto. Las intensidades se incrementaron después de la adquisición para que sea más fácil ver los movimientos de gastrulación.
Haga clic aquí para película
| Evento de desarrollo y tiempo * | Cambios en las células relacionadas con la forma | Un enlace a la enfermedad o la salud humana | Referencias recientes con imágenes en vivo |
| Pseudo-división surco formación (4, 90 minutos pf) | Citocinesis | Poliploidía y la progresión del cáncer 1 | Mavrakis et al., 2009 8 Cao et al., 2010 9 |
| Cellularization (5, 130 pf minutos) | Citocinesis | Poliploidía y la progresión del cáncer 1 | Cao et al., 2008 10 Sokac y Wieschaus, 2008 11 |
| La formación de surcos ventrales; invaginación del mesodermo (6, 180 minutos pf) | Apical constricción; transición epitelio-mesenquimal | Metástasis del cáncer 2 | Fox y Peifer, 2007 12 Martin et al., 2009 13 |
| Germband extensión (7, 195 pf minutos) | Extensión convergente | Defectos del tubo neural 3 | Bertet et al., 2004 14 Blankenship et al., 2006 15 |
| Tracheogenesis (11, 320 pf minutos) | La formación del tubo epitelial y la ramificación | Angiogénesis 4 | Caussinus et al., 2008 16 Gervais y Casanova, 2010 17 |
| Cierre dorsal (14, 620 minutos pf) | Constricción apical | Cicatrización de la herida 5 | Gorfinkiel et al., 2009 18 Solon et al., 2009 19 |
Ejemplos de la Tabla 1. Cambios de forma de la célula imágenes en embriones de la mosca de vida
* El número de la etapa Bownes y el tiempo de post-fertilización (pf), cuando cada evento de inicio, se muestran de acuerdo con Campos-Ortega, 1985.
| Mosca de valores | Las etiquetas | Referencia original |
| Spider-GFP (95-1) | La membrana plasmática | Morin et al., 2001 22 |
| Resille-GFP (117-2) | La membrana plasmática | Morin et al., 2001 22 |
| GAP43-Venus | La membrana plasmática | Mavrakis et al., 2009 8 |
| Spaghetti Squash-GFP (sqh-GFP) | Miosina-2 | Royou et al., 2002 6 |
| E-cadherina-GFP (ECAD-GFP) | Célula-célula cruces | Oda et al., 2001 23 |
| GFP-Moesin | F-actina | Kiehart et al., 2000 24 |
| Utrofina-Venus (Utro-Venus) | F-actina | Sokac et al., Resultados no publicados |
Tabla 2. Útiles acciones para el cambio de imagen la forma celular en embriones de mosca
Access restricted. Please log in or start a trial to view this content.
Discusión
El protocolo se describe en este documento permitirá a la imagen en vivo, confocal de una serie de cambios en la forma de células en el embrión de la mosca en desarrollo. Las poblaciones de las buenas prácticas agrarias para la imagen puede ser preparado por un laboratorio individual (Tabla 2), pero muchas de esas poblaciones también están a disposición del público de los centros, tales como Bloomington Drosophila Stock Center en la Universidad de Indiana ( htt...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Queremos agradecer a Eric Wieschaus, que proporcionó el fundamento sobre el cual se desarrolló este protocolo. Nuestro trabajo es apoyado por un Departamento de Verna y Marrs McLean de Bioquímica y Biología Molecular de la puesta en marcha Premio, Baylor College of Medicine.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Slides | Fisher Scientific | 12-550-343 | |
| Cover slips 25x25 | Fisher Scientific | 1 2-524C | |
| Squirt bottles (H2O) | Fisher Scientific | 02-897-11 | |
| 50 ml Falcon tubes | Fisher Scientific | 14-432-22 | |
| Bulbs for small pipets, 1 mL | Fisher Scientific | 03-448-21 | |
| Scintillation vials with caps | VWR international | 66021-533 | |
| Tri-Corn Beakers, 100 mL | Electron Microscopy Sciences | 60970 | |
| BD Falcon Petri dish 60x15mm | Fisher Scientific | 08757 100B | |
| BD Falcon Cell strainer | Fisher Scientific | 08-771-2 | |
| Yellow pipet tips | Rainin | L200 | |
| Stainless steel mesh, 304, 12x24 | Small Parts, Inc. | CX-0150-F-01 | |
| Glass 5¾ inch Pasteur Pipets | Fisher Scientific | 13-678-20B | |
| P4 Filter paper | Fisher Scientific | 09-803-6F | |
| Rubber bands | Office Max | A620645 | |
| Scotch double-sided tape, ½ inch | Office Max | A8137DM-2 | |
| Robert Simmons Expression paint brushes E85 round #2 | Jerry’s Artarama | 56460 | |
| Dumont #5 Forceps High Precision Inox | Electron Microscopy Sciences | 72701-DZ | |
| Razor blades | VWR international | 55411-050 | |
| Halocarbon Oil 27 | Sigma-Aldrich | H 8773 | |
| Heptane | Fisher Scientific | H360-1 | |
| BD Bacto Agar | VWR international | 90000-760 | |
| Sucrose | Sigma-Aldrich | S7903 | |
| p-Hydroxybenzoic acid | Sigma-Aldrich | H5501 | |
| Red Star Active Dry Yeast | LeSaffre | 15700 | |
| Paper towels, C-fold | Kleenex | ||
| Heavy duty aluminum foil | Reynolds Wrap | ||
| Bleach | Austin’s A-1 Commercial | ||
| 100% Apple juice | Ocean Spray or Tree Top |
Referencias
- Sagona, A. P., Stenmark, H. Cytokinesis and cancer. FEBS Lett. 584, 2652-2661 (2010).
- Baum, B., Settleman, J., Quinlan, M. P. Transitions between epithelial and mesenchymal states in development and disease. Semin Cell Dev Biol. 19, 294-308 (2008).
- Kibar, Z., Capra, V., Gros, P. Toward understanding the genetic basis of neural tube defects. Clin Genet. 71, 295-310 (2007).
- Jazwinska, A., Ribeiro, C., Affolter, M. Epithelial tube morphogenesis during Drosophila tracheal development requires Piopio, a luminal ZP protein. Nat Cell Biol. 5, 895-901 (2003).
- Martin, P., Parkhurst, S. M. Parallels between tissue repair and embryo morphogenesis. Development. 131, 3021-3034 (2004).
- Royou, A., Field, C., Sisson, J. C., Sullivan, W., Karess, R. Reassessing the role and dynamics of nonmuscle myosin II during furrow formation in early Drosophila embryos. Mol Biol Cell. 15, 838-850 (2004).
- Lecuit, T., Wieschaus, E. Polarized insertion of new membrane from a cytoplasmic reservoir during cleavage of the Drosophila embryo. J Cell Biol. 150, 849-860 (2000).
- Mavrakis, M., Rikhy, R., Lippincott-Schwartz, J. Plasma membrane polarity and compartmentalization are established before cellularization in the fly embryo. Dev Cell. 16, 93-104 (2009).
- Cao, J., Crest, J., Fasulo, B., Sullivan, W. Cortical Actin Dynamics Facilitate Early-Stage Centrosome Separation. Curr Biol. , (2010).
- Cao, J., Albertson, R., Riggs, B., Field, C. M., Sullivan, W. N. uf a Rab11 effector, maintains cytokinetic furrow integrity by promoting local actin polymerization. J Cell Biol. 182, 301-313 (2008).
- Sokac, A. M., Wieschaus, E. Local actin-dependent endocytosis is zygotically controlled to initiate Drosophila cellularization. Dev Cell. 14, 775-786 (2008).
- Fox, D. T., Peifer, M. Abelson kinase (Abl) and RhoGEF2 regulate actin organization during cell constriction in Drosophila. Development. 134, 567-578 (2007).
- Martin, A. C., Kaschube, M., Wieschaus, E. F. Pulsed contractions of an actin-myosin network drive apical constriction. Nature. 457, 495-499 (2009).
- Bertet, C., Sulak, L., Lecuit, T. Myosin-dependent junction remodelling controls planar cell intercalation and axis elongation. Nature. 429, 667-671 (2004).
- Blankenship, J. T., Backovic, S. T., Sanny, J. S., Weitz, O., Zallen, J. A. Multicellular rosette formation links planar cell polarity to tissue morphogenesis. Dev Cell. 11, 459-470 (2006).
- Caussinus, E., Colombelli, J., Affolter, M. Tip-cell migration controls stalk-cell intercalation during Drosophila tracheal tube elongation. Curr Biol. 18, 1727-1734 (2008).
- Gervais, L., Casanova, J. In vivo coupling of cell elongation and lumen formation in a single cell. Curr Biol. 20, 359-366 (2010).
- Gorfinkiel, N., Blanchard, G. B., Adams, R. J., Arias, M. artinez, A, Mechanical control of global cell behaviour during dorsal closure in Drosophila. Development. 136, 1889-1898 (2009).
- Solon, J., Kaya-Copur, A., Colombelli, J., Brunner, D. Pulsed forces timed by a ratchet-like mechanism drive directed tissue movement during dorsal closure. Cell. 137, 1331-1342 (2009).
- Bownes, M. A photographic study of development in the living embryo of Drosophila melanogaster. J Embryol Exp Morphol. 33, 789-801 (1975).
- Sokac, A. M., Wieschaus, E. Zygotically controlled F-actin establishes cortical compartments to stabilize furrows during Drosophila cellularization. J Cell Sci. 121, 1815-1824 (2008).
- Morin, X., Daneman, R., Zavortink, M., Chia, W. A protein trap strategy to detect GFP-tagged proteins expressed from their endogenous loci in Drosophila. Proc Natl Acad Sci U S A. 98, 15050-15055 (2001).
- Oda, H., Tsukita, S. Real-time imaging of cell-cell adherens junctions reveals that Drosophila mesoderm invagination begins with two phases of apical constriction of cells. J Cell Sci. 114, 493-501 (2001).
- Kiehart, D. P., Galbraith, C. G., Edwards, K. A., Rickoll, W. L., Montague, R. A. Multiple forces contribute to cell sheet morphogenesis for dorsal closure in Drosophila. J Cell Biol. 149, 471-490 (2000).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados