Method Article
La presión de la ventilación controlada para inducir la lesión pulmonar aguda en ratones
En este artículo
Resumen
Un modelo murino de lesión pulmonar inducida por ventilador es una herramienta importante para el estudio de una lesión pulmonar aguda In vivo. En este sentido, un informe de fácil aplicación In situ Modelo de lesión pulmonar aguda con alta presión de ventilación mecánica para inducir un fallo agudo del pulmón.
Resumen
Modelos murinos son ampliamente utilizados para investigar las lesiones agudas de los sistemas de los diferentes órganos (1-34). La lesión pulmonar aguda (LPA), que ocurre con la ventilación mecánica prolongada, contribuye a la morbilidad y la mortalidad de la enfermedad crítica, y estudios sobre nuevas dianas genéticas o farmacológicas son zonas de intensa investigación (1-3, 5, 8, 26, 30, 33 -36). ALI se define por la aparición aguda de la enfermedad, lo que lleva a no cardiaca y edema pulmonar consiguiente alteración del intercambio pulmonar de gases (36). Hemos desarrollado un modelo murino de ALI mediante el uso de un sistema de ventilación con presión controlada para inducir el ventilador de la lesión pulmonar inducida (2). Para ello, los ratones C57BL / 6 son anestesiados y una traqueotomía se realiza seguida por la inducción de la LPA a través de la ventilación mecánica. Los ratones son ventilados en un entorno controlado por presión con una presión inspiratoria máxima de 45 mbar durante 1 a 3 horas. Como parámetros de resultado, edema pulmonar (húmedo a seco ratio), el contenido de fluido de albúmina broncoalveolar, líquido broncoalveolar y el contenido de tejido pulmonar mieloperoxidasa y el intercambio de gases pulmonares se evalúan (2). Usando esta técnica podemos demostrar que lo suficientemente induce la inflamación pulmonar aguda y puede distinguir entre los diferentes grupos de tratamiento o genotipos (1-3, 5). Por lo tanto, esta técnica puede ser útil para los investigadores que persiguen los mecanismos moleculares implicados en la LPA con un enfoque genético en ratones con genes específicos eliminación.
Protocolo
Observaciones generales:
Todas las operaciones deberán realizarse bajo un microscopio de disección en posición vertical (Olympus, SZX10 con Post manivela del eje Z con STU2 codo ya pie) y utilizando un coagulador quirúrgico (11). Los grupos experimentales deberían ir acompañados de la mejor manera posible en la edad y el peso para asegurar la comparabilidad de los resultados. Administración de la temperatura, la presión arterial, la anestesia y el líquido debe ser estable a lo largo.
1. Anestesia y preparación tráquea
- Use los ratones C57BL / 6 que son al menos 10 semanas de edad y tener un cuerpo de 22 a 25 g. Inducir la anestesia con pentobarbital sódico a una dosis de 70 mg / kg peso corporal ip (6). Mantenimiento de la anestesia, aproximadamente, con 10 mg / kg / h de sodio pentobarbital. Tenga cuidado con la sobredosis ya que esto podría reducir significativamente la presión arterial. Volver a la dosis de pentobarbital - incluso después de horas-puede conducir a un aumento severo en los niveles plasmáticos.
- Después de la inducción de anestesia, los ratones seguro en una posición supina con las extremidades superiores e inferiores unido a la mesa con una cinta y una sutura sujeta a los tobillos. Haga lo mismo con la cabeza con los dientes. Restricción suficiente es importante para una intubación exitosa y una cirugía bien controlados. Antes de la cirugía, la cubierta del ratón con aceite mineral para reducir el riesgo de alergia del ratón de pelo. A fin de garantizar que la temperatura corporal se mantiene estable cubrir los ratones con una envoltura de los alimentos disponibles en el mercado.
- Ratones a cabo sobre una mesa se calienta a temperatura controlada (RT, Effenberg, Munich, Alemania) con una sonda del termómetro rectal conectado a un controlador de retroalimentación térmica para mantener la temperatura corporal a 37 º C.
- Exponer la tráquea mediante cirugía. Diseccionar los laterales y dorsal de la tráquea del tejido conectivo y el lugar dos 3.0 sutura de seda quirúrgica (Harvard aparato, EE.UU.), cada 10 cm de largo por debajo de la tráquea. Las suturas deben ser de aproximadamente 1 cm de distancia.
- Cuidadosamente la incisión en la tráquea 3-4 mm por debajo de la laringe entre los dos cartílagos circular con una tijera McPherson-Vannas (8 cm, hoja recta, instrumentos de precisión del mundo, EE.UU.). Asegúrese de no causar un sangrado, ya que esto podría confundir a los parámetros de resultado.
- Realizar una intubación traqueal con un objeto contundente de polietileno de cánulas (Insyte 22g, Beckton Dickinson, EE.UU.). Inserte la punta de la cánula de polietileno en un ángulo de 85 grados en la tráquea. A continuación, la inclinación de la cánula por lo que está en consonancia con la luz traqueal. Poco a poco avanzar el tubo más abajo en la tráquea hasta la punta de la cánula ha desaparecido en la apertura del tórax. Se fija el tubo en esta posición con la sutura de seda quirúrgica colocado dos dorsal de la tráquea (ver 1.4).
2. Técnica de la lesión pulmonar inducida por el ventilador
- Conecte el tubo a un ventilador. Para inducir la lesión pulmonar se utiliza una técnica de ventilación con presión controlada mediante el uso de un Servo 900 C de Siemens (DRE Veterinaria, EE.UU.). Los animales serán ventilados con presión inspiratoria máxima de 45 mbar, la frecuencia de 80 respiraciones / min y una presión espiratoria final positiva de 0-3 mbar con una FiO 2 = 1,0. La inspiración de relación de caducidad debe ser de 1:1. A pesar del hecho de que el Servo 900 C es construido como ventilador para los seres humanos, su uso en un entorno de presión del ventilador controlado excelentes trabajos para la ventilación de los ratones.
- Monitor de ritmo cardíaco con un electrocardiograma (por ejemplo, Hewlett Packard, B blingen, Alemania). Asegúrese de que la frecuencia cardiaca no baja por debajo de 400. Uno debe ver un cambio del eje de corazón a la derecha, cuando la ventilación mecánica se instituye como un signo de aumento de la presión arterial pulmonar posterior a un aumento de la presión intratorácica. Si el ratón desarrolla bradicardia, comprobar la temperatura y la dosis de anestesia / concentración. Xylacin / ketamina induce anestesia el corazón del corazón de 250 / min y por lo tanto no se recomienda.
- Aplicar una adecuada reposición de líquidos. Una infusión de solución salina normal 0,1 ml / hora a través de un catéter arterial o venosa debe realizarse antes de la ventilación para asegurar una presentación venosa suficiente. Debido a las altas presiones de ventilación se deteriora el retorno venoso al corazón, lo que podría conducir a una disminución crítica de la presión arterial media. Además, un bolo de solución salina de 500 l se podría dar ip antes de la cirugía.
- Colocar un catéter en la arteria carótida para la grabación continua de la presión arterial (27). Fije el brazo al cuerpo antes de comenzar la disección de la arteria. La arteria carótida se expone a través de una disección roma de los músculos paratraqueales. Después de la exposición y evitar más cuidadosa de cualquier trauma tisular (en particular del nervio vago), se inserta un catéter en el vaso con dos puntos de sutura y una pequeña abrazadera (37). Esto expondrá un segmento más largo de la arteria. Colocar una ligadura en el extremo de la arteria carótida. Coloque una pinza más grande hasta el final de la sutura para obtener ª tensión o se fijene sutura a la mesa con cinta adhesiva. En otro lugar de sutura alrededor de la arteria y la disección de la arteria hasta el final distal. Aquí, el lugar una pequeña abrazadera. Use las tijeras micro a un pequeño corte diagonal en la arteria. Mantener la apertura con una pinza fina (Dumont, IPM) y el catéter de tamaño adecuado con las manos / pinzas. Hacer un nudo con su segunda sutura y seguro de la arteria. Afloje la abrazadera y el catéter más. Asegure el catéter con varios nudos y cinta adhesiva. Alternativamente, el catéter en la arteria carótida se puede colocar al final del experimento para recoger muestras de sangre arterial para análisis de gases en sangre.
3. Recuperación de muestras de tejido
Después de 3 horas de ventilación mecánica, se recogen muestras para evaluar el grado de lesión pulmonar. Se recomienda recoger el líquido de lavado brochnoalveolar (BAL), la sangre arterial y el tejido pulmonar.
- Obtener el líquido de BAL en el final del experimento. Después de la profundización de la anestesia, a ras del tubo traqueal con fosfato de 1 ml de solución salina (PBS). El líquido debe permanecer en la tráquea / pulmón durante tres segundos antes de que sea a través de la recuperación de la jeringa conectada. El BAL es snap-congelado en nitrógeno líquido y se almacenan a -80 ° C para su posterior análisis. Tenga en cuenta que el volumen recuperado puede ser significativamente inferior a 1 ml.
- Realizar un análisis de gases en sangre al final del experimento. Con el fin de hacer eso, una incisión debe ser justo debajo del esternón. Mantenga el esternón con las pinzas y la extensión de la incisión a lo largo de la caja torácica. A continuación, el diafragma se incide en los bordes y se corta de las costillas. Ahora hay una bella vista en la abertura inferior del tórax. Levantar el esternón con fórceps y abrir el tórax por los recortes de largo en el lado derecho e izquierdo (como lateral como sea posible) para que toda la pared torácica anterior está activado, las salas. Esto se debe hacer, mientras que el animal de experimentación sigue siendo ventilados mecánicamente. El ventrículo izquierdo se pincha con una aguja de 27 G ½ y el análisis de la sangre arterial se realiza mediante el Sistema i-STAT (Abbott, EE.UU.). Si el análisis de gases en sangre arterial se debe realizar, una BAL no se puede obtener, ya que éste será un factor de confusión importante en los resultados.
- Como alternativa al método anterior, las muestras de sangre arterial pueden ser recogidos a través del catéter en la arteria carótida. Sin embargo, esto debe hacerse antes de la BAL se obtiene.
- Sobre consumos específicos de los pulmones en bloque tirando hacia arriba el corazón y cortar la tráquea. Tiene un pedazo de tejido preparado para absorber la sangre, por lo que el lugar de la cirugía es visible. Tire el corazón en la dirección del abdomen y corte con cuidado a lo largo de la columna vertebral para movilizar a todos los órganos torácicos. Cortar la aorta, extraer los órganos torácicos y colocarlos en una mesa de cirugía limpia.
- Cortar el corazón y el vaso principal de la muestra de tejido. Asegúrese de que no hay tejido del timo todavía conectado a los pulmones. Aparte de los pulmones con una tijera y colocar en tubos individuales y complemento de congelación. Almacenar a -80 ° C para su posterior análisis.
4. Medición de la lesión pulmonar
Se recomienda utilizar los parámetros siguientes resultados para evaluar el grado de lesión pulmonar: Realizar una albúmina ELISA (Bethyl Laboratories, EE.UU.) y mieloperoxidasa (MPO) ELISA (Hycult Biotecnología, EE.UU.) para evaluar el grado de disfunción de la barrera y la cantidad de inflamación las células en el líquido de BAL. Realizar una MPO ELISA también forman el tejido pulmonar. Si está mojado a seco relación se va a medir no se obtiene el líquido de BAL y la circulación pulmonar no se lava (ver 3.3). Medir el peso de los pulmones después de la escisión. A continuación, los pulmones son liofilizadas durante 48 horas y el tejido pulmonar se mide de nuevo. Entonces la relación de húmedo a seco se mide como mg de agua por mg de tejido seco (5).
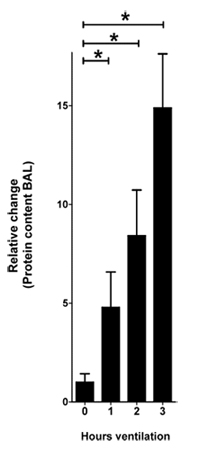
Figura 1. El contenido de proteína en el BAL, en respuesta a la IVL. Ratones fueron anestesiados con pentobarbital, la ventilación mecánica fue instituido y ratones fueron ventilados con presión controlada-settings (presión inspiratoria de 45 mbar, positiva al final de la presión exspiratory 3 mbar, 100% inspiración concentración de oxígeno). Después de 0, 1 hora, 2 y 3 de la ventilación BAL fue cosechada y el contenido de proteína se cuantificó mediante un ensayo de ácido bicinconínico (BCA). El cambio relativo del contenido de proteínas se muestra normalizada a 0 horas de ventilación (n = 4 por grupo, * indica p <0.05 en comparación con el control, la media ± SEM)
Discusión
El presente estudio describe una técnica de llevar a cabo la ventilación lesión pulmonar inducida en ratones. Este modelo demuestra una lesión altamente reproducible debido a la ventilación de alta presión. Los investigadores que consideran que el estudio de la lesión pulmonar aguda en ratones se pueden beneficiar de este modelo.
Divulgaciones
Agradecimientos
En el presente estudio son apoyados por National Heart, Lung, and Blood Institute Grant R01-HL0921, R01-DK083385 y R01HL098294 a HK Eltzschig, el 1K08HL102267-01 a T. Eckle, y la Fundación para la Educación Anestesia y becas de investigación a T. Eckle y HK Eltzschig, y la American Heart Association Grant T. Eckle y Eltzschig HK y Deutsche Forschungsgemeinschaft (DFG) beca de investigación de M. Koeppen.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Pentobarbital sódico (Fatal Plus) | Ls Vortech Farmacéutica, SA, | VPL 9372 | 4mg/mL en solución salina |
| Insyte 22 G | Beckton Dickinson | n / a | |
| Sutura de seda 4.0 | Harvard Apparatus | 517698 | |
| Sutura de Prolene 8.0 | Ethicon, EE.UU. | M8739 | reutilizables |
| Siemens 900 ° C | DRE Veterinaria, EE.UU. | # 336 | reformado |
| microscopio de disección (SZX10) | Olimpo | n / a | considerar la distancia amplia zona de trabajo |
| Calefacción Mesa | Rt, Effenberger, Alemania | n / a | único proveedor y una sola |
| Dispositivo de presión de la sangre | El sentido cibernético, Inc | BPM02 | |
| Yo STAT | Abbott | n / a |
Referencias
- Eckle, T., Faigle, M., Grenz, A., Laucher, S., Thompson, L. F., Eltzschig, H. K. A2B adenosine receptor dampens hypoxia-induced vascular leak. Blood. 111, 2024-2035 (2008).
- Eckle, T., Fullbier, L. G. r. e. n. z., A, ., Eltzschig, H. K. Usefulness of pressure-controlled ventilation at high inspiratory pressures to induce acute lung injury in mice. Am J Physiol Lung Cell Mol Physiol. 295, 718-724 (2008).
- Eckle, T., Fullbier, L., Wehrmann, M., Khoury, J., Mittelbronn, M., Ibla, J., Rosenberger, P., Eltzschig, H. K. Identification of ectonucleotidases CD39 and CD73 in innate protection during acute lung injury. J Immunol. 178, 8127-8137 (2007).
- Eckle, T., Grenz, A., Kohler, D., Redel, A., Falk, M., Rolauffs, B., Osswald, H., Kehl, F., Eltzschig, H. K. Systematic evaluation of a novel model for cardiac ischemic preconditioning in mice. Am J Physiol Heart Circ Physiol. 291, 2533-2540 (2006).
- Eckle, T., Grenz, A., Laucher, S., Eltzschig, H. K. A2B adenosine receptor signaling attenuates acute lung injury by enhancing alveolar fluid clearance in mice. J Clin Invest. 118, 3301-3315 (2008).
- Eckle, T., Krahn, T., Grenz, A., Kohler, D., Mittelbronn, M., Ledent, C., Jacobson, M. A., Osswald, H., Thompson, L. F., Unertl, K., Eltzschig, H. K. Cardioprotection by ecto-5'-nucleotidase (CD73) and A2B adenosine receptors. Circulation. 115, 1581-1590 (2007).
- Eltzschig, H. K. Adenosine: an old drug newly discovered. Anesthesiology. 111, 904-915 (2009).
- Eltzschig, H. K., Eckle, T., Mager, A., Kuper, N., Karcher, C., Weissmuller, T., Boengler, K., Schulz, R., Robson, S. C., Colgan, S. P. ATP release from activated neutrophils occurs via connexin 43 and modulates adenosine-dependent endothelial cell function. Circ Res. 99, 1100-1108 (2006).
- Eltzschig, H. K., Ibla, J. C., Furuta, G. T., Leonard, M. O., Jacobson, K. A., Enjyoji, K., Robson, S. C., Colgan, S. P. Coordinated adenine nucleotide phosphohydrolysis and nucleoside signaling in posthypoxic endothelium: role of ectonucleotidases and adenosine A2B receptors. J Exp Med. 198, 783-796 (2003).
- Eltzschig, H. K., Kohler, D., Eckle, T., Kong, T., Robson, S. C., Colgan, S. P. Central role of Sp1-regulated CD39 in hypoxia/ischemia protection. Blood. 113, 224-232 (2009).
- Frick, J. S., MacManus, C. F., Scully, M., Glover, L. E., Eltzschig, H. K., Colgan, S. P. Contribution of adenosine A2B receptors to inflammatory parameters of experimental colitis. J Immunol. 182, 4957-4964 (2009).
- Grenz, A., Eckle, T., Zhang, H., Huang, D. Y., Wehrmann, M., Kohle, C., Unertl, K., Osswald, H., Eltzschig, H. K. Use of a hanging-weight system for isolated renal artery occlusion during ischemic preconditioning in mice. Am J Physiol Renal Physiol. 292, 475-485 (2007).
- Grenz, A., Osswald, H., Eckle, T., Yang, D., Zhang, H., Tran, Z. V., Klingel, K., Ravid, K., Eltzschig, H. K. The Reno-Vascular A2B Adenosine Receptor Protects the Kidney from Ischemia. PLoS Medicine. 5, e137-e137 (2008).
- Grenz, A., Zhang, H., Eckle, T., Mittelbronn, M., Wehrmann, M., Kohle, C., Kloor, D., Thompson, L. F., Osswald, H., Eltzschig, H. K. Protective role of ecto-5'-nucleotidase (CD73) in renal ischemia. J Am Soc Nephrol. 18, 833-845 (2007).
- Grenz, A., Zhang, H., Hermes, M., Eckle, T., Klingel, K., Huang, D. Y., Muller, C. E., Robson, S. C., Osswald, H., Eltzschig, H. K. Contribution of E-NTPDase1 (CD39) to renal protection from ischemia-reperfusion injury. FASEB J. 21, 2863-2873 (2007).
- Grenz, A., Zhang, H., Weingart, J., von Wietersheim, S., Eckle, T., Schnermann, J. B., Kohle, C., Kloor, D., Gleiter, C. H., Vallon, V., Eltzschig, H. K., Osswald, H. Lack of effect of extracellular adenosine generation and signalling on renal erythropoietin secretion during hypoxia. Am J Physiol Renal Physiol. , (2007).
- Haeberle, H. A., Durrstein, C., Rosenberger, P., Hosakote, Y. M., Kuhlicke, J., Kempf, V. A., Garofalo, R. P., Eltzschig, H. K. Oxygen-independent stabilization of hypoxia inducible factor (HIF)-1 during RSV infection. PLoS ONE. 3, e3352-e3352 (2008).
- Hart, M. L., Gorzolla, I. C., Schittenhelm, J., Robson, S. C., Eltzschig, H. K. SP1-dependent induction of CD39 facilitates hepatic ischemic preconditioning. J Immunol. 184, 4017-4024 (2010).
- Hart, M. L., Henn, M., Kohler, D., Kloor, D., Mittelbronn, M., Gorzolla, I. C., Stahl, G. L., Eltzschig, H. K. Role of extracellular nucleotide phosphohydrolysis in intestinal ischemia-reperfusion injury. FASEB J. 22, 2784-2797 (2008).
- Hart, M. L., Jacobi, B., Schittenhelm, J., Henn, M., Eltzschig, H. K. Cutting Edge: A2B Adenosine receptor signaling provides potent protection during intestinal ischemia/reperfusion injury. J Immunol. 182, 3965-3968 (2009).
- Hart, M. L., Kohler, D., Eckle, T., Kloor, D., Stahl, G. L., Eltzschig, H. K. Direct treatment of mouse or human blood with soluble 5'-nucleotidase inhibits platelet aggregation. Arterioscler Thromb Vasc Biol. 28, 1477-1483 (2008).
- Hart, M. L., Much, C., Gorzolla, I. C., Schittenhelm, J., Kloor, D., Stahl, G. L., Eltzschig, H. K. Extracellular adenosine production by ecto-5'-nucleotidase protects during murine hepatic ischemic preconditioning. Gastroenterology. 135, 1739-1750 (2008).
- Hart, M. L., Much, C., Kohler, D., Schittenhelm, J., Gorzolla, I. C., Stahl, G. L., Eltzschig, H. K. Use of a hanging-weight system for liver ischemic preconditioning in mice. Am J Physiol Gastrointest Liver Physiol. 294, 1431-1440 (2008).
- Hartmann, H., Eltzschig, H. K., Wurz, H., Hantke, K., Rakin, A., Yazdi, A. S., Matteoli, G., Bohn, E., Autenrieth, I. B., Karhausen, J., Neumann, D., Colgan, S. P., Kempf, V. A. Hypoxia-independent activation of HIF-1 by enterobacteriaceae and their siderophores. Gastroenterology. 134, 756-767 (2008).
- Heinzelmann, F., Jendrossek, V., Lauber, K., Nowak, K., Eldh, T., Boras, R., Handrick, R., Henkel, M., Martin, C., Uhlig, S., Kohler, D., Eltzschig, H. K., Wehrmann, M., Budach, W., Belka, C. Irradiation-induced pneumonitis mediated by the CD95/CD95-ligand system. J Natl Cancer Inst. 98, 1248-1251 (2006).
- Koeppen, M., Eckle, T., Eltzschig, H. K. Selective deletion of the A1 adenosine receptor abolishes heart-rate slowing effects of intravascular adenosine in vivo. PLoS One. 4, e6784-e6784 (2009).
- Kohler, D., Eckle, T., Faigle, M., Grenz, A., Mittelbronn, M., Laucher, S., Hart, M. L., Robson, S. C., Muller, C. E., Eltzschig, H. K. CD39/ectonucleoside triphosphate diphosphohydrolase 1 provides myocardial protection during cardiac ischemia/reperfusion injury. Circulation. 116, 1784-1794 (2007).
- Kuhlicke, J., Frick, J. S., Morote-Garcia, J. C., Rosenberger, P., Eltzschig, H. K. Hypoxia Inducible Factor (HIF)-1 Coordinates Induction of Toll-Like Receptors TLR2 and TLR6 during Hypoxia. PLoS ONE. 2, e1364-e1364 (2007).
- Morote-Garcia, J. C., Rosenberger, P., Kuhlicke, J., Eltzschig, H. K. HIF-1-dependent repression of adenosine kinase attenuates hypoxia-induced vascular leak. Blood. 111, 5571-5580 (2008).
- Morote-Garcia, J. C., Rosenberger, P., Nivillac, N. M., Coe, I. R., Eltzschig, H. K. Hypoxia-inducible factor-dependent repression of equilibrative nucleoside transporter 2 attenuates mucosal inflammation during intestinal hypoxia. Gastroenterology. 136, 607-618 (2009).
- Reutershan, J., Vollmer, I., Stark, S., Wagner, R., Ngamsri, K. C., Eltzschig, H. K. Adenosine and inflammation: CD39 and CD73 are critical mediators in LPS-induced PMN trafficking into the lungs. FASEB J. 23, 473-482 (2009).
- Schingnitz, U., Hartmann, K., Macmanus, C. F., Eckle, T., Zug, S., Colgan, S. P., Eltzschig, H. K. Signaling through the A2B adenosine receptor dampens endotoxin-induced acute lung injury. J Immunol. 184, 5271-5279 (2010).
- Thompson, L. F., Eltzschig, H. K., Ibla, J. C., Van De Wiele, C. J., Resta, R., Morote-Garcia, J. C., Colgan, S. P. Crucial role for ecto-5'-nucleotidase (CD73) in vascular leakage during hypoxia. J. Exp. Med. 200, 1395-1405 (2004).
- Aherne, C. M., Kewley, E. M., Eltzschig, H. K. The resurgence of A2B adenosine receptor signaling. Biochim Biophys Acta. , (2010).
- Eckle, T., Koeppen, M., Eltzschig, H. K. Role of extracellular adenosine in acute lung injury. Physiology (Bethesda). 24, 298-306 (2009).
- Koeppen, M., Feil, R., Siegl, D., Feil, S., Hofmann, F., Pohl, U., de Wit, C. cGMP-dependent protein kinase mediates NO- but not acetylcholine-induced dilations in resistance vessels in vivo. Hypertension. 44, 952-955 (2004).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados