Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Luciferasa utilizando a las infecciones bacterianas de la imagen en ratones
En este artículo
Resumen
Métodos para obtener imágenes de bioluminiscencia de las infecciones bacterianas en los animales vivos se describen. Los patógenos son modificadas para expresar luciferasa permitiendo imágenes ópticas de todo el cuerpo de las infecciones en los animales vivos. Los modelos animales pueden ser infectados con agentes patógenos que expresan luciferasa y el curso de la enfermedad como resultado visualizado en tiempo real de imágenes de bioluminiscencia.
Resumen
Imágenes es una técnica valiosa que puede ser usado para monitorear los procesos biológicos. En particular, la presencia de células cancerosas, las células madre, los tipos específicos de células inmunes, los patógenos virales, parásitos y bacterias se pueden seguir en tiempo real en que viven los animales 1-2. Aplicación de imágenes de bioluminiscencia para el estudio de patógenos tiene ventajas en comparación con las estrategias convencionales para el análisis de las infecciones en modelos animales 3-4. Las infecciones pueden ser visualizados en animales individuales a través del tiempo, sin necesidad de la eutanasia para determinar la ubicación y la cantidad del patógeno. Imagen óptica que permite la evaluación integral de todos los tejidos y órganos, en lugar de muestreo de los sitios previamente sabe que están infectados. Además, la exactitud de la inoculación en tejidos específicos puede determinarse directamente antes de llevar adelante los animales que fueron inoculados sin éxito durante todo el experimento. Variabilidad entre animales puede ser controlada, ya que permite imágenes de cada animal que han de seguirse por separado. Imágenes tiene el potencial de reducir considerablemente el número de animales necesarios debido a la capacidad de obtener datos de los puntos de tiempo sin tener que numerosas muestras de tejidos para determinar la carga de patógenos 4.3.
Este protocolo describe los métodos para visualizar las infecciones en los animales vivos con imágenes de bioluminiscencia de las cepas recombinantes de bacterias que expresan luciferasa. El escarabajo clic (CBRLuc) y luciferasas luciérnaga (FFluc) utilizan como sustrato luciferina 5-6. La luz producida por las dos CBRluc y FFluc tiene una longitud de onda amplia de 500 nm a 700 nm, por lo que esos reporteros luciferasas excelente para la obtención de imágenes ópticas en modelos animales vivos 7.9. Esto es principalmente porque las longitudes de onda de la luz superior a 600 nm se requieren para evitar la absorción por la hemoglobina y, por tanto, viajar a través de tejidos de mamíferos de manera eficiente. Luciferasa es genéticamente introducido en la bacteria para producir la señal de la luz 10. Los ratones son inoculados con la bacteria pulmonar bioluminiscentes intratraqueal para permitir el monitoreo de las infecciones en tiempo real. Después de la inyección luciferina, las imágenes se adquieren mediante el sistema de imágenes IVIS. Durante estas pruebas, los ratones son anestesiados con isoflurano con una XGI-8 Sistema de Gas Anethesia. Las imágenes pueden ser analizadas para localizar y cuantificar la fuente de señal, lo que representa el sitio de la infección bacteriana (s) y el número, respectivamente. Después de la filmación, la determinación de UFC se lleva a cabo en el tejido homogeneizado para confirmar la presencia de bacterias. Varias dosis de bacterias se utilizan para correlacionar el número de bacterias con luminiscencia. Imagen se puede aplicar al estudio de la patogénesis y la evaluación de la eficacia de los compuestos antibacterianos y vacunas.
Protocolo
1. La infección pulmonar por la intubación intratraqueal
- Pesar los ratones y, opcionalmente, se pueden hacer marcas en las orejas para una fácil identificación.
- Anestesiar a los ratones con ketamina (100 mg por g de peso del ratón) y xilazina (10 mg por gramo de peso del ratón) mediante la inoculación intraperitoneal.
- Ratones a cabo en jaulas hasta que esté completamente anestesiado. Apriete las almohadillas de sus patas para revisar pedal reflejo. Los ratones deben mostrar reducido o sin reacción refleja.
- Coloque el ratón en el stand de la intubación acostado sobre su espalda.
- Fijar una banda de goma para la intubación de pie y luego se coloca en los incisivos superiores del ratón. Utilice cinta adhesiva para fijar las piernas y los brazos en el stand de la intubación.
- Suavemente mueva Tougue de la boca con unas pinzas.
- Introduzca el espéculo dentro de octoscope de la boca y mirar en la orofaringe hasta la apertura de la laringe es visible.
- Alambre de guía de avance cubierto con cathether en la tráquea hasta catether centro se encuentra en los incisivos. Retire el cable de guía. Poner aire en cathether para observar la expansión del tórax y confirmar la correcta intubación.
- Inyectar 50 L de bacterias (en las imágenes mostradas se utilizó el bacilo de Calmette Guerin (BCG) que expresa clic escarabajo rojo luciferasa (CBRLuc), construido en nuestro laboratorio, pero ninguna cepa bacteriana luminiscente puede ser utilizado) solución a través de cathether utilizando una jeringa de 1 ml.
- Coloque el ratón en una jaula y observar durante la recuperación de la anestesia.
2. Animal anestesia y preparación para imágenes de bioluminiscencia
Los ratones son anestesiados con isoflurano con el XGI-8 Sistema de Gas Aneshesia.
- Antes de utilizar la XGI-8 sistema de anestesia, pesar cada recipiente de filtro de carbón y escribir el peso y la fecha de la misma. Si el peso es 50 gramos más del peso inicial, reemplazarlo con un nuevo envase.
- Comprobar el nivel de isoflurano en el vaporizador y rellene si es necesario.
- Encienda la bomba de evacuación en la parte delantera de la XGI-8 sistema de anestesia y se puso a 8 lpm (litros por minuite).
- Abra el suministro de oxígeno del cilindro de alta presión y la puso a 55 psig.
- Encienda el oxígeno cambiar (verde) en la parte frontal del sistema de anestesia XGI-8.
- A su vez el flujo de gas a la cámara de imagen para ajustar el nivel de flujo de gas. Se establece en 0,25 lpm y luego apagar el flujo de gas.
- A su vez el flujo de gas a la cámara de inducción de la anestesia para establecer el nivel de flujo de gas. A 1.5 lpm y luego apagar el flujo de gas.
- Encienda el isoflurano con el vaporizador y se puso a 2-2,5 por ciento. El nivel de isoflurano puede ser ajustado en función del número de animales utilizados y el peso.
- Ratones lugar en la cámara de inducción y cierre la tapa. A su vez el flujo de gas a la cámara de inducción. Ratones lugar en la cámara de 5 a 10 minuites hasta que se anestesiar por completo.
- Aplique un ungüento ópticos de los ojos para proteger los ojos del ratón en la imagen y el lugar de los ratones en la cámara de imágenes en uno de los conos de ojiva en el colector de la anestesia. Use reflector lumínico entre los ratones para evitar el reflejo de la luz sobre los temas circundantes de animales.
- Inyectar luciferina (150 mg / gramo de peso corporal) mediante la inoculación intraperitoneal.
3. Bioluminiscencia de imágenes
- Inicie el software de imágenes de vida.
- Si el sistema no se inicia, inicializar el sistema de imágenes IVIS.
- Establecer los parámetros de imagen, haga clic en configuración de la secuencia en el panel de control de la adquisición de IVIS.
Seleccione la luminiscencia y la fotografía en el modo de imagen. Si la opción de llevar a cabo DLIT reconstrucción 3D se desea, seleccionar las imágenes fotográficas de luz, luminosa y estructurales, como parte de la secuencia de imágenes.
Establecer el tiempo de exposición de 0,5 segundos a 10 minutos.
Establecer Binning y F / parada según el brillo de espera de la muestra.
Set de excitación filtro para bloquear y filtrar las emisiones de abrir, a menos que la planificación de la adquisición de longitudes de onda de luz específicas solamente. En el caso de DLIT 3D Constitución, establece varios filtros de emisión de diferentes longitudes de onda para permitir una localización precisa de la fuente.
FOV conjunto de la A a D, dependiendo del número de ratones o región de origen animal a explorar. Seleccione A y B de un ratón, ratones C por 2-3, 4-5 y D para los ratones. - Haga clic en Agregar en el Asistente para imágenes en el Panel de Control de Adquisición de añadir la configuración de la secuencia.
- Inicio de la secuencia de imágenes haciendo clic en adquirir.
En el caso de DLIT construcción en 3D, imágenes luminosas serán adquiridas por múltiples filtros de emisión en longitudes de onda diferentes. Imágenes de luz fotográfica y estructurado también se adquirirán. - Durante la adquisición de la imagen y editar los niveles de la imagen paneles serán visibles. Rellene la información más detallada posible para cada experimento en edición de imágenes para asegurar un fácil seguimiento de las imágenes en los últimos tiempos y guardar sus imágenes.
- ReRemove a los ratones de IVIS imágenes de cámara y devolverlos a sus jaulas. Observar la recuperación de unaestesis para asegurar los ratones no se vieron afectados significativamente por el procedimiento. Los animales deben ser monitoreados constantemente hasta que se recupera de la anestesia (generalmente 1-2 min).
4. Ex vivo de imágenes y análisis de UFC para la cuantificación de bacterias en los pulmones
- Se inyecta por vía intraperitoneal a ratones con luciferina de la misma manera que para la imagen, justo antes de la eutanasia.
- La eutanasia a los ratones por inyección intraperitoneal de 100 mg / kg pentobarbitol 5 min después de la inyección luciferina.
- Explante de los pulmones de los ratones y el lugar en placas petri estéril con pinzas estériles y tijeras.
- Colocar petri plato que contiene órgano explantado en las imágenes de cámara y obtener imágenes de bioluminiscencia en la misma forma que para el ratón entero.
- Después de la imagen, eliminar órganos explantados de placa de Petri con pinzas estériles y homogeneizar en 1 ml de PBS.
- Hacer diluciones y el tejido de la placa de los medios selectivos apropiados. Tejido homogeneizado se pueden almacenar -80 ° C para volver a las placas, deberá de ser necesario. Por otra parte, el tejido homogeneizado se puede utilizar para la extracción de ADN o ARN para cuantificar el número de bacterias por qPCR.
5. Análisis de imágenes de luminiscencia
- Inicio »Software de estar imagen" y navegar por los archivos de imagen.
- Use "paleta de herramientas para ajustar las imágenes. Haga clic en Ajuste de imagen para modificar la corrección / configuración de filtrado y min / max para las escalas de color.
- Utilice las herramientas de ROI en la lista desplegable para la cuantificación de la intensidad de la luz. Seleccione la forma retorno de la inversión, el número y tamaño. Arrastre ROI marco de la región de interés en la imagen. Asegúrese de que todos ROI son del mismo tamaño y forma. Haga clic en el ROI de medición y guardar, copiar y / o exportación de datos cuantitativos.
- En el caso de DLIT reconstrucciones en 3D, la carga de secuencia de imágenes incluyendo la imagen de luz estructurada. Haga clic en topografía de la superficie de la herramienta de Platte. En la lista desplegable, seleccione la ficha Reconstruir para generar la topografía de la superficie. Un lío superficie aparecerá en la ventana.
- Seleccione la reconstrucción DLIT 3D en la herramienta de Platte. En la lista desplegable, seleccione la pestaña Propiedades para establecer las propiedades de los tejidos y el espectro de la fuente. Muscular se recomienda en la mayoría de las circunstancias. En la lista desplegable, haga clic en la ficha Analizar para seleccionar la longitud de onda para el análisis. Haga clic en la pestaña de parámetros y confirmar los valores por defecto o ajustar los parámetros de DLIT si es necesario. Haga clic en Reconstruir ficha para iniciar el análisis en 3D.
- Cuando la reconstrucción 3D está terminado, la vista 3D se muestran los resultados de la reconstrucción en 3D. Haga clic en la ficha de resultados para ver el análisis de datos de densidad de fotones, voxels y los parámetros DLIT algoritmo.
- Guardar y / o exportar los resultados de los análisis de la reconstrucción 3D en figuras y archivos de datos.
6. Los resultados representativos:
Las imágenes de bioluminiscencia de los ratones infectados con bacterias bioluminiscentes, junto con un control del ratón no infectado se muestra en la Figura 1. La pulmonar ratones infectados con bacterias bioluminiscentes producir una señal significativa de los pulmones (Figura 1). La intensidad de la luminiscencia se cuantifica como flujo total dentro de un ROI (región de interés) (Figura 2). Los datos cuantitativos para la intensidad de la luz está normalizado para las unidades formadoras de colonias (UFC) de bacterias obtenidas de los pulmones para confirmar que la señal es producida por las bacterias bioluminiscentes y pueden ser comparados con el control negativo. La ubicación y la intensidad de la señal pueden ser analizados por DLIT reconstrucción en 3D de la fuente de luminiscencia sobre la base de la tomografía de la superficie del ratón 11. Estos análisis permiten la cuantificación y localización de la señal de bioluminiscencia producida. Los resultados de la reconstrucción en 3D de una fuente luminosa en ratones infectados demuestra que la luz es producida a partir de los pulmones del ratón (Figura 3). Las imágenes ex vivo de los pulmones de los ratones resultantes confirman que la luminiscencia se emite desde los pulmones, en lugar de algún otro tejido u órgano estrechamente yuxtapuestos (Figura 2C).

Figura 1. Imágenes de luminiscencia pulmonar ratones infectados con bacterias bioluminiscentes etiquetados con CBRluc. Control del ratón no infectado es a la izquierda y dos ratones infectados están a la derecha. Los ratones fueron infectados con bacterias que expresan CBRluc (n = 2) a través de la vía intratraqueal. 10 minutos después de la inyección luciferina, las imágenes de luminiscencia fueron adquiridas por 10 min a 4 posiciones: dorsal, ventral lateral, izquierda y derecha.
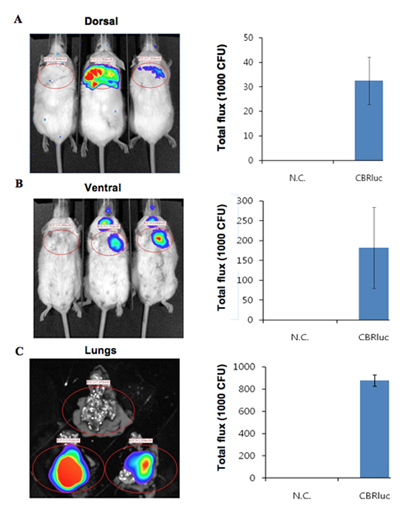
Figura 2. La intensidad de la luz cuantitativa de los ratones infectados con bacterias que expresan CBRluc. (A, B) imágenes de luminiscencia de análisis de retorno de la inversión y el flujo total de cuantificar la luz de retorno de la inversión en posiciones dorsal y ventral, respectivamente. Los ratones no infectados están a la izquierda y dos ratones infectados están a la derecha. Luminiscencia imágenes fueron adquiridas de los pulmones of ratones no infectados e infectados con CBRlux (n = 2). La intensidad de la luz alrededor de los pulmones se cuantificó mediante el análisis de retorno de la inversión. C) ex vivo imágenes de pulmones infectados (arriba) e infectados (abajo, dos conjuntos de los pulmones) de los ratones. Luciferina se inyectó 5 miniuts antes de la eutanasia y las imágenes fueron adquiridas. Los valores cuantificados se normalizan a UFC.
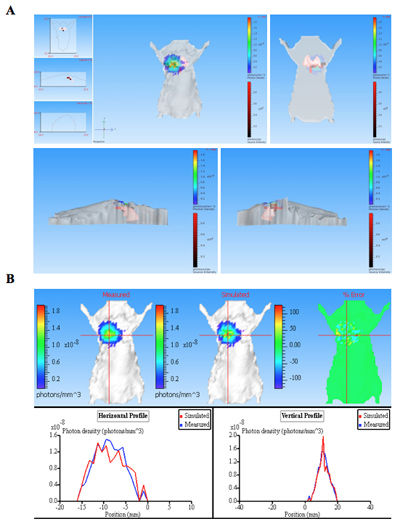
Figura 3. La reconstrucción en 3D de la fuente de la bioluminiscencia (s) de un ratón infectado pulmonar. El ratón fue infectado con bacterias que expresan CBRluc por inyección intratraqueal. La secuencia de imagen fue adquirida el uso de filtros diferentes longitudes de onda de emisión de la serie de 540 nm a 700 nm. Una secuencia de imágenes se utilizó para la reconstitución en 3D para la fuente de luminiscencia en sujetos animales que contenía una imag estructurado. A) La tomografía de mouse se muestra en diferentes posiciones: delante, detrás, izquierda y derecha. Las fuentes de luz se muestran como voxels (cajas de color rojo dentro del ratón 3D) que se encuentran dentro de los pulmones según lo determinado por la reconstrucción. B) Photon densiy mapa de los datos medidos y simulados. Comparando las curvas de fotones medidos y simulados densidad proporcionar la información de la calidad de la reconstrucción. Reconstrucciones de buena calidad como resultado densidades similares fotones medidos y simulados.
Access restricted. Please log in or start a trial to view this content.
Discusión
Aunque después de estos protocolos por lo general resultan en imágenes de alta calidad, es importante tener en cuenta algunas cuestiones clave con el fin de obtener datos precisos y consistentes de los estudios de imagen. Imágenes de luminiscencia se deben adquirir que cuenta con entre 600 y 60.000 para asegurar que la señal está por encima de fondo y la cámara no está saturado. Si la señal obtenida es inferior a 600 las condiciones de exposición debe ser ajustada para aumentar el recuento. Si la señal obtenid...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
Agradecimientos
Los autores agradecen a los miembros Cirillo laboratorio valiosa para los debates y la asistencia a lo largo de este estudio. Agradecemos al Dr. Joshua Hill y el laboratorio del doctor James Samuel para obtener ayuda con durante el rodaje de este protocolo. Este trabajo fue financiado por la beca 48523 de la Fundación Bill & Melinda Gates Foundation y AI47866 beca de los Institutos Nacionales de Salud.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Isoflurane | VETONE | 501027 | |
| Ketamine | Butler Animal Health Supply | ||
| Xylazine | MP Biomedicals | 158307 | |
| Luciferin | GMT | LUCK-100 | |
| Fetal plus solution | Vortech Pharmaceutical Ls, Ltd | ||
| Cathether (22G x 1”) | Terumo Medical Corp. | OX2225CA | |
| Guide wire | Hallowell EMC | 210A3491 | |
| Octocope with speculum | Hallowell EMC | 000A3748 | |
| Xenogen IVIS system | Caliper Life Sciences | ||
| XGI-8-gas Anesthsia System | Caliper Life Sciences | ||
| Living Imaging Software | Caliper Life Sciences | ||
| Transparent nose cones | Caliper Life Sciences | ||
| Light baffle divider | Caliper Life Sciences |
Referencias
- Wilson, T., Hastings, J. W. Bioluminescence. Annu Rev Cell Dev Biol. 14, 197-230 (1998).
- Contag, C. H., Bachmann, M. H. Advances in in vivo bioluminescence imaging of gene expression. Annu Rev Biomed Eng. 4, 235-260 (2002).
- Hutchens, M., Luker, G. D. Applications of bioluminescence imaging to the study of infectious diseases. Cell Microbiol. 9, 2315-2322 (2007).
- Doyle, T. C., Burns, S. M., Contag, C. H. In vivo bioluminescence imaging for integrated studies of infection. Cell Microbiol. 6, 303-317 (2004).
- Wood, K. V., Lam, Y. A., Seliger, H. H., McElroy, W. D. Complementary DNA coding click beetle luciferases can elicit bioluminescence of different colors. Science. 244, 700-702 (1989).
- Wet, J. R. de, Wood, K. V., Helinski, D. R., DeLuca, M. Cloning of firefly luciferase cDNA and the expression of active luciferase in Escherichia coli. Proc Natl Acad Sci U S A. 82, 7870-7873 (1985).
- Hastings, J. W. Chemistries and colors of bioluminescent reactions: a review. Gene. 173, 5-11 (1996).
- Zhao, H. Emission spectra of bioluminescent reporters and interaction with mammalian tissue determine the sensitivity of detection in vivo. J Biomed Opt. 10, 41210-41210 (2005).
- Rice, B. W., Cable, M. D., Nelson, M. B. In vivo imaging of light-emitting probes. J Biomed Opt. 6, 432-440 (2001).
- Contag, C. H. Photonic detection of bacterial pathogens in living hosts. Mol Microbiol. 18, 593-603 (1995).
- Kuo, C., Coquoz, O., Troy, T. L., Xu, H., Rice, B. W. Three-dimensional reconstruction of in vivo bioluminescent sources based on multispectral imaging. J Biomed Opt. 12, 024007-024007 (2007).
- Weissleder, R. A clearer vision for in vivo imaging. Nat Biotechnol. 19, 316-317 (2001).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados