Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Disección de un ojo del ratón de un monte entero del epitelio pigmentario de la retina
En este artículo
Resumen
Una demostración formal de la disección de un ojo del ratón, lo que resulta en un montaje de todo el epitelio pigmentario de la retina.
Resumen
El epitelio pigmentario retiniano (EPR) se encuentra en la parte posterior del ojo de los mamíferos, justo debajo de la retina neural, que contiene los fotorreceptores (conos y bastones). El EPR es una monocapa de células pigmentadas cúbicas y asociados estrechamente con la retina neural justo encima de él. Esta asociación hace que el RPE de gran interés para los investigadores que estudian enfermedades de la retina. El EPR es también el sitio de un ensayo in vivo de la homología dirigida por la reparación del ADN, la prueba de p de la ONU. El ojo del ratón es particularmente difícil de analizar debido a su pequeño tamaño (alrededor de 3,5 mm de diámetro) y su forma esférica. En este artículo se demuestra con todo detalle un procedimiento para la disección del ojo que resulta en un montaje conjunto de la RPE. En este procedimiento, se muestra cómo trabajar con y no contra, la estructura esférica del ojo. En pocas palabras, el tejido conectivo, el músculo y el nervio óptico se eliminan de la parte posterior del ojo. Luego, la córnea y el cristalino se eliminan. A continuación, se hacen cortes estratégicos que dan lugar a aplanamiento significativo del tejido restante. Por último, la retina neural se levanta suavemente, dejando al descubierto un EPR intacto, que aún está unido a la coroides y la esclera subyacente. Este monte se puede utilizar para realizar el ensayo de la ONU o p para la evaluación de inmunohistoquímica o inmunofluorescencia el tejido de RPE.
Protocolo
1. Eliminar el tejido extraños desde el exterior del ojo
- Vierta 1X PBS en la tapa de un plato de 35 mm. El nivel debe estar justo debajo del labio de la tapa.
- El uso de pinzas rectas, los ojos de transferencia (s) del tubo de almacenamiento para el plato de 35 mm. Los ojos se sumergen en PBS, por dos razones: 1. Los tejidos extraños "flotan" fuera del ojo para que pueda ver y quitar con facilidad, y 2. Durante la disección, los ojos, naturalmente, mantienen su forma esférica, mientras que en la suspensión, que le permite trabajar con esta forma en lugar de combatirla.
- Utilizando los dos pares de pinzas en ángulo (45 ° y 15 °), retire suavemente tanto músculo y el tejido conectivo como sea posible, tirando del tejido contra la corriente (es decir, hacia la córnea). Parte del tejido conectivo se mantendrá. Debería hacerse lo posible para exprimir el globo ocular lo menos posible.
- El comercio de su 15 ° para tijeras pinzas de resorte. Mientras mantiene los ojos estable con 45 pinzas °, utilice las tijeras para cortar la primavera del músculo restante y del tejido conjuntivo, así como el nervio óptico. * Consejo: Use el borde exterior de las tijeras para empujar el tejido contra la corriente (hacia la brecha corneo-escleral) y después del ajuste. Continúe hasta que todos los tejidos extraños se ha quitado de la vista.
2. Retire la córnea y el cristalino
- Con la córnea hacia arriba, use las pinzas de 45 ° a pellizcar un pequeño pliegue en el centro de la córnea.
- Usando las tijeras de primavera, hace una pequeña incisión en la base de la aleta. Dejar de lado la solapa.
- La celebración de los ojos y permanezca con los fórceps, introduzca el extremo inferior de tijera dentro y perpendicular a la incisión y hacer un corte hacia la brecha corneo-escleral. Trate de mantener su hoja inferior bajo el iris para la córnea y el iris se cortan. No corte todo el camino a la brecha corneo-escleral. Mantenga las tijeras inserta en el ojo.
- Usando su pinza de 45 °, gire con cuidado los ojos de manera que las tijeras son paralelas a la línea divisoria corneo-escleral y hacer un pequeño corte. Gire lentamente el Este tiempo 360, haciendo pequeñas incisiones en todos los sentidos. Una vez más, trate de mantener la hoja inferior de la tijera de su primavera bajo el iris lo tanto el iris y la córnea se corta. Levante el iris y la córnea del resto del ojo y desecharlos.
- Inclinación de los ojos de su lado y presione suavemente hacia abajo en la mitad posterior del ojo, lo que obligó a la lente. Deseche los lentes. El interior de la ojera restante está rodeada por la retina neural, lo que debería ser suave y opaca.
3. Trimestre el ocular como resultado, lo que resulta en un 4 - "pétalos", la flor-como la estructura
- El ojo debe estar colocada de tal modo que la apertura de la ojera es perpendicular a su cuerpo. Utilizar su pinza de 45 ° para mantener el equilibrio y la posición del ocular.
- La celebración de las tijeras de primavera frente a usted lo que son perpendiculares a su cuerpo, introduzca el extremo inferior de las tijeras de su resorte en el borde superior de la copa de los ojos abiertos. Usando su pinza de 45 °, alinee cuidadosamente la copa del ocular para que un solo corte, se puede hacer directamente desde la línea divisoria corneo-escleral hacia la cabeza del nervio óptico. Todos los cortes deben ser perpendiculares a la línea divisoria corneo-escleral y menos que se especifique, debe ir lo más cerca de la cabeza del nervio óptico como sea posible sin cortar en ella.
- Gire el ocular de 180 °, manteniendo la perpendicularidad con su cuerpo. Use la técnica en el paso 3.2 para hacer un corte perpendicular segundo.
- Gire el ocular y repetir la técnica descrita en el apartado 3.2 para hacer dos cortes más. Los cuatro cortes deben ser lo más cercano a 90 º como sea posible. Tenga en cuenta que el ojo no es perfectamente esférica por lo que habrá una cierta variabilidad.
4. Corte cada uno de los cuatro "pétalos" en la mitad, resultando en un niño de ocho pétalos de flores-como la estructura
- La transferencia de la ojera en cuartos de la antena de 35 mm de una lámina limpia. Con el ocular hacia arriba, en primicia con la pinza de 45 °. Con cuidado, sacarlo del líquido y lo coloca en un portaobjetos limpio.
- Utilizando los dos pares de pinzas en ángulo, abra suavemente el ojo, la retina neural hacia arriba. NO QUITE LA RETINA NEURAL-que ayuda a mantener la vista algunos de su forma esférica por lo que no están trabajando en contra de ella. También protege el EPR de ser dañado accidentalmente en los siguientes procedimientos.
- Mover la tarjeta hasta que uno de los pétalos es perpendicular a su cuerpo.
- Utilice su 15 pinzas °, agarrar suavemente la esquina de los pétalos. La esquina de los pétalos se debe córnea, retina neural o no del EPR. Levante suavemente la esquina, lo que le permite mantener su curvatura.
- Inserte la hoja inferior de las tijeras de muelle entre los pétalos y la corredera. Alinear sus tijeras de tal manera que una sola recta, perpendicular corte puede hacerse desde la línea divisoria corneo-escleral hacia la cabeza del nervio óptico. Cortar tan cerca de la cabeza del nervio óptico como withou posiblet reducción en el mismo. Dejar de lado el pétalo, lo que le permite estar en la diapositiva.
- Mover la tarjeta de 90 °, de modo que el pétalo siguiente es perpendicular a su cuerpo. Repita el paso 4.5.
- Repita los pasos 4.5 y 4.6 veces más. La estructura resultante debe ser similar a una flor de ocho pétalos.
5. Retire la retina neural
- Pipeta de 100 a 200 l de PBS 1X a la muestra. Esto evitará que la retina neural se pegue a medida que despegarlo de la RPE.
- Normalmente, la retina neural se unen libremente a la RPE. Sin embargo, se necesita práctica y habilidad para eliminar sólo la retina neural y no del EPR. Pellizque suavemente un pétalo de la retina neural con un par de pinzas en ángulo, mientras que la estabilización (manteniendo pulsado) el resto del ojo con el otro par de pinzas de ángulo. Tire de la retina neural del resto del ojo. Repita este procedimiento hasta que la retina neural todo ha sido eliminado. * Consejo: pegar la punta de la pinza de 15 ° en la cabeza del nervio óptico para anclar el ojo. A continuación, utilice las pinzas de 45 ° para barrer debajo de la retina neural y lo despega y lejos. Por lo general, la mejor manera de levantar la retina neural de la cabeza del nervio óptico hacia la brecha corneo-escleral. Asegúrese de tirar a la basura cualquier restos sueltos del iris. El iris es muy pegajosa y de lo contrario pueden quedar atrapados en el RPE.
- Enjuagar la muestra con PBS 1X. Pipeta de 100 a 200 l de PBS 1X en la muestra y chupar una copia de seguridad. Deseche la PBS. Repita según sea necesario para eliminar el polvo y los escombros.
6. Montaje que muestra (s) en una diapositiva
- Pipeta de 80 a 90 l de 90% de glicerol en una nueva diapositiva en una forma rectangular. Use el lado de la punta de la pipeta para hacer un frotis, incluso, rectangular de glicerol. (Este es el procedimiento para el montaje de dos EPR en una diapositiva.)
- Inserte el brazo inferior de 15 ° bajo unas pinzas de la muestra. Levante suavemente la muestra fuera de la diapositiva de disección.
- Baje lentamente la muestra en el glicerol. Suavemente mueva la pinza a medida que los saca de debajo de la muestra.
- Repita los pasos 6.1-6.3 para el otro espécimen.
- Mover la tarjeta a fin de que el lado más largo es perpendicular a su cuerpo. Mantenga la cubierta de vidrio a un ángulo de 45 ° a la diapositiva de modo que está en contacto con la diapositiva. Se mueven hacia el frotis de glicerina hasta que se toquen. Mantener el contacto entre la cubierta de vidrio y de diapositivas, mueva lentamente la tapa de vidrio lejos de la mancha, hacia el borde de la diapositiva. Alinee los lados largos de la diapositiva y la cubierta de vidrio para que sean paralelas. Mantenga las esquinas de la cubierta de vidrio entre los dedos pulgar e índice.
- Recoge el 15 ° en fórceps la otra mano. Cuna de la parte superior (gratuito) borde de la cubierta de cristal en la parte interior del brazo. Muy lentamente, baje la tapa de vidrio. Cuando se hace el contacto entre la cubierta de vidrio y el glicerol, parar y esperar a que el glicerol a emigrar. Repita este descenso y esperar hasta que el conjunto se monta RPE están completamente cubiertos. Esto es para prevenir el glicerol de alta viscosidad de la captura de burbujas de aire. NO empuje hacia abajo en el cubre - el glicerol se exprima debajo de él, haciendo una adherencia muy pobre.
- Con esmalte transparente de uñas, pintura de todo el perímetro donde el cristal de la cubierta y deslice cumplir.
- Colocar la placa en la parte superior de un estante vacío que se seque.
7. Los resultados representativos:
El resultado de este procedimiento debe ser una estructura que se parece a una flor y debe ser bastante simétricas.

Figura 1. Todo RPE montaje de un ratón de tipo salvaje C67Bl/6J. RPE de color negro o agouti animales debe ser de color marrón oscuro y debe tener una superficie lisa. Es normal observar ondulaciones en la topografía de los pétalos. La pigmentación en cualquier muestra de dar puede ser algo variable, debido a la densidad variable de pigmentación tanto de la EPR y la coroides subyacente. Las flechas blancas señalan hipopigmentadas "canales" - esto es normal y es debido a la vascularización subyacente del ojo. Puntos de flecha azul a los daños físicos tanto a la EPR y la coroides subyacente.

Figura 2. Todo RPE montaje de un ratón diluido. Muestras recolectadas de animales diluidos puede variar en color de casi transparente a café con leche y cualquier espécimen es como tener la variabilidad dentro de ella, se indica en los círculos negro aquí. En general, RPE cosecha de los animales más jóvenes son más ligeros y los cosechados de los animales más viejos son más oscuras. Flechas de color negro indican algunos de los vasos subyacentes, que aparece hipopigmentadas.
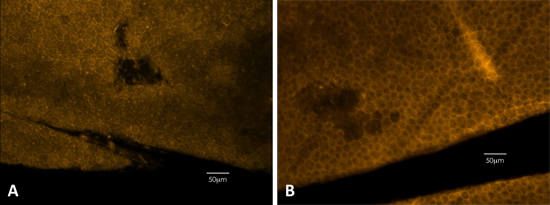
Figura 3. Tinción phalloidin se puede utilizar para detectar daños físicos a la RPE. Tinción faloidina define claramente las membranas celulares, mostrando la forma hexagonal del epitelio. (A) Ejemplo de un ratón negro. (B) Ejemplo de un ratón diluido.
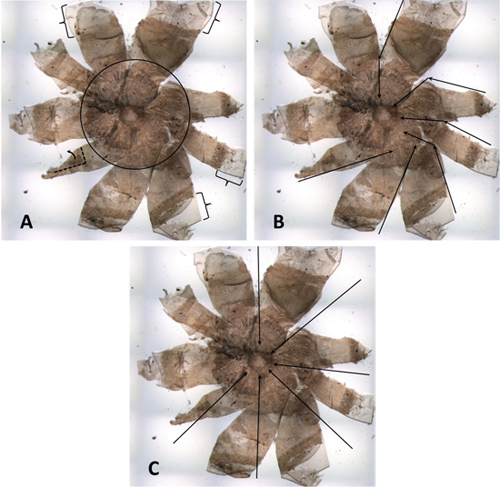
Figura 4. Un RPE mal disecado de un ratón diluido. (A) Los corchetes indican los márgenes de la córnea que son demasiado grandes, que pueden causar la deformación y / o plegables. Dentro del círculo negro se puede ver una cantidad excesiva de tejido extraño que no se han retirado de la parte posterior del ojo. Son particularmente evidente, porque la muestra es de un animal diluido. El pétalo de abajo a la izquierda está parcialmente doblada. (B) Este monte se tiene la apariencia de un molinillo de viento. Flechas de color negro indican algunos de los cortes que se hicieron. Muchos de los cortes de la brecha corneo-escleral hacia la cabeza del nervio óptico no están en línea con el diámetro. (C) flechas Negro indican cómo los recortes que se han hecho, de acuerdo con el diámetro y la perpendicular a la tangente.
Discusión
El EPR es el sitio de la prueba de p de la ONU, un ensayo in vivo de la homología dirigida reparación. El ensayo de p de la ONU ha sido utilizado para estudiar los efectos de los daños del ADN diferentes 1,2 y señalización daño en el ADN y los genes de reparación 3,4,5 de la frecuencia de homología dirigida reparación. Este ensayo es muy sensible, la detección de una sola célula eventos en el RPE 1. También puede detectar difer...
Divulgaciones
Agradecimientos
Este trabajo fue apoyado por el Instituto Nacional de Ciencias de Salud Ambiental [K22ES012264 a AJRB] y una Sociedad Americana del Cáncer InstitutionalResearch Grant [ACS-IRG-00-173-04] piloto projectaward [a AJRB]. También queremos agradecer a los miembros del laboratorio de obispo para la lectura crítica del manuscrito y comentarios sobre el vídeo y Brown Adán, en particular, por el ejemplo de qué no hacer. Agradecemos al Dr. Donald McEwen del Cáncer del Instituto de Investigación de Niños Greehey por permitirnos el uso de su microscopio de disección / cámara de video puesta a punto para el rodaje del vídeo de la disección. Damos las gracias a Daron Brown en Instrumentos Corte para el afilado y reparación de nuestras herramientas de microdisección.
Materiales
| Name | Company | Catalog Number | Comments |
| straight forceps | Roboz Surgical Instruments Co. | RS-4903 | tip: .08 x .04 mm material: INOX |
| 45° forceps | Roboz Surgical Instruments Co. | RS-5005 | tip: .05 x.01 mm material: INOX |
| 15° "up" forceps | Roboz Surgical Instruments Co. | RS-5045A | tip: .1 x.06 mm material: INOX |
| spring scissors | Roboz Surgical Instruments Co. | RS-5604 | comb. tip width 0.3mm cutting edge length 3mm material: stainless steel |
| binocular dissecting microscope | Carl Zeiss, Inc. | Discovery V.8 | use reflected light source |
| phalloidin | Invitrogen | A22283 | Alexa Fluor 546 |
Referencias
- Bishop, A. J., Kosaras, B., Sidman, R. L., Scheistl, R. H. Benzo(a)pyrene andX-rays induce reversions of the pink-eyed unstable mutation in the retinal pigmentepithelium of mice. Mutat. Res.. 457, 31-31 (2000).
- Reliene, R. H. l. a. v. a. c. o. v. e., Mahadevan, A., Baird, B., M, W., Schiestl, R. H. Diesel exhaust particles cause increased levels of DNA deletions after transplacental exposure in mice. Mutat. Res. 570, 245-2452 (2005).
- Bishop, A. J., Barlow, C., Wynshaw-Boris, A. J., Scheistl, R. H. Atm deficiency causes increased frequency of intrachromosomal homologous recombination in mice. Cancer Res. 60, 395-399 (2000).
- Brown, A. D., Claybon, A. B., Bishop, A. J. Mouse WRN helicase domain is not required for spontaneous homologous recombination-mediated DNA deletion. J. Nucleic Acids. , (2010).
- Claybon, A., Karia, B., Bruce, C., Bishop, A. J. PARP1 suppresses homologous recombination events in mice in vivo. Nucleic Acids Res. , (2010).
- Bishop, A. J. p53-, and Gadd45a-deficient mice show an increased frequency ofhomologous recombination at different stages during development. Cancer Res. 63, 5335-5343 (2003).
- Bodenstein, L., Sidman, R. L. Growth and development of the mouse retinalpigment epithelium. Part I. Cell and tissue morphometrics and topography of mitoticactivity. Dev Biol. 121, 192-204 (1987).
- Burke, J. M. Epithelial phenotype and the RPE: is the answer blowing in the Wnt?. Prog Retin. Eye Res. 27, 579-595 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados