Method Article
Haz de iones enfocado fresado y microscopía electrónica de barrido en el tejido cerebral
En este artículo
Resumen
Este protocolo describe cómo resina incrustada tejido cerebral puede ser preparado y fotografiado en las tres dimensiones en el haz de iones enfocado, microscopio electrónico de barrido.
Resumen
Este protocolo describe cómo las muestras biológicas, como el tejido cerebral, se pueden obtener imágenes en tres dimensiones utilizando el ion del haz enfocado / microscopio electrónico de barrido (FIB / SEM). Las muestras se fijarán con aldehídos, teñido de metales pesados usando tetróxido de osmio y el acetato de uranilo. Luego se deshidrata con alcohol y se infiltró con resina, que luego se endureció. Utilizando un microscopio de luz y ultramicrotomo con cuchillas de vidrio, un pequeño bloque que contiene la región de interés cerca de la superficie se hace. El bloque se coloca dentro de la FIB / SEM, y el haz de iones utilizado para aproximadamente un molino vertical de la cara en un lado de la cuadra, cerca de esta región. Utilizando electrones retrodispersados a la imagen de las estructuras subyacentes, una cara más pequeña se muele con un fino haz de iones y la superficie de analizarse con más detenimiento para determinar el área exacta de la cara para ser fotografiada y se muele. Los parámetros del microscopio se ajustarán de manera que la cara es repetidamente molida y la imagen para que las imágenes de serie se recogen a través de un volumen del bloque. La pila de imágenes típicamente contienen vóxeles isotrópicos con dimensiones tan pequeñas un 4 nm en cada dirección. Esta calidad de imagen en cualquier plano de la imagen permite al usuario analizar ultraestructura celular en cualquier ángulo de visión dentro de la pila de la imagen.
Protocolo
1. Ejemplo de fijación e inclusión de resina
- Las muestras de tejido fresco y las células se fijan por lo menos 2 horas en 2% de paraformaldehído y glutaraldehído al 2,5% en tampón fosfato 0,1 M a un pH de 7,4. El tamaño de la muestra no debe exceder de 0,150 mm de espesor para permitir la penetración adecuada o fijador, y no debe ser dejado en la solución para más de 12 horas.
- Colocar las muestras en viales de cristal de centelleo de 20 ml y enjuagar tres veces, 5 minutos cada uno, en 0,1 M tampón cacodilato.
- Mancha con un 1,5% (w / v) de tetróxido de osmio ferrocianuro de potasio y el 1% (w / v) en tampón cacodilato 0,1 M (0,1 M, pH 7,4) durante 30 minutos.
- Tinción con tetróxido de osmio al 1,0% (w / v) en tampón cacodilato 0,1 M durante 30 minutos.
- Enjuague inmediatamente con agua destilada durante 3 minutos.
- Mancha con un 1% (w / v) de acetato de uranilo en agua destilada durante 30 minutos.
- Enjuague las secciones de 5 minutos en agua destilada, y luego deshidratar alcohol en serie gradual, a 2 minutos de cada cambio (1 x 50%, 1 x 70%, 1 x 90%, 1 x 95%, 2 x 100%).
- Insertar en el aumento de las concentraciones de resina Durcupan mezclada con etanol, a 30 minutos de cada cambio, a partir de 50% Durcupan en etanol, a continuación, seguido de: 70%, 90%, 95%, y luego el 100%.
- Reemplazar con Durcupan fresco y agitar lentamente durante 4 horas.
- Secciones lugar, usando palos de madera de cóctel, en los microscopios portaobjetos de vidrio recubierto con un agente de separación del molde, y colocar en horno de 65 ° C durante 24 horas.
2. Preparación de la muestra para el FIB / SEM
- Separar la capa de resina, que contienen las muestras, de entre los dos portaobjetos de vidrio y lavar a fondo para eliminar cualquier agente de separación del molde.
- Utilizando un microscopio de luz transmitida con los objetivos de baja potencia, o microscopio de disección con iluminación transmitida, para identificar la región de interés en el trozo de resina.
- Corte un pequeño (3 mm x 3 mm) cuadrado alrededor de la región de interés, utilizando una hoja de afeitar y el palo esta en la parte superior del bloque de resina blanco con adhesivo acrílico (Figura 1). Espere 5 minutos para que el pegamento se endurece, y luego proceder con el siguiente paso.
- Sujete el bloque en el titular de la ulramicrotome y, usando el microscopio estereoscópico adjunta, recorte alrededor de la región de interés con una cuchilla de afeitar hasta que sólo una pequeña pirámide de los restos materiales.
- Más acabado del bloque, con un cuchillo de cristal fijo en el ultramicrotomo, de modo que la región de interés puede ser localizado con precisión en relación con las dimensiones de la superficie del bloque (Figura 1). Cortar un extremo de la cuadra, cerca de la región de interés, de modo que un paso perpendicular se corta a través de la muestra (Figura 1 y 2). Este paso forma la cara de imagen (Figura 2).
- Retire el bloque de la ultramicrotomo y fotografiar la región de interés dentro del bloque, utilizando un microscopio de luz transmitida.
- Cortar la manzana recortada desde el talón de resina restante. Esto se hace mediante el uso de sierra de joyero y asegura que sólo un pequeño bloque se coloca dentro de la FIB / SEM. La altura total de este bloque no debe ser superior a 5 mm.
- Pegue el bloque a un trozo de aluminio con pasta de carbono asegurar que la cara de imágenes se encuentra en el borde exterior (Figura 1).
- Después de que el pegamento se haya secado, cubra el bloque con una fina capa de oro (> 20 nm; vacío Cressington sistema de evaporación).
3. Imagen en el FIB / SEM
- Con un aumento bajo, y el uso de imágenes de electrones secundarios (5 kV, 0,5 NAMP), oriente el bloque para que la zona elegida de interés y el lado de la manzana para obtener imágenes que se enfrenta el operador (Figura 2 c, d).
- Orientar el bloque de manera que la cara que se encuentra reflejado en paralelo a la viga de la molienda. Esto significa que un haz de electrones se orienta a 54 ° de esta cara (Figura 2 b).
- El uso de un haz de iones actual de 13 a 27 NAMPS a 30 kV eliminar una banda estrecha de la resina de la parte frontal de la región a explorar.
- Cambiar al modo de imágenes de retrodispersión para ver la cara molida que cubre la región de interés.
- Utilizando la imagen de microscopía de luz de referencia (tomada en el paso 16) y la imagen de la cara molida localizar la región exacta en el bloque de fresado y la imagen (Figura 2).
- Depositar una capa de protección (aproximadamente 1 micra de espesor) de carbono (o metal), mediante el sistema de inyección de gas del microscopio, en la superficie del bloque, por encima de la región de interés (Figura 2).
- Utilizando una corriente de 700 picoamperios, el molino fino de la región del bloque en el que las imágenes finales que se adopten.
- Deja el haz de molienda por completo fábrica de esta cara de la imagen hasta que no haya artefactos de molienda se puede ver en la cara. Una planta completa de la cara está marcada por la observación de cambios en cada imagen posterior en todo el campo de visión. Molienda inadecuada también puede verse como rayas blancas o "cortinas" que aparecen vertically en la imagen.
- Dejar el microscopio por lo menos de 2 horas para que los cambios térmicos a disiparse. Esto reduce el riesgo de que la cara del bloque a la deriva durante la exploración, lo que resulta en imágenes desalineadas.
- Seleccionar los parámetros de microscopio para obtener imágenes de la cara de serie. Asegúrese de que el haz de electrones tiene una tensión que es lo suficientemente bajo como para la imagen sólo muy poca profundidad de material en la cara del bloque. Esto también debería ser mucho menos profundo que el espesor de la cara para ser eliminado. Los parámetros típicos de imágenes son los voltajes de entre 1,2 a 2,0 kV con un tamaño de pixel de entre 4 a 20 nm. El píxel habitan necesita tiempo para mantenerse en torno al 10 μsecs para que el tiempo total para la cara y el molino de adquirir una imagen se mantiene por debajo de 2 minutos (Figura 3).
4. Secretos para el éxito
Paso 1) Asegúrese de que las muestras no son más gruesas de 150 micrones. Esto permitirá una adecuada penetración de las manchas de diferentes y de la resina en el material. Esto se puede lograr por la sección de la muestra con un vibratome inmediatamente después de la fijación. Este espesor es apropiada para el tejido cerebral. Otros tejidos deben ser probados para asegurar una adecuada fijación y tinción.
Paso 3) Las muestras deberán ser distribuido libremente a través de la solución, y no agrupadas en una parte del vial, mientras que el fijador de secundaria se introduce. Esto asegurará la máxima penetración de la muestra y reducir la muestra se distorsione durante este proceso de fijación. Esto se logra girando suavemente las muestras en el frasco inmediatamente después de la disolución se añade.
Paso 15) Asegúrese de que la región de interés se encuentra inmediatamente por debajo (<30 micras) de la superficie del bloque. Esto reducirá la cantidad de molienda por el haz de iones en la fase de adquisición de imágenes.
Paso 22) El tiempo de escaneo del haz de iones debe ser adequte para asegurarse de que la cara de imágenes todo es completamente molido. Molienda inadecuada se muestra como manchas blancas, o de "cortinas" que aparece verticalmente en la cara de imagen.
Paso 26) La cara final molida debe ser mayor que la cara que se va a examinar. Esto se debe a la resina molida es expulsada del bloque y redepósitos en la superficie del bloque en las inmediaciones. Este redeposición puede invadir en el campo de la imagen de vista, y se evita el fresado de una zona mucho más grande que se forma la imagen. Para una ventana de imagen que es de 20 micrones de ancho, la cara del bloque molido es mayor de 30 micrones de ancho.
Paso 29) Es fundamental que los parámetros del haz de electrones son tales que la imagen es generada por electrones que se desprenden únicamente de los primeros nanómetros de la superficie del bloque. Este es un acheved reduciendo al mínimo la tensión por debajo de 2 kV y asegurar que no hay electrones penetran demasiado lejos. Esto también es ayudado por el uso de una tensión de red en el detector de manera que sólo los electrones con las más altas energías contribuyen a la imagen final. Por lo general, una tensión de 1,3 kV red se utiliza para una tensión de imagen de 1,5 kV.
5. Los resultados representativos:

Figura 1. Preparación del bloque de resina. Una resina) incrustado sección coronal (80 micras de espesor) a través de un cerebro de rata adulta se ve en un steromicroscope. La imagen muestra claramente las regiones cerebrales diferentes que pueden ser cortadas de la sección (b) utilizando una hoja de bisturí. En este caso, un cuadrado de 1 mm de la corteza se extrae y (c) pegado a un bloque de resina en blanco. D) El bloque de resina se recorta con un cuchillo de vidrio montada en un ultramicrótomo, y una vez que el bloque se ha reducido para dejar sólo la región de interés (e), un paso se corta perpendicularmente a la superficie frontal del material incluido. f) Toda esta región recortada se corta del resto de la resina y montado sobre un trozo de aluminio listo para el recubrimiento de metal y de imagen en el microscopio electrónico de barrido.

Figura 2. Preparación de la cara del bloque de la FIB / SEM de imágenes. A) yb) muestran ilustraciones del bloque y el borde que se muele para crear la imagen de la cara (se indica con el color negro con dos puntas de flecha). La posición del haz de iones (blanco) se muestra paralela a la cara de imágenes, y el haz de electrones (gris) se muestra golpear la cara a 54 ° para el haz de iones. C) muestra una vista del bloque tomadas con el haz de electrones y la imagen con los electrones secundarios. A lo largo de este lado del bloque de una región más oscura (indicado con caja blanca punteada) muestra una parte de la cara que ha sido más o menos elaborado (se muestra con doble cabezaed negro flecha) para revelar la muestra de base. d) Cuando esta región se crea una imagen usando sólo los electrones retrodispersados el tejido embebido puede ser visto. Aquí, todo el ancho de la sección de tejido embebido se indica con una flecha doble cabeza blanca. Barra de escala en c) es de 100 micras.
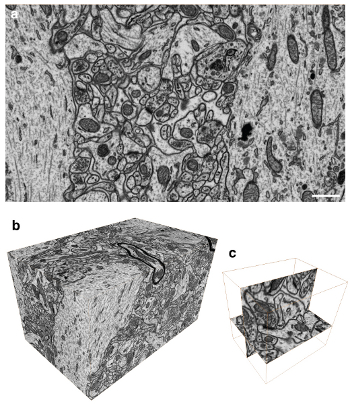
Figura 3. Imágenes del volumen de tejido cerebral con vóxeles isotrópicos. A) invertido de contraste de imagen de retrodispersión de la cara de bloques que muestra la ultraestructura de una región del cerebro de rata. Todas las membranas son visibles, así como grandes estructuras macromoleculares. B) Un total de 1.600 imágenes se recogieron a intervalos de 5 nm resultando en una pila de imágenes con vóxeles isotrópicos. C) Esta pila se pueden obtener imágenes en cualquier plano con la misma resolución. Esta imagen muestra única conexión sináptica que es imaginada en el plano xy y el plano yz.
Discusión
La técnica de la FIB / SEM funciona de manera óptima cuando la región de interés no es demasiado grande. El límite superior de un volumen de imágenes depende del haz de iones y el área que puede consistentemente molino en repetidas ocasiones durante muchas horas. Hasta ahora esto se ha hecho con las zonas de alrededor de 60 x 60 micrones, sin embargo, imágenes de toda esta zona no es posible con una resolución de imagen adecuada, debido principalmente a que el factor tiempo en la recogida de una imagen tan grande. A modo de ejemplo, una imagen de 4 kx 4 k con un píxel de tiempo de permanencia de 10 microsegundos tomaría 2 minutos y 40 segundos para adquirir, y por un campo de visión de 60 micras esto sólo daría un tamaño de pixel de 15 nm. Para obtener imágenes de la ultraestructura de células y tejidos, un tamaño de píxel más pequeño es más adecuado, por lo general entre 4 y 10 nm / pixel. Para una superficie de 60 x 60 micrones de la imagen se adquirió en 10 horas, aunque el microscopio tenido esta capacidad. Por estas razones, el microscopio es una herramienta ideal para los volúmenes de imágenes en el orden de 10 x 10 x 10 micrones, o regiones importantes de células enteras. Esto se puede hacer fácilmente dentro de un período de 48 horas en las muestras que están bien contrastados con este procedimiento.
Hasta ahora, el protocolo se ha utilizado principalmente con el tejido cerebral, así como varios tipos de células de mamífero cultivadas adherirse a cubreobjetos. Sin embargo, el procedimiento de fijación y la tinción se puede utilizar con muchos otros tipos de material biológico, incluido el material vegetal para producir igual de bien contrastada montones de imágenes.
Por lo tanto, la principal ventaja de esta técnica es su capacidad para volúmenes de imágenes con vóxeles isotrópicos. Las pilas de la imagen de este tipo permiten análisis del volumen en 3D usando imágenes tomadas en cualquier plano de la pila. La ventaja de esto es permitir que el observador a las características de la imagen en la serie de imágenes desde cualquier dirección y proporcionar un mayor detalles de la imagen (Figura 3).
Divulgaciones
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| Pegamento de cianoacrilato | |||
| Microscopio de disección: Leica MZ8 | Leica Microsystems, Alemania | ||
| Durcupan resina | Sigma-Aldrich Chemie GmbH, Suiza | ||
| FIB / SEM microscopio (Zeiss, Nvision 40) | |||
| Histología diapositivas de vidrio | Menzel-Gläser, Alemania | AA00008032E | |
| Fabricante de vidrio cuchillo: Leica EM KMR2 | Leica Microsystems, Alemania | ||
| Viales de centelleo de vidrio (20 ml) | EMS, EE.UU. | 72634 | |
| Glutaraldehído | EMS, EE.UU. | 16222 | |
| Joyero vio | EMS, EE.UU. | 72010 | |
| Agente de separación del molde | Glorex, Suiza | 62407445 | |
| Tetróxido de osmio | EMS, EE.UU. | 19110 | |
| Paraformaldehído | EMS, EE.UU. | RT 19208 | |
| Sales de fosfato de tampón fosfato | Sigma-Aldrich Chemie GmbH, Suiza | 71642 y 71496 | |
| Cacodilato de sodio | Sigma-Aldrich Chemie GmbH, Suiza | 20840 | |
| Sputter Coater con el objetivo de oro | Cressington, EE.UU. | ||
| Tris base (TBS) | Sigma-Aldrich Chemie GmbH, Suiza | T1378 | |
| Ultramicrotomo: Leica UCT | Leica Microsystems, Alemania | ||
| Acetato de uranilo | EMS, EE.UU. | RT 22451 |
Referencias
- Knott, G., Marchman, H., Wall, D., Lich, B. Serial section scanning electron microscopy of adult brain tissue using focused ion beam milling. J Neurosci. 28, 2959-2964 (2008).
- Hekking, L. H., Lebbink, M. N., De Winter, D. A., Schneijdenberg, C. T. Focused ion beam-scanning electron microscope: exploring large volumes of atherosclerotic tissue. J Microsc. 235, 336-347 (2009).
- Armer, H. E., Mariggi, G., Png, K. M., Genoud, C. Imaging transient blood vessel fusion events in zebrafish by correlative volume electron microscopy. PLoS One. 4, e7716-e7716 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoExplorar más artículos
This article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados