Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
El estudio de las trayectorias celular Rolling en los patrones del receptor asimétrica
En este artículo
Resumen
Se describe un protocolo para observar y analizar las trayectorias de células rodando por patrones asimétricos receptor de sustratos. Los datos resultantes son útiles para la ingeniería de patrones receptor sustratos para etiquetas sin separación celular y el análisis.
Resumen
El desplazamiento lateral de las células ortogonal a una corriente de flujo moviendo en los patrones de los receptores asimétrica presenta una oportunidad para el desarrollo de nuevos dispositivos para el sello libre de separación y análisis de las células 1. Estos dispositivos pueden usar el desplazamiento lateral de separación de flujo continuo, o los patrones de los receptores que modulan la adhesión para distinguir entre fenotipos de células diferentes o niveles de expresión del receptor. Comprender la naturaleza de las trayectorias de células rodando por los receptores de dibujos sustratos es necesario para la ingeniería de los soportes y el diseño de estos dispositivos.
Este sentido, demuestran un protocolo para el estudio de las trayectorias de células rodando por los patrones asimétricos que el apoyo de los receptores de adhesión celular móvil 2. Bien definida, m escala los patrones de P-selectina receptores fueron fabricados utilizando impresión por microcontacto en oro revestida de diapositivas que se han incorporado en una cámara de flujo. HL60 células que expresan el ligando PSGL-1 3 se fluyó a través de un campo de las líneas de estampado y se visualizaron en un microscopio de campo claro invertida. Las células laminadas y seguimiento a lo largo de los bordes inclinados de los patrones, lo que resulta en una desviación lateral. Cada celda generalmente rodó a una cierta distancia a lo largo de los bordes del patrón (definido como la duración de seguimiento de borde), separado de la orilla, y volver a colocar a un patrón descendente. A pesar de esta separación hace que sea difícil de rastrear toda la trayectoria de una célula de entrada a la salida de la cámara de flujo, las partículas de seguimiento de software se utilizó para analizar el rendimiento y las trayectorias de rodadura de las células durante el tiempo en que se movían en un solo receptor con dibujos de línea. Las trayectorias fueron examinados para obtener distribuciones de las velocidades de balanceo de células y la longitud de borde de rastreo para cada celda de diferentes modelos.
Este protocolo es útil para la cuantificación de las trayectorias de células rodando en los patrones de los receptores y sobre estos parámetros de ingeniería tales como el ángulo de patrones y esfuerzo cortante. Estos datos serán útiles para el diseño de dispositivos de microfluídica para el sello libre de separación celular y el análisis.
Protocolo
1. HL60 celular móvil
1.1. Fabricación de sustratos con dibujos.
- Utilizando impresión por microcontacto (μCP) 4-7 para alternar las monocapas autoensambladas (SAMs) de las moléculas de PEG en el portaobjetos de vidrio recubierto de oro: Fabricar microcontacto impresión polidimetilsiloxano (PDMS) sellos que definen los patrones del receptor con un ángulo de inclinación de α = 10 ° por un SU-8 proceso de moldeo. Limpie la superficie de oro con una solución de pirañas (3:1 mezcla de ácido sulfúrico al 30% de peróxido de hidrógeno) durante 20 minutos y luego enjuague la superficie con abundante agua DI a 24,5 ° C antes de su uso. El sello de tinta con una solución de PEG PDMS 5 mM en etanol. El sello seco en el aire durante 20 minutos. Suavemente ponga el sello en la superficie del oro durante 40 segundos y asegúrese de que haya un buen contacto entre la superficie del oro y el sello. No hay un exceso de presión es necesaria. Enjuague la superficie con etanol y se seca bajo una corriente de N 2.
- Incubar el sustrato dentro de la P-selectina solución (15 mg / ml en DPBS), utilizando una cámara de perfusión (Microscopía Electrónica de Ciencias) durante 3 horas a 24,5 ° C al patrón de las áreas restantes con la P-selectina. Enjuague la superficie con abundante DPBS.
- El relleno de la superficie con BSA (1 mg / ml en DPBS) durante 1 h para bloquear interacciones no específicas. Enjuague la superficie con abundante DPBS.
1.2. Los experimentos en células Rolling una cámara de flujo.
- El flujo de una suspensión de células HL60 (~ 10 5 células / ml) sobre las superficies estampadas en una cámara de flujo rectangular (Glycotech, Inc; ancho w = 1,0 cm, longitud = 6 cm, la altura h = 0.0127 cm) a 24,5 ° C. Use una bomba de jeringa (Instrumentos del Mundo de precisión, SP230IW) para generar el caudal de 75 l / min, correspondiente a la tensión de corte en torno al 0,5 dinas / cm 2 (~ 0,05 Pa). Calcule el esfuerzo cortante τ mediante el uso de la ecuación del plano de Poiseuille flujo de τ = 6μQ/wh 2, donde μ es la viscosidad cinemática (0,001002 Pa s), Q es el caudal volumétrico, w es el ancho de la cámara de flujo, y h es la altura de la cámara de flujo.
- El uso de un microscopio invertido (Nikon TE2000-U) con una cámara montada (Andor ixon 885) para registrar las células HL60 rodar interacciones con adhesivo P-selectina sustratos con un 4 × objetivo, por lo general a un ritmo de 1 fotograma por segundo para una duración de 300 s. Realizar tres experimentos independientes para cada magnitud esfuerzo cortante y el ángulo de inclinación del patrón. Presentar los datos como media y desviación estándar de los valores promedio obtenidos en cada experimento.
- Análisis de datos.
Analizar las secuencias de imágenes de una medida Matlab (The Mathworks, Inc.) que utilizó un programa de rastreo de partículas gratuito de 8 a generar pistas a lo largo de los bordes con patrones. Las pistas se extiende hasta el final de una banda de P-selectina se seleccionan y se dispone de dos segmentos de línea recta - que está alineada con el flujo y el otro alineado con el borde del patrón. Estos dos segmentos se utilizan para calcular la longitud de borde de seguimiento, poniendo la velocidad en el borde, y la velocidad de balanceo en la región de llanura.
2. Los resultados representativos:
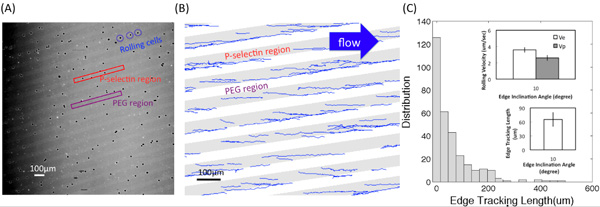
La figura (A) muestra una de las imágenes del microscopio convertido en el vídeo de HL60 interacciones de laminación con adhesivo P-selectina sustratos utilizando un objetivo × 4. Regiones brillantes y oscuras corresponden a P-selectina receptor y regiones PEG, respectivamente. Figura (B) muestra las pistas obtenidas mediante un programa personalizado de Matlab. El ángulo de inclinación ventaja fue de 10 ° y el esfuerzo de corte fue de 0,5 dinas / cm 2. La longitud de seguimiento de borde, l e, el desplazamiento, d, y las velocidades de balanceo en el borde y dentro de las bandas, V E y P V, respectivamente, se describen en la figura (C-1). Figura (C-2) muestra la distribución (el número de células registradas) de longitud de la arista de seguimiento. El recuadro muestra el valor promedio de l e y la velocidad de rotación en el borde (V e) y dentro de las bandas (V p) en el ángulo de inclinación α = 10 ° y la magnitud de líquido esfuerzo de corte en torno al 0,5 dinas / cm 2. Las barras de error representan la desviación estándar, donde n = 3 replicar los experimentos (3 superficies de réplica) para cada condición.
Discusión
Se ha descrito un protocolo para examinar células trayectorias rodando por patrones asimétricos receptor de las superficies fabricadas con impresión por microcontacto 2. Las imágenes de microscopio óptico de la superficie de estampado que muestra un claro contraste entre el PEG y áreas de P-selectina se puede utilizar para confirmar si es sellado con éxito. Los bordes afilados, directamente se puede observar cuando el sellado se realiza bien. Presionando duro de la marca puede dar lugar a la deformaci?...
Divulgaciones
Agradecimientos
Este proyecto fue apoyado por el Centro de Innovación Tecnológica Deshpande en el MIT (RK y JMK) y el premio CARRERA NSF 0952493 de RK a través del programa de Química y Biológica de separaciones. Damos las gracias al Instituto de Nanotecnologías Soldado (ISN) y el Laboratorio de Tecnología de Microsistemas (MTL) en el MIT para el uso de sus instalaciones.
Materiales
| Name | Company | Catalog Number | Comments |
| Human promyelocytic leukemia cells | ATCC | CCL-240 | HL60 cells |
| Gold-coated glass slides | EMF | TA134 | Gold slides |
| (1-Mercaptoundec-11-yl)tetra(ethylene glycol) | Sigma-Aldrich | 674508 | PEG |
| Recombinant human P-selectin | R&D Systems | ADP3-050 | P-selectin |
| Bovine serum albumin | Rockland Immunochemicals | BSA-50 | BSA |
| Dulbecco’s phosphate buffered saline | Mediatech, Inc. | 21-030 | DPBS |
| Sulfuric acid | Sigma-Aldrich | 339741 | |
| Hydrogen peroxide | Sigma-Aldrich | 316989 |
Referencias
- Karnik, R., Hong, S., Zhang, H., Mei, Y., Anderson, D. G., Karp, J. M., Langer, R. Nanomechanical control of cell rolling in two dimensions through surface Patterning of receptors. Nano Lett. 8 (4), 1153-1158 (2008).
- Lee, C. H., Bose, S., Van Vliet, K. J., Karp, J. M., Karnik, R. Examining Lateral Displacement of HL60 Cells Rolling on Asymmetric P-selectin Patterns. Langmuir. 27 (1), 240-249 (2011).
- Norman, K. E., Moore, K. L., McEver, R. P., Ley, K. Leukocyte rolling in-vivo is mediated by p-selectin glycoprotein ligand-1. Blood. 86 (12), 4417-4421 (1995).
- Bernard, A., Delamarche, E., Schmid, H., Michel, B., Bosshard, H. R., Biebuyck, H. Printing patterns of proteins. Langmuir. 14 (9), 2225-2229 (1998).
- James, C. D., Davis, R. C., Kam, L., Craighead, H. G., Isaacson, M., Turner, J. N., Shain, W. Patterned protein layers on solid substrates by thin stamp microcontact printing. Langmuir. 14 (4), 741-744 (1998).
- Mrksich, M., Whitesides, G. M. Using self-assembled monolayers to understand the interactions of man-made surfaces with proteins and cells. Annual Review of Biophysics and Biomolecular Structure. 25, 55-78 (1996).
- Tan, J. L., Tien, J., Chen, C. S. Microcontact printing of proteins on mixed self-assembled monolayers. Langmuir. 18 (2), 519-523 (2002).
- Lee, D., King, M. R. Microcontact Printing of P-Selectin Increases the Rate of Neutrophil Recruitment Under Shear Flow. Biotechnology Progress. 24 (5), 1052-1059 .
- Greenberg, A. W., Hammer, D. A. Cell separation mediated by differential rolling adhesion. Biotechnol. Bioeng. 73 (2), 111-124 (2001).
- Higuchi, A., Tsukamoto, Y. Cell separation of hepatocytes and fibroblasts through surface-modified polyurethane membranes. J. Biomed. Mater. Res. Part A. 71A (3), 470-479 (2004).
- Alexeev, A., Verberg, R., Balazs, A. C. Patterned surfaces segregate compliant microcapsules. Langmuir. 23 (3), 983-987 (2007).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados