Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La ingeniería biológica basada en los injertos vasculares El uso de un biorreactor pulsátil
En este artículo
Resumen
Nuestro grupo ha desarrollado un sistema de cultivo bio-reactor que imita el estrés pulsátil fisiológicos del sistema cardiovascular para regenerar implantables de pequeño diámetro injertos vasculares.
Resumen
Mucho esfuerzo se ha dedicado a desarrollar y fomentar la metodología de regeneración funcional de pequeño diámetro arterial pasa por alto. En el medio fisiológico, tanto la estimulación mecánica y química están obligados a mantener el adecuado desarrollo y la funcionalidad de 1,2 vasos arteriales.
Sistemas de biorreactor de la cultura desarrollada por nuestro grupo están diseñados para apoyar la regeneración de vasos dentro de un control preciso quimio-mecánica entorno imitando la de los vasos nativos. Nuestra asamblea biorreactor y procedimientos de mantenimiento son bastante simples y altamente repetible 3,4. Las células musculares lisas (SMC) se siembran en un ácido poliglicólico tubular (PGA) de malla que se coloca en un tubo de silicona compatible y cultivadas en el biorreactor con o sin estimulación pulsátil de hasta 12 semanas. Hay cuatro características principales que distinguen a nuestro biorreactor de algunos predecesores. 1) A diferencia de otros sistemas de cultivo que simulan sólo la bioquímica de los vasos sanguíneos circundantes nativo, nuestro biorreactor también crea un ambiente pulsátil fisiológico mediante la aplicación de la tensión radial cíclico de los vasos en la cultura. 2) Varios barcos de ingeniería pueden ser cultivadas simultáneamente bajo diferentes condiciones mecánicas en un entorno químicas controladas. 3) El biorreactor permite una monocapa de células endoteliales (CE) para ser fácilmente cubierta en el lado luminal de los vasos diseñados para los modelos de implantación de los animales. 4) El biorreactor puede recipientes de cultivo diseñado con un tamaño diferente diámetro osciló entre 1 mm y 3 mm, ahorrando el esfuerzo de adaptar cada biorreactor individuales para ajustarse a un tamaño de diámetro específico.
Los vasos de ingeniería cultivadas en nuestro biorreactor se asemejan a los vasos nativos sangre histológicamente en algún grado. Las células de la pared de los vasos maduros expresan marcadores de SMC contráctiles del músculo liso, como la cadena pesada de miosina (SMMHC) 3. Una cantidad sustancial de colágeno se deposita dentro de la matriz extracelular, que es responsable de la resistencia a la rotura mecánica de los vasos de ingeniería 5. El análisis bioquímico también indica que el contenido de colágeno de los vasos de ingeniería es comparable a la de las arterias nativas 6. Es importante destacar que el biorreactor pulsátil siempre ha regenerado los vasos que muestran propiedades mecánicas que permiten la implantación de experiencias exitosas en modelos animales 3,7. Además, este biorreactor se pueden modificar para permitir la evaluación en tiempo real y el seguimiento de la remodelación del colágeno a través del tiempo, de forma no invasiva, utilizando un microscopio óptico no lineal (NLOM) 8. Para concluir, este biorreactor debe servir como una plataforma excelente para el estudio de los mecanismos fundamentales que regulan la regeneración funcional de pequeño diámetro injertos vasculares.
Protocolo
Autoclave
Ensamble y autoclave los tubos del sistema de caudal y componentes bio-reactor (biorreactor sí mismo y la tapa de silicona tapón) como se indica en la Figura 1 y Figura 2. Alimentación por sonda tiene un conector macho en un extremo y un extremo abierto en el otro lado. Tres segmentos de tubo corto se inserta a través de una gorra de silicona para el intercambio de gases.
1. Coser PGA Mesh
- Corte de malla de 1,1 cm PGA ~ x 8 cm hoja (depende del tamaño del biorreactor).
- Limpie el tubo de silicona (diámetro interior de 3 mm) con agua destilada (dH20) y secar al aire antes de su uso.
- Use Dexon 6.0 de sutura para coser PGA de malla alrededor del tubo de silicona limpia a partir de tres nudos quirúrgica seguida de puntos individuales.
2. PGA andamios Tratamiento de Superficies
- Sumerja los andamios de la PGA en NaOH 1 M de 1-2min y registrar el tiempo de tratamiento y utilizar el mismo tiempo para todos los andamios de la PGA.
- Enjuague los andamios de la PGA en baños dH2O durante 2 minutos, 3 veces.
- Pat PGA andamios seco con Kimwipes entre cada inmersión en DH 2 O baños.
- Seco PGA andamios bajo el capó de cultivo de tejidos se sequen al aire durante 15 minutos con el ventilador.
3. Coser los brazos Dacron
- El uso de sutura Prolene 4.0 a coser pequeños trozos de manguitos de dacrón (1 cm) en cada extremo de la malla de la PGA con una superposición de 2 a 3 mm. Nota: no tener cuidado a la tubería de perforación de silicona (Figura 3).
- Use la misma sutura para coser tres puntos de sutura alrededor del extremo libre de los manguitos de dacrón. Asegúrese de dejar suficiente suturas en los extremos libres de la sutura de Prolene de paso 5.1 (Figura 3).
4. Asamblea de biorreactor (día antes del comienzo de la cultura biorreactor)
- Remoje malla cosida y tubo de silicona, instrumentos quirúrgicos, y un alambre delgado en un baño de etanol al 70% durante 20-30 minutos.
- Abrir las bolsas de autoclave que contiene el biorreactor y sumergirlo en un baño de etanol al 70% por lo menos 30 minutos antes del montaje. Asegúrese de lavar el biorreactor a fondo con etanol. La exposición de todos los componentes bio-reactor a 70% de etanol es una etapa de esterilización de adición. Este paso también elimina la endotoxina, que no se quita en autoclave y es perjudicial para las células vasculares.
- Tire el tubo de silicona a través de armas de mano con alambre delgado para salir adelante.
- Tome biorreactor de baño de etanol (mantener la malla sumergida en etanol). Fijar el andamio PGA dentro del biorreactor de Fijación de los puños Dacron sobre los labios de vidrio estalló apretando y atar las suturas de Prolene (Figura 3).
- Conecte un extremo de los brazos laterales biorreactor para conectores a través de un tubo de silicona.
- Tirar al otro lado del tubo de silicona con la suficiente tensión e inserte los otros dos conectores en el tubo de silicona. Mantenerse en el tubo de silicona con fuerza al insertar los conectores!
- Vuelva a insertar biorreactor en el baño de etanol y lavar con etanol, tirando suavemente los conectores de los brazos laterales.
- Voltear biorreactor más y permitir que un remojo durante 10 minutos.
- Biorreactor voltear del lado derecho y en remojo durante 10 minutos adicionales.
- Drenaje de todo el etanol.
- Establecer tres grandes placas de Petri (10 cm) en serie y biorreactor a cabo en el plato central para mantener el exceso de etanol goteaba de los extremos de los tubos.
- Ras biorreactor y la malla de la PGA con el agua de cultivo de tejidos utilizando una pipeta de 5 ml o 10 ml. También el tejido ras cultura del agua en el tubo de silicona.
- Escurrir el exceso de agua en placas de Petri a ambos lados del biorreactor.
- Biorreactor secar durante la noche en la capilla con ventilador encendido y apagado UV.
- Notas adicionales: asegúrese de barra de agitación estéril en el biorreactor. Asegúrese de no "libera" a la bio-reactor a partir de ahora, para evitar la contaminación. Cortar un montón de tiras de parafilm y se ponga en remojo en un baño de etanol al 70% pequeñas (de gran placa de Petri funciona bien).
5. Día 1: Configuración del biorreactor
- Coloque una placa de Petri estéril sobre la abertura de cada biorreactor para proteger el interior PGA andamio de contaminantes.
- Montar sistema de flujo de biorreactor, como se indica en la Figura 4 y parafina todas las juntas de conexión.
- Limpie los conectores primero con toallitas con alcohol.
- Conecte el puerto de inyección de tercer brazo, sin uso de biorreactores.
- Remueva el tubo de morsa y atar extremo azul de la dilución salina establecen tan cerca de la unión Y-como sea posible. Tire de la abrazadera del tubo en su lugar para asegurar que no se traslade el líquido a esta parte del tubo
- Retire la bolsa de IV, y conectar la tubería de morsa (rojo) en el momento final de la bolsa de IV. Asegúrese de limpiar el puerto de inserción con un algodón con alcohol en primer lugar.
- Adjuntar morsa a un lado del sistema de flujo (a través del tubo de extremo blanco).
- Inserte llave de 3 vías en el sistema de flujo.
- Retire el transductor de presión y conectar con llave de tres vías.
- Conecte el otro extremo del transductor de presión para la apertura de media en la bolsa.
- Conectarel biorreactor para el sistema de flujo a través de la Y-unión. Use una jeringa de 60 ml para añadir 350 ml de una fungizone% (mezcla de 5 ml fungizone con 495ml de PBS) a la bolsa de IV.
- Apriete la bolsa IV para limpiar el sistema de flujo mediante el ajuste de las llaves de paso para permitir el flujo de PBS. Nota: revisar el interior de biorreactor para asegurar que no haya fugas.
- Vuelva a suspender 8 x 10 6 SMC (alrededor de una confluencia T75) en 1.25ml de mediano y de semillas en cada scafffold PGA. Asegúrese de que la suspensión de células ha sido uniformemente goteó en el PGA de malla de dacrón de unión, así como en la parte inferior de la PGA de malla.
- Limpie el borde de biorreactor con un algodón con alcohol a través de rotación del biorreactor lado evitar flotando.
- Tapón de silicona tapa de montaje (Figura 2)
- Pelar bolsa de autoclave de nuevo con cuidado, asegurándose de no exponer a fondo de la tapa.
- Conecte el puerto de inyección al tubo de alimentación en el conector macho.
- Adjuntar PTFE 0,20 micras filtros a cada uno de los tres puertos de aire.
- Tenga cuidado de no exponer a / tocar el fondo de la tapa durante este proceso.
- Parafilm el puerto de inyección.
- Inserte la tapa del tapón de silicona en biorreactor de vidrio y asegúrese de que la sonda de alimentación en el interior del bioreactor no toque los andamios sin semillas PGA. Parafilm alrededor de la tapa.
- Lugar biorreactor con el sistema de flujo dentro de la incubadora (de lado) y rotar el biorreactor cada 5 minutos durante 25-30 minutos.
- Llenar la cámara de biorreactor con 400 ml de nuestros medios de cultivo 4.10 como se describe en la (Tabla 1). Este medio de cultivo es "óptima" para las arterias porcinas de ingeniería.
6. Día 6-7: Conexión de la bomba, y la primera alimentación
- Crecen los andamios sin semillas estática sin ningún tipo de bombeo pulsátil a través del tubo de silicona durante 6-7 días. No hay necesidad de un cambio medio o los suplementos de vitamina C durante este tiempo.
- Asegúrese de que no haya fugas de PBS o retorcimiento del tubo de flujo del sistema antes de encender la bomba.
- Encienda la bomba del sistema de flujo y asegúrese de ajustar la configuración de la bomba para que la presión se lee aproximadamente 270/-30mmHg.
- Presiones de registro diario en toda la cultura y mantener la presión en 270/-30mmHg. Transductor de presión se puede conectar a un ordenador para leer y controlar la presión.
Primera alimentación
- Ensamble inyección de puerto y filtro de PTFE en la alimentación de tapas para tanto el cambio medio y medio con fines de residuos deposal.
- Coloque el tubo de alimentación con firmeza en la bomba e introduzca un extremo al puerto de alimentación del reactor biológico y el otro extremo de la tapa de la alimentación. Asegúrese de limpiar los puertos de inyección con toallitas de etanol.
- Use una bomba de doble dirección Masterflex para bombear 200 ml de medio. A continuación, utilice una sonda de alimentación a la bomba de nuevo 200 ml de medio fresco de nuevo en el biorreactor. Comience siempre con una velocidad muy lenta, sobre todo cuando se bombea de nuevo a medio y del biorreactor.
- Cambio de medio y 2x/semana suplemento de ácido ascórbico. Para añadir ácido ascórbico, el uso de una jeringa 30 ml para extraer 25 ml de medio y colocarlo a un lado de la campana de los tejidos. Disolver 25 mg de ácido ascórbico en 5 ml de PBS y filtrarla a través de un filtro de 0,22 micras. En primer lugar se inyecta el ácido ascórbico estéril en el tubo de alimentación y volver a agregar el medio 25ml sacado antes. La receta es medio en la Tabla 1.
7. Los resultados representativos:
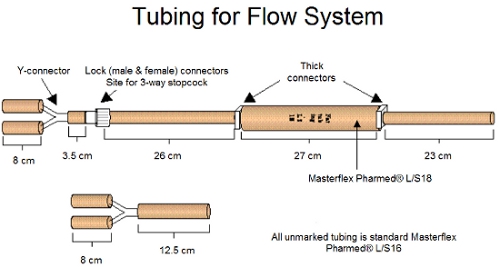
Figura 1. Los tubos y conectores para el montaje del sistema de flujo se muestra más arriba.
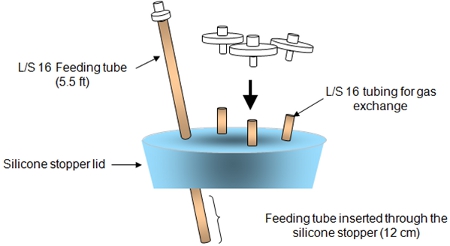
Figura 2. El tapón de silicona conjunto de la tapa se muestra arriba.

Figura 3. Esquema de montaje biorreactor se muestra más arriba. En el interior de los puños Dacron biorreactor se fijan en los brazos de cristal con los nudos de sutura azul.

Figura 4. Sistema de flujo conectada a un tubo y biorreactor se muestra arriba. L/S18 tubería será bombeada por una bomba Masterflex y así conducir la corriente. El transductor de presión se mide la presión antes de entrar en el biorreactor en el curso superior.

Figura 5. Imagen del buque cosecha de ingeniería. Barcos de ingeniería que parecen ser opaco y alcanzar un espesor de pared de aproximadamente 250 micras después de un cultivo de 8 semanas en condiciones pulsátil.
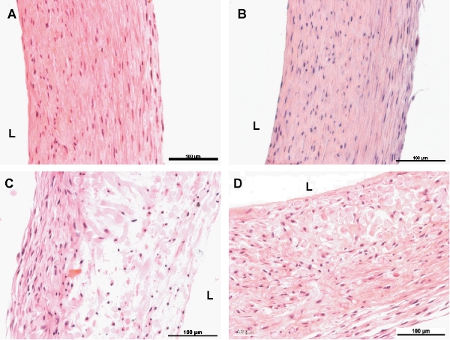
Figura 6. Hematoxilina y eosina secciones transversales de los vasos de ingeniería. A y B son de 8 semanas no pulsátil y los vasos impulsos, respectivamente.C y D son cuatro semanas de los buques no pulsado y pulsado, respectivamente. L indica el lado luminal de los vasos. La barra de escalas es 100μm.

Figura 7. Manchas de tricrómico de Masson para el colágeno (azul) para las secciones transversales de los vasos de ingeniería. A y B son de 8 semanas de buques no pulsado y pulsado, respectivamente. C y D son cuatro semanas de los buques no pulsado y pulsado, respectivamente. Tenga en cuenta que el buque pulsos de 4 semanas muestra más colágeno que su contraparte no pulsátil. Las flechas blancas señalan fragmentos restantes del PGA en los vasos. La barra de escalas es 100μm.
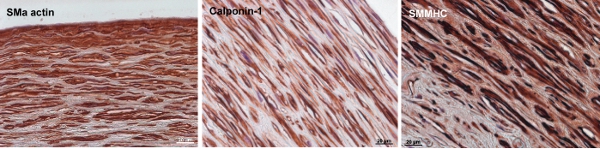
Figura 8. Tinción inmunoquímica de los marcadores de SMC en las arterias de la especie bovina de ingeniería. Músculo liso α-actina, calponin-1, y el músculo liso de la cadena pesada de miosina (SMMHC) son intermedios principios y finales de los marcadores contráctil SMC, respectivamente. Al final de la cultura de 12 semanas, las células de la pared del vaso expresar α-SM actina y cantidades moderadas de calponin-1 y SMMHC. La barra de escalas es 20μm.
| Componente | Cantidad |
| DMEM (DME / baja modificados) | 500 ml |
| FBS (suero fetal bovino) inactivado por calor | 100 ml |
| HEPES 1,0 M | 5 ml |
| La vitamina C (disuelto en PBS o DMEM) | 25 mg |
| Prolina / glicina / alanina 25 mg/25 mg/10 mg (disuelto en 5 ml de PBS) | 5 ml |
| CuSO4 1,5 mg (disuelto in1 ml de PBS) | 1 ml |
| Penicilina G en 10.000 unidades / ml | 5 ml |
| PDGF-BB (derivado de las plaquetas del factor de crecimiento-BB) en 10ng/ml | 5μg |
| bFGF (factor de crecimiento de fibroblastos) en 10ng/ml | 5μg |
Tabla 1. Los componentes de "4.10" medio se muestran en la tabla anterior. Con la excepción de PDGF-BB y bFGF, todos los demás componentes han de ser filtrada a través de un filtro de 0.2μm antes de su uso.
Discusión
La calidad de los buques de ingeniería es en gran parte dictadas por la calidad de la SMC utilizados en el cultivo de tejidos. Los aspectos críticos del fenotipo contráctil SMC incluyen la morfología, el número de paso bajo, y la capacidad de proliferar en el interior del biorreactor. Se recomienda que el número de pases no será superior a P3 en el momento de la siembra de células en el andamiaje de polímero. Por otra parte, es crucial para confirmar que las fuentes de SMC son libres de micoplasma antes de su u...
Divulgaciones
Agradecimientos
Este trabajo está financiado por los Institutos Nacionales de Salud Grant R01 EB-008836 y HL083895 R01 (tanto a LEN). Podríamos agradecer a Daryl Smith, el soplador de vidrio de la Universidad, para la toma de los biorreactores de nuestra investigación.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo / Material | Proveedor | Número de catálogo | |
|---|---|---|---|
| FBS (suero fetal bovino) inactivado por calor | HyClone | SH30071 | |
| DMEM | GIBCO | 11885 | |
| rhFGF-básica | R & B | 234-FSE | |
| rrPDGF-BB | R & B | 520-BB | |
| Penicilina G | Sigma | PENNA | |
| De cobre (II) sulfato | Sigma | C8027 | |
| Gylcine | Sigma | C8790 | |
| L-alanina | Sigma | A7469-25G | |
| L-prolina | Sigma | P5607-25G | |
| Ácido Ascórbico | Sigma | A4544-25G | |
| HEPES | Sigma | H3375-100G | |
| Tapón de silicona | Cole-Parmer | 06298-24 | |
| Masterflex tubos L / S | Cole-Parmer | 06508-16, 06508-18 | |
| Masterflex bomba | Cole-Parmer | 7553-80 | |
| Dacron manguito | Maquet | 174406 | |
| PGA se sintió | Concordia | MO000877-01 | |
| 4-0 1.5 métricas Surgipro II sutura | Syneture | VP-557-X | |
| 6-0 0.7 sutura Dexon métricas | Syneture | 7538-11 | |
| 0.22μm PTFE filtros | Whatman | 6780-2502 | |
| Three Way llave de paso | Edwards Lifesciences | 593WSC | |
| Transductor de presión | Edwards Lifesciences | PX212 | |
| IV bolsas | Baxter | R4R2110 | |
| Conjunto de dilución salina | Flecha | W20030 | |
| Tubo de silicona | Saint-Gobain | F05027 |
Referencias
- Risau, W., Flamme, I. Vasculogenesis. Annu. Rev. Cell Dev. Biol. 11, 73-91 (1995).
- Fankhauser, F., Bebie, H., Kwasniewska, S. The Influcence of mechanical Forices and Flow Mechanisms on Vessel Occlusion. Lasers in Surgery and Medicine. 6, 530-532 (1987).
- Niklason, L. E., Gao, J., Abbott, W. M., Hirschi, K. K., Houser, S., Marini, R., Langer, R. Functional arteries grown in vitro. Science. 284, 489-493 (1999).
- Prabhakar, V., Grinstaff, M. W., Alarcon, J., Knors, C., Solan, A. K., Niklason, L. E. Engineering porcine arteries: Effects of scaffold modification. Journal of Biomedical Materials Research Part A. 67A, 303-311 (2003).
- Mitchell, S. L., Niklason, L. E. Requirements for growing tissue-engineered vascular grafts. Cardiovascular Pathology. 12, 59-64 (2003).
- Dahl, S. L. M., Rhim, C., Song, Y. C., Niklason, L. E. Mechanical properties and compositions of tissue engineered and native arteries. Annals of Biomedical Engineering. 35, 348-355 (2007).
- Quint, C., Kondo, Y., Manson, R. J., Lawson, J. H., Dardik, A., Niklason, L. E. Decellularized tissue-engineered blood vessel as an arterial conduit. Proc Natl Acad Sci U S A. 108, 9214-9219 (2011).
- Niklason, L. E., Yeh, A. T., Calle, E. A., Bai, Y., Valentín, A., Humphrey, J. D. Enabling Tools for Engineering Collagenous Tissues Integrating Bioreactors, Intravital Imaging, and Biomechanical Modeling. Proceedings of the National Academy of Sciences of the United States of America. 107, 3335-3339 (2010).
- Gong, Z., Calkins, G., Cheng, E. -. c., Krause, D., Niklason, L. E. Influence of Culture Medium on Smooth Muscle Cell Differentiation from Human Bone Marrow-Derived Mesenchymal Stem Cells. Tissue Engineering Part A. 15, 319-330 (2009).
- Gong, Z. D., Niklason, L. E. Small-diameter human vessel wall engineered from bone marrow-derived mesenchymal stem cells (hMSCs. Faseb Journal. 22, 1635-1648 (2008).
- Poh, M. Blood vessels engineered from human cells. Lancet. 365, 2122-2124 (2005).
- American Heart Association. . Biostatistical fact sheet: cardiovascular procedures. , (2002).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados