Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
La transfección de células de ratón del ganglio de la retina por In vivo La electroporación
En este artículo
Resumen
Se demuestra una In vivo Electroporación protocolo para la transfección de grupos individuales o pequeños grupos de células ganglionares de la retina (CGR) y otros tipos de células de la retina en ratones postnatales en un amplio rango de edades. La capacidad de etiquetar y manipular genéticamente CGR postnatal In vivo Es una poderosa herramienta para los estudios de desarrollo.
Resumen
La selección y el refinamiento de las proyecciones de RGC para el cerebro medio es un sistema modelo popular y de gran alcance para el estudio de cómo los patrones precisos de la forma de conectividad neuronal durante el desarrollo. En los ratones, las proyecciones retinofugal están dispuestos de una manera topográfica y la forma del ojo específicos de las capas del núcleo geniculado lateral (dLGN) del tálamo y el colículo superior (SC). El desarrollo de estos patrones precisos de proyecciones retinofugal típicamente ha sido estudiado por el etiquetado las poblaciones de la CGR con tintes fluorescentes y marcadores, como la peroxidasa de rábano picante 1-4. Sin embargo, estos métodos son demasiado gruesas para dar una idea de los cambios de desarrollo en cada morfología axonal RGC cenador que son la base de la formación del mapa retinotópica. Asimismo, no permitir la manipulación genética de la CGR.
Recientemente, la electroporación se ha convertido en un método eficaz para proporcionar un control preciso espacial y temporal para la entrega de las moléculas cargadas en la retina 05.11. Los protocolos actuales de electroporación retina no permiten la manipulación genética y la localización de las proyecciones de retinofugal de un solo grupo o pequeño de la CGR en ratones postnatales. Se ha argumentado que después del parto en la electroporación in vivo no es un método viable para la transfección CGR desde el etiquetado de eficiencia es muy baja y por lo tanto requiere dirigidos a edades embrionarias cuando los progenitores RGC están experimentando la diferenciación y la proliferación de 6.
En este video se describe un protocolo de electroporación in vivo para la entrega selectiva de genes, shRNA, y dextranos fluorescentes para CGR murino después del nacimiento. Esta técnica proporciona una solución eficaz, rápida y relativamente fácil de plataforma para la detección eficaz de los genes candidatos involucrados en varios aspectos del desarrollo neural como la retracción del axón, la ramificación, la laminación, la regeneración y la formación de sinapsis en las distintas etapas del desarrollo del circuito. En resumen, como se describe aquí una valiosa herramienta que ofrecerá nuevas perspectivas sobre los mecanismos moleculares que subyacen al desarrollo del mapa sensorial.
Protocolo
1. Instalación del equipo de electroporación
- Electrodos: Hemos modificado Dumont # 5 pinzas para su uso como electrodos.
- Separado y se separan las pinzas.
- Soldar un cable en el extremo más ancho de cada diente. Envuelva el cable conectado y puntas con cinta aislante dejando aproximadamente 25-30 mm de la punta de los dientes expuestos.
- Ponga las pinzas modificado de nuevo junto con los espaciadores plásticos adecuados (por ejemplo un botón) entre las dos puntas para proporcionar una acción de resorte.
- Equipo eléctrico: Utilizamos un estimulador eléctrico para entregar pulsos de corriente de electroporación y un monitor de osciloscopio y de audio para confirmar la forma de onda y el número de pulsos que se entregó.
- Conecte el cable de una punta de la pinza de un pedal de pie que también está conectado en serie con el estimulador. El pedal actúa como un interruptor. Cuando se pulsa se cierra el circuito para la electroporación.
- Conecte el cable de la otra punta del estimulador eléctrico.
- Conecte el estimulador en el osciloscopio y el monitor de audio.
- Micropipeta y el inyector de configuración: Usamos fuerte tiró pipetas de vidrio y el sistema de Nanoinject II inyector para inyectar volúmenes muy pequeños de tinte o solución de ADN directamente en la retina.
- Monte sistema de inyección en un micromanipulador de 3 ejes.
- Tire de pipetas de vidrio con una vela larga y pequeña propina.
- Volver llenar la pipeta tiró con aceite mineral y seguro a los inyectores (para más detalles véase el manual de instrucciones Nanoinect II).
- Utilizando unas tijeras afiladas microdissecting un corte de la punta de la pipeta, la creación de una pequeña abertura (~ 3.2 m).
- Llenar la pipeta con la cantidad deseada de la solución de inyección a través de la punta de la pipeta. Siempre y cuando la integridad de la punta se mantiene, se puede utilizar para múltiples inyecciones y los animales.
Nota: i) Velar por la solución de inyección de suficiente carga en la punta de tal manera que el aceite mineral rellenadas no se inyecta en el ojo. ii) El Nanoinject II del sistema y el equipo específico electrónicos que se utilizan en este video no son críticos para lograr el éxito de etiquetado de la CGR. Inyecciones realizadas con otros dispositivos, como un picospritzer y electroporación con otros estimuladores común también se puede utilizar para CGR etiqueta.
2. Soluciones para el etiquetado plásmido RGC
- Para el etiquetado de pequeños grupos de la CGR: Utilizamos una construcción codificación EGFP (~ 3.2 g / l) la mejora de la proteína fluorescente verde) bajo el control de un promotor CAG (β-actina de pollo con un promotor de CMV inmediata principios potenciador). EGFP está marcado con la secuencia palmitoilación de GAP-43 (el crecimiento de la proteína asociada a-43) dirigidas a la membrana celular (mut4EGFP) 12. Esta construcción se conoce como pCAG-gapEGFP.
- Para el etiquetado sola célula: Utilizamos una combinación de dos construcciones. El primer vector es un promotor CAG de conducción de la recombinasa Cre (Cre-pCAG, Addgene [Cambridge, MA] plásmido 13775) 13 y el segundo vector contiene una cinta de parada floxed seguido por una membrana dirigidos EGFP (pCAG-LNL-gapEGFP). pCAG-Cre (~ 0.15-ng/μL) se utiliza a una concentración de aproximadamente 1.000-10.000 veces más bajos que pCAG-LNL-gapEGFP (~ 1-2 μgμL), limitando la expresión EGFP fuerte a un pequeño número de células (en virtud de la relativamente baja concentración pCAG-Cre).
3. Inyección de la retina y el Protocolo de electroporación
- Después del día 0 (P0) a los cachorros P5 son anestesiados por hipotermia, mientras que los ratones de más de P5 se anestesian con una inyección intraperitoneal (0,7 ml / kg) de un cóctel de ketamina (4,28 mg / ml), la xilazina (0,82 mg / ml) , y acepromacina (0.07mg/ml) 14.
- Esterilizar todos los instrumentos quirúrgicos y puntas de los electrodos en un esterilizador de cuentas en caliente. Posteriormente, tanto fresco en solución salina estéril antes de su uso para evitar daños térmicos en los ojos.
- Coloque el ratón en un ámbito de la disección y la posición del inyector.
- Para los ratones más jóvenes que P14 (antes de abrir los ojos), cirugía del párpado abierto cortando a lo largo de toda la longitud de la apertura de los párpados futuro con micro primavera disección b tijeras.
- Hacer que el globo ocular sobresale parcialmente ejerciendo una suave presión alrededor de los ojos con la punta de unas pinzas c.
- Mantener el ojo en su lugar con cuidado pellizcar la piel alrededor del ojo.
- Ajuste micromanipulador y llevar la pipeta cerca del globo ocular.
- Presione el pedal, el cual está conectado al sistema de Nanoinject II, para expulsar a unas pocas gotas de solución de la inyección y por lo tanto verificar que la pipeta no esté obstruido.
- Con una mano la estabilización del globo ocular, mueva el micromanipulador de tal manera que la punta de la pipeta de vidrio atraviesa el epitelio pigmentario de la retina y entra en la retina.
- Inyectar desired cantidad de solución presionando el pedal de pie para el sistema de Nanoinject II. Por ejemplo, para etiquetar CGR solo hacemos una sola inyección de 2,3 4.6nL.
- Retractarse de la pipeta y se coloca cuidadosamente puntas de los electrodos directamente sobre el sitio de la inyección y presione el pedal de estimulador para completar el circuito y electroporar el ojo. Por lo general usan pulsos cuadrados con la configuración de la fuerza de 25V, 50msec duración, 1 segundo de diferencia. 10 pulsos (5 pulsos de cada polaridad) se aplican a ratones pulsos mayores de P4 y 6 (3 pulsos de cada polaridad) se aplican a ratones para P0 P3.
- Empuje suavemente ojo de nuevo en el zócalo y aplicar el ungüento oftálmico estéril sobre los párpados cortados.
- Animales a cabo en una plataforma de temperatura controlada de calor y en la recuperación completa, incluyendo el recalentamiento adecuado y la movilidad, el retorno de los animales a su madre.
- Observar a los animales cada 12 horas para detectar cualquier signo de dolor, angustia o malestar, como la pérdida de la movilidad, postura anormal o falta de preparación. Ciclos repetidos de la anestesia, las inyecciones y la electroporación no se debe realizar en el mismo animal.
4. Notas
- El método de la inyección se describe en este video es un "ciego" de la inyección. Es posible visualizar la cantidad y localización de la inyección cuando se trabaja con ratones albinos y soluciones de color (DII o solución de plásmido con trazas de azul más rápido). Sin embargo, con las cepas de ratones pigmentados el lugar de inyección no pueden verse directamente y por lo tanto es difícil de describir verbalmente si se ha llegado a la ubicación de retina previsto o hasta dónde se debe mover la pipeta para orientar la capa de CGR en particular. Por lo tanto, le recomendamos los nuevos usuarios a empezar primero con inyecciones de DII en ratones albinos ya que estas inyecciones pueden ser visualizados inmediatamente en la retina y el etiquetado de las proyecciones de RGC a la retina y el cerebro se puede utilizar para evaluar la calidad de la inyección. Prepare un 10% en DII N, N-dimetilformamida (100%) para inyección de actividad. Una vez que los usuarios de este procedimiento es dominado debe ser capaz de dirigirse constantemente CGR con las soluciones de ADN plásmido en claro los ratones pigmentados.
- El método de la inyección se describe en este vídeo se puede utilizar para hacer focal inyecciones DII para etiquetar pequeñas poblaciones de células para estudiar retinotopy (4.6nL etiquetas de unos pocos cientos de CGR) 14 y CGR etiqueta a granel con fluoróforos (Alexa555, 488, etc) conjugado con la toxina del cólera subunidad B para el estudio del ojo específicos de la segregación, la exclusión de la etapa de la electroporación en el # 10. Un volumen máximo de inyección total de 2-3UL para los ratones mayores de P14 y un 2UL-de los ratones más jóvenes que P14 de cualquier solución es recomendable.
- Pipetas pueden ser rellenados con las soluciones a inyectar seguido por el relleno con aceite mineral antes de montar la pipeta en el inyector y romper la punta. Esto es especialmente útil cuando se utilizan soluciones de alta concentración de ADN (~ 6ug/uL), que son en general muy viscoso y difícil de cargar desde la punta de la pipeta.
- Si la pipeta de vidrio se tapa, limpie cuidadosamente la punta de la pipeta con un algodón empapado en agua para las soluciones de ADN y el etanol (100%) para el tinte (DII) soluciones.
- Después de inyectar en el ojo, retirar la punta de la pipeta del globo ocular y pulse el pedal para inyectar de nuevo. Esto es para confirmar que la punta no se obstruyen durante el proceso de inyección. Si no hay solución se dispensa, es muy probable que la inyección no tuvo éxito. Sin embargo, esto no debe ser tomado como una señal absoluta de que la inyección no se ha realizado correctamente. El experimentador puede inyectar el ojo mismo de nuevo si los sitios de inyección múltiple y el etiquetado de un mayor número de células que se desea.
- Para el etiquetado de CGR solo establece la velocidad de inyección para reducir en la caja de control Nanoinject. Esto reduce aún más la cantidad de solución se inyecta en la retina como el sistema tarda más tiempo en esta opción para prescindir de la solución y al mismo tiempo la punta de las pipetas de vidrio se retractó rápidamente del globo ocular.
- Electroporación de días después del parto 0 a 3 (P0 a P3) los ratones requiere un cuidado adicional, ya que es muy fácil dañar el ojo (esto se hace evidente a los pocos días de recuperación, cuando el ojo se puede demostrar más pequeñas de lo normal). Reducir el número de pulsos y la tensión aplicada es aconsejable para principios de ratones recién nacidos. Después de P4, los globos oculares son más resistentes a los daños de la electroporación.
- En nuestra experiencia de versiones específicas de la membrana EGFP o RFP ("gapEGFP, véase 12) son muy superiores a las buenas prácticas agrarias sin modificaciones para el examen de las proyecciones retinofugal al cerebro. Sin embargo, pCAG-tdTomato, que carece de una membrana objetivo modificación, también funciona bien (Figura 1). Además, el dextrano conjugado fluorescente colorantes también se puede utilizar para CGR etiqueta utilizando el protocolo de electroporación descrito anteriormente.
- Por lo general, 9 de cada 10 inyecciones llevará a CGR etiqueta, aunque sólo el 15% de las inyecciones con el enfoque de doble plásmido sellegar en cuestión de RGC solo se está etiquetando. El número de casos de éxito se puede aumentar mediante la inyección de ADN en múltiples lugares en un ojo o mediante la inyección de plásmidos que codifican distintas proteínas fluorescentes en cada ojo.
5. Resultados representante
RGC etiquetado se observó en todas las edades, que van desde P2 a P25, con el etiquetado de EGFP en CGR por 24 horas después de la electroporación y mantenido la expresión de al menos tres semanas después de la transfección.
Dendritas marcados con fluorescencia (Figura 1 A, B) y pérgolas axonal (Figura 1 F) de la CGR solo se puede visualizar claramente y reconstruido.
Aparte de la CGR, esta técnica puede ser utilizada para etiquetar otros tipos de células de la retina, como las células horizontales, células bipolares y diversos subtipos de células amacrinas (fig. 1C)
Este método no interfiere con el transcurso del tiempo normal de refinamiento mapa visual, como lo demuestra retinotopy normal en el SC (Figura 1).
En todas las edades, en un 90% de los casos, una inyección de pequeño volumen (~ 2,3 4.6nL) de pCAG-gapEGFP llevado a su expresión en una pocas CGR (Figura 1D).
En aproximadamente el 15% de los ensayos con una sola inyección de la pCAG-Cre y pCAG-LNL-gapEGFP plásmidos combinación por animal, dirigido al etiquetado individual de neuronas retinianas incluyendo CGR (Figura 1 A, B, D) y otros tipos de células como amacrinas las células (fig. 1C).
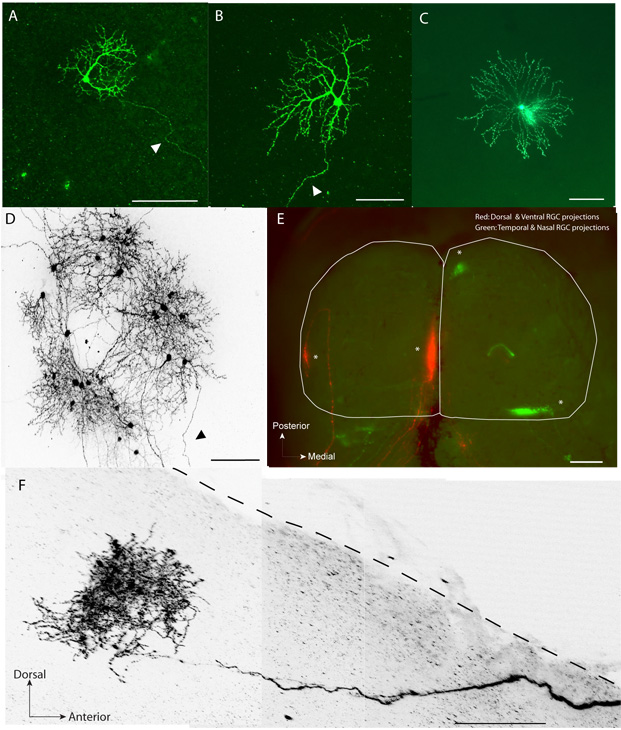
Figura 1 - A, B. Ejemplos de EGFP etiqueta solo las células ganglionares de la retina (cabeza de flecha apuntando al axón) en una retina plana de montaje en el post-natal el día 14 (P14) C. Ejemplo de célula amacrinas estelar en P8 D.. . Un grupo de EGFP etiqueta neuronas de la retina incluyendo CGR y las células amacrinas de la retina plana de montaje en P14. CGR E. dorsal y ventral en el ojo derecho se electroporated y etiquetados con EGFP y CGR temporal y ventral en el ojo izquierdo galvanizado y se etiquetados con tdTomato en P1. Las zonas de destino (asteriscos) formado por la CGR etiqueta se puede ver en su ubicación topográficamente correcta en el SC en P9 (todo el montaje, esquema de color blanco). F. Ejemplo de una sola etiqueta EGFP RGC cenador (2-D de proyección) en un corte sagital (250 micras de espesor) de la SC (línea punteada). Para mayor claridad, las imágenes en (D) y (F) ha sido convertida a escala de grises y se invierte. Las barras de escala (m): (A) - (D), (F): 100 (E): 500
Discusión
En este video se demuestra un protocolo de electroporación in vivo que se traduce en el etiquetado de los grupos individuales o pequeños de las neuronas de la retina en ratones postnatales, con construcciones de ADN que codifican las proteínas fluorescentes. Pequeños grupos de marcado con fluorescencia proyecciones CGR a la dLGN SC y reproduce patrones similares de proyección ya que estudios previos con el etiquetado de CGR con colorantes lipofílicos, lo que indica que la electroporación no inte...
Divulgaciones
Agradecimientos
El plásmido pCAG-gapEGFP fue un regalo del doctor S. McConnell (Stanford, CA). pCAG-tdTomato plásmido fue un regalo del doctor Feller M. (Berkeley, CA). Agradecemos al Dr. Edward Ruthazer por sugerir el uso de una estrategia de dos plásmidos para el etiquetado de células individuales y Schohl Anne (Montreal, QC) para validar los dos plásmidos Cre / loxP estrategia en los estudios piloto y los miembros de Crair de laboratorio para soporte técnico. Con el apoyo de R01 MH62639 (MC), NIH R01 EY015788 (MC) y NIH P30 EY000785 (MC).
Materiales
| Name | Company | Catalog Number | Comments |
| Materiales | Empresa | Número de catálogo | |
|---|---|---|---|
| Dumont # 5 Pinzas | Herramientas de Bellas Ciencia | 11252-20 | |
| Estimulador eléctrico | Grass Instruments | Modelo S4 | |
| Osciloscopio | Agilent | Modelo 54621A | |
| Monitor de audio | Grass Instruments | Modelo AM8B | |
| Extractor | Sutter Instrumentos | Modelo P-97 | |
| Vannas Tijeras una | Mundial de Instrumentos de Precisión | 14003 | |
| Micro Tijeras b | Ted Pella | 1347 | |
| Dumont AA Pinzas c | Herramientas de Bellas Ciencia | 11210-20 | |
| Nanoinject II del Sistema | Drummond Científico | 3-000-204 | |
| Pipetas de vidrio | Drummond Científico | 3-000-203-G / X | |
| Pedal | Drummond Científico | 3-000-026 | |
| Aceite mineral | Sigma-Aldrich | M3516 | |
| DII | Invitrogen | D-383 | |
| N, N-dimetilformamida | Sigma | D4551 |
Referencias
- Huberman, A. D., Feller, M. B., Chapman, B. Mechanisms underlying development of visual maps and receptive fields. Annu Rev Neurosci. 31, 479-509 (2008).
- McLaughlin, T., Torborg, C. L., Feller, M. B., O'Leary, D. D. Retinotopic map refinement requires spontaneous retinal waves during a brief critical period of development. Neuron. 40, 1147-1160 (2003).
- Godement, P., Salaun, J., Imbert, M. Prenatal and postnatal development of retinogeniculate and retinocollicular projections in the mouse. J Comp Neurol. 230, 552-575 (1984).
- Jaubert-Miazza, L. Structural and functional composition of the developing retinogeniculate pathway in the mouse. Vis Neurosci. 22, 661-676 (2005).
- Garcia-Frigola, C., Carreres, M. I., Vegar, C., Herrera, E. Gene delivery into mouse retinal ganglion cells by in utero electroporation. BMC Dev Biol. 7, 103-103 (2007).
- Matsuda, T., Cepko, C. L. Analysis of gene function in the retina. Methods Mol Biol. 423, 259-278 (2008).
- Petros, T. J., Rebsam, A., Mason, C. A. In utero and ex vivo electroporation for gene expression in mouse retinal ganglion cells. J Vis Exp. , (2009).
- Ishikawa, H. Effect of GDNF gene transfer into axotomized retinal ganglion cells using in vivo electroporation with a contact lens-type electrode. Gene Ther. 12, 289-298 (2005).
- Hewapathirane, D. S., Haas, K. Single cell electroporation in vivo within the intact developing brain. J Vis Exp. , (2008).
- Ruthazer, E. S., Haas, K., Javaherian, A., Jensen, K., Sin, W. C., Cline, H. T., Yuste, R., Konnerth, A. In vivo time- lapse imaging of neuronal development. Imaging in Neuroscience and Development: A Laboratory Manual. , 191-204 .
- Kachi, S., Oshima, Y., Esumi, N., Kachi, M., Rogers, B., Zack, D. J., Campochiaro, P. A. Nonviral ocular gene transfer. Gene Ther. 12, 843-851 (2005).
- Okada, A., Lansford, R., Weimann, J. M., Fraser, S. E., McConnell, S. K. Imaging cells in the developing nervous system with retrovirus expressing modified green fluorescent protein. Exp Neurol. 156, 394-406 (1999).
- Matsuda, T., Cepko, C. L. Controlled expression of transgenes introduced by in vivo electroporation. Proc Natl Acad Sci U S A. 104, 1027-1032 (2007).
- Plas, D. T. morphogenetic proteins, eye patterning, and retinocollicular map formation in the mouse. J Neurosci. 28, 7057-7067 (2008).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados