Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Un aplastamiento del nervio óptico Lesiones modelo murino para estudiar la supervivencia de células ganglionares retinianas
En este artículo
Resumen
Este protocolo indica cómo etiquetar retrógradamente las células ganglionares de la retina, y cómo hacer posteriormente una lesión del nervio óptico aplastar con el fin de analizar la supervivencia de células ganglionares retinianas y apoptosis. Se trata de un modelo de enfermedad experimental para los diferentes tipos de neuropatía óptica, incluyendo el glaucoma.
Resumen
La lesión del nervio óptico puede conducir a la degeneración axonal, seguido de una muerte gradual de las células ganglionares de la retina (CGR), que se traduce en la pérdida de visión irreversible. Ejemplos de tales enfermedades en humanos son la neuropatía óptica traumática y la degeneración del nervio óptico en el glaucoma. Se caracteriza por los cambios típicos en la cabeza del nervio óptico, degeneración progresiva del nervio óptico y la pérdida de células ganglionares de la retina, si no se controla, lo que lleva a la pérdida de visión y ceguera.
El aplastamiento del nervio óptico (ONC) lesión modelo de ratón es un modelo importante para la enfermedad experimental neuropatía óptica traumática, glaucoma, etc En este modelo, la lesión por aplastamiento del nervio óptico conduce a la gradual ganglionares de la retina apoptosis de las células. Este modelo de la enfermedad puede ser usado para estudiar los procesos generales y los mecanismos de muerte neuronal y la supervivencia, que es esencial para el desarrollo de medidas terapéuticas. Además, los enfoques farmacológicos y moleculares pueden ser utilizados en este modelo para identificar y comprobar el potencial de reactivos terapéuticos para tratar diferentes tipos de neuropatía óptica.
Aquí, le ofrecemos una demostración paso a paso (I) el etiquetado de referencia retrógrada de las células ganglionares de la retina (CGR) en el día 1, (II) lesión aplastamiento del nervio óptico en el día 4, (III) la cosecha de la retina y analizar la supervivencia de las CGR en el día 11, y (IV) son el resultado Representante.
Protocolo
Todos los equipos y los reactivos utilizados son estériles. Todos los experimentos con animales fueron aprobados por el Cuidado de Animales y el empleo Comisión (ACUC) en el NEI / NIH (protocolo de estudio en animales NEI-570), y se realizaron de acuerdo a las directrices del NIH y los reglamentos.
1. Etiquetado de referencia retrógrada de las células ganglionares retinianas (CGR) en el Día 1
El propósito de este procedimiento consiste en identificar a las células ganglionares de la retina retrógrada mediante la inyección de un tinte trazador neuronal en el colículo superior de los ratones tres días antes de la lesión del nervio óptico aplastar. El colorante se forma retrógrada tomadas por las células ganglionares de la retina y proporciona un indicador de la CGR de vida (Figura 1). Este enfoque produce el etiquetado reproducible de las CGR viables con poca variación 1-5.
- Profundamente anestesiar el ratón. Limpiar el cabello en la parte superior de la cabeza. Coloque el ratón en un pequeño aparato estereotáxico. Oinment de protección se aplica tanto a los ojos. La desinfección de la piel de la cabeza tres veces cada uno con un yodóforo y un lavado de alcohol al 70%.
- Hacer una incisión en la piel para exponer el cráneo, y mantenerlo seco y limpio con 3% de peróxido de hidrógeno.
- Identificar y marcar el bregma. Taladrar un agujero por encima del colículo superior a 2,9 mm por detrás del bregma y 0,5 mm lateral a la línea media de cada hemisferio 7. Durante la perforación, aplicar solución salina al sitio donde se perfora el agujero para evitar lesiones de calor secundario.
- El uso de un dispositivo de medición estereotáxica y una jeringa Hamilton, inyectar el trazador de tinta FluoroGold neural (1 l de 3% Fluorocromo en solución salina) muy lentamente en el colículo superior de cada hemisferio, a una profundidad de 1,6 mm de la superficie ósea del cerebro.
- Sutura de la incisión. Una inyección subcutánea de la buprenorfina para la analgesia.
- Mueve el ratón a un lugar caliente y seco y el monitor hasta que es capaz de mantener una postura erguida, y devolverlo a su jaula. Durante los tres primeros días después del procedimiento de etiquetado, analgésicos sistémicos (por ejemplo, buprenorfina) y un ungüento antibiótico tópico se dan dos veces al día y el ratón es monitoreado de cerca.
2. Lesión por aplastamiento del nervio óptico en el día 4
En este procedimiento, se aplicará una lesión por aplastamiento del nervio óptico que causa un daño primario a los axones (Figura 2), lo que conducirá a una muerte gradual de las células ganglionares de la retina.
- Tres días después de la aplicación de tinte trazador, el ratón está profundamente anestesiados. Utilizando un microscopio de disección, la conjuntiva del ojo se realiza una incisión alrededor de la posición de las cuatro con un par de tijeras de primavera.
- Desviar suavemente los músculos de la órbita y los puso a un lado. Exponer el nervio óptico blanco en su salida del globo ocular. Tenga mucho cuidado de no dañar los vasos sanguíneos.
- Con la ayuda de un par de pinzas de acción de la Cruz-, aplicar una lesión por aplastamiento del nervio óptico a unos 2 mm del globo ocular durante unos 3 segundos. Tenga mucho cuidado de no dañar la arteria oftálmica para causar sangrado.
- Después de la terminación de la lesión por aplastamiento, se sutura la incisión.
- Antes de que el ratón se recupera de la anestesia, la inyección subcutánea de la buprenorfina para la analgesia.
- Mueve el ratón a un lugar caliente y seco y el monitor, hasta que es capaz de mantener una postura erguida y devolverlo a su jaula. Durante los primeros tres días después del procedimiento de lesión por aplastamiento, analgésicos sistémicos (por ejemplo, buprenorfina) y un ungüento antibiótico tópico se dan dos veces al día y el ratón es monitoreado de cerca.
3. Cosecha de las retinas y analizar la supervivencia de CGR en el Día 11
El propósito de este procedimiento es la cosecha retinaeto analizar la supervivencia de células ganglionares retinianas.
- En el día 11 (día 7 después de ONC), el ratón es sacrificado por la infusión de CO 2 y la dislocación cervical.
- Los ojos son enucleados con la ayuda de un par de pinzas, aplicando presión a la órbita.
- Los ojos se fijaron en solución de paraformaldehído al 4% durante dos horas y se lavaron con PBS tres veces. Diseccionar la retina. El procedimiento de disección de la retina ya ha sido publicado previamente por Júpiter en 2010 por Gustmann, S. et al. 6, y por lo tanto no se describe aquí.
- Las imágenes de las células ganglionares de la retina sobrevivientes son tomadas con un microscopio de fluorescencia en las regiones definidas de la retina, y la densidad de las células ganglionares de la retina se puede contar. Un resultado representativo de las células ganglionares de la retina de fluorescencia con etiqueta, con o sin lesión de aplastamiento del nervio óptico se muestra en la Figura 3.
4. Los resultados representativos:
Para analizar la supervivencia de células ganglionares retinianas, siete días después de la lesión aplastamiento del nervio óptico, la retina se recogieron, se fija, aplanado y montaje. Imágenes de la retina fueron tomadas con un microscopio de fluorescencia. En comparación con el r normales sin lesionesetina (izquierda, Normal), el número de CGR viables (verde, retrógradamente marcados por el tinte FluoroGold neural marcador se inyecta en el colículo superior) es significativamente menor en las retinas con una lesión del nervio óptico aplastar (derecha, ONC) (Figura 3) .
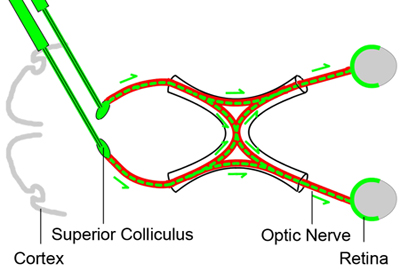
Figura 1. Línea de base retrógrada etiquetado de las células ganglionares de la retina
Con el fin de contar las células viables ganglionares de la retina, en diferentes momentos después de la lesión aplastamiento del nervio óptico, las células ganglionares de la retina están etiquetados retrógrada mediante la inyección de un tinte trazador neural (color verde) en el colículo superior en el cerebro tres días antes del nervio óptico ( rojo) lesión por aplastamiento. Dado que los axones de las células ganglionares de la retina residen en el colículo superior, el tinte trazador se tomarán por la CGR retrógrada y proporciona un indicador de la CGR de vida.
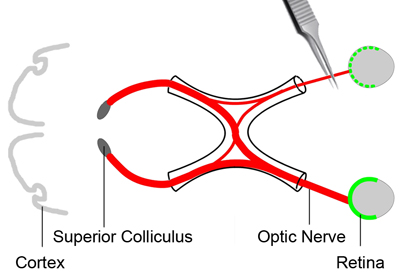
Figura 2. Nervio óptico lesión por aplastamiento
Con el fin de analizar el estado de la supervivencia de células ganglionares retinianas, una lesión por aplastamiento se aplica en el nervio óptico (rojo) para causar un daño primario a los axones. Esto llevará a una muerte gradual de las células ganglionares de la retina. Tres días después de que el trazador de tinta (color verde) de la inyección, el ratón está anestesiado. La conjuntiva de un ojo se hace una incisión. Desviar los músculos orbitales y los puso a un lado. Exponer el nervio óptico en su salida del globo ocular. Aplique una lesión por aplastamiento del nervio óptico a unos 2 mm del globo ocular durante unos 3 segundos con un par de pinzas de acción transversal.
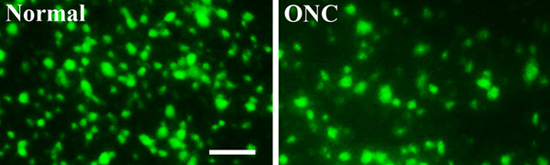
Figura 3. Fluorescencia de células marcadas con ganglionares de la retina, con o sin lesión de aplastamiento del nervio óptico
Para analizar la supervivencia de células ganglionares retinianas, siete días después de la lesión aplastamiento del nervio óptico, la retina se recogieron, se fija, aplanado y montaje. Imágenes de la retina fueron tomadas con un microscopio de fluorescencia. En comparación con la retina ileso normal (a la izquierda, Normal), el número de CGR viables (verde, retrógrada etiquetado por el FluoroGold neural trazador se inyecta un contraste en el colículo superior) fue significativamente menor en las retinas con una lesión del nervio óptico aplastar (ONC derecho, ) (Figura 3). Barra de escala: 50 micras
Discusión
El aplastamiento del nervio óptico modelo murino lesión es útil para estudiar el proceso de la muerte de las CGR y la supervivencia. Este modelo también se utiliza a menudo para investigar los efectos de diferentes reactivos y los genes de la apoptosis y la supervivencia de las CGR. Una de las ventajas de este modelo es que tiene un alto grado de reproducibilidad con variaciones mínimas.
Sin embargo, se requiere un cuidado especial en varias etapas en este modelo. En primer lugar, la ho...
Divulgaciones
Agradecimientos
Nuestra investigación es apoyada por el Programa de Investigación Intramural del NIH, el Instituto Nacional del Ojo.
Materiales
| Name | Company | Catalog Number | Comments |
| Stereotaxic apparatus | ASI Instruments | SAS-4100 | |
| Dissecting microscope | World Precision Instruments, Inc. | PZMIV-BS | |
| Scalpel handle | Fine Science Tools | 10003-12 | |
| Scalpel Blades #15 | Fine Science Tools | 10015-00 | |
| Microdrill | Fine Science Tools | 18000-17 | |
| Suture needle | Fine Science Tools | 12050-03 | |
| Spring scissors | Fine Science Tools | 16144-13 | |
| Dumont #5 forceps | Fine Science Tools | 11252-50 | |
| Hamilton syringe | Hamilton Co | 88400 | |
| Gauze sponges | Office Depot | 674889 | |
| Fluorochrome | Sigma-Aldrich | 39286 | |
| Alcohol | Sigma-Aldrich | 459844 | 70% |
| H2O2 | Sigma-Aldrich | H3410 | 3% |
Referencias
- Yoles, E. GM1 reduces injury-induced metabolic deficits and degeneration in the rat optic nerve. Investigative ophthalmology & visual science. 33, 3586-3591 (1992).
- Fisher, J. Vaccination for neuroprotection in the mouse optic nerve: implications for optic neuropathies. J Neurosci. 21, 136-142 (2001).
- Levkovitch-Verbin, H. RGC death in mice after optic nerve crush injury: oxidative stress and neuroprotection. Investigative ophthalmology & visual science. 41, 4169-4174 (2000).
- Li, Y. VEGF-B inhibits apoptosis via VEGFR-1-mediated suppression of the expression of BH3-only protein genes in mice and rats. The Journal of clinical investigation. 118, 913-923 (2008).
- Tang, Z. Survival effect of PDGF-CC rescues neurons from apoptosis in both brain and retina by regulating GSK3beta phosphorylation. The Journal of experimental medicine. 207, 867-880 (2010).
- Gustmann, S., Dunker, N. In vivo-like organotypic murine retinal wholemount culture. J Vis Exp. , (2010).
- Franklin, K., Paxinos, G. . The Mouse Brain in Stereotaxic Coordinates. , (1997).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados