Method Article
Determinación de Especies de la membrana mitocondrial de oxígeno potencial y reactiva en las neuronas corticales de rata en vivo
En este artículo
Resumen
Se demuestra la aplicación del indicador de fluorescencia, TMRM, en las neuronas corticales para determinar los cambios relativos en la intensidad de fluorescencia TMRM antes y después de la aplicación de un estímulo específico. También muestran la aplicación de la fluorescencia de la sonda H 2 DCF-DA para evaluar el nivel relativo de especies reactivas del oxígeno en las neuronas corticales.
Resumen
Potencial de membrana mitocondrial (ΔΨm) es fundamental para mantener la función fisiológica de la cadena respiratoria para generar ATP. Una pérdida significativa de ΔΨm hace agotadas las células de la energía con la posterior muerte. Las especies reactivas del oxígeno (ROS) son importantes moléculas de señalización, pero su acumulación en condiciones patológicas conduce a estrés oxidativo. Las dos principales fuentes de ROS en las células son las toxinas ambientales y el proceso de fosforilación oxidativa. Disfunción mitocondrial y de estrés oxidativo han sido implicados en la fisiopatología de muchas enfermedades, por lo tanto, la capacidad de determinar ΔΨm y ROS pueden proporcionar pistas importantes sobre el estado fisiológico de la célula y la función de la mitocondria.
Varias sondas fluorescentes (Rodamina 123, TMRM, TMRE, JC-1) se puede utilizar para determinar Δψm en una variedad de tipos celulares, y muchos indicadores de fluorescencia (dihydroethidium, dihidrorodamina 123, H 2 DCF-DA) se puede utilizar para determinar ROS . Casi todas las sondas de fluorescencia que se utilizan para evaluar ΔΨm o ROS son de una sola longitud de onda de los indicadores, que aumentan o disminuyen su intensidad de fluorescencia proporcional a un estímulo que aumenta o disminuye los niveles de ΔΨm o ROS. Por lo tanto, es imprescindible para medir la intensidad de la fluorescencia de las sondas a nivel basal y después de la aplicación de un estímulo específico. Esto permite determinar el porcentaje de cambio en la intensidad de fluorescencia entre el nivel de referencia y un estímulo. Este cambio en la intensidad de la fluorescencia refleja el cambio en los niveles relativos de ΔΨm o ROS. En este video, que muestra cómo aplicar el indicador de fluorescencia, TMRM, en ratas las neuronas corticales para determinar el porcentaje de cambio en la intensidad de fluorescencia TMRM entre el nivel basal y después de aplicar FCCP, un desacoplador mitocondrial. Los niveles más bajos de TMRM fluorescencia que resulta del tratamiento FCCP reflejan la despolarización del potencial de membrana mitocondrial. También se muestra cómo aplicar la fluorescencia de la sonda H 2 DCF-DA para evaluar el nivel de ROS en las neuronas corticales, en primer lugar al inicio del estudio y después de la aplicación de H 2 O 2. Este protocolo (con modificaciones menores) también se puede utilizar para determinar los cambios en ΔΨm y ROS en diferentes tipos celulares y en neuronas aisladas de otras regiones del cerebro.
Protocolo
1. De cultivo celular
- Las neuronas corticales son aisladas y cultivadas con técnicas descritas anteriormente y se cultivaron en placas de cultivo con fondo de cristal (MatTek Corporation, Ashland, MA), recubierta con poli-D-lisina y laminina 1.
2. Preparación de las soluciones madre de los fluorescentes TMRM sondas y H 2 DCF-DA
- Preparar una solución de 10 mM de TMRM disolviendo 5,0 mg de TMRM en 1 ml de dimetilsulfóxido anhidro. Vortex durante 1 min. Entonces, hacer alícuotas y almacenarlos a -20 ° C, protegido de la luz, y su uso dentro de un mes.
- A continuación, preparar una solución de 10 mM de H 2 DCF-DA mediante la disolución de 4,87 mg de H 2 DCF-DA en 1 ml de DMSO anhidro. Del mismo modo, vortex durante 1 min. Entonces, hacer alícuotas y almacenarlos a -20 ° C, protegido de la luz, y su uso dentro de una semana.
3. Cargando corticales de rata neuronas con TMRM y H 2 DCF-DA
TMRM es un potenciómetro, penetran en las células indicador fluorescente que se acumula en el interior de alta carga negativa de las mitocondrias. Es importante la utilización de las bajas concentraciones (10-50 nm de rango) de TMRM para evitar la auto-extinción de TMRM mitocondrial. Luego, la señal de fluorescencia de TMRM pueden ser directamente relacionados con la co-ΔΨm través de la membrana mitocondrial interna. Una pérdida de ΔΨm causas TMRM de fuga de la mitocondria que resulta en una pérdida de intensidad de fluorescencia. H 2 DCF-DA se penetra en las células de la sonda convierte en DCF-DA por las esterasas intracelulares, y sus resultados en la oxidación de DCF fluorescente. La concentración final de H 2 DCF-DA oscila entre 2.10 M y que debe ser probado empíricamente en neuronas derivadas de las diferentes regiones del cerebro ya que las altas concentraciones de carga podría dar lugar a la saturación de fluorescencia de DCF, incluso en ausencia de H 2 O 2. La presencia de oxidantes endógenos o exógenos (por ejemplo, el óxido nítrico peróxido de hidrógeno) se incrementará la intensidad de fluorescencia DFC. A continuación, ofrecemos un protocolo para la carga de las neuronas corticales de rata con TMRM y H 2 DCF-DA.
- Para cargar las neuronas corticales de rata con TMRM, en primer lugar, lavar los cultivos de neuronas 3 veces con tampón de Tyrode (superposición de texto: TB: 145 mM NaCl, 5 mM KCl, 10 mM de glucosa, 1,5 mM CaCl 2, 1 mM MgCl 2, y 10 mM HEPES, ajustar el pH a 7,4 con NaOH). A continuación, preparar 20 nM de TMRM diluyendo el stock de 10 mM TMRM 1 / 1000 veces la tuberculosis y después agregue 2 l de TMRM diluidas por 1 ml de la tuberculosis. Incubar las neuronas con TMRM durante 45 minutos en la oscuridad a temperatura ambiente. Después de 45 minutos, coloque la placa de cultivo en la platina del microscopio y empezar de imágenes.
- Para cargar las neuronas corticales de rata con H 2 DCF-DA, lavar los cultivos de neuronas 3 veces con la tuberculosis. A continuación, preparar 2 M de H 2 DCF-DA mediante la dilución de los 10 mm de H 2 DCF-DA stock 1 / 10 veces en la tuberculosis y después agregue 2 l de diluirse H 2 DCF-DA por 1 ml de TB. A continuación, se incuban las neuronas con H 2 DCF-DA durante 45 minutos en oscuridad a temperatura ambiente. Después de 45 minutos, lavar las neuronas 4 veces con TB para eliminar el exceso de indicador fluorescente antes de obtener las imágenes.
4. Imágenes en directo de las neuronas se incubaron con TMRM para determinar ΔΨm
- Para realizar las imágenes en directo de las neuronas se incubaron con TMRM, la microscopía de escaneo láser confocal (superposición de texto: LSM 510, Carl Zeiss, Inc.), con la aplicación de vivir de series de tiempo del programa, se utiliza. Aplicar de baja resolución y atenuado la potencia del láser (superposición de texto: baja resolución: 256 x 256, la potencia del láser: 1%) para reducir al mínimo el tiempo necesario para obtener imágenes y para evitar photobleaching.
- . A continuación, ajustar el enfoque de las neuronas montado cargado con TMRM con la luz reflejada. Examine la fluorescencia TMRM por la iluminación a 514 nm y la detección a 570 nm. Ajustar la ganancia de la detección de una cámara debajo del nivel de saturación.
- Una vez que todos los parámetros que incluyen la resolución, la potencia del láser, el aumento de la detección de una cámara, y el intervalo de tiempo transcurrido para obtener las imágenes se establecen, no cambian estos valores entre los experimentos. A continuación, cambie el campo. Comenzar a recoger las imágenes.
- Para probar los cambios en ΔΨm, estímulos, tales como una M de FCCP o 2 mg / ml de oligomicina, se puede aplicar, lo cual permitirá despolarización o hiperpolarización del potencial de membrana mitocondrial, respectivamente. Estos cambios se reflejarán en una disminución en la intensidad de fluorescencia TMRM en comparación con la intensidad de fluorescencia de referencia en el caso del FCCP, o un aumento en la intensidad de fluorescencia TMRM en el caso de oligomicina.
5. Imágenes en vivo de neuronas incubadas con H 2 DCF-DA para determinar ROS
- Para realizar las imágenes en directo de las neuronas incubadas con H 2 DCF-DA, en primer lugar, montar la placa de cultivo en el escenario de un microscopio. Ajustar el enfoque de las células que nosción refleja la luz. Examine DCF de fluorescencia de excitación a 488 nm y emisión a 515 nm.
- A continuación, ajustar la potencia del láser a un 5-7%, la ganancia del detector, y resolución de 256 x 256. No cambie estos ajustes entre los experimentos. A continuación, establezca la frecuencia para la obtención de imágenes en directo mediante el programa de series de tiempo.
- Seleccione un nuevo campo y comenzar a adquirir las imágenes. Para detectar cambios en los niveles de ROS, tratar las células con 100 a 200 M de H 2 O 2. Esto se refleja en un aumento en la intensidad de fluorescencia de DCF en comparación con el nivel de referencia.
6. Análisis de los datos
- Use la región de interés (Superposición de texto: ROI) de herramientas del programa de LSM para seleccionar las áreas. A continuación, medir la intensidad de ROS TMRM o fluorescencia. Seleccione el ROI de las regiones mitocondriales o regiones de interés desde el cuerpo celular en las células de todo imágenes para medir la intensidad de fluorescencia de TMRM o ROS, respectivamente.
- Calcular la intensidad media de fluorescencia de todas las regiones de interés de cada célula de TMRM o de los cuerpos de célula entera para todas las células de imágenes de ROS para cada momento. Seleccione las regiones próximas a las células para calcular la intensidad de fluorescencia de fondo. Tomar varias mediciones y calcular la intensidad media de fondo.
- Restar la intensidad de fluorescencia de fondo promedio de intensidad de fluorescencia media de rendimiento de la inversión en cada celda para cada momento el uso de Microsoft Excel. Después de restar la intensidad de fondo, normalizar la intensidad de fluorescencia de DCF o TMRM a la fluorescencia basal mediante esta fórmula (superposición de texto: Df = FF o / F o x 100, donde F = intensidad de la fluorescencia en cualquier punto del tiempo, para = línea de base de fluorescencia). A continuación, utilice el programa Sigma Plot para generar el gráfico que muestra los cambios en la intensidad de la fluorescencia con el tiempo.
7. Resultados representante
La figura 1A muestra una imagen de fluorescencia de las neuronas corticales de rata incubados con TMRM. Además del FCCP, un desacoplador mitocondrial, conduce a la despolarización mitocondrial y una pérdida de intensidad de fluorescencia TMRM (Fig. 1B). El nivel básico TMRM fluorescencia se mantiene estable antes de la adición de FCCP (los primeros 350 segundos;. Fig. 1C). El análisis cuantitativo de TMRM cambios de fluorescencia en el tiempo muestra una disminución significativa de la fluorescencia TMRM tras la adición de FCCP (Fig. 1C).
Figura 1D muestra la imagen de fluorescencia de las neuronas corticales de rata cargado con DCF. Además de H 2 O 2 da como resultado una mayor intensidad de fluorescencia de DCF en los cuerpos celulares (Fig. 1E). La línea de base DCF nivel de fluorescencia no se ha modificado (los primeros 120 segundos) antes de la aplicación de H 2 O 2. Lapso de tiempo-las medidas de fluorescencia de DCF muestran sus niveles estables, lo que aumenta después de H 2 O 2 tratamiento (Fig. 1F).
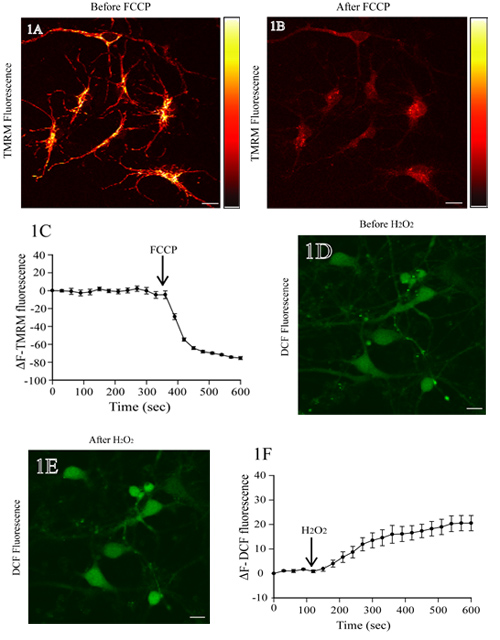
Figura 1. Evaluación del potencial de membrana mitocondrial y los niveles de ROS en las neuronas corticales de rata viva. (A) Imagen Representante de fluorescencia de las neuronas corticales cargado con TMRM. Después de escanear la línea de base TMRM fluorescencia, las neuronas fueron tratadas con el FCCP protonophore (1 M). A la derecha hay una barra de intensidad de la fluorescencia pseudocolor TMRM con un máximo de brillantes que representan a amarillo y negro y la intensidad mínima, respectivamente. La pérdida de fluorescencia TMRM de las regiones mitocondrial indica el colapso de ΔΨm a FCCP tratamiento (grupo B). La representación cuantitativa de los cambios en la intensidad de fluorescencia TMRM en diferentes momentos antes y después del tratamiento FCCP se muestra en el panel C. (D) Imagen de fluorescencia de las neuronas corticales de rata cargado con H2DCF-DA. Después de determinar la base de DCF de fluorescencia, las células fueron tratadas con 200 mM H 2 O 2, y el cambio en la fluorescencia de DCF se evaluó. Un aumento en la fluorescencia de DCF refleja el aumento en los niveles de ROS en H 2 O 2 tratamiento (E). El análisis cuantitativo de los cambios en la fluorescencia de DCF, antes y después de H 2 O 2 tratamiento, se muestra en el panel de F. barra de escala = 10 m
Video.7.1 - labmedia 2704_Joshi.avi
En vivo de imágenes de células en las neuronas corticales TMRM antes y después de la adición FCCP con objetivo de 40X. La intensidad de pseudocolor muestra un máximo (de color amarillo brillante, antes de añadir FCCP) y la disminución (de color rojo, después de la adición FCCP) la intensidad de fluorescencia después de la adición TMRM FCCP. Haga clic aquí para ver el video
Vídeo. 7.5 - labmedia 2704_Joshi.avi
En vivo de imágenes de células de DCF en las neuronas corticales antes y después de H 2 O 2 además con objetivo de 40X. La línea de base DCF fluorescencia de color verde claro en los cuerpos celulares y H2O2 Además aumenta la DCF intensidad de la fluorescencia de color verde brillante. Haga clic aquí para ver el video
Discusión
Hemos presentado un procedimiento paso a paso describe cómo determinar ΔΨm y ROS en ratas las neuronas corticales con el fluorescente TMRM indicadores y H 2 DCF-DA, respectivamente. Para otros tipos de células, es importante para determinar empíricamente la concentración final y el tiempo de carga de TMRM o H 2 DCF-DA. En general, la gama de concentraciones de 20 a 200 nM TMRM, y el tiempo de incubación de células con TMRM varía de 20 a 60 min. La concentración final de H 2 DCF-DA varía desde 2 hasta 10 M, y la incubación de las células en una solución de carga que contiene este indicador varía entre 30-45 minutos.
Es importante para optimizar la potencia del láser y la velocidad de escaneo de tomar las imágenes para evitar tanto la foto-toxicidad para las células y cambios en la intensidad de fluorescencia (por ejemplo, el parpadeo de TMRM fluorescencia) en ausencia de cualquier estímulo. Los ajustes ópticos optimizados debería resultar en una señal de fluorescencia que no es mayor o menor saturación (umbral) en ausencia de estímulo. Las condiciones óptimas para recoger las imágenes de un campo seleccionado en una potencia del láser en particular y una velocidad de escaneado se logra cuando no hay cambios en la intensidad de la fluorescencia de la sonda en la ausencia de cualquier estímulo durante 10-15 minutos de imágenes en vivo.
Otras sondas de fluorescencia para determinar ΔΨm incluyen rodamina 123 y tetra metil éster etílico rodamina (TMRE). Sin embargo, se encontró que inhibe los procesos respiratorios en dos mitocondrias aisladas. Es importante destacar que TMRM no tiene ningún efecto sobre la respiración mitocondrial en bajas concentraciones y tiene dos bajas y fototoxicidad photobleaching 3 en comparación con otras sondas. H 2 DCF-DA es un buen indicador de ROS como es bien retenido en las células y reconoce varias especies oxidantes, como peróxidos, óxidos de super, y el óxido nítrico 4.
Divulgaciones
Agradecimientos
Este trabajo fue financiado por los Institutos Nacionales de Salud (K22NS050137 a JCB).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| Con fondo de cristal cultura plato | MatTek Corporación | P35G-1.5-14-C | |
| NbActive4 | BrainBits | NbActive4 | |
| TMRM | Invitrogen | T668 | |
| H 2 DCF-DA | Invitrogen | C400 | |
| NaCl | Sigma | S6191 | |
| KCl | Sigma | P3911 | |
| CaCl2 • 2H 2 O | Sigma | C3306 | |
| MgCl2 • 6H 2 O | Sigma | M2670 | |
| D-glucosa | Sigma | G6152 | |
| HEPES | Invitrogen | 15630 |
Referencias
- Hilgenberg, L. G., Smith, M. A. Preparation of dissociated mouse cortical neuron cultures. J. Vis. Exp. , (2007).
- Scaduto, R. C. Jr, Grotyohann, L. W. Measurement of mitochondrial membrane potential using fluorescent rhodamine derivatives. Biophys. J. 76, 469-477 (1999).
- Ward, M. W. The amyloid precursor protein intracellular domain (AICD) disrupts actin dynamics and mitochondrial bioenergetics. J. Neurochem. 113, 275-284 (2010).
- Gunasekar, P. G., Kanthasamy, A. G., Borowitz, J. L., Isom, G. E. NMDA receptor activation produces concurrent generation of nitric oxide and reactive oxygen species: implication for cell death. J. Neurochem. 65, 2016-2021 (1995).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados