Method Article
Visualización de MG53 mediada por reparación de la membrana celular mediante In vivo Y In vitro Sistemas de
En este artículo
Resumen
Aquí descritos son protocolos que se utilizan para visualizar el proceso dinámico de la MG53 mediada por reparación de la membrana celular en todo el animal y en el nivel celular. Estos métodos se pueden aplicar para investigar la biología celular de volver a sellar la membrana plasmática y la medicina regenerativa.
Resumen
Reparación de una lesión aguda de la membrana celular es un proceso elemental de la fisiología celular normal y defectuosa reparación de la membrana se ha relacionado con muchas enfermedades humanas degenerativas. El reciente descubrimiento de la MG53 como un componente clave de la maquinaria de volver a sellar la membrana permite una mejor comprensión molecular de la biología básica de la reparación de tejidos, así como para posibles aplicaciones traslacional en medicina regenerativa. Aquí se detallan los protocolos experimentales para explorar la función in vivo de la MG53 en la reparación de una lesión muscular a través de protocolos esfuerzo en tapiz rodante en modelos de ratón, para las pruebas de la membrana ex vivo la capacidad de reparación mediante la medición de entrada de un colorante en las fibras musculares aisladas, y para vigilar el proceso dinámico de tráfico de vesículas MG53-mediada y reparación de la membrana celular en las células cultivadas mediante microscopía confocal de células en vivo.
Protocolo
1. Carrera en cinta para revelar el alcance de la lesión muscular en modelos de ratón
- Establecer el ángulo de la superficie de la cinta para su uso durante el protocolo de funcionamiento. Por lo general, una superficie plana o un ángulo de entre 7 ° y 15 ° grados hacia abajo o hacia arriba se utiliza. Algunas cintas tienen en el aparato integral para ajustar la inclinación, mientras que otros requieren de la cinta para ser elevada a través de otros medios.
- Coloque una bandeja o una plataforma de laboratorio de color azul por debajo de la cinta antes de poner los animales en la cinta para recoger los residuos de los animales durante el protocolo de funcionamiento.
- Antes de ratones corriendo debe aclimatarse al ambiente de la cinta. Esto implica la colocación de los animales en la cinta durante 15 minutos con la red eléctrica y el motor de accionamiento por correa, pero en la cinta no se mueve (es decir, con la velocidad ajustada a 0 m / s).
- Encienda la motivación red eléctrica. La intensidad y la frecuencia de los pulsos utilizados usualmente se puede controlar en cintas de correr, pero varía de un fabricante a otro. En general, la intensidad máxima no está obligado a motivar a los ratones a correr, mientras que una alta frecuencia (al menos una vez cada dos segundos) mejorará el cumplimiento.
- Activar el cinturón de cinta para iniciar el protocolo de funcionamiento. Una velocidad inicial de aproximadamente 5 m / min se debe utilizar para un período de calentamiento para los ratones. La velocidad de la cinta se puede acelerar lentamente, por lo general mediante la adición de 1.2 metros / minuto por cada minuto después del comienzo de la cinta.
- El cumplimiento de los animales en la mayoría de los protocolos se pueden mejorar mediante la realización de una serie de tiradas cortas (5 minutos) a una velocidad de calentamiento de 3 a 10 días antes de la marcha experimental se inicia.
- Un ejercicio de agotamiento agudo suele implicar el aumento de la velocidad de la cinta con el tiempo hasta una velocidad máxima (generalmente <30 m / m) se logra y se mantiene hasta que los ratones muestran signos de agotamiento. Criterios para juzgar el agotamiento varían, pero generalmente incluyen un ratón de gastar más de la mitad del tiempo en la red eléctrica o 5 segundos consecutivos en la red eléctrica sin tener que regresar a la superficie cinta de correr. Después de un ratón individual se agota, puede ser removido de la cinta y el tiempo total de funcionamiento se pueden grabar.
- Cambiar el ángulo de la cinta puede ser utilizado en ensayos agudos en ejecución para aumentar la carga de ejercicio (con un ángulo hacia arriba) o para inducir a dañar las contracciones excéntricas (con un descenso del ángulo) que destruyen las membranas del sarcolema de una fibra muscular. Colorante azul de Evans puede ser inyectado en los animales antes de estos procedimientos para su uso como colorante histológico para identificar las fibras musculares dañadas 2,3.
- El entrenamiento de resistencia corriendo protocolos proporcionan una carga de ejercicio para el animal durante un período prolongado de tiempo (hasta meses) a fin de producir la remodelación del músculo o el sistema cardiovascular. Calentamiento procedimiento es el mismo que el anterior (paso 1.5), sin embargo la velocidad máxima suele ser menor y los tiempos de funcionamiento puede ser bastante largo (> 1 hora).
- Después de terminar de correr a los ratones pueden ser devueltos a sus jaulas. Cintas de correr por lo general llegar a ser muy sucia, mientras que los ratones se están ejecutando, en especial a través de protocolos de largo. Es necesario limpiar la cinta, por lo general con un spray de etanol al 70%, después de cada uso.
2. Ex ensayo in vivo de la capacidad de reparación de membrana de las fibras musculares aisladas después de la radiación UV-láser daños
- Diseccionar la capa superficial del flexor corto de los dedos (FDB) los músculos del pie del ratón. En primer lugar, cortar la piel de la única abierta en la línea media, teniendo cuidado de no dañar el músculo debajo, a continuación, hacer cortes horizontales y quitar la piel. El tendón del músculo blanco plano de la FDB (tendón proximal) se puede ver inserta en el hueso calcáneo. Sin rodeos por separado del tendón por las pinzas y cortar el tendón cerca del sitio de unión, toma el tendón sin la ayuda de fórceps y tire hacia arriba suavemente para separar la FDB de los tejidos circundantes al cortar cualquier tejido conectivo que permanecer unidos. Al ver a la rama de tendones distales a los dígitos puede ser la FDB mediante cortes en los tendones conectan a la capa más profunda de los músculos.
- Ponga el paquete muscular FDB en 1 ml de solución de colagenasa pre-calentado a 37 ° C en un tubo Eppendorf de 1,5 ml, la cinta del tubo en posición horizontal en un 37 ° C agitador orbital y agitar a 200 rpm durante 65 min. Tiempos de incubación puede tener que ser ajustados para garantizar una digestión suficiente, lo que se indica con un aspecto desgastado y el color pálido de los músculos.
- Transferir cuidadosamente el paquete de FDB digerido en un tubo de centrífuga de 1,5 l que contiene unos 600 l de 2,5 Ca 2 + Tyrode a través de una punta de pipeta de 1 ml con un extremo de corte que tiene un diámetro suficiente para permitir que el paquete de digerir para pasar fácilmente a través de sin interrupción. Mueva suavemente el tubo para sacudir las fibras sueltas del paquete.
- Cortar una punta de pipeta de 30 l para que el diameter es sólo ligeramente menor que el haz muscular (entre 15 a 20 micras de diámetro) Use la pipeta para sacar con cuidado el paquete en la pipeta y luego empuje hacia atrás en la solución.. Repita este proceso hasta que la mayoría de las fibras se desvinculan del paquete.
- Mezcla de fibras disociadas y girando suavemente el tubo, tome la cantidad deseada y colocar en un plato con fondo de vidrio delta T. El volumen de carga puede variar en función de la eficacia del aislamiento y el número de fibras útiles que se necesitan en un plato para un protocolo determinado. Las fibras restantes se pueden almacenar en el tubo a 4 ° C durante aproximadamente 6 horas de estudios adicionales.
- Dejar que la cápsula que se siente en reposo durante 5 minutos. Esto permite que las fibras se adhieren al fondo de cristal de la placa.
- Coloque el plato con fondo de cristal en un microscopio confocal equipado con un láser UV. Observe las fibras bajo el microscopio de fase con un aumento de> 100 veces para comprobar la presencia de un patrón de estriación normal y una barra recta, como la forma.
- Añadir FM1-43 o FM4-64 tintes styrylpyridinium 4 a solución a una concentración final de 2,5 M 5.
- Para inducir daño a la posición de la fibra en la ventana de imagen por lo que la fibra está orientado en un ángulo de 45 ° desde la parte superior izquierda del campo de visión de la parte inferior derecha (Figura 1). Irradiar un área de píxeles de 5x5 (aproximadamente 0.9μmx0.9μm) de la membrana plasmática utilizando un láser UV (80 mW o más, 351/364 nm), establecido a la máxima potencia durante 5 segundos. La región irradiada debe partir de la membrana plasmática, es decir, la mitad de la caja de 5x5 debe estar dentro de la fibra, mientras que el resto debe estar fuera de la fibra (Figura 1).
- Capturar imágenes de entrada tinte en la fibra, a intervalos de 5 segundos cada uno durante un máximo de 5 minutos.
- Repita el paso 2.8 para no más de 3 fibras por plato, ya que el colorante fluorescente con el tiempo se endocitosis en la fibra y complican cualquier análisis de datos. Después de 3 fibras de un nuevo plato debe estar preparado en el paso 2.5.
- Analizar los datos mediante el cálculo del cambio en la intensidad de fluorescencia (Df / F 0) entre cada fotograma capturado para medir la cantidad de entrada de medio de contraste. Esto requiere la medición de la fluorescencia media de un área de aproximadamente 200 m 2 con el software de análisis, tales como la disposición del público ImageJ (http://rsbweb.nih.gov/ij/). Para la comparación entre las fibras, el siguiente cálculo debe ser realizado para cada cuadro: Df / F 0, donde F 0 es la media de fluorescencia de la región de interés en el primer fotograma capturado (t = 0, antes de la lesión), y es Df el cambio en la fluorescencia de cada fotograma siguiente (FF 0).
3. En vivo de imágenes de células confocal para vigilar el proceso dinámico de Reparación de la Membrana Celular
- Micropipetas se hicieron a partir PYREX capilares. El capilar se coloca en un extractor de micropipeta y tirado por el programa pre-establecido (calor = 695; Tire = 50; Vel .= 55; hora = 250).
- Micropipeta se adjuntó a una de 3 ejes (XYZ) micromanipulador.
- Las células son transfectadas con el plásmido de ADN utilizando los métodos normales en un plato con fondo de cristal delta T. Los medios de comunicación deben ser cambiados a 2,5 mm de Ca 2 + tampón de Tyrode antes de comenzar los experimentos.
- Los platos de cristal que contiene las células transfectadas fueron colocados en un microscopio confocal de barrido láser con el objetivo de 40X 1.3NA inmersión en aceite.
- La aguda de células vivas daños se llevó a cabo mediante la inserción de la micropipeta en la membrana celular y rápidamente retirar la micropipeta fuera de la célula 3,6. Consecutivos imágenes de células vivas se han obtenido en un intervalo de 1,54 s / marco.
- Para el ensayo de saponina inducida disrupción de la membrana, 0,005% de saponina (Sigma) en 2,5 mm de Ca 2 + tampón de Tyrode fue perfundido por un sistema de perfusión de flujo por gravedad a medida montado 7. La velocidad de perfusión es de aproximadamente 1 ml / min y la punta de la perfusión se debe colocar directamente sobre la célula se va a examinar.
4. Los resultados representativos:
Una película representativa de la carrera en cinta ergométrica ratón se pueden hacer durante el rodaje. La película se ilustra la disminución de la capacidad de funcionamiento de la mg53-/ - ratones debido a daños en el músculo esquelético.
La extensión del daño causado por el protocolo de los rayos UV-láser se detalla más arriba depende de la capacidad de reparación de la membrana de la fibra analizado. Esta capacidad se ve afectada por el genotipo del ratón desde que se aisló de la fibra, las condiciones extracelular, y cualquier alteración de la expresión de proteínas (transfección o infección). Una fibra normal de tipo salvaje permitirá la entrada de leve a moderada tinción (Figura 2a). Fibras musculares derivados de la mg53-/ - ratones con capacidad comprometida reparación de la membrana se mostrará la entrada más importante de colorante en la fibra (Figura 2b).
Los resultados típicos para la translocación de microelectrodos muestran lesiones de MG53 contienen vesiobstáculos para el sitio de la lesión. Figura 3a y 3b muestran GFP-MG53 transfectadas C2C12 miotubos dañados mediante la inserción de la micropipeta en la membrana celular. En la celda antes de que el daño micropipeta, GFP-MG53 se encuentra tanto en la membrana plasmática y el citoplasma 3. Después de la penetración micropipeta, GFP-MG53 vesículas que contienen se movió hacia los sitios de daño (como se indica en punta de flecha). La figura 3c muestra una MG53 GFP-transfectadas C2C12 mioblastos tratados con 0,005% de saponina, un detergente que se puede permeabilizar la membrana plasmática. En el tratamiento de saponina, GFP-MG53 trasladadas desde el citosol a la membrana celular.
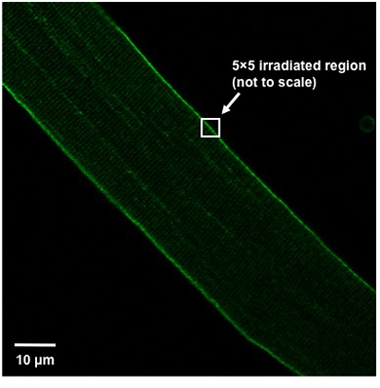
Weisleder, et al. Figura 1. Fibra de la alineación y la definición de región de la lesión. Correcta orientación de las fibras musculares aisladas en el campo de visión y definición de la región muestran una lesión.
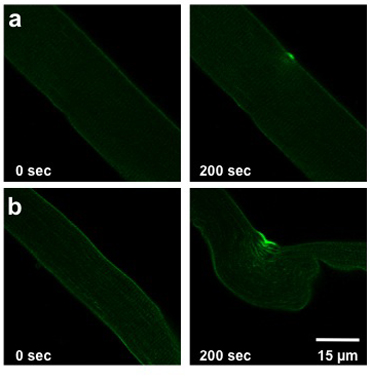
Weisleder, et al. Figura 2. Daño de la fibra láser UV FDB. Las imágenes muestran las fibras antes de la lesión (0 segundos, a la izquierda) y en 200 segundos después de la lesión (derecha). Las fibras de un ratón de tipo salvaje (a) muestran lesiones leves. Las fibras procedentes de los ratones con la reparación de la membrana comprometida (b) permitir que más tinte para entrar.
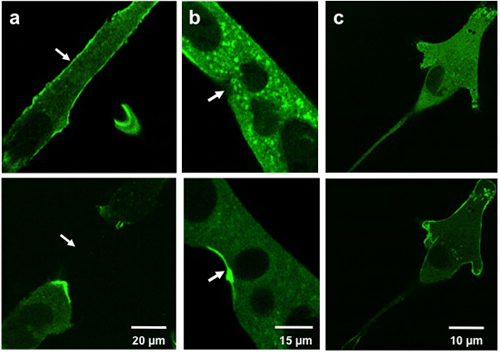
Weisleder, et al. Figura 3. Daños microelectrodo y saponina a las células cultivadas. Las imágenes muestran miotubos C2C12 (a, b) y mioblastos C2C12 (c) antes de la lesión (arriba) y después de la lesión (abajo). Las células dañadas con un microelectrodo (a, b) muestran MG53 desplazamiento a los sitios de la lesión (flechas). Las células tratadas con saponina (c) muestran MG53 translocación a la membrana celular.
Discusión
Carrera en cinta ergométrica es una metodología útil a proporcionar una carga de ejercicio para los animales tratados. Como una metodología para la medición de la función muscular o la capacidad de resistencia es un enfoque notablemente ruidoso que es difícil de ejecutar en forma consistente reproducible 8. En general, los tiempos hasta el agotamiento puede ser utilizado como un punto final para resolver las diferencias principales entre los grupos experimentales, tales como las que existen entre algunas líneas de octavos de final del ratón y los ratones de tipo salvaje 9. Manipulaciones experimentales que producen diferencias más sutiles, tales como algunos ensayos farmacéuticos, no puede resolver las diferencias por encima del ruido asociado a esta técnica. Con el fin de maximizar la reproducibilidad y la sensibilidad de estas técnicas es importante para mantener las condiciones para una sesión a otra muy de cerca. La hora del día los animales se ejercen, así como las condiciones de período de calentamiento utilizado, son factores importantes y debe permanecer constante de ensayo a otro.
Efectos de la tensión puede tener un impacto significativo en el diseño de los protocolos de rutina, como ciertas cepas de ratones puede funcionar durante mucho más tiempo en la cinta que otras cepas y responden de manera diferente al ejercicio de resistencia 10. Como pauta general, muchos ratones se podrá ejecutar total de 200-300 metros en un estudio de agotamiento con el aumento constante de la velocidad de la cinta (5 m / m velocidad inicial de 1 m / m añadido por cada minuto después del arranque). Para un ejercicio de resistencia de los ratones se puede ejecutar de 9 a 12 m / m durante 30 minutos dos o tres veces a la semana. Sin embargo, los estudios individuales por lo general requieren una optimización del protocolo para que coincida con las necesidades individuales de experimentación.
El procedimiento de los rayos UV-láser ha demostrado ser un método eficaz para medir la capacidad de reparación de la membrana de las fibras musculares esqueléticas 3,6,11. Un componente vital para el éxito de estos experimentos es el uso de las fibras musculares que sólo mostrar una apariencia recta, en forma de varilla con un patrón regular de estrías y un sarcolema suave que no parece arrugada. Si las fibras musculares de otro tipo son seleccionados daño de la membrana puede estar ya presente en las fibras y la interpretación de los resultados de estos experimentos pueden ser complicados. También es importante que la orientación de la fibra y la definición de la región irradiada que se definen en la Figura 1. Esto proporciona una lesión de tamaño reproducible, permitiendo así la comparación entre las fibras. Si la región definida de la lesión se encuentra por completo dentro de la fibra, una lesión, se creará en lugar de interrumpir el sarcolema. Además, el valor calculado para Df / F 0 es muy sensible a la región de interés seleccionados para la medición de la fluorescencia media. Un área de aproximadamente 200μm 2, adyacentes e incluyendo el sitio de la lesión, es la adecuada. A diferencia de la región definida por lesión, esta área debe estar completamente dentro de la fibra. Si se incluye el espacio fuera de la fibra, el área en blanco resultante se incrementará Df / 0 F en las fibras con la entrada de tinte poco tiempo que reduce Df / 0 F en las fibras con un fenotipo más grave. Esto disminuye la sensibilidad de la prueba, con lo que la comparación entre las fibras más difícil.
Para la prueba de daño micropipeta, el ángulo entre la micropipeta y un plato con fondo de cristal debe ser aproximadamente 45 grados con el fin de los daños efectivamente la membrana celular. Las células fueron elegidos por los daños micropipeta debe estar bien pegada al fondo del recipiente y de células redondeadas no debe ser utilizado desde más probable es que se separará después de meter micropipeta. Experimentos saponina permeabilzation son técnicamente menos exigentes y más rápido para llevar a cabo relativamente en comparación con los ensayos de penetración micropipeta. Sin embargo, existen varias limitaciones a los daños saponina, entre ellos el de una sola célula puede ser utilizado por plato desde la saponina se difundirá y daños en otras células en el plato.
Divulgaciones
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| Roedor cinta | Columbus Instrumentos Exer 03.06 o su equivalente | ||
| 70% de etanol | ISC Bioexpress | ||
| Herramientas de disección como pinzas de punta fina, tijeras de primavera | Mundial de Instrumentos de Precisión | ||
| 2 mg / ml de colagenasa tipo I | Sigma | ||
| 0 Ca 2 + Tyrode buffer (140 mM NaCl, KCl 5 mM, HEPES 10 mM, MgCl2 2 mM, pH 7,2, 290 mOsm) | Sigma | ||
| 2,5 Ca 2 + Tyrode buffer (140 mM NaCl, 2,5 mM de CaCl2, KCl 5 mM, HEPES 10 mM, 2 mM MgCl 2, pH 7,2, 290 mOsm) | Sigma | ||
| Temperatura controlable agitador orbital | New Brunswick o equivalente | ||
| Delta TPG plato | Fisher Scientific | 1207133 | |
| LSM 510 microscopio confocal con una empresa 80 mW láser UV o equivalente microscopio confocal | Zeiss | ||
| FM1-43 o los tintes FM4-64 | Invitrogen | ||
| Los capilares de borosilicato Tamaño 0,8-1,0 x 100 mm | PYREX | Parte N º 9530-2 | |
| Micropipeta extractor | Sutter Instrumentos | modelo P-97 | |
| 3 ejes micromanipulador | Narishige | MHW-3 | |
| Radiación láser de 2100 microscopio confocal de barrido microscopio o equivalente | BioRad | MHW-3 | |
| Saponina | Sigma | 47036 |
Referencias
- Armstrong, R. B., Ogilvie, R. W., Schwane, J. A. Eccentric exercise-induced injury to rat skeletal muscle. J Appl Physiol. 54, 80-93 (1983).
- Hamer, P. W., McGeachie, J. M., Davies, M. J., Grounds, M. D. Evans Blue Dye as an in vivo marker of myofibre damage: optimising parameters for detecting initial myofibre membrane permeability. J Anat. 200, 69-79 (2002).
- Cai, C. MG53 nucleates assembly of cell membrane repair machinery. Nat Cell Biol. 11, 56-64 (2009).
- Cochilla, A. J., Angleson, J. K., Betz, W. J. Monitoring secretory membrane with FM1-43 fluorescence. Annu Rev Neurosci. 22, 1-10 (1999).
- McNeil, P. L., Miyake, K., Vogel, S. S. The endomembrane requirement for cell surface repair. Proc Natl Acad Sci U S A. 100, 4592-4597 (2003).
- Cai, C. Membrane repair defects in muscular dystrophy are linked to altered interaction between MG53, caveolin-3, and dysferlin. J Biol Chem. 284, 15894-15902 (2009).
- Wang, X. Cardioprotection of ischemia/reperfusion injury by cholesterol-dependent MG53-mediated membrane repair. Circ Res. 107, 76-83 (2010).
- Knab, A. M. Repeatability of exercise behaviors in mice. Physiol Behav. 98, 433-440 (2009).
- Zhao, X. Enhanced resistance to fatigue and altered calcium handling properties of sarcalumenin knockout mice. Physiol Genomics. 23, 72-78 (2005).
- Massett, M. P., Berk, B. C. Strain-dependent differences in responses to exercise training in inbred and hybrid mice. Am J Physiol Regul Integr Comp Physiol. 288, 1006-1013 (2005).
- Bansal, D. Defective membrane repair in dysferlin-deficient muscular dystrophy. Nature. 423, 168-172 (2003).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados