Method Article
Imágenes en vivo del calcio celular combinado con el silenciamiento de genes mediada por siRNA Identifica Ca 2 + Canales de fugas en la membrana del ER y sus mecanismos de regulación
En este artículo
Resumen
El retículo endoplasmático juega un papel clave en la biogénesis de proteínas y en la homeostasis del calcio. Hemos establecido un sistema experimental que nos permite abordar el papel de los canales de Ca2 + de fugas y para caracterizar sus mecanismos de regulación putativo. Este sistema consiste en el silenciamiento de genes mediada por siRNA y de células vivas imágenes de Ca2 +.
Resumen
En células de mamíferos, el retículo endoplasmático (ER) juega un papel clave en la biogénesis de proteínas, así como en la señalización del calcio 1. El heterotrimeric Sec61 complejo en la membrana del ER proporciona una ruta acuosa de polipéptidos recién sintetizados en el lumen del ER. Trabajos recientes de varios laboratorios sugieren que este complejo heterotrimeric también forma transitoria de Ca 2 + canales de fuga de 2-8. La observación clave de esta idea fue que la liberación de polipéptidos nacientes de los ribosomas y complejo Sec61 por puromicina conduce a la liberación transitoria de Ca 2 + de la sala de emergencias. Además, se ha observado in vitro que la proteína luminal ER Bip está involucrado en la prevención de la permeabilidad de iones a nivel del complejo Sec61 9,10. Hemos establecido un sistema experimental que nos permite abordar directamente el papel del complejo Sec61 como posibles canales de Ca 2 + de fuga y la caracterización de sus mecanismos de regulación putativo 11-13. Este sistema combina mediada siRNA silenciamiento de los genes y células vivas imágenes de Ca 2 + 13. Las células son tratadas con siRNAs que se dirigen contra la codificación y la región no traducida (UTR), respectivamente, del gen SEC61A1 o un siRNA control negativo. En el análisis de complementación, las células co-transfectadas con un vector de IRES-GFP que permite que el siRNA resistentes a la expresión del gen de tipo salvaje SEC61A1. Luego, las células se cargan con el radiométrica Ca 2 +-indicador Fura-2 para controlar simultáneamente los cambios en la citosólica de Ca 2 + de concentración en un número de células a través de un microscopio de fluorescencia. La medición continua de citosólica de Ca 2 + también permite la evaluación del impacto de los diversos agentes, como la puromicina, inhibidores de moléculas pequeñas, y thapsigargin de Ca 2 + de fuga. Este sistema experimental nos da la oportunidad única de i) evaluar la contribución de las diferentes proteínas de la membrana ER pasiva Ca 2 + flujo de salida de la sala de emergencia en varios tipos de células, ii) caracterizar las proteínas y los mecanismos que limitan el pasivo de Ca 2 + flujo de salida, y iii) estudiar los efectos de las mutaciones de las enfermedades vinculadas a los componentes pertinentes.
Protocolo
1. Preparación de soluciones madre
- Prepare libre de calcio tampón (140 mM NaCl, 5 KCl, 1 mM MgCl 2, 0,5 mM EGTA, 10 mM de glucosa en 10 mM HEPES-KOH (pH 7,35)).
- Solubilizar FURA-2 de la mañana en DMSO para obtener una solución 1 mM. Mezclar con un agitar hasta que la solución es homogénea de color amarillo claro. Proteger a la taza de la luz. Diluir la FURA-02 a.m. solución madre en 1 ml Dulbecco modificado por Eagle (DMEM) con 10% de suero fetal bovino (FBS) y el 1% penicilina / estreptomicina a una concentración final de 4 M para la carga de las células HeLa.
- Preparar un 12,5 puromicina mM solución madre en agua destilada (pH 7,0). Alícuotas de almacenar a -20 ° C. Diluir el 12,5 puromicina mM solución madre en el buffer libre de calcio a una concentración final de puromicina M 500.
- Disolver thapsigargin en DMSO para obtener una solución 1 mM de archivo.
- Solubilizar 1 mg ophiobolin A en 20 l de cloroformo y, posteriormente, se mezclan con 25 l de DMSO. El tubo de microcentrífuga permanece abierta hasta que el cloroformo se evapora. Así, el final de ophiobolin una concentración de 100 mm. Alícuotas de almacenar a -20 ° C. Antes de su uso, las soluciones diluidas de valores en calcio sin buffer a una concentración final de 100 mM. Por lo tanto, la concentración final de DMSO de imágenes de células vivas no exceda del 0,1%.
- Disolver la trifluoperazina en DMSO a una concentración de 10 mM y alícuotas almacenar a -20 ° C. Las soluciones diluidas de valores en calcio sin buffer a una concentración final de 10 mM antes de su uso. Así, la concentración final de DMSO de imágenes de células vivas, como por ophiobolin A, no supere el 0,1%.
- Disolver el siRNAs (siRNA SEC61A1, siRNA SEC61A1-UTR y el control de siRNA) en RNasa libre de agua para preparar una solución 20 M de acciones. Mezclar con un vórtice y observar la solubilización de los ojos. Almacenar 50 alícuotas a -20 ° C.
2. El silenciamiento de genes en las células HeLa
Con el fin de estudiar la contribución de una determinada proteína de ER Ca 2 + flujo de salida, el gen respectivo tiene que ser eficiente callar con dos diferentes siRNAs (Fig. 1). Además, el efecto de silenciar tiene que ser superada por la expresión del gen de tipo salvaje respectivo. Normalmente usamos siRNAs que se dirigen contra la codificación y la región no codificante (UTR), respectivamente, del gen de interés. El empleo de UTR-dirigido siRNA proporciona una manera conveniente para la complementación.
- Semillas de 5,2 x 10 5 células HeLa (ATCC no. CCL-2) en una placa de cultivo de 6 cm con una hoja de 25 mm de la cubierta (pre-tratados con 200 l de ácido poli-L-lisina (1 mg / ml) durante 1 h) en Dulbecco modificado por Eagle (DMEM) con 10% de suero fetal bovino (SFB) y 1% de penicilina / estreptomicina y se incuba a 37 ° C en un ambiente humidificado con un 5% de CO 2 (volumen final 3,9 ml).
- Transfectar las células con SEC61A1 siRNA, siRNA SEC61A1-UTR, o siRNA control negativo utilizando el reactivo HiPerFect de acuerdo a las instrucciones del fabricante (concentración final de siRNA: 20 nM). En pocas palabras, preparar siRNAs recién en un tubo de microcentrífuga separados antes de la actual procedimiento de transfección: Añadir 20 l de reactivo de transfección HiPerFect a 4 l de cada siRNA (20 M) que se disuelve en 80 l de OptiMEM. Esta mezcla se agita y suavemente se incuban a temperatura ambiente durante 10 min. Añadir la mezcla de siRNA (104 l) gota a gota a la cabeza de serie 5,2 x 10 5 células HeLa (3,9 ml).
- Después de 24 h, el cambio del medio (3,9 ml) y transfectar las células por segunda vez con la mezcla de siRNA mismo (104 l).
- Evaluar el silenciamiento por Western blot. Debe estar por encima del 80%. Lavar las células de la placa de cultivo de células en tampón fosfato salino (PBS) y la cosecha en DMEM. Contar las células mediante el empleo de la lucha contra la condesa de células automatizado. Lisis de las células en tampón de lisis celular (10 mM NaCl, 10 mM Tris-HCl, pH 8,0, 3 mM MgCl 2, 0,5% NP40), complementado con un cóctel de inhibidores de la proteasa (3 mg / ml Pepstatin A, 3 mg / ml leupeptina, 3 mg / ml Antipain, 3 mg / ml Chymastatin) y mezclar con tampón SDS-muestra (60 mM Tris-HCl, pH 6,8, SDS 2%, glicerol al 10%, 5% β-mercaptoetanol, 0.01% azul de bromofenol ) para obtener una concentración final de 10.000 células / microlitro. Muestras de calor a 56 ° C durante 15 minutos y, posteriormente, añadir algunas perlas de vidrio y agitar durante 20 minutos a fragmentos de ADN. Separado de 20 l de cada muestra por un tipo de Laemmli SDS-PAGE (típicamente 15% de poliacrilamida para la separación de gel). Transferencia de las proteínas separadas a una membrana de PVDF mediante electrotransferencia ("wet-blot") a precios constantes de 400 mA durante 3 horas o toda la noche en tampón de transferencia (100 mM glicina, 12,5 mM Tris-HCl). A continuación, el bloque con un 5% (w / v) de leche baja en grasa seca en PBS durante 30 minutos a temperatura ambiente y luego exponer la mancha con el anticuerpo primario contra el C-terminal de Sec61α de conejo y un anti-β-actina de anticuerpos de ratón. Lavar la mancha en PBS-TritonX-100 (0,05%) y tWICE en PBS durante 5 min, respectivamente. Visualizar los anticuerpos primarios utilizando ECL Plex de cabra anti-IgG de conejo-Cy5 o ECL Plex de cabra anti-IgG de ratón-Cy3-conjugado y el sistema de imágenes Typhoon Trio en combinación con el software Image Quant TL 7.0. En el caso del gen SEC61A1, el efecto silenciador máxima se ve típicamente 96 horas después de la transfección en primer lugar. Un representante experimento se muestra en la figura. 2.
3. Complementación de las células HeLa
Con el fin de rescatar el fenotipo de SEC61A1 silenciamiento, la SEC61A1 cDNA se inserta en el sitio de clonación múltiple (MCS) de un sitio de entrada ribosomal interno-pCDNA3 (IRES)-GFP-vector que contenía el citomegalovirus (CMV), la MCS, el IRES, además de la proteína fluoresecent verde (GFP) la secuencia de codificación.
- 48 h después de la transfección de siRNA en primer lugar, el intercambio de la media (3,9 ml) por segunda vez y transformar las células con el vector vacío o SEC61A1 plásmido de expresión utilizando Fugene HD de acuerdo con el protocolo del fabricante (ratio final del vector a Fugene HD es de 4 mg vector a 16 l Fugene HD). En pocas palabras, preparar plásmidos recién en un tubo de microcentrífuga separados antes de que el procedimiento de transformación: Añadir 16 l de reactivo Fugene transformación HD a 4 mg de cada plásmido que se disuelve en 80 l de OptiMEM. Suavemente vórtice de esta mezcla e incubar a temperatura ambiente durante 10 min. Añadir la mezcla de plásmidos (0,1 ml) gota a gota a la cabeza de serie 5,2 x 10 5 células HeLa (3,9 ml).
- Después de 48 h de plásmido de expresión, platos sujetos a la cultura antes de la microscopía de fluorescencia de imágenes de calcio y la cosecha. Si es necesario reemplazar DMEM por PBS para mejorar las señales de fluorescencia. Grabar imágenes de fluorescencia en un microscopio de fluorescencia equipado con cámara CCD enfriado. La eficiencia de transformación se puede determinar al dividir el número de células que presentan fluorescencia de GFP por células contadas en el modo claro y debe estar por encima del 80%. Un resultado típico se muestra en la figura. 3.
4. Células vivas imágenes de calcio
- Antes de la medición, la transferencia de la hoja de la cubierta revestida con células HeLa transfectadas en una placa de cultivo separadas 3,5 cm. Las células de carga con 4 M FURA-2 de la mañana en 1 ml de DMEM durante 45 min a 25 ° C en la oscuridad 11,12.
- Fijar una hoja de 25 mm de la cubierta de metal en la cámara mencionada anteriormente y lavar las células dos veces y se incuban en un tampón libre de calcio (cada vez que 300 l).
- Empezar a recoger datos en un microscopio iMic con policromía V alternativamente excitante a 340 nm y 380 nm y medir la fluorescencia emitida a 510 nm (de filtros: divisor, 565 nm; emisor, 605/70 nm). Las imágenes de muestra que contiene 20 a 50 células / frame cada 3 s. Registro FURA-2 señales de que la relación F340/F380, F340 y F380 que corresponden a los antecedentes-resta intensidad de fluorescencia a 340 y 380 nm, respectivamente.
- Después de 1 minuto, tratar las células con puromicina (500 M) en tampón libre de calcio o con el mismo tampón. Por otra parte, tratar las células con un inhibidor de molécula pequeña (como la trifluoperazina M 10 o 100 M ophibolin A) o con el tampón libre de calcio.
- Después de las mediciones radiométrica se llevan a cabo de 2 a 10 minutos, añadir thapsigargin (1 M) y continuar con las mediciones.
- Con el tiempo, cytoslic [Ca 2 +] se calcula a partir de mediciones relación con un método de calibración establecida. 2 Analizar los datos de Excel 2007 y origen 6.1.
5. Los resultados representativos:
Hasta ahora, hemos abordado la cuestión de si el silenciamiento del gen afecta SEC61A1 calcio (Ca 2 +) las fugas de la sala de emergencia (Fig. 1). El gen SEC61A1 fue silenciada por dos diferentes siRNAs en células HeLa durante 96 horas. Mientras que el silenciamiento de crecimiento apenas se ven afectados y la viabilidad celular, el transporte de proteínas en la sala de emergencias de semi-permeabilized células se inhibió casi completamente. Además, las células SEC61A1 silencio se vieron gravemente afectados con respecto a Ca 2 + de fuga de la sala de emergencias. El efecto de silenciamiento de los genes fue revocada por la expresión del gen SEC61A1. Por lo tanto, Sec61 complejos que están presentes en la membrana del ER de todas las células nucleadas forma canales de Ca 2 + de fugas que se puede esperar para jugar un papel fundamental en la homeostasis del Ca 2 +. Sin embargo, la presencia de grandes poros llenos de agua con la permeabilidad de iones de control, como formado por Sec61 complejos en la membrana del RE, seriamente interferir con la liberación regulada de Ca 2 + desde el lumen del RE en el citosol, un mecanismo esencial para intracelular señalización. Se identificó un calmodulina (CaM) motivo de unión en el citosol N-terminal de Sec61α mamíferos que la CAM consolidados, pero no de Ca 2 + libre apocalmodulin con afinidad nanomolar y especificidad de secuencia. A nivel celular, dos antagonistas de la CaM diferentes estimulado Ca 2 + liberación de las ER en la presencia, pero no en la ausencia de canales Sec61 (Figuras 4 y 5). Este último no se observó cuando Sec61 canales estaban presentes que contenían mutaciones en el motivo de IQ Sec61α. Por lo tanto, Ca 2 +-CAM está involucrado en la limitación de Ca 2 + de fuga de la sala de emergencia (Fig. 6).
Figura 1. Diagrama de flujo. Ver texto para más detalles.
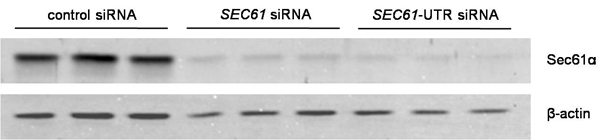
Figura 2. Análisis de los datos para silenciar la eficiencia. Silenciar fue evaluada mediante Western-blot utilizando anticuerpos que se dirige contra Sec61α y β-actina (control de carga). Los anticuerpos primarios fueron visualizadas mediante el uso de anticuerpos ECL Plex secundaria y de imágenes de fluorescencia.
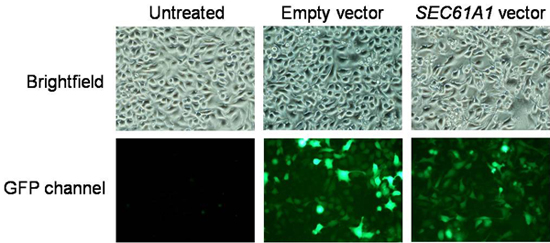
Figura 3. Análisis de los datos de eficacia de la transfección. Las imágenes fueron grabadas en un microscopio de fluorescencia equipado con cámara CCD enfriado. La eficiencia de transformación se puede determinar al dividir el número de células que presentan fluorescencia de GFP por células contadas en el modo de campo claro.

Figura 4 disparos. Pantalla de imágenes en vivo de calcio celular de las células HeLa en presencia de control o SEC61A1 siRNA y la presencia o ausencia del antagonista del CAM-células ophiobolin A. HeLa fueron tratados con siRNA dirigido contra SEC61A1 (B) o un siRNA control negativo (A) durante 96 horas como se indica. Estas células se cargaron con el indicador de calcio fura-2 AM y se incubaron en un tampón de Ca 2 + libre que contiene 0,5 mM EGTA, luego de amortiguación o ophiobolin A (Ophio A) en tampón y se añadió reanudó la incubación. Después de 10 minutos, liberación de Ca 2 + se inició mediante la aplicación de thapsigargin (TG) en ausencia de Ca 2 + externo y la incubación se continuó. Las capturas de pantalla de la imagen continua de calcio fueron tomadas en el momento indicado.
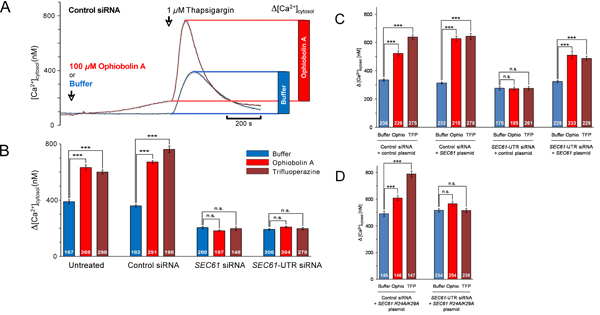
Figura 5. Análisis de los datos para los experimentos de células vivas imágenes de calcio. (A) El análisis cinético y cuantitativa de una serie de experimentos como se muestra en la figura. 4A. Cytoslic [Ca 2 +] se calcula a partir de mediciones relación con un método de calibración establecida 2. El efecto de thapsigargin se muestra como diagrama de barras. (BD) Las células fueron tratadas con siRNA control o el indicado SEC61A1-siRNA durante 48 horas y luego se transformó con el vector de control, ya sea (C), o SEC61A1 plásmido de expresión (C), o mutantes SEC61A1 plásmido de expresión (D) como se indica. Después de 48 h, los experimentos de imagen de calcio se llevaron a cabo como en las figuras 4 y 5A. El análisis estadístico de los cambios en la citosólica de Ca 2 + de concentración después de la adición de thapsigargin en los experimentos tal como se presenta en A se muestran. Los valores de p <0,001 fueron definidos como significativos por la prueba t no apareada y se indican con tres asteriscos (***), ns, no significativo. El número de células que se analizaron se indican. Los valores medios se da, las barras de error representan los errores típicos de los medios de barrido (SEM). Tomamos nota de que estos ejemplos han sido adaptados de ref. 13.
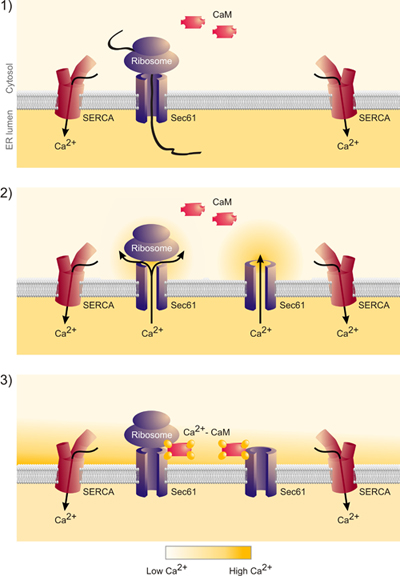
Figura 6. Estos datos indican que la liberación de las cadenas nacientes del complejo Sec61 de hecho conduce a la liberación de calcio desde la sala de emergencias y la formación de un nanodomain de calcio alrededor de la boca citosólica del complejo Sec61. Este calcio se une a la calmodulina y calcio-calmodulina se cierra el complejo Sec61. "
Discusión
En células de mamíferos, el retículo endoplasmático (ER) juega un papel clave en la biogénesis de proteínas, así como en la señalización de calcio. Aquí hemos descrito un sistema experimental que nos permite abordar directamente el papel de un potencial canal de Ca 2 + de fuga y la caracterización de sus posibles mecanismos reglamentarios 13. Este sistema experimental nos da la oportunidad única de i) evaluar la contribución de las diferentes proteínas de la membrana ER pasiva Ca 2 + flujo de salida de la sala de emergencia en varios tipos de células, ii) caracterizar las proteínas y los mecanismos que limitan el pasivo de Ca 2 + flujo de salida, y iii) estudiar los efectos de las mutaciones de las enfermedades vinculadas a los componentes pertinentes.
Tomamos nota de que sólo las células viables deben ser analizados y que la viabilidad en general debe estar por encima del 80%. Por lo tanto, la viabilidad celular es evaluada en forma rutinaria empleando nucleares ID reactivo para la viabilidad de azul / verde de acuerdo con el protocolo del fabricante. Además, el análisis estadístico de los cambios en el citosol concentración de Ca2 + es obligatorio. Por lo tanto, los experimentos que se llevarán a cabo durante cuatro lotes diferentes de las células y los dos cubreobjetos con al menos 20 células tienen que ser analizados para cada condición en un solo experimento. Tomamos nota de que los diversos experimentos que se llevarán a cabo al mismo tiempo, después de la siembra en el cubreobjetos.
Divulgaciones
Agradecimientos
SL fue apoyado por una beca de la DFG (Escuela de Posgrado de Investigación 845). Este trabajo fue apoyado por becas de la DFG (SFB y 530/C1 PARA 967) y por HOMFOR.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| DMEM + Glutamax | Invitrogen | 31966 | |
| OptiMEM + Glutamax | Invitrogen | 51985 | |
| FBS | Biochrom | S0115 | |
| Penicilina / estreptomicina | PAA | P11-010 | |
| HiPerFect | Qiagen | 301707 | |
| Fugene HD | Roche Diagnostics | 04709713 | |
| Nuclear-ID Azul / Verde reactivo de viabilidad celular | Enzo Ciencias de la Vida | ENZ-53004 | |
| FURA-02 a.m. | Invitrogen | F-1221 | |
| Puromicina | Sigma | P 7255 | |
| Thapsigargin | Invitrogen | T-7459 | |
| A Ophiobolin | Enzo Ciencias de la Vida | ALX-270-109 | |
| Trifluoperazina | Sigma | T 6062 | |
| Condesa ® contador celular automático | Invitrogen | ||
| Tifón-Trio sistema de imágenes | GE Healthcare | ||
| TE2000-S microscopio con cámara DS-5Mc | Nikon | ||
| microscopio iMic con policromía V | Hasta Fotónica |
Referencias
- Clapham, D. E. Calcium signalling. Cell. 131, 1047-1058 (2007).
- Lomax, R. B., Camello, C., Van Coppenolle, F., Petersen, O. H., Tepikin, A. V. Basal and physiological Ca2+ leak from the endoplasmic reticulum of pancreatic acinar cells. J. Biol. Chem. 277, 26479-26485 (2002).
- Van Coppenolle, F. Ribosome-translocon complex mediates calcium leakage from endoplasmic reticulum stores. J. Cell Sci. 117, 4135-4142 (2004).
- Flourakis, M. Passive calcium leak via translocon is a first step for iPLA2-pathway regulated store operated channel activation. FASEB J. 20, 1215-1217 (2006).
- Giunti, R., Gamberucci, A., Fulceri, R., Banhegyi, G. Both translocon and a cation channel are involved in the passive Ca2+ leak from the endoplasmic reticulum: a mechanistic study on rat liver microsomes. Arch. Biochem. Biophys. 462, 115-121 (2007).
- Ong, H. L., Liu, X., Sharma, A., Hegde, R. S., Ambudkar, I. S. Intracellular Ca2+ release via the ER translocon activates store operated calcium entry. Pflugers Arch. Eur. J. Physiol. 453, 797-808 (2007).
- Amer, M. S. Translocon closure to Ca2+ leak in proliferating vascular smooth muscle cells. Am. J. Physiol. Heart Circ. Physiol. 296, 910-916 (2009).
- Tu, H. Presenilins form ER Ca2+ leak channels, a function disrupted by familial Alzheimer's disease-linked mutations. Cell. 126, 981-993 (2006).
- Hamman, B. D., Hendershot, L. M., Johnson, A. E. BiP maintains the permeability barrier of the ER membrane by sealing the lumenal end of the translocon pore before and early in translocation. Cell. 92, 747-758 (1998).
- Alder, N. N., Shen, Y., Brodsky, J. L., Hendershot, L. M., Johnson, A. E. The molecular mechanism underlying BiP-mediated gating of the Sec61 translocon of the endoplasmic reticulum. J. Cell Biol. 168, 389-399 (2005).
- Aneiros, E., Philipp, S. E., Lis, A., Freichel, M., Cavalie, A. Modulation of Ca2+ signalling by Na+/Ca2+ exchangers in mast cells. J. Immunol. 174, 119-130 (2005).
- Gross, S. A. TRPC5 is a Ca2+-activated channel functionally coupled to Ca2+-selective ion channels. J. Biol. Chem. 284, 34423-34432 (2009).
- Erdmann, F. Interaction of calmodulin with Sec61a limit Ca2+ leakage from the endoplasmic reticulum. EMBO J. 30, 17-31 (2011).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados