Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Asistida por microondas de un bote de síntesis de N-Succinimidil-4-[ 18 F] fluorobenzoato ([ 18 F] SFB)
* Estos autores han contribuido por igual
En este artículo
Resumen
Una fácil, one-pot síntesis de N-succinimidil-4-[ 18 F] fluorobenzoato ([ 18 F] SFB) fue desarrollado sobre la base de un no-acuoso, proceso radioquímico de tres pasos. Usando calentamiento por microondas, el procedimiento se puede completar en menos de 30 minutos o 60 minutos con posterior purificación por HPLC preparativa. La decadencia corregida rendimiento radioquímico (RCYs) fueron 35-5% (n> 30).
Resumen
Biomoléculas, como péptidos, proteínas 01.09, 10,11 y anticuerpos y sus fragmentos de ingeniería, 12-14 están ganando importancia como agentes terapéuticos potenciales y de imagen molecular. En particular, cuando se han etiquetado con radioisótopos emisores de positrones (por ejemplo, Cu-64, Ga-68 o F-18), que pueden ser utilizados como sondas para la imagen objetivo de muchos procesos fisiológicos y patológicos. 15-18 Por lo tanto, un esfuerzo significativo ha dedicado a la síntesis y la exploración de 18 F-etiquetados biomoléculas. Aunque hay ejemplos de la elegante directa 18 F-etiquetado de los péptidos, 19-22 de las condiciones de reacción dura (es decir, un disolvente orgánico pH, extrema, alta temperatura) asociados con radiofluorination directos suelen ser incompatibles con las muestras de proteínas frágiles. Hasta la fecha, por lo tanto, la incorporación de grupos prostéticos radiomarcado en biomoléculas sigue siendo el método de elección 23,24.
N-succinimidil-4-[18 F] fluorobenzoato ([18 F] SFB), 25-37 de un reactivo tipo de Bolton-Hunter que reacciona con los grupos amino primarios de las biomoléculas, es un grupo prostético muy versátil para los 18 F-etiquetado de un amplio espectro de entidades biológicas, en términos de su evidente en la estabilidad y el rendimiento in vivo de alta radiomarcado. Tras el marcaje con [18 F] SFB, el resultado [18 F] biomoléculas fluorobenzoylated podrían explorarse como trazadores de PET potencial de los estudios in vivo de imágenes. La mayoría de 1 [18 F] radiosyntheses SFB se describe en la literatura actual requieren dos o hasta tres reactores y purificaciones múltiples mediante el uso de cualquiera de extracción en fase sólida (SPE) o de alto rendimiento de cromatografía líquida (HPLC). Tales procesos largos dificultan la producción de rutina y amplias aplicaciones en el radiomarcado de biomoléculas. A pesar de varios módulos con ayuda de [18 F] síntesis SFB se ha informado, 29-32, 41-42 que se basan principalmente en procedimientos complicados y largos con costosos disponibles en el mercado cajas de radioquímica (Tabla 1). Por lo tanto, una mayor simplificación de la radiosíntesis de [18 F] SFB utilizando una configuración de bajo costo sería muy beneficioso para su adaptación a un proceso automatizado.
Presentamos una preparación concisa de [18 F] SFB, basado en una versión simplificada de una olla asistida por microondas de síntesis (Figura 1). Nuestro enfoque no requiere la purificación entre los pasos o los reactivos acuosos. Además, la irradiación de microondas, que se ha utilizado en la síntesis de varios trazadores de PET, 38-41 se da un mayor RCYs y una mejor selectividad de la reacción térmica correspondiente o que proporcionan rendimientos similares en los tiempos de reacción más cortos. 38 más importante, cuando el etiquetado biomoléculas , el tiempo ahorrado podría ser desviado a bioconjugation paso posterior o PET 28,43 La novedad de nuestro mejor [18 F] síntesis de SFB es doble: (1). la estrategia de desprotección anhidro no requiere la purificación de intermedios (s) entre cada paso y (2) el horno de microondas con ayuda de las transformaciones radioquímica permitir la producción rápida y fiable de [18 F] SFB.
Protocolo
1. Los preparativos iniciales
- Un V-vial (5 ml) RV1 (con barra de agitación) se utiliza como recipiente de la reacción principal para llevar a cabo la síntesis de microondas. Se conecta a un adaptador de PEEK con siete de entrada / salida conecta los puertos y dentro de la cavidad de microondas (ver Figura 2). RV2 está conectado al cartucho de SPE (I) para recoger el crudo [18 F] SFB. RV3 está conectado al cartucho de SPE (II) para la recogida de final [18 F] solución de SFB. Se puede colocar en un baño de agua tibia (40 ° C) para concentrar la solución correspondiente antes de la reconstitución en tampón PBS, especialmente para el radiomarcado aguas abajo de las biomoléculas.
- Configuración para la recolección de crudo [18 F] SFB: Llene MeCN / H 2 O [6 mL, 1:4 (v: v)] solución acuosa al 5% AcOH (8 ml), MeCN (2 ml) para un depósito, B y C, respectivamente. A continuación, activar un cartucho de SPE (I) (poliestireno, Merck LiCholut EN) con etanol (10 ml), seguido por acuosa al 5% AcOH (10 ml) de lavado.
- Configuración para la recogida purificado [18 F] SFB: Prepare depósito D y E se llenó con 10 ml de H 2 O y 3 ml de éter dietílico, respectivamente. El segundo cartucho de SPE (II) (poliestireno, Merck LiCholut EN) es activada por el mismo procedimiento antes mencionado.
- Inicie el HPLC (tampón de elución: MeCN / H 2 O, 1:1 (v / v) que contenía 0,2% TFA, caudal: 3 ml / min) para pre-acondicionamiento de la columna HPLC [a fase inversa semi-prep columna (Luna, 5 micras C18 (2) 100 A, 250 x 10 mm), Phenomenex, Torrance, CA, EE.UU.].
2. Preparación de secado [es decir, no portador añadido, (NCA)] [18 F] fluoruro
- [18 F] una solución de fluoruro en [18 O] H 2 O (100 l) se añadió a una mezcla de Kryptofix 222 (20 mg), 1M acuosa K 2 CO 3 (26 l) y MeCN (0,8 ml) en un Eppendorf tubo. Toda la solución se mezcla bien antes de transferir a la RV1 a través de la línea de entrada 1. El [18 F] una solución de fluoruro también puede ser pasado a través de un cartucho de intercambio aniónico (por ejemplo, CMA-luz Sep-Pak de Waters) para atrapar el flúor-18 y luego se eluye con una mezcla de K 2 CO 3 y Kryptofix en MeCN.
- Ejecutar la secuencia de secado (20 W, 3 min), bajo el programa de control de microondas para eliminar el agua residual en RV1 [al vacío]. Después de que el enfriamiento de la temperatura del sistema es inferior a 50 ° C, más MeCN (1,0 ml) se introduce en el reactor y la secuencia se repite una vez.
3. Síntesis de 4 - [18 F] fluorobenzoato
- A una solución de DMSO (0,4 ml) contiene 4 - (N, N, N-trimetilamonio) benzoato de triflato (1,5 mg) en RV1 través de la línea de entrada 2.
- Ejecutar la secuencia de etiquetado (50 W, 1 min), bajo el programa de control de microondas con el enfriamiento de agitación buque, y todas las válvulas cerradas para pagar 4 - [18 F] fluorobenzoato ([18 F] 2).
4. Síntesis de potasio 4 - [18 F] fluorobenzoato
- A una solución de DMSO (0,5 ml) contiene KOtBu (13 mg) en RV1 a través de la línea de entrada 3.
- Ejecutar programa de desproteger (40 W, 1 min), bajo el programa de control de microondas con el enfriamiento de agitación buque, y todas las válvulas cerradas para permitir el 4 - [18 F] fluorobenzoato sal ([18 F] 3).
5. Síntesis de crudo [18 F] SFB
- Para una solución de acetonitrilo (2,5 ml) contiene TSTU (30 mg) se añadió a la línea de entrada a través de RV1 6. TSTU es la humedad y sensibles a la luz. Cabe alícuotas en frasco pequeño y se almacenan a 4 ° C en un recipiente cerrado, cubiertas con papel de aluminio.
- Ejecutar la secuencia de acoplamiento (30 W, 2 min), bajo el programa de control de microondas con el enfriamiento de agitación buque, y todas las válvulas cerradas para permitir el crudo [18 F] SFB.
6. La preparación de los SPE-purificado [18 F] SFB
- Acuosa al 5% AcOH (1,0 ml) se añadió a través de RV1 línea de entrada de 7 a neutralizar la mezcla de reacción. La solución había sido trasladado en B vial que contiene 8 ml de una solución acuosa al 5% AcOH (Figura 2).
- Pase la mezcla de reacción se diluyó a través del cartucho SPE (I) para atrapar crudo [18 F] SFB utilizando nitrógeno (10 psi).
- LAVADO SPE cartucho (I) con una mezcla de MeCN y H 2 O [10 mL, 1:4 (v: v)] desde el embalse de A.
- [18 F] SFB se eluyó a cabo en RV2 con MeCN (2 ml) desde el embalse de C.
7. Purificación del crudo [18 F] SFB con Radio-HPLC
- Diluir bien crudo [18 F] SFB o purificada-SPE [18 F] SFB con H 2 O (2 ml) en RV2 y la transferencia de la mezcla en el circuito de HPLC (5 ml). La solución se inyecta en la radio-HPLC [O MeCN / H 2, 1:1 (v / v) que contenía 0,2% TFA, caudal: 3 ml / min].
- Recoger la fracción que contiene purificado [18 F] SFB (retención de time: 8-10 minutos) en el vial D (precargada con 10 ml de H 2 O) (Figura 2). Paso crítico: Si se realiza correctamente, el volumen de fracción recogida aquí debe ser 4-5 ml.
- Pase la mezcla de reacción se diluyó a través del cartucho SPE (II) para atrapar purificado [18 F] SFB utilizando nitrógeno (10 psi). Secar el cartucho con una corriente de nitrógeno durante 2-3 minutos.
- [18 F] SFB se eluyó a cabo en RV3 con éter dietílico (3 ml) desde el embalse de E..
- Se evapora el solvente en RV3 a sequedad mediante una suave corriente de gas nitrógeno (10 psi) con un baño de agua (40 ° C). El secado final [18 F] SFB se puede reconstituir en tampón PBS para la aplicación posterior.
8. Los resultados representativos:
Hemos desarrollado un sistema simplificado y rápido, una olla de método para la síntesis de [18 F] SFB utilizando una estrategia de desprotección en condiciones anhidras y calentamiento con microondas en cada transformación radioquímica / químicos. La figura 1 presenta los detalles de nuestro radiosíntesis. La identidad del producto final se confirmó mediante la comparación del tiempo de retención de HPLC con una referencia no radiactivo SFB. El purificado [18 F] SFB también fue analizado a través de la radio-TLC y HPLC para determinar la pureza radioquímica y química. El RCY de [18 F] SFB fue de 35 ± 5% dentro de los 60 minutos después de la purificación por HPLC (n> 30), de alta pureza radioquímica (> 99%) y buena pureza química (ver la huella UV en el perfil de HPLC, la Figura 3 ). La actividad específica fue de aprox. 67-330 GBq / mmol (1.8 a 9.0 Ci / mmol), dependiendo de la radiactividad inicial.

Figura 1. Asistida por microondas en un único recipiente radiosíntesis de [18 F] SFB. En primer lugar, la radiofluorination de 4 - (N, N, N-trimetilamonio) benzoato de triflato (1) se realizó en el calentamiento por microondas (50 W, 1 min) en presencia de [K ⊃ 2.2.2] [18 F] F - complejo en dimetilsulfóxido (DMSO) para dar 4 - [18 F] fluorobenzoato ([18 F] 2). Sin purificación, una solución de DMSO de terc-butóxido (t BuOK) y se añadió el recipiente de reacción se irradia microondas (40 W, 1 min) para completar la desprotección anhidro. La conversión final de [18 F] 3 en [18 F] SFB se logró mediante O-(N-succinimidil) - N, N, N ', N'-tetramethyluronium tetrafluoroborato (TSTU) de activación. TSTU en acetonitrilo se añadió a la mezcla de reacción que contiene el 4 - [18 F] fluorobenzoato ([18 F] 3) la sal, este paso dado crudo sintético pasado [18 F] SFB después de la calefacción (30 W, 2 min).

Figura 2. El esquema de configuración de microondas con ayuda de una olla de [18 F] síntesis de SFB.
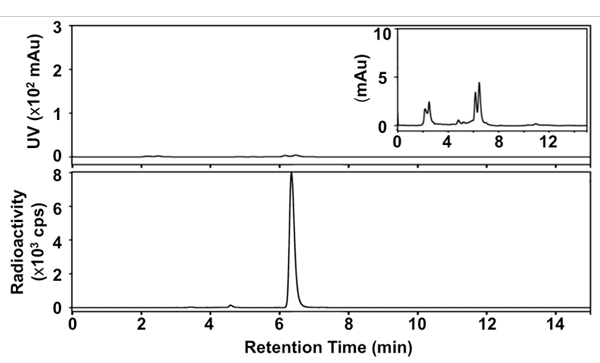
Figura 3. HPL Radio-cromatogramas de final [18 F] SFB. Arriba: La señal de UV a 254 nm, en la planta: la señal radiactiva; recuadro: UV señal a 254 nm (x 33,3).
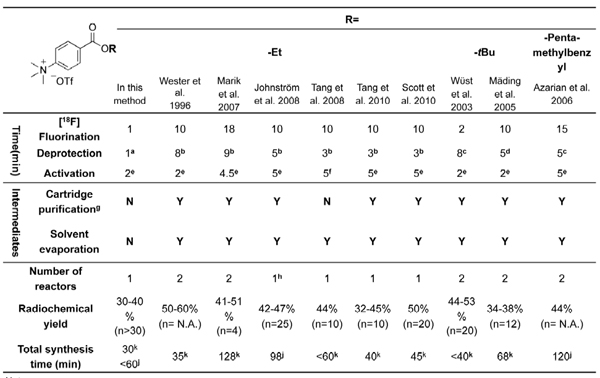
. Tabla 1 Resumen de [18 F] radiosyntheses SFB en la literatura con alquilo 4 - (trimetilamonio) triflato benzoato como precursores.
Discusión
Esto simplifica en tres pasos, en un único recipiente radiosíntesis de los 18 F-acilación reactivo [18 F] SFB se desarrolla sobre la base de la química no acuosos. Este proceso tiene una excelente reproducibilidad y podría ser utilizado de forma fiable para la producción de [18 F] SFB en los módulos de radioquímica automatizado, debido a dos modificaciones principales que se describen como de seguidores: 1. Contamos con una etapa de desprotección / saponificación en anhidro KOt...
Divulgaciones
Agradecimientos
Este estudio fue apoyado por el Departamento de Energía de EE.UU. (DE-FG02-09ER09-08 y DE-PS02-09ER09 18), el Centro Comprensivo del Cáncer Jonsson de la UCLA, y el Programa de Industria-Universidad de Investigación Cooperativa (UC Discovery Grant, bio07 -10.665). Agradecemos al Dr. Nagichettiar Satyamurthy y el personal en las instalaciones de UCLA Biomédica ciclotrón para la prestación del F-18 de radioisótopos y muchas discusiones profundas. Agradecemos a los Dres. Michael Collins, Greg Leblanc, José Lambert, y Keller Barnhardt de CEM para su asesoramiento y apoyo técnico. Damos las gracias a Dirk Williams, Williams Darin, los Dres. Joseph Hong Lin Dun y Michael van Dam para el diseño y mecanizado de piezas para modificar el reactor de microondas CEM y para los módulos de depuración de SPE.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
| ácido acético en solución acuosa (5% v / v) | Pescador | A38-500 | Preparado en nuestro laboratorio |
| Acetonitrilo | Sigma-Aldrich | 75-05-8 | |
| Éter dietílico | Sigma-Aldrich | 14775 | |
| Dimetilsulfóxido (DMSO) | Sigma-Aldrich | 472301 | |
| 4 - (N, N, N-trimetilamonio) benzoato de triflato | Preparados en el laboratorio | ||
| 4,7,13,16,21,24-Hexaoxa-1 ,10-diazabiciclo [8.8.8] hexacosane (K222) | Sigma-Aldrich | 29,111-0 | |
| O - (N-succinimidil) - N, N, N ', N'-tetramethyluronium tetrafluoroborato (TSTU) | Sigma-Aldrich | 105832-38-0 | |
| El carbonato de potasio en solución acuosa (1M) | Sigma-Aldrich | 209619 | Preparado en nuestro laboratorio |
| Terc-butóxido | Sigma-Aldrich | 156671 |
Referencias
- Okarvi, S. M. Recent progress in fluorine-18 labeled peptide radiopharmaceuticals. Eur. J. Nucl. Med. 28, 929-938 (2001).
- Chen, X. Y., Park, R., Hou, Y. P., Khankaldyyan, V., Gonzales-Gomez, I., Tohme, M., Bading, J. R., Laug, W. E., Conti, P. S. MicroPET imaging of brain tumor angiogenesis with 18F-labeled PEGylated RGD peptide. Eur. J. Nucl. Med. Mol. Imaging. 31, 1081-1089 (2004).
- Wu, Z., Li, Z. -. B., Chen, K., Cai, W., He, L., Chin, F. T., Li, F., Chen, X. MicroPET of tumor integrin αvβ3 expression using 18F-labeled PEGylated tetrameric RGD peptide. J. Nucl. Med. 49, 1536-1544 (2007).
- Cheng, D., Yin, D., Zhang, L., Li, G., Wang, M., Li, S., Zheng, M., Cai, H., Wang, Y. Radiolabeling and in vitro and in vivo characterization of [18F]FB-[R8,15,21, L17]-VIP as a PET imaging agent for tumor over-expressed VIP receptors. Chem. Biol. Drug Des. 68, 319-325 (2006).
- Cheng, D., Yin, D., Zhang, L., Wang, M., Li, G., Wang, Y. Preparation of the novel fluorine-18-labeled VIP analog for PET imaging studies using two different synthesis methods. J. Fluorine Chem. 128, 196-201 (2007).
- Fredriksson, A., Johnstroem, P., Stone-Elander, S., Jonasson, P., Nygren, P. -. A., Ekberg, K., Johansson, B. -. L., Wahren, J. Labeling of human C-peptide by conjugation with N-succinimidyl-4-[18F]fluorobenzoate. J. Label. Compd. Radiopharm. 44, 509-519 (2001).
- Bergmann, R., Scheunemann, M., Heichert, C., Mäding, P., Wittrisch, H., Kretzschmar, M., Rodig, H., Tourwe, D., Iterbeke, K., Chavatte, K. Biodistribution and catabolism of 18F-labeled neurotensin(8-13) analogs. Nucl. Med. Biol. 29, 61-72 (2002).
- Guenther, K. J., Yoganathan, S., Garofalo, R., Kawabata, T., Strack, T., Labiris, R., Dolovich, M., Chirakal, R., Valliant, J. F. Synthesis and in vitro evaluation of 18F- and 19F-labeled insulin: a new radiotracer for PET-based molecular imaging studies. J. Med. Chem. 49, 1466-1474 (2006).
- Zhang, X., Cai, W., Cao, F., Schreibmann, E., Wu, Y., Wu, J. C., Xing, L., Chen, X. 18F-labeled bombesin analogs for targeting GRP receptor-expressing prostate cancer. J. Nucl. Med. 47, 492-501 (2006).
- Murakami, Y., Takamatsu, H., Taki, J., Tatsumi, M., Noda, A., Ichise, R., Tait, J. F., Nishimura, S. 18F-labelled annexin V: a PET tracer for apoptosis imaging. Eur. J. Nucl. Med. Mol. Imaging. 31, 469-474 (2004).
- Yagle, K. J., Eary, J. F., Tait, J. F., Grierson, J. R., Link, J. M., Lewellen, B., Gibson, D. F., Krohn, K. A. Evaluation of 18F-annexin v as a PET imaging agent in an animal model of apoptosis. J. Nucl. Med. 46, 658-666 (2005).
- Vaidyanathan, G., Zalutsky, M. R. An improved synthesis of N-succinimidyl 4-[18F]fluorobenzoate and its application to the labeling of a monoclonal antibody fragment. Bioconjugate Chem. 5, 352-356 (1994).
- Garg, P. K., Garg, S., Zalutsky, M. R. Fluorine-18 labeling of monoclonal antibodies and fragments with preservation of immunoreactivity. Bioconjugate Chem. 2, 44-49 (1991).
- Cai, W., Olafsen, T., Zhang, X., Cao, Q., Gambhir, S. S., Williams, L. E., Wu, A. M., Chen, X. PET imaging of colorectal cancer in xenograft-bearing mice by use of an 18F-labeled T84.66 anti-carcinoembryonic antigen diabody. J. Nucl. Med. 48, 304-310 (2007).
- Cai, W., Chen, X. Multimodality molecular imaging of tumor angiogenesis. J. Nucl. Med. 49, 113-128 (2008).
- Jong, M. d. e., Breeman, W. A., Kwekkeboom, D. J., Valkema, R., Krenning, E. P. Tumor imaging and therapy using radiolabeled somatostatin analogues. Acc. Chem. Res. 42, 873-880 (2009).
- Fani, M., André, J. P., Maecke, H. R. 68Ga-PET: a powerful generator-based alternative to cyclotron-based PET radiopharmaceuticals. Contrast Media Mol. Imaging. 3, 53-63 (2008).
- Shokeen, M., Anderson, C. J. Molecular imaging of cancer with copper-64 radiopharmaceuticals and positron emission tomography (PET. Acc. Chem. Res. 42, 832-841 .
- McBride, W. J., Sharkey, R. M., Karacay, H. C., D'Souza, A., Rossi, E. A., Laverman, P., Chang, C. -. H., Boerman, O. C., Goldenberg, D. M. A novel method of 18F radiolabeling for PET. J. Nucl. Med. 50, 991-998 (2009).
- Becaud, J., Mu, L., Karramkam, M., Schubiger, P. A., Ametamey, S. M., Graham, K., Stellfeld, T., Lehmann, L., Borkowski, S., Berndorff, D., Dinkelborg, L., Srinivasan, A., Smits, R., Koksch, B. Direct one-step 18F-labeling of peptides via nucleophilic aromatic substitution. Bioconjugate Chem. 20, 2254-2261 (2009).
- Mu, L., Höhne, A., Schubiger, P. A., Ametamey, S. M., Graham, K., Cyr, J. E., Dinkelborg, L., Stellfeld, T., Srinivasan, A., Voigtmann, U., Klar, U. Silicon-based building blocks for one-step 18F-radiolabeling of peptides for PET imaging. Angew. Chem. Int. Ed. 47, 4922-4925 (2008).
- Schirrmacher, R., Bradtmöller, G., Schirrmacher, E., Thews, O., Tillmanns, J., Siessmeier, T., Buchholz, H. G., Bartenstein, P., Wängler, B., Niemeyer, C. M., Jurkschat, K. 18F-labeling of peptides by means of an organosilicon-based fluoride acceptor. Angew. Chem. Int. Ed. 45, 6047-6050 (2006).
- Olberg, D. E., Hjelstuen, O. K., Solbakken, M., Arukwe, J., Karlsen, H., Cuthbertson, A. A novel prosthetic group for site-selective labeling of peptides for positron emission tomography. Bioconjugate Chem. 19, 1301-1308 .
- Wuest, F., Köhler, L., Berndt, M., Pietzsch, J. Systematic comparison of two novel, thiol-reactive prosthetic groups for 18F labeling of peptides and proteins with the acylation agent succinimidyl-4-[18F]fluorobenzoate ([18F]SFB. Amino Acids. 36, 283-295 (2009).
- Vaidyanathan, G., Zalutsky, M. R. Synthesis of N-succinimidyl 4-[18F]fluorobenzoate, an agent for labeling proteins and peptides with 18F. Nat. Protocols. 1, 1655-1661 .
- Guhlke, S., Coenen, H. H., Stöcklin, G. Fluoroacylation agents based on small N.C.A. [18F]fluorocarboxylic acids. Appl. Radiat. Isot. 45, 715-727 (1994).
- Wester, H. J., Hamacher, K., Stöcklin, G. A comparative study of N.C.A. Fluorine-18 labeling of proteins via acylation and photochemical conjugation. Nucl. Med. Biol. 23, 365-372 (1996).
- Wüst, F., Hultsch, C., Bergmann, R., Johannsen, B., Henle, T. Radiolabeling of isopeptide NE epsilon-(γ-glutamyl)-L-lysine by conjugation with N-succinimidyl-4-[18F]fluorobenzoate. Appl. Radiat. Isot. 59, 43-48 (2003).
- Zijlstra, S., Gunawan, J., Burchert, W. Synthesis and evaluation of a 18F-labelled recombinant annexin-V derivative, for identification and quantification of apoptotic cells with PET. Appl. Rad. Isot. 58, 201-207 (2003).
- Mäding, P., Füchtner, F., Wüst, F. Module-assisted synthesis of the bifunctional labeling agent N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB. Appl. Rad. Isot. 63, 329-332 (2005).
- Marik, J., Sutcliffe, J. L. Fully automated preparation of N.C.A. 4-[18F]fluorobenzoic acid and N-succinimidyl 4-[18F]fluorobenzoate using a Siemens/CTI chemistry process control unit (CPCU). Appl. Rad. Isot. 65, 199-203 (2007).
- Johnström, P., Clark, J. C., Pickard, J. D., Davenport, A. P. Automated synthesis of the generic peptide labelling agent N-succinimidyl 4-[18F]fluorobenzoate and application to 18F-label the vasoactive transmitter urotensin-II as a ligand for positron emission tomography. Nucl. Med. Biol. 35, 725-731 (2008).
- Tang, G., Zeng, W. B., Yu, M. X., Kabalka, G. Facile synthesis of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB) for protein labeling. J Label. Compd. Radiopharm. 51, 68-71 .
- Azarian, V., Gangloff, A., Seimbille, Y., Delaloye, S., Czernin, J., Phelps, M. E., Silverman, D. H. S. Synthesis and liposome encapsulation of a novel 18F-conjugate of ω-conotoxin GVIA for the potential imaging of N-type Ca2+ channels in the brain by positron emission tomography. J. Label. Compd. Radiopharm. 49, 269-283 (2006).
- Toretsky, J., Levenson, A., Weinberg, I. N., Tait, J. F., Uren, A., Mease, R. C. Preparation of F-18 labeled annexin V: a potential PET radiopharmaceutical for imaging cell death. Nucl. Med. Biol. 31, 747-752 (2004).
- Glaser, M., Arstad, E., Luthra, S. K., Robins, E. G. Two-step radiosynthesis of [18F]N-succinimidyl-4-fluorobenzoate ([18F]SFB. J. Label. Compd. Radiopharm. 52, 327-330 (2009).
- Carroll, M., Yan, R., Aigbirhio, F., Soloviev, D., Brichard, L. The first nucleophilic synthesis of 3-[18F]fluoroethylbenzoate. J. Nucl. Med. 49, 303P-303P (2008).
- Stone-Elander, S., Elander, N. Microwave application in radiolabeling with short-lived positron-emitting radionuclides. J. Label. Compd. Radiopharm. 45, 715-746 (2002).
- Guo, N., Alagille, D., Tamagnan, G., Price, R. R., Baldwin, R. M. Microwave-induced nucleophilic [18F]fluorination on aromatic rings: synthesis and effect of halogen on [18F]fluoride substitution of meta-halo (F, Cl, Br, I)-benzonitrile derivatives. Appl. Rad. Isot. 66, 1396-1402 (2008).
- Mandap, K. S., Ido, T., Kiyono, Y., Kobayashi, M., Lohith, T. G., Mori, T., Kasamatsu, S., Kudo, T., Okazawa, H., Fujibayashi, Y. Development of microwave-based automated nucleophilic [18F]fluorination system and its application to the production of [18F]flumazenil. Nucl. Med. Biol. 36, 403-409 (2009).
- Scott, P. J. H., Shao, X. Fully automated, high yielding production of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB), and its use in microwave-enhanced radiochemical coupling reactions. J. Label. Compd. Radiopharm. 53, 586-591 (2010).
- Tang, G., Tang, X., Wang, X. A facile automated synthesis of N-succinimidyl 4-[18F]fluorobenzoate ([18F]SFB) for 18F-labeled cell-penetrating peptide as PET tracer. J. Label. Compd. Radiopharm. 53, 543-547 (2010).
- Olma, S., Liu, K., Chen, Y. -. C., Dam, R. v. a. n., Shen, C. K. -. F. Microfluidic Droplet Mixer for Fluorine-18 Labeling of Biomolecules. J. Label. Compd. Radiopharm. 52, S10-S10 (2009).
- Olma, S., Lambert, J., Barnhardt, E., Liu, K., Shen, C. K. -. F., van Dam, R. A compact microwave system for rapid, semi-automated radiosyntheses. J. Label. Compd. Radiopharm. 52, S509-S509 (2009).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados