Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
Ensayo in vitro de la adhesión bacteriana a las células epiteliales de mamíferos
En este artículo
Resumen
Este protocolo es un ensayo simple adhesión bacteriana consiste en contar el número de unidades formadoras de colonias bacterianas que se adhieren a las células cultivadas. El ensayo es sólida, independiente de la adhesina estudiados, y numerosas variantes se utilizan en la mayoría de los laboratorios que trabajan en la patogénesis bacteriana.
Resumen
Para causar infecciones, las bacterias deben colonizar su anfitrión. Los patógenos bacterianos expresan diversas moléculas o estructuras capaces de fomentar el apego a las células huésped 1. Estas adhesinas se basan en la interacción con los receptores de superficie de la célula huésped o proteínas solubles que actúan como un puente entre la bacteria y el huésped. La adhesión es un primer paso crítico antes de la invasión y / o la secreción de toxinas, por lo que es un evento clave para ser estudiado en la patogénesis bacteriana. Además, las bacterias adheridas a menudo inducen a exquisitamente afinado la respuesta celular, los estudios de los cuales han dado a luz al campo de la 2 'microbiología celular. Ensayos robusto para la adhesión bacteriana a las células huésped y su invasión por lo tanto, desempeñan un papel clave en los estudios de la patogénesis bacteriana y han sido utilizados en muchos laboratorios pioneros 3,4. Estos ensayos se practica actualmente por la mayoría de los laboratorios que trabajan en la patogénesis bacteriana.
Aquí se describe un ensayo de adherencia tipo que ilustren la contribución de un determinado adhesina. Nosotros usamos la cepa de Escherichia coli 2787 5, una cepa patógena humana que expresa la autotransporter Adhesin que participan en la adhesión difusa (AIDA). Como control, se utiliza una cepa mutante que carecen del gen aida, 2787Δ Aida (F. Berthiaume y Mourez M., inédito), y una cepa de laboratorio comercial de E. coli, C600 (New England Biolabs). Las bacterias son de izquierda a adherirse a las células de los comúnmente utilizados HEp-2 la línea humana de células epiteliales. Este ensayo no ha sido tan ampliamente descritas antes de las 6.
Protocolo
1. Preliminar: Cepas bacterianas y células epiteliales.
Manipulaciones de las células y las bacterias se realizado de forma aséptica, bajo una campana de flujo laminar.
- Recién aislar el E. coli 2787, 2787Δ Aida, y C600 de las existencias de caldo de glicerol Lisogenia (LB) placas de agar (1 triptona%, 0,5% de cloruro sódico, un 0,5% de extracto de levadura, 1,5% de agar) y crecer a 37 ° C. Para minimizar la variabilidad en el ensayo, se aconseja utilizar siempre las cepas recién plateado y para mantener las cepas a 4 ° C en placas de Petri sellada sólo por un máximo de un par de semanas.
- Cultura células HEp-2 (ATCC CCL-23) en el modificado del medio altos de glucosa en Dulbecco Eagle (DMEM) suplementado con 10% inactivado por calor suero bovino (inactivación por calor se realiza a 56 ° C durante 30 min). Durante el cultivo de rutina, también se suman 10 U / ml de penicilina y estreptomicina 10 mg / ml.
- Crecer células Hep-2 a 37 ° C en una celda de la incubadora con una atmósfera que contiene 5% de CO 2. Use los procedimientos estándar de cultivo celular para mantener las células, que se cultivan en 75 cm 2 frascos y se subcultivaron cada vez que llegan confluencia. Usamos nuestras células cultivadas hasta alcanzar 30 a 40 pasajes y luego los desecha.
- Preparar un ensayo cuando las células HEp-2 en un matraz de 75 cm 2 son casi llegar a la confluencia y por lo tanto, están listos para un ensayo de adherencia.
2. DIA 1: Preparación del inóculo y las células epiteliales
- Lave la células HEp-2 en el matraz una vez con fosfato caliente de Dulbecco buffer salino (DPBS: 8 g / L NaCl, 0,2 g / KCl L, 0,2 g / L KH 2 PO 4, 0,21 g / L de Na 2 HPO 4: 7H 2 O)
- Las células se incubaron con 0,05% de tripsina - EDTA durante 5 min antes de añadir medio fresco completo de calentamiento. Después de un nuevo medio, se añade, las células se resuspenden pipeteando arriba y hacia abajo.
- Se centrifuga la suspensión celular a 2000 rpm durante 5 minutos y volver a suspender las pastillas en DPBS y centrifugar de nuevo.
- Resuspender las células en medio fresco suplementado con 10% de suero, pero que no contengan antibióticos, a una concentración de 2x10 5 células / ml.
- Semilla de un mililitro de suspensión celular en tres series de pocillos (uno para cada cepa) en el centro de una placa de 24 pocillos y se incuba la placa durante la noche en una celda de la cultura incubadora.
Nota: Es importante que el suero a fondo decomplemented y que los antibióticos se han omitido después de esta etapa. De lo contrario, podría matar a las bacterias que infectan. - Inocular una colonia aislada de cada cepa bacteriana (2787, 2787Δ Aida y C600) en 5 ml de medio LB (triptona 1%, 0,5% de cloruro sódico, un 0,5% de extracto de levadura) y crecen durante la noche a 37 ° C con agitación vigorosa (180 rpm ).
3. DIA 2: La infección de las células
- Inspeccione las células HEp-2 bajo un microscopio invertido para cerciorarse de que son al menos el 90% confluentes y no contaminado.
- Lavar las células con DPBS cálido y, a cada pocillo, añada 1 ml de medio fresco suplementado con 10% de suero, pero que no contengan antibióticos. También añade un nuevo medio de tres pozos sin células. Esto será utilizado para determinar el número total de bacterias en el inóculo de cada cepa.
- Medir la densidad óptica a 600 nm (OD 0.600 nm) de los cultivos bacterianos. Agregar una alícuota de cada cultivo bacteriano a un conjunto de pocillos que contienen células Hep-2 y un bien que no contienen células. Por lo general, se utiliza un volumen de cultivo de una noche que corresponde a 10 6 unidades formadoras de colonias (ufc). Esto representa una multiplicidad de infección (MOI), de 5:1 (bacterias: las células). A pesar de que utilizan directamente los cultivos de una noche, a veces es recomendable centrifugar y resuspender las bacterias en DPBS para evitar los efectos nocivos de las moléculas secretadas presentes en los cultivos durante la noche (como citotoxinas, por ejemplo)
Nota: El momento de inercia puede variar entre 100:1 y 01:10. MOI más alto rendimiento y una mayor variabilidad del fondo y las bacterias tienden a pegarse al plástico de la placa. Menor momento de inercia también produce una gran variabilidad. Una vez que una MOI que se elija, es imprescindible para ser coherentes y mantener este momento de inercia. - Se incuban las células infectadas en el cultivo celular incubadora durante 3 horas a 37 º C con CO2 al 5%.
Nota: También es posible centrifugar brevemente la placa a baja velocidad (por ejemplo, 1.000 g durante 1-2 minutos), a fin de que todas las bacterias en contacto directo con las células. Esto tiene el beneficio añadido de la sincronización de la infección, y permitir menores tiempos de incubación (tan poco como 15-30 min). - Eliminar el medio de las células infectadas y se lavan las células 3 veces con DPBS caliente. En esta etapa, las bacterias adheridas por lo general se puede observar con un microscopio estándar y de manera rutinaria realizar esta comprobación.
- Para lisar las células y separar la adherido bacrios, añadir 100 ml de 1% de Triton X-100 a cada pocillo que contiene las células. Detergentes se pueden utilizar otros (como la saponina, por ejemplo).
- Se incuban las células durante 10 minutos a temperatura ambiente y luego añadir 900 l de medio LB.
- Suavemente homogeneizar la suspensión por las reiteradas hacia arriba y hacia abajo de pipeteo. Los pozos sin células que contienen el inóculo son igualmente suavemente homogeneizada.
Nota: Algunas de las bacterias puede ser muy sensible a los detergentes, en ese caso, separar las células epiteliales de incubación con 0,05% de tripsina - EDTA durante 20 minutos a 37 ° C. Las células con bacterias adheridas también puede ser raspado de los pozos con una punta de la pipeta. - Prepare serie de 10 diluciones de las suspensiones de bacterias adheridas e inóculo con caldo de LB y placa de 100 l de 3 diluciones (por lo general las diluciones 1:1.000, 1:10.000 y 1:100.000) en agar LB e incubar durante la noche a 37 ° C .
4. DIA 3: contar ufc y presentación de datos.
- Contar las colonias en las placas y calcular el número de UFC de bacterias adheridas y del inóculo por el promedio de cada serie de diluciones. Placas sólo con entre 10 a 300 colonias deben ser contados.
5. Los resultados representativos:
La siguiente tabla muestra los resultados típicos de ufc recuento de bacterias adheridas y el inóculo de 3 experimentos realizados en días diferentes:

Los resultados pueden ser reportados directamente adherido ufc, como se muestra en la Figura 1A. Dado que el tamaño de inóculo puede variar entre cepas debido a las diferencias en las tasas de crecimiento o los errores de pipeteo, a menudo es recomendable informar de los resultados como porcentaje de bacterias adheridas. El porcentaje de bacterias adheridas se puede calcular dividiendo el número de UFC de bacterias adheridas por el número de ufc del inóculo, como se muestra en la Figura 1B. Al realizar una medida repetidas ANOVA y Bonferroni pruebas post-para comparar todas las columnas de la Figura 1b, se puede observar que existen diferencias significativas (p <0,05) entre 2787 y 2787Δ Aida, así como entre 2787 y el C600, pero no hubo diferencias significativas 2787Δ entre Aida y C600.
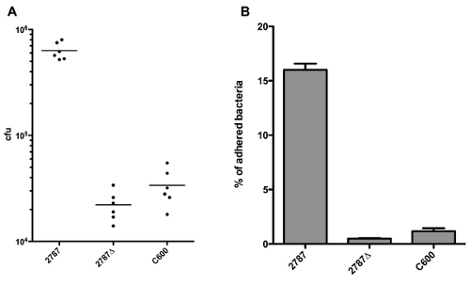
Figura 1. Representación de los resultados en UFC de bacterias adheridas (A) o el porcentaje de bacterias adheridas (B)
El porcentaje de cumplimiento observado con frecuencia es muy dependiente del montaje experimental (y, en menor medida, por el experimentador). De particular importancia son las MOI y el número de lavados, por lo que el porcentaje no debe interpretarse literalmente.
Las bacterias en el inóculo a veces puede crecer mucho más rápido que las bacterias en la presencia de células, sesgando el tamaño del inóculo en comparación con el número total real de bacterias en los pozos con células. Para solucionar este problema, se recomienda que sea: (i) el uso de pozos con las células para determinar el inóculo: HEp-2 células se siembran en otros así y se infecta. Al final del ensayo, en lugar de desechar el sobrenadante y lavar, 100 l de 10% de Triton X-100 se añade a la fuente. Las células se lisan y el lisado contiene bacterias adheridas y no adheridas-es ligeramente homogeneizada por las repetidas hacia arriba y hacia abajo pipeteo;. O (ii) recoger los sobrenadantes de las células infectadas al final del ensayo, así como los sobrenadantes de los lavados DPBS y determinar el número de ufc en los sobrenadantes combinados. Esto dará lugar a que el número de UFC de bacterias no adheridas. El porcentaje de bacterias adheridas se puede calcular dividiendo el número de UFC de bacterias adheridas por la adición de la cantidad de UFC de bacterias adheridas y no adheridas.
Para ilustrar la solidez de la prueba, podemos comparar este protocolo con el ensayo realizado con el S4074, una cepa porcina patógenos adhesiva de Actinobacillus pleuropneumoniae 7, se incubaron con células de una recientemente creada línea de células traqueales lechones, NPTR 8. Aparte de las diferencias en los medios de comunicación necesarios para el crecimiento de las bacterias y las células, la única diferencia es que las bacterias utilizan para la infección son de una cultura de crecimiento exponencial, y no de un cultivo de una noche de la fase estacionaria. Con A. pleuropneumoniae también es muy importante respetar una MOI de 10:1 y de no más de 3 horas de la infección, de lo contrario la secreción de toxinas causa la muerte celular y el sesgo de los resultados. Además, esta cepa de A. pleuropneumoniae puede fácilmente se adhieren al plástico por lo que es importante la utilización de células confluentes y comprobar visualmente que las células no están mudando.
Discusión
Este protocolo describe un ensayo estándar de la adhesión de bacterias que pueden ser modificados para estudiar la invasión (por ejemplo, usando gentamicina ensayo de protección de 3). El recuento de unidades formadoras de colonias permite cuantificar, en comparación con los enfoques de confiar en las técnicas de visualización estándar bajo un microscopio, como la tinción de Giemsa. Este último sólo da una visión cualitativa de la adherencia, pero es a menudo un complemento útil ya que se pueden ...
Divulgaciones
Agradecimientos
Trabajo en los laboratorios de los autores es apoyado por becas de las Ciencias Naturales e Ingeniería de Investigación de Canadá, el Instituto de Investigación en Salud de Canadá, y el programa de Cátedras de Investigación de Canadá. JL es apoyado por una beca del Groupe d'Étude des Membranaires Protéines (GEPROM) a través de la financiación del Fonds de Recherche en Santé du Québec.
Materiales
| Name | Company | Catalog Number | Comments |
| Reactivo | Empresa | Número de catálogo | |
|---|---|---|---|
| Elevados de glucosa en DMEM | GIBCO-Invitrogen | 12430-054 | |
| DDPBS | GIBCO-Invitrogen | 14190-144 | |
| Suero de crecimiento bovino | Hyclone | SH3054 | |
| Penicilina / estreptomicina | GIBCO-Invitrogen | 15140-148 | |
| Placas de 24 pocillos | Corning | 3337 | |
| Triton X-100 | Fisher Scientific | BP151-100 |
Referencias
- Kline, K. A. Bacterial adhesins in host-microbe interactions. Cell Host Microbe. 5, 580-580 (2009).
- Cossart, P., Boquet, P., Normark, S., Rappuoli, R. Cellular microbiology emerging. Science. 271, 315-315 (1996).
- Elsinghorst, E. A. Measurement of invasion by gentamicin resistance. Methods Enzymol. 236, 405-405 (1994).
- Pizarro-Cerda, J., Lecuit, M., Cossart, P., Sansonetti, P., Zychlinsky, A. . Molecular Cellular Microbiology. , 161-161 (2002).
- Srivastava, A., Isberg, R. R., Sansonetti, P., Zychlinsky, A. . Molecular Cellular Microbiology. , 179-179 (2002).
- Benz, I., Schmidt, M. A. Cloning and expression of an adhesin (AIDA-I) involved in diffuse adherence of enteropathogenic Escherichia coli. Infect Immun. 57, 1506-1506 (1989).
- Charbonneau, M. E., Berthiaume, F., Mourez, M. Proteolytic processing is not essential for multiple functions of the Escherichia coli autotransporter adhesin involved in diffuse adherence (AIDA-I). J Bacteriol. 188, 8504-8504 (2006).
- Jacques, M., Paradis, S. E. Adhesin-receptor interactions in Pasteurellaceae. FEMS Microbiol Rev. 22, 45-45 (1998).
- Auger, E. Host-pathogen interactions of Actinobacillus pleuropneumoniae with porcine lung and tracheal epithelial cells. Infect Immun. 77, 1426-1426 (2009).
- Jacques, M. Role of lipo-oligosaccharides and lipopolysaccharides in bacterial adherence. Trends Microbiol. 4, 408-408 (1996).
- Nataro, J. P., Kaper, J. B. Diarrheagenic Escherichia coli. Clin Microbiol Rev. 11, 142-142 (1998).
- Jallat, C., Darfeuille-Michaud, A., Rich, C., Joly, B. Survey of clinical isolates of diarrhoeogenic Escherichia coli: diffusely adhering E. coli strains with multiple adhesive factors. Res Microbiol. 145, 621-621 (1994).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados