Method Article
Generación y Etiquetado de murino médula ósea procedentes de células dendríticas con nanocristales Qdot de Estudios de seguimiento
En este artículo
Resumen
Dendríticas las células de captación de antígenos y migran hacia los órganos inmunes para presentar antígenos procesados a los linfocitos T. Qdot nanocristales etiquetado proporciona una señal fluorescente de larga duración y estables. Esto permite el seguimiento de las células dendríticas a los diferentes órganos por microscopía de fluorescencia.
Resumen
Las células dendríticas (DC) son células profesionales presentadoras de antígeno (CPA) que se encuentran en los tejidos periféricos y en los órganos inmunológicos, tales como el timo, la médula ósea, el bazo, los ganglios linfáticos y las placas de Peyer 1-3. Los países en desarrollo presentes en la muestra de los tejidos periféricos del organismo por la presencia de antígenos, que ocupan, procesar y presentar en su superficie en el contexto de las moléculas de histocompatibilidad (MHC). Entonces, cargado de antígenos DC migrar a los órganos inmunológicos en los que presentan el antígeno procesado a los linfocitos T desencadenar una respuesta inmunitaria específica. Una forma de evaluar las capacidades migratorias de los países en desarrollo se les etiqueta con tintes fluorescentes 4.
Por la presente nos demuestran el uso de Qdot nanocristales fluorescentes para etiquetar derivadas de médula ósea murina DC. La ventaja de este etiquetado es que Qdot nanocristales poseen fluorescencia duradera estable y de largo que los hacen ideales para la detección de células marcadas en los tejidos recuperados. Para lograr esto, las primeras células se recuperará de médulas óseas murina y se cultivaron durante 8 días en la presencia de colonias de granulocitos macrófagos factor estimulante con el fin de inducir la diferenciación de DC. Estas células se denominan entonces con Qdots fluorescentes de corta incubación in vitro. Células teñidas pueden ser visualizados con un microscopio fluorescente. Las células se pueden inyectar en animales de experimentación, en este momento o puede convertirse en células maduras en la incubación in vitro con estímulos inflamatorios. En nuestras manos, la maduración de DC no determinó la pérdida de la señal fluorescente ni manchas Qdot afectar a las propiedades biológicas de los países en desarrollo. Tras la inyección, estas células se pueden identificar en los órganos inmunes por microscopía de fluorescencia después de la disección típica y los procedimientos de fijación.
Protocolo
1. La disección de los fémures y tibias del ratón y el cultivo de células de médula ósea
- Sacrificio de dos ratones por asfixia de CO 2 y diseccionar cuidadosamente tibias y fémures sin cortar los extremos de los huesos.
- Limpiar los huesos de todos los tejidos adheridos mediante el uso de papel de seda. Tenga cuidado de no romper los huesos.
- Esterilizar los huesos por inmersión en etanol al 70% durante 10 minutos en un 35 mm placa de Petri. A partir de este momento, el trabajo dentro de una campana de bioseguridad para evitar la contaminación de los cultivos celulares.
- Recuperar los huesos del etanol y dejar secar al aire durante 5 minutos en una placa de Petri en el interior del gabinete de bioseguridad.
- Corte el fémur por la mitad, y la tibia por su extremo más delgado. Infundir el interior del hueso con 1 ml de medio RPMI (sin suero, pero con los antibióticos) con una jeringa estéril en una placa de Petri estéril.
- La suspensión de células se recogieron y se lavaron 2 veces en medio RPMI por centrifugación de 10 minutos en un tubo de 15 ml, se centrifuga a 1.100 rpm en una centrífuga refrigerada (4 ° C) con un rotor basculante.
- Después del último lavado, resuspender las células en 2 ml de solución amortiguadora de lisis ACK e incubar durante 5 minutos a temperatura ambiente con el fin de eliminar las células rojas de la sangre.
- Añadir 13 ml de RPMI con 10% de SFB, resuspender y lavar 2 veces en este medio con la misma configuración que se describe en 1.6.
- Recuento de células, se ajustan a 2 x 10 5 células / ml con RPMI 10% FBS, y añadir rm-GM-CSF (20 ng / ml concentración final) 5.
- Agregar 10 ml de esta suspensión a una calidad de estéril, microbiológicos, 10 cm plato de Petri, y la cultura en una incubadora de CO 2 (37 ° C, 5% de CO 2).
- Tres días después, añadir otro 10 ml de RPMI 10% FBS con 20 ng / l de rmgm-CSF a cada uno de los platos preparados.
- Tres días después, 10 ml de suspensión celular se recuperan de cada placa de Petri, se centrifuga como en 1.6, se resuspendieron en el mismo volumen de RPMI 10% FBS con rmgm-CSF y regresó a la placa de Petri. Las células se cultivan durante 2 días más en la incubadora de CO 2.
2. Recogida y etiquetado de los países en desarrollo
- Después de 8 días en cultivo de células de baja adherencia son recuperados por lavado de las placas de Petri con medio fresco. Este protocolo hace alrededor de 4.2 x 10 8 países en desarrollo en nuestras manos. Las células pueden ser analizados para DC fenotipo por citometría de flujo.
- Las células obtenidas son etiquetados con la Qtracker 655 Kit de etiquetado celular siguiendo estrictamente las instrucciones del fabricante.
- Tenemos excelentes resultados etiquetado derivadas de médula ósea murina países en desarrollo con Qdots a una concentración de 10 nM. Para lograr esto, las alícuotas de los componentes Qtracker Celular Kit de etiquetado A y B se mezclan en volúmenes iguales, se incubaron 5 minutos a temperatura ambiente, e inmediatamente se diluye 1 / 100 en medio fresco con agitación durante 30 s.
- Para la tinción de 5 x 10 6 países en desarrollo, mezcla de 5 l de cada componentes del equipo A y B en un tubo eppendorf y se incuban durante 5 minutos a temperatura ambiente. A continuación, añadir 1 ml de RPMI 10% FBS incubar, y agitar durante 30 segundos.
- Añadir 0,5 ml de suspensión celular que contiene 5 x 10 6 países en desarrollo, y se incuba a 37 ° C durante 60 min.
- A continuación, lavar las células 2 veces en RPMI 10% FBS (1100 RPM). Las células pueden ser resuspendidas en RPMI a la cultura más o en PBS para la inyección en ratones de experimentación.
3. Evaluación de la DC etiquetado
- Etiquetado de células pueden ser evaluados por medio de microscopía de fluorescencia. Para lograr esto, una gota de suspensión celular se añade a un portaobjetos de microscopio, cubierta con un cubreobjetos, y se evaluaron con un microscopio de fluorescencia teniendo en cuenta que estos Qdots tienen espectros de emisión y excitación de 565nm 525nm y 405, respectivamente (Fig. 3 )
- En este punto, las células marcadas se pueden utilizar para inyectar animales, o la maduración puede ser inducida mediante la incubación de estas células durante 48 h (37 ° C, 5 CO 2) en presencia de LPS (100 ng / ml) y TNF (- 20 ng / ml). Fluorescentes de etiquetado no se ve afectada por la maduración de DC (Fig. 4).
4. Los resultados representativos:
Por la presente se describe cómo preparar derivadas de médula ósea murina países en desarrollo y cómo se les etiqueta con Qdots fluorescentes. Fig. 1 resume el procedimiento para obtener la célula, mientras que la figura. 2 describe el procedimiento para la etiqueta del Qdots. Como se muestra en la figura. 3, casi todas las células están marcadas por este procedimiento, y esto no se ve afectada por la maduración de DC con factores inflamatorios (Fig. 4). Fig. 5 muestra que Qdot manchada de países en desarrollo (Fig.5a) se comportan similares a los no-células teñidas cuando son tratados con un cóctel inflamatoria. Ambas preparaciones de células similar regular al alza la expresión de moléculas coestimuladoras (Fig. 5b), y producen cantidades similares de IL-6 (Fig. 5c) y el óxido nítrico (Fig. 5d) a los estímulos de maduración. Esto concuerda con PreviOU datos publicados indican que la tinción Qdot no afecta a la capacidad de las DC para convertirse en células maduras capaces de inducir respuestas inmunes [6]. Estas células se pueden utilizar para la inyección de los animales de experimentación. Como se muestra en la figura. 6, 2 días después de la inyección intravenosa de los países en desarrollo etiquetados en ratones, que fueron capaces de detectar Qdot células teñidas en el bazo. Esto también está de acuerdo con los anteriores datos publicados muestran el uso de nanocristales Qdot para evaluar la migración de la CD en vivo [6], de imagen no invasivas y citometría de flujo.
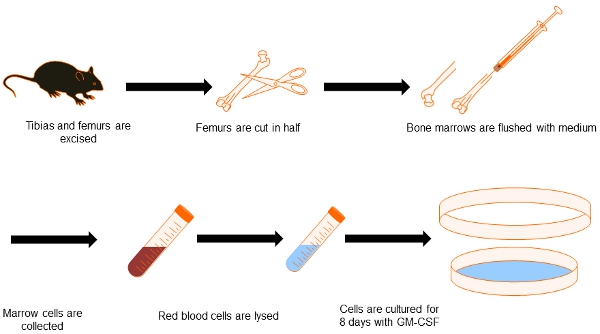
Figura 1. Diagrama de flujo de generación de DC de la médula ósea. Por la presente nos muestran el proceso para obtener médula ósea procedentes de DC. Ambas tibias y fémures, se disecan y limpieza del tejido circundante. Puntas de hueso y se conservan en el interior de los huesos se vuelcan con el medio. Después de la eliminación de las células rojas de la sangre, las células de la médula ósea se cultivan durante 8 días en presencia de GM-CSF para diferenciarse en los países en desarrollo.
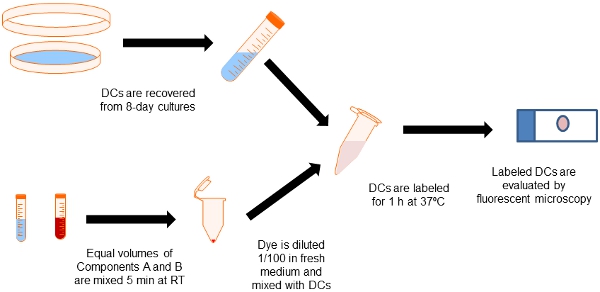
Figura 2. Diagrama de flujo del procedimiento de etiquetado. Alícuotas iguales de los componentes Qtracker Celular Kit de etiquetado A y B se mezclan en un tubo eppendorf. Las células dendríticas se obtienen a partir de cultivos de 8 días de médula ósea con GM-CSF y se mezcla con el tinte de etiquetado para los 60 min a 37 º C. Luego se lavan las células en los medios de comunicación para eliminar el exceso de partículas de etiquetado.

Figura 3. Microfotografía fluorescente de los países en desarrollo inmediatamente después de etiquetado. Una gota de células marcadas se depositó en un portaobjetos de vidrio y cubierta por un cubre. Luego, las muestras fueron evaluadas en un microscopio de fluorescencia y las imágenes fueron adquiridas a través de una cámara de 5,0 Micropublisher Color Digital CCD (Qimaging, Surrey, BC Canadá).
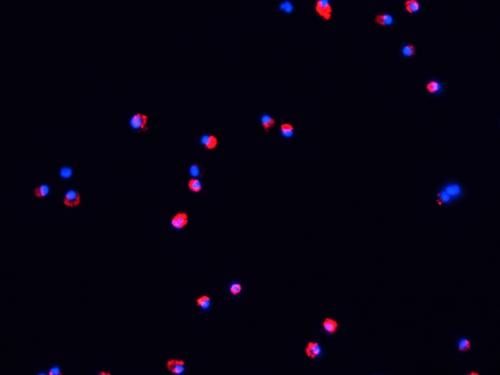
Figura 4. Microfotografía fluorescente de los países en desarrollo después de 48 h de maduración in vitro. Los países en desarrollo la etiqueta se cultivaron durante 48 h con LPS (100 ng / ml) y TNF-α (20 ng / ml) en placas de vidrio en una incubadora de CO 2 (37 ° C, 5% de CO 2). Luego, las muestras fueron lavadas con PBS (5 min, 2X), se fija con acetona (15 min, 4 ° C) y de contraste con DAPI. Las células fueron evaluadas en un microscopio de fluorescencia que el anterior.
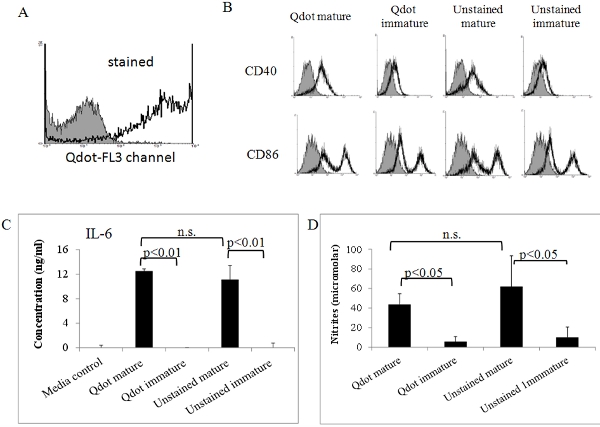
Figura 5. La actividad biológica de los países en desarrollo Qdot maduro manchado. Los países en desarrollo etiquetados madurados in vitro que el anterior fueron analizadas por citometría de flujo (A) y (B). (A) Qdot células teñidas dar una señal fuerte en el FL3 (PerCP) del canal. Sombra histograma: control sin mancha. (B) Los países en desarrollo Qdot-teñidas y sin teñir, además, se tiñeron con anticuerpos específicos frente a la maduración de los marcadores CD86 y CD40, y controles de isotipo. Las células fueron analizadas en un citómetro de flujo FACSort (Becton Dickinson, San Jose, CA). Además, IL-6 (C) y el óxido nítrico (NO) se determinó en los sobrenadantes de madurez Qdot manchada de países en desarrollo y los controles. Los niveles de IL-6 y el óxido nítrico se determinó mediante un análisis de ELISA y el ensayo de Griess como hemos descrito previamente 7, 8. Todos los datos que aparecen en esta figura es representativa de dos o tres experimentos independientes que muestran resultados similares. Los datos fueron analizados por ANOVA utilizando el software GraphPad.
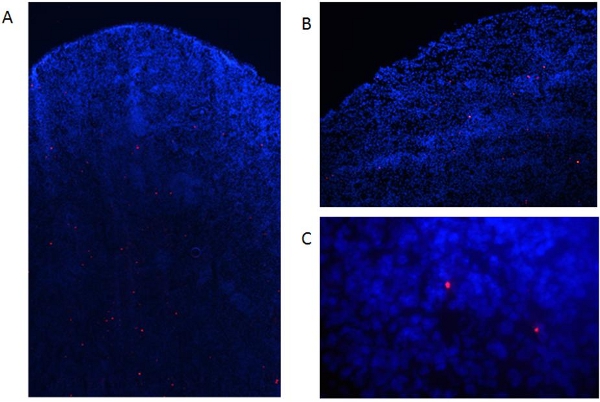
Figura 6. Detección de los centros de datos etiquetados en los tejidos disecados. Etiquetados DC maduras (1x10 6 células) fueron inyectados por vía intravenosa en ratones C57BL / 6. (A) Dos días después los ratones fueron sacrificados y se colectaron los bazos, congelados snap, incrustado en octubre, y 8 secciones M preparada con un criostato. Luego, las muestras fueron fijadas con acetona (15 min, 4 ° C) y de contraste con DAPI. Las células fueron evaluadas en un microscopio de fluorescencia como por encima de la figura 6a:. Magnificación de 40X, la figura 6b: un aumento de 100X, fig. Ampliación 6C, 400X.
Discusión
Murino mieloide) países en desarrollo han sido ampliamente utilizados para determinar la eficacia y la mejora de la DC, vacunas, investigar DC: las interacciones de las células T o el desarrollo de DC, y determinar su papel en varias enfermedades 9-11. Por la presente se muestra cómo se generan los países en desarrollo a partir de precursores recuperado de médulas óseas de tibia y fémur. Recuperamos los huesos sin cortar las puntas, lo que nos para esterilizarlos por inmersión en etanol al 70%, reduciendo así la probabilidad de contaminación. Para diferenciar los países en desarrollo a partir de células de médula ósea y sólo la usamos GM-CSF como se describió anteriormente 5. Aunque algunos también utilizan protocolos de IL-4, se ha informado de que esta citocina no es necesario cuando se trabaja con altos niveles de GM-CSF 12. De hecho, hemos demostrado que estos países en desarrollo son capaces de inducir respuestas inmunes 13. También, el cuidado debe ser tomado para recuperar sólo las células de baja adherencia a partir de cultivos de 8 días a lavar los platos Petri con medio ya que las células adjuntas muestran un fenotipo más monocitos-like. Aquí se muestra el etiquetado de los países en desarrollo con partículas fluorescentes Qdot. Esta etiqueta tiene algunas ventajas respecto a otros métodos. En primer lugar, las partículas Qdots se incorporan fácilmente a las células. En segundo lugar, la señal fluorescente es muy alto y no se altera por la maduración de las DC. En tercer lugar, la fluorescencia no se pierde cuando las células o los tejidos se fijan con solventes como la acetona, contrariamente a lo que sucede si GFP se utiliza para etiquetar los países en desarrollo 14, dando una mayor flexibilidad en el momento de elegir los protocolos de tinción. Finalmente, la señal fluorescente de alta dada por estas partículas permite la visualización de las células de los tejidos a pesar de autofluorescencia. Como se describió anteriormente 6, tinción Qdot no afectó la capacidad de maduración de estas células. Por la presente nos muestran que Qdot manchado de los países en desarrollo se comportan de forma similar a como no manchada de países en desarrollo, upregulating moléculas estimuladoras, y la producción de IL-6 y el óxido nítrico en respuesta a estímulos inflamatorios. Aunque los países en desarrollo son células especializadas en el desencadenamiento de la respuesta inmune, se ha demostrado para participar en procesos patológicos como el cáncer y la aterosclerosis 4, 15, 16. Han sido también afirmó que participar en el proceso angiogénico 17, 18, incluso sugirió que estructuralmente que participan en el desarrollo de nuevos buques 19, 20. Por lo tanto, los métodos que permiten el seguimiento de DC en vivo, y la determinación de su localización geográfica en diferentes tejidos 4, 21, 22 son muy valiosos.
Divulgaciones
Agradecimientos
Este trabajo apoyado en parte por el NIH virtud de la subvención R15 CA137499-01 (FB) y un fondo de inicio de la Universidad de Ohio (FB).
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Ratones C57BL / 6 | Jackson laboratorios | Las hembras, 6-8 semanas de edad | |
| RPMI | Invitrogen | 11875-119 | |
| Suero bovino fetal, calificado | Invitrogen | 10437-028 | |
| Antibiótico-antimicótico | Invitrogen | 15240-096 | |
| PBS | Invitrogen | 10010-049 | |
| Buffer de lisis ACK | Lonza Walkersville, Inc | 10-548E | |
| Recombinante murino GM-CSF | PeproTech Inc | 315-03 | |
| Qtracker 655 Celular Kit de etiquetado | Invitrogen | Q25021MP | |
| Lipopolisacárido | Invivogen | tlrl-eblps | |
| Recombinante murino TNF alfa | Peprotech | 315-01A | |
| CD86 de anticuerpos | BD Biosciences | 553691 | |
| CD40 de anticuerpos | BD Biosciences | 553791 | |
| Sistema reactivo de Griess | Promega | G2930 | |
| IL-6 de captura de anticuerpo | eBioscience | 13-7061-81 | |
| IL-6 la detección de anticuerpos | eBioscience | 13-7062-81 |
Referencias
- Banchereau, J., Briere, F., Caux, C., Davoust, J., Lebecque, S., Liu, Y. J., Pulendran, B., Palucka, K. Immunobiology of dendritic cells. Annu Rev Immunol. 18, 767-811 (2000).
- Bonasio, R., von Andrian, U. H. Generation, migration and function of circulating dendritic cells. Curr Opin Immunol. 18, 503-511 (2006).
- Lanzavecchia, A., Sallusto, F. The instructive role of dendritic cells on T cell responses: lineages, plasticity and kinetics. Curr Opin Immunol. 13, 291-298 (2001).
- Conejo-Garcia, J. R., Benencia, F., Courreges, M. C., Kang, E., Mohamed-Hadley, A., Buckanovich, R. J., Holtz, D. O., Jenkins, A., Na, H., Zhang, L. Tumor-infiltrating dendritic cell precursors recruited by a beta-defensin contribute to vasculogenesis under the influence of Vegf-A. Nat Med. 10, 950-958 (2004).
- Lutz, M. B., Kukutsch, N., Ogilvie, A. L., Rossner, S., Koch, F., Romani, N., Schuler, G. An advanced culture method for generating large quantities of highly pure dendritic cells from mouse bone marrow. J Immunol Methods. 223, 77-92 (1999).
- Noh, Y. W., Lim, Y. T., Chung, B. H. Noninvasive imaging of dendritic cell migration into lymph nodes using near-infrared fluorescent semiconductor nanocrystals. Faseb J. 22, 3908-3918 (2008).
- Benencia, F., Courreges, M. C., Conejo-Garcia, J. R., Mohamed-Hadley, A., Zhang, L., Buckanovich, R. J., Carroll, R., Fraser, N., Coukos, G., Franco, L. G. HSV oncolytic therapy upregulates interferon-inducible chemokines and recruits immune effector cells in ovarian cancer. Mol Ther. 12, 789-802 (2005).
- Gilboa, E., Vieweg, J. Cancer immunotherapy with mRNA-transfected dendritic cells. Immunol Rev. 199, 251-263 (2004).
- Grolleau-Julius, A., Abernathy, L., Harning, E., Yung, R. L. Mechanisms of murine dendritic cell antitumor dysfunction in aging. Cancer Immunol Immunother. 58, 1935-1939 (2009).
- Yrlid, U., Svensson, M., Johansson, C., Wick, M. J. Salmonella infection of bone marrow-derived macrophages and dendritic cells: influence on antigen presentation and initiating an immune response. FEMS Immunol Med Microbiol. 27, 313-320 (2000).
- Lutz, M. B., Schnare, M., Menges, M., Rossner, S., Rollinghoff, M., Schuler, G., Gessner, A. Differential functions of IL-4 receptor types I and II for dendritic cell maturation and IL-12 production and their dependency on GM-CSF. J Immunol. 169, 3574-3580 (2002).
- Benencia, F., Courreges, M. C., Coukos, G. Whole tumor antigen vaccination using dendritic cells: comparison of RNA electroporation and pulsing with UV-irradiated tumor cells. J Transl Med. 6, 21-21 (2008).
- Probst, H. C., Tschannen, K., Odermatt, B., Schwendener, R., Zinkernagel, R. M., Van Den Broek, M. Histological analysis of CD11c-DTR/GFP mice after in vivo depletion of dendritic cells. Clin Exp Immunol. 141, 398-404 (2005).
- Fainaru, O., Adini, A., Benny, O., Adini, I., Short, S., Bazinet, L., Nakai, K., Pravda, E., Hornstein, M. D., D'Amato, R. J., Folkman, J. Dendritic cells support angiogenesis and promote lesion growth in a murine model of endometriosis. Faseb J. 22, 522-529 (2008).
- Bobryshev, Y. V., Lord, R. S., Rainer, S., Jamal, O. S., Munro, V. F. Vascular dendritic cells and atherosclerosis. Pathol Res Pract. 192, 462-467 (1996).
- Nakai, K., Fainaru, O., Bazinet, L., Pakneshan, P., Benny, O., Pravda, E., Folkman, J., D'Amato, R. J. Dendritic cells augment choroidal neovascularization. Invest Ophthalmol Vis Sci. 49, 3666-3670 (2008).
- Huarte, E., Cubillos-Ruiz, J. R., Nesbeth, Y. C., Scarlett, U. K., Martinez, D. G., Buckanovich, R. J., Benencia, F., Stan, R. V., Keler, T., Sarobe, P. Depletion of dendritic cells delays ovarian cancer progression by boosting antitumor immunity. Cancer Res. 68, 7684-7691 (2008).
- Fernandez Pujol, B., Lucibello, F. C., Zuzarte, M., Lutjens, P., Muller, R., Havemann, K. Dendritic cells derived from peripheral monocytes express endothelial markers and in the presence of angiogenic growth factors differentiate into endothelial-like cells. Eur J Cell Biol. 80, 99-110 (2001).
- Gottfried, E., Kreutz, M., Haffner, S., Holler, E., Iacobelli, M., Andreesen, R., Eissner, G. Differentiation of human tumour-associated dendritic cells into endothelial-like cells: an alternative pathway of tumour angiogenesis. Scand J Immunol. 65, 329-335 (2007).
- Bobryshev, Y. V., Lord, R. S. Mapping of vascular dendritic cells in atherosclerotic arteries suggests their involvement in local immune-inflammatory reactions. Cardiovasc Res. 37, 799-810 (1998).
- Bobryshev, Y. V., Lord, R. S. Co-accumulation of dendritic cells and natural killer T cells within rupture-prone regions in human atherosclerotic plaques. J Histochem Cytochem. 53, 781-785 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados