Method Article
La microinyección de ovocitos de ratón, Maduración y Evaluación de ploidía
En este artículo
Resumen
Los ovocitos son propensos a la aneuploidía debido a errores en la segregación cromosómica durante la maduración meiótica. Huevos aneuploides puede causar infertilidad, abortos involuntarios o trastornos del desarrollo como el síndrome de Down. Aquí se describen los métodos para introducir los materiales de elección en los ovocitos y los métodos para estudiar la maduración meiótica y evaluar la ploidía.
Resumen
Errores en la segregación cromosómica llevar a las células aneuploides. En las células somáticas, la aneuploidía se asocia con el cáncer, pero en los gametos, la aneuploidía lleva a la infertilidad, abortos involuntarios o trastornos del desarrollo como el síndrome de Down. Gametos haploides forma a través de las especies-programas de desarrollo específicos que se acoplan a la meiosis. La primera división meiótica (MI) es único a la meiosis, porque las cromátidas hermanas permanecen unidas, mientras que los cromosomas homólogos se separan. Por razones que no se entiende, esta división reduccional es propenso a errores y es más común la fuente de aneuploidía que los errores en la meiosis II (MII), o que los errores en la meiosis masculina 1,2.
En los mamíferos, la detención ovocitos en profase de la MI con una vesícula grande, intacto germinal (GV; núcleo) y sólo reanudar la meiosis cuando se reciben señales de la ovulación. Una vez que se reanuda la meiosis, MI ovocitos completo y someterse a una división celular asimétrica, a arrestar de nuevo en la metafase de MII. Los huevos no se completará hasta MII son fertilizados por el esperma. Los ovocitos también pueden someterse a la maduración meiótica utilizando establecido en las condiciones de cultivo in vitro 3. Ya que la generación de mutantes de ratones transgénicos y de genes específicos-es costoso y puede tomar mucho tiempo, la manipulación de los gametos femeninos in vitro es una estrategia más económica y de ahorro de tiempo.
Aquí se describen los métodos para aislar la profase detenido de los ovocitos de ratón y de microinyección. Cualquier material de elección puede ser introducido en el óvulo, sino porque meiotically-competente ovocitos son transcriptionally silencio cRNA 4,5, y no el ADN, se debe inyectar para los estudios de la expresión ectópica. Para evaluar la ploidía, describimos nuestras condiciones para la maduración in vitro de ovocitos MII a los huevos. Históricamente, el cromosoma de propagación se utilizan técnicas para contar el número de cromosomas 6. Este método es técnicamente difícil y se limita a la identificación de hyperploidies. Aquí se describe un método para determinar la hipo y la hyperploidies con huevos intactos 7-8. Este método utiliza monastrol, un inhibidor de la kinesina-5, que se derrumba el huso bipolar en un huso monopolar 9 cromosomas separando así como que cinetocoros individuales pueden ser fácilmente detectados y contados mediante el uso de un suero anti-CREST autoinmunes. Debido a que este método se lleva a cabo en huevos intactos, los cromosomas no se pierden debido a errores del operador.
Protocolo
1. Recogida de ovocitos de ratón
- Para maximizar el número de folículos antrales aislado de cada ratón, por vía intraperitoneal se inyectan ratones hembras sexualmente maduras (usamos 6 semanas de edad ratones CF-1 de Harlan) con 5 UI de gonadotropina sérica de yegua preñada (PMSG).
- Preparar el medio de recolección (MEM / PVP) (3 ml / ratón) mediante la adición de milrinona a 2,5 M y calentarlo a 37 º C. La milrinona es un inhibidor de la fosfodiesterasa, que mantiene una detención meiótica de ovocitos se extraen de los folículos. Por otra parte, 3-isobutil-1-metilxantina (IBMX) (0,2 mM) o dibutiril-monofosfato cíclico de adenosina (dbcAMP) (100 mg / ml) se puede utilizar. Preparar el medio de cultivo mediante la adición de glutamina (1 mM) y milrinona (2,5 M) a 1 ml de CZB y deje que se equilibre en la incubadora por lo menos una hora. Establecer las microgotas de cada uno en una placa de Petri y la superposición con aceite mineral. El plato CZB se coloca en la incubadora, mientras que el plato MEM / PVP queda fuera de una diapositiva más cálido. Otra colección y medio de cultivo que están disponibles en el mercado (M2 y M16 de soportes especiales o Sigma) también se utilizan habitualmente.
- Aproximadamente 48 horas después de la PMSG cebado, el sacrificio del ratón usando CO 2 sedación seguido por dislocación cervical, disección de los ovarios y los situará en un vidrio de reloj que contiene pre-calentado MEM / PVP + milrinona (MEM / PVP + M).
- Con una jeringa de insulina de 1 ml, de anclaje de los ovarios al plato y la liberación de los folículos antrales por punción de ellos en varias ocasiones con el de calibre 27 (o de coser) agujas que se unen entre sí.
- Mientras mira a través de un microscopio de disección, recoger cumulus-ovocito complejos usando una pipeta de boca de cristal. Es útil contar con un microscopio con mucho contraste. Como alternativa, el medio que contiene el tejido y las células pueden ser una pipeta a una tapa de una placa Petri de plástico. Sólo recogemos los folículos grandes antral y no menor pre-antral folículos o oocitos desnudos. Una vez recogidos, la transferencia de los complejos de una microgota de MEM / PVP + M que se encuentra en la diapositiva más caliente y con aceite.
- Con una pipeta pequeña (poco más grande que el diámetro de los ovocitos), pipeta de arriba y abajo de los complejos de separar las células del cúmulo. La transferencia de los ovocitos denudados con una pipeta más grande en una microgota de CZB + milrinona (CZB + M) y el lugar en la incubadora.
- Permita que los ovocitos para recuperar por lo menos durante 1 h en la incubadora antes de la manipulación.
2. Microinyección de ovocitos
- Hacer pipetas de inyección tirando de vidrio borosilicato tubo capilar en un extractor mecánico. Utilizamos un Flaming-Brown micropipeta extractor (Modelo P-97) con los siguientes valores: P = 500, Heat = 300, = 150 Tire, Vel = 100, Tiempo = 150.
- Preparar la plataforma de microinyección mediante la colocación de una caída de 5 l de MEM / PVP + M lo más cerca posible a una caída de 0,5 l de inyección de material de elección (siRNA, por ejemplo, cRNA, oligonucleótidos morfolino, etc) en un portaobjetos de la cámara de 1-bien que tiene la cámara de los medios de comunicación eliminado. Cubrir con aceite mineral y el lugar en la platina del microscopio (Fig. 1).
- Lugar de la inyección y pipetas de explotación en los titulares y la posición en la caída del MEM / PVP + M. A su vez en los tanques de nitrógeno que están conectados a la mesa de picoinjector y anti-vibración. Abrir la punta de la pipeta de inyección de él con cuidado golpeando contra la pipeta de sujeción, mientras que el llenado con el medio. Si la abertura es demasiado grande, el medio se mueven dentro y fuera de forma rápida y la aguja va a matar la célula. Pipetas con demasiado pequeño de una apertura con frecuencia se obstruyen fácilmente.
- Transferencia de ovocitos (5-10) de la incubadora para el MEM / PVP + M caída en la plataforma. Antes de inyectar, la configuración de la picoinjector. Nosotros utilizamos los siguientes parámetros en nuestro picoinjector (PLI-100 Modelo de Harvard Apparatus): PBal = 2.5-3.5 psi, PInj = 7,8 psi, PClear = 10-12 psi, tiempo = 3s. Esto se traduce en un volumen de inyección de 5-10 pL.
- Mientras presiona CLEAR, mover la aguja de la inyección a la caída de materiales y relleno. Volver a la caída de mediano plazo.
- Use la pipeta de sujeción a la captura de un ovocito y alinear la aguja de inyección, óvulos y pipeta de sujeción a lo largo del eje-x.
- A mayor aumento, el avance de la pipeta de inyección a través de los ovocitos con cuidado para evitar que el núcleo. Una vez que la membrana plasmática se perfora, pulse la inyección. Después de la inyección, retire la aguja. Liberación del ovocito y repetir. Una vez que todos los ovocitos se inyectan, a volver a la incubadora. Mantenga en CZB + M para la cantidad de tiempo deseado, y esta vez depende de la finalidad experimental (siRNA es decir, caída y morfolino (hasta 24 h), la sobreexpresión (03.12 h)). Tenga en cuenta que las incubaciones más de 24 horas pondrá en peligro la maduración meiótica.
3. Maduración de ovocitos
- Después de incubación, lavar los ovocitos a través de varias gotas de CZB (medio de maduración) y traslado a una microgota de medio de maduración con aceite y colocar en la incubadora.
- Permita 16 horas para completar la maduración de t o metafase de la meiosis II.
4. Ploidía análisis
- Prepare CZB + monastrol (100 M) y el lugar 750 l en el pozo de una placa de cultivo de órganos que tiene el agua en el anillo exterior.
- Lavar los huevos a través de varias gotas de CZB + monastrol y transferirlos a la placa de cultivo de órganos. Lugar en la incubadora durante 1 h.
- Fijar los huevos, transfiriéndolos a un vidrio de reloj que contiene 2% de paraformaldehído en PBS durante 20 minutos a temperatura ambiente. Transferencia a otro vidrio de reloj con solución de bloqueo. Este plato se puede almacenar a 4 ° C hasta su transformación.
- Traslado a la solución de permeabilización (PBS + 0,3% BSA + TritonX-100 0,1% + 0,02% NaN 3) en un vidrio de reloj durante 15 minutos a temperatura ambiente. Enjuague a través de varios grandes volúmenes de solución de bloqueo (PBS + 0,3% BSA + 0,01 Tween-20 + 0,02% NaN 3).
- El resto del procedimiento se realiza en la tapa de una placa de 96 pozos en una cámara húmeda a temperatura ambiente protegido de la luz. Las gotas (~ 25 l) se colocan dentro de las hendiduras circulares. Transferencia de huevos a la solución de bloqueo durante 15 minutos.
- Los centrómeros etiqueta, los huevos de transferencia a una gota de solución de bloqueo que contienen CREST anti-suero a las 1:40. Incubar durante al menos 1 h. Lavar a 3 gotas de solución de bloqueo, incubación de 15 minutos cada uno.
- La transferencia de los huevos de una gota de solución de bloqueo que contienen-o Cy5 Alexa-flúor-594-conjugado anti-IgG humana (1:200) y se incuba durante 1 hora. Repita la limpieza de los pasos que el anterior excepto para el último paso, incluyen Sytox Verde (1:5000) en la solución de bloqueo para detectar los cromosomas. Montaje en 5 l de Vectashield. Para evitar el aplastamiento de los huevos, poner 4 puntos poco de vaselina en las esquinas del lugar donde el cubreobjetos se. Coloque un cubreobjetos encima y sellar con esmalte de uñas. Conservar en una caja de diapositivas a 4 ° C hasta su procesamiento a través de microscopía confocal.
- Mientras que las imágenes con un objetivo de 100X, la captura de 0,4 micras medidas en el plano Z y la imagen de toda la región del eje de la metafase. Conde centrómeros utilizando el software de imagen como Image J (NIH).
5. Los resultados representativos:
La figura 2 es una proyección de Z-de un huevo euploides. En la metafase de la MII, los huevos euploides ratón contienen 20 pares de cromosomas y por lo tanto tiene 40 centrómeros. De vez en cuando los cromosomas no difundir a pesar del tratamiento monastrol. Esta situación hace que sea difícil contar con fiabilidad los centrómeros y por lo tanto, no incluyen los huevos en nuestros análisis. En ocasiones, puede ser difícil determinar si un CREST-inmunorreactiva "spot" es de 1 o 2 centrómeros. El uso de programas tales como J de la imagen es útil porque se puede analizar cada sección Z, mientras que observando cuidadosamente la orientación de los cromosomas, el número de secciones en las que se detecta un "punto" y la intensidad de los píxeles de la "spots" tiene. Dependiendo de donde el huso meiótico se posiciona en relación con el cuerpo polar, las regiones de ADN se pueden superponer y estas muestras no deben ser incluidos en el análisis.
No manipulado, en vivo huevos ovularon de ratones jóvenes reproductivamente tienen bajas tasas de aneuploidía (~ 1.2%). Sin embargo, por razones que no entiende, la microinyección y en los procedimientos de maduración in vitro puede aumentar este índice al alza de 10%. Por lo tanto, es fundamental que los ovocitos control inyectados están incluidos en cualquier estudio de microinyección.

Figura 1. Plato microinyección establecido. Una diapositiva de cámara con 5 gotas de l MEM / PVP + M justo por encima de las gotas 0.5μl de solución inyectable. Cubrir con aceite mineral. En este ejemplo hay 3 gotas de tres soluciones diferentes de inyección y la tapa está sentado en el escenario de un microscopio. A la izquierda está la aguja de microinyección y la derecha es la pipeta de sujeción. Tenga en cuenta que no es un reflejo de los titulares de la aguja.
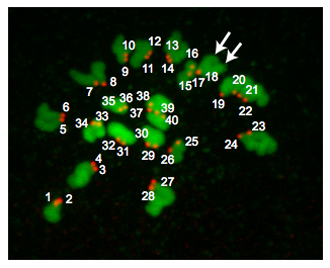
Figura 2. Los resultados de ploidía. A a la Z-proyección de un huevo euploides metafase II. ADN es de color verde y cinetocoros son de color rojo. Las flechas apuntan a dos armas distintas de cromátidas que indica que cinetocoros (# 17 y # 18) se superponen. Huevos euploides ratón contienen 20 pares cinetocoro (40 en total "spots"). Un huevo aneuploides contener cualquier variación en este número. Si este procedimiento se llevó a cabo en metafase MI, habría 40 pares cinetocoro (80 total de "puntos").
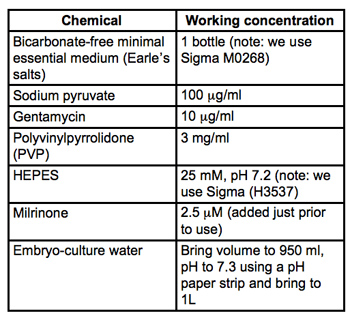
Tabla 1. Receta para el medio de recolección y la microinyección (MEM / PVP + M). Todos los materiales son embrión de la cultura y el grado de Sigma-Aldrich. Filtro de esterilización a través de filtros de 0.22μm PVDF (usamos Stericups miliporo) y almacenar a 4 ° C.
iles/ftp_upload/2851/2851table2.jpg "alt =" Tabla 2 "/>
Tabla 2. Receta para el medio CZB. Todos los materiales son embrión de la cultura y el grado de Sigma-Aldrich. Filtro de esterilización a través de filtros de 0.22μm PVDF (usamos Stericups miliporo) y almacenar a 4 ° C.
Discusión
Microinyección de ovocitos es un poderoso método para estudiar los mecanismos que regulan la maduración meiótica 10,11, 12, 13. Este método ofrece una forma económica de probar las hipótesis antes de hacer una gran inversión en el desarrollo de modelos de ratones transgénicos y de destino. Recolección de los ovocitos y las técnicas de microinyección requieren más tiempo para dominar a los procedimientos típicos de la biología celular. Obstáculos específicos con la colección a menudo incluyen el control de la pipeta de la boca, tirando de la pipeta de vidrio de tamaño adecuado para la recolección y extracción de las células somáticas y el aumento de la velocidad de recogida para reducir al mínimo el tiempo en que los ovocitos se encuentran fuera de la incubadora. Se recomienda la práctica muchas veces antes de hacer experimentos. La transferencia de ovocitos entre microgotas, manteniendo el mismo número de células es una buena manera de sentirse cómodo con este método.
La muerte celular ocurre comúnmente mientras aprenden microinyección. Esto puede ocurrir por varias razones, incluyendo la inyección de demasiado grande de un volumen de material (es decir, la abertura de la aguja de la inyección es demasiado grande), alcanzando el núcleo con la aguja de inyección, la perforación del otro lado de los ovocitos o que el material inyectado es tóxico para el ovocito. Practicar con la inyección de buffer en oocitos hasta que su tasa de supervivencia es de al menos el 50% es la clave para dominar esta técnica. Si no maduran los ovocitos es probable que la milrinona no se diluye bastante. Se recomienda enjuagar los ovocitos a través de muchas gotas grandes de milrinona sin CZB antes de la maduración.
La microinyección siguiente análisis de ploidía es uno de los muchos ensayos para evaluar la maduración meiótica. Otros análisis de rutina que utilizamos en el laboratorio incluyen el control de la cinética en la que el progreso a través de los ovocitos de la meiosis, la inmunofluorescencia para analizar la formación del huso y la alineación de los cromosomas y la activación del huevo o la fertilización in vitro para evaluar las consecuencias del desarrollo de la manipulación de los ovocitos 14,15, 16, 17.
Divulgaciones
Agradecimientos
Este trabajo se llevó a cabo en el laboratorio de Richard M. Schultz 's. Los autores también desean agradecer a Michael Lampson para la conceptualización de la prueba de recuento de centrómero y el acceso a su microscopio confocal. Teresa Chiang y Duncan Francesca ayuda en la optimización de la prueba de recuento de centrómero. Paula Stein con el apoyo de HD022681 (a RMS) y Karen Schindler con el apoyo de HD055822.
Materiales
Tabla de reactivos específicos:
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Milrinona | Sigma-Aldrich | M4659 | Resuspender en DMSO a 2,5 mm |
| De aceite mineral | Sigma-Aldrich | M5310 | Sólo el uso de embriones a prueba, esterilizada por filtración |
| CREST autoserum | Immunovision | HCT-0100 | |
| Sytox Verde | Invitrogen | 57020 | |
| Anti-humano Alexa 594 | Invitrogen | A-11014 | |
| Vectashield | Vector Laboratories | H-100 | |
| Paraformaldehído | Polysciences | 577773 | |
| Albúmina de suero bovino | Sigma-Aldrich | A3294 | |
| PMSG | Calbiochem | 367222 | |
| Monastrol | Sigma-Aldrich | M8515 | Resuspender en DMSO a 100 mM |
| Tween-20 | Sigma-Aldrich | 274348 | |
| TritonX-100 | Sigma-Aldrich | X-100 |
Tabla de equipos específicos:
| Nombre del Equipo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| Boquilla | Biodiseno | MP-001-Y | |
| Vidrio de reloj | Microscopía electrónica de Ciencias | 70543-30 | |
| Jeringa | BD | 309623 | 1 ml, 27 G 1 / 2 |
| 60 mm Petri | Halcón | 351007 | |
| Pipetas Pasteur de vidrio | Fisher Scientific | 13-678-200 | |
| Lado más caliente | Fisher Scientific | Cualquier modelo estándar | |
| Disección microscopio | Cualquier modelo estándar | ||
| Cámara de diapositivas | Nunc | 177372 | |
| Tubos capilares | Drummond | 1-000-0500 | Microcaps |
| Pipeta Extractor | Flaming-Brown micropipeta extractor | Modelo P-97 | |
| Microscopio invertido | Nikon | Cualquier modelo estándar | |
| Micromanipuladores | Eppendorf | Cualquier modelo estándar | |
| Picoinjector | Harvard Apparatus | Modelo PLI-100 | Cualquier modelo estándar |
| CO 2 tanques | De la incubadora | ||
| N2 tanque | Para la tabla y el inyector | ||
| Anti-vibración de mesa | Producción técnica | Cualquier modelo estándar | |
| Incubadora | Cualquier modelo estándar | ||
| Pipetas de la celebración de | Eppendorf | 930001015 | Vacutip |
| Microscopio confocal | Leica | Cualquier modelo estándar | |
| Herramientas de disección | Herramientas de Bellas ciencia | Cualquier modelo estándar | |
| Cámara húmeda | Usamos tupperware | ||
| Tapa de placa de 96 pocillos | Nunc | 263339 | |
| Portaobjetos de microscopio | Fisher Scientific | 12-544-3 | |
| Cubreobjetos | Thomas científica | 6663-F10 | De espesor puede variar para los microscopios en particular |
| Centro de órganos y placa de cultivo | Fisher Scientific | 353037 | 60 X 15 mm |
Referencias
- Hunt, P. A., Hassold, T. J. . Science. 296 (5576), 2181-2181 (2002).
- Hassold, T., Hall, H., Hunt, P. . Hum Mol Genet. 16 Spec No. 2, R203-R203 (2007).
- Chatot, C. L., Ziomek, C. A., Bavister, B. D. . Journal of reproduction and fertility. 86 (2), 679-679 (1989).
- Schultz, M. R. . Oogenesis and the control of meiotic maturation. , (1986).
- Moore, G. P., Lintern-Moore, S. . Biol Reprod. 18 (5), 865-865 (1978).
- Hodges, C. A., Hunt, P. A. . Chromosoma. 111 (3), 165-165 (2002).
- Schindler, K., Schultz, R. M. . Cell Cycle. 8 (7), 1090-1090 (2009).
- Chiang, T., Duncan, F. E., Schindler, K. . 20 (17), 1522-1522 (2010).
- Mayer, T. U., Kapoor, T. M., Haggarty, S. J. . Science. 286 (5441), 971-971 (1999).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5135-pdb prot5135 (2009).
- Stein, P. . Cold Spring Harbor protocols. 2009 (1), pdb prot5132-pdb prot5132 (2009).
- Reis, A., Chang, H. Y., Levasseur, M. . Nat Cell Biol. 8 (5), 539-539 (2006).
- Schuh, M., Ellenberg, J. . Cell. 130 (4), 484-484 (2007).
- Backs, J., Stein, P., Backs, T. . Proceedings of the National Academy of Sciences of the United States of America. 107 (1), 81-81 (2010).
- Schindler, K., Schultz, R. M. . Biol Reprod. 80 (4), 795-795 (2009).
- Kudo, N. R., Wassmann, K., Anger, M. . Cell. 126 (1), 135-135 (2006).
- Shoji, S., Yoshida, N., Amanai, M. . The EMBO Journal. 25 (4), 834-834 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados