Method Article
Ex infección in vivo del tejido vivo con virus oncolíticos
En este artículo
Resumen
Virus oncolíticos son prometedores para la terapéutica del cáncer. La capacidad de determinar la infectability de muestras de tejido obtenidas de pacientes vivos antes del tratamiento es una ventaja única de este enfoque terapéutico. Este protocolo describe cómo procesar los tejidos de Ex vivo Infección con el virus oncolíticos y cuantificación viral posterior.
Resumen
Los virus oncolíticos (VO) son nuevas terapias que se replican en forma selectiva y eliminar las células tumorales 1. Varios ensayos clínicos que evalúan la efectividad de una variedad de plataformas incluyendo oncolíticos HSV, reovirus, y VO Vaccinia como tratamiento para el cáncer son actualmente 5.2 en marcha. Una característica clave de los virus oncolíticos es que pueden ser modificados genéticamente para expresar transgenes periodista que hace posible visualizar la infección de los tejidos al microscopio o bio-luminiscencia de imagen 6,7. Esto ofrece una ventaja única, ya que es posible infectar los tejidos de los pacientes ex vivo antes de la terapia con el fin de determinar la probabilidad de éxito viroterapia oncolíticos 8. Para ello, es fundamental para la muestra adecuada de tejido para compensar la heterogeneidad del tejido y evaluar la viabilidad del tejido, especialmente antes de la infección 9. También es importante seguir la replicación viral con transgenes periodista si se expresa por la plataforma oncolíticos, así como por la valoración directa de los tejidos después de la homogeneización con el fin de distinguir entre infección abortiva y productiva. El objeto de este protocolo es para tratar estos temas y en este documento se describe una. El muestreo y la preparación del tejido tumoral para el cultivo celular 2. La evaluación de la viabilidad del tejido con el metabolismo tinte azul alamar 3. Infección ex vivo de tejidos cultivados con el virus vaccinia que expresan bien las buenas prácticas agrarias o luciferasa de luciérnaga 4. La detección de la expresión del transgén por microscopía de fluorescencia o el uso de un sistema de imágenes in vivo (IVIS) 5. La cuantificación del virus de la placa de ensayo. Este método integral presenta varias ventajas, incluyendo la facilidad de procesamiento de tejidos, la compensación por la heterogeneidad del tejido, el control de la viabilidad del tejido, y la discriminación entre la infección abortiva y hueso la replicación viral de buena fe.
Protocolo
1. Procesamiento de tejidos
- Para mejores resultados, este protocolo debe llevarse a cabo utilizando tejido aislado recién depositados en los medios de comunicación DMEM con 10% de SFB, 1% Pennicilin / estreptomicina solución, y el 0,1% anfotericina B solución inmediatamente después de la cirugía antes de su procesamiento. Si esto no es posible, los tejidos se puede dejar toda la noche en este medio a 4 grados antes del procesamiento.
- Antes de procesar la muestra, esterilizar unas pinzas de metal y las cuchillas desechables, depositando en una solución de etanol al 70% por lo menos durante 5 minutos. También preparamos una placa de 24 pocillos con 2 ml de DMEM medio que contiene 10% de SFB, 1% Pennicilin / estreptomicina solución, y el 0,1% anfotericina B.
- Recoger la muestra de tejido en una campana de flujo laminar cultivo celular utilizando pinzas esterilizadas y el depósito de tejido en un vacío de 15 cm de placa de Petri, manteniendo la tapa en el lateral, parte estéril hacia arriba.
- En la capilla de cultivo celular, utilizar una biopsia en sacabocados de 2 mm para obtener núcleos diferentes de una variedad de regiones dentro de los tejidos como en la figura 1. Depósito de los núcleos en la tapa de la de Petri de 15 cm con la ayuda de unas pinzas, dejando espacio suficiente entre cada núcleo de manera que se pueden cortar a lo largo del eje horizontal.
- Dividir cada núcleo en 4 cuartos, incluso utilizando una hoja de afeitar esterilizadas como en la figura 1.
- Usando una punta de pipeta, poner a cada trimestre núcleo de un núcleo dado en un lugar bien distinto de A1 a A4 como en la figura 1, ya que contiene 1,5 ml de DMEM con 10% de SFB, 1% Pennicilin / estreptomicina solución, y la solución al 0,1% anfotericina B . Repita este procedimiento para cada núcleo. Esto debería permitir a una muestra representativa del tumor, minimizando el sesgo de un bien dado / condición. Para una mejor representación, aumentar el número de núcleos.
2. Evaluación de la viabilidad del tejido
- Procesamiento de los tejidos siguientes, agregar 25μl Alamar azul para así # # A1 y A2 como se muestra en la figura 1 y se incuba durante 1 hora a 37 grados en un incubador humidificado con un 5% de CO 2.
- Después de la incubación con alamar azul, eliminar 3 veces 100 l de cada uno de A1 y A2 bien y transferir a 6 diferentes pozos de una placa de 96 pocillos. Leer la señal mediante un lector de placas de fluorescencia (530 excitación, emisión de 590) y mantener los datos en sus archivos.
- Después de Alamar azul señal de que se ha leído, la transferencia de todas las piezas de tejido mediante una punta de pipeta, de A1 a C1 y que contiene DMEM, 10% de SFB + PS + AmphoB. Tenga cuidado de no transferencia de una cantidad excesiva de medios de comunicación y A1.
- Infectar a los pozos A3 y A4, respectivamente, con 10 6 UFP de que expresan GFP y luciferasa que expresan el virus de la vacuna diluida en 25 l de los medios de comunicación. Así A2 puede estar infectada con un virus que expresa que cualquier transgén dado incluso ninguno en absoluto.
- 72 horas más tarde, se añaden 25 l azul Alamar a los pocillos C1 y D1 y repita el paso 2.2
3. La visualización de la expresión del transgén GFP por microscopía de fluorescencia
- Quite todos los medios de cultivo celular que cubre las piezas de tejidos con el fin de tomar buenas imágenes de fluorescencia.
- Utilizando un microscopio de disección de fluorescencia con capacidad de, en primer lugar tener una imagen de contraste de fase en una resolución adecuada
- Cambiar a modo de fluorescencia y tomar una foto utilizando el filtro adecuado para visualizar el transgen de interés, en este caso las buenas prácticas agrarias.
- Use un filtro de fluorescencia para otra longitud de onda en la medida de un posible de la de los transgenes de interés (por ejemplo, RFP) para tomar una fotografía de fluorescencia de fondo
4. La visualización de expresión de luciferasa utilizando un sistema de imágenes in vivo (IVIS)
- Asegúrese de que el IVIS se inicia antes de empezar.
- En los pozos A4 y B4, añadir 5 l de sustrato luciferina 10 mg / ml, mezclar bien e incubar durante 5 minutos a temperatura ambiente.
- Establecer el tiempo de exposición IVIS a 5 segundos y tomar una foto de sus pozos. Si la imagen está saturada, repetir con el tiempo de exposición más bajos. Si no hay señal, aumentar el tiempo de exposición.
- Utilizando el software de imágenes IVIS, puede eliminar el fondo con la señal de bien B4 y seleccione la región de interés para cuantificar la señal de luminiscencia.
5. La evaluación de los títulos virales mediante el ensayo de placa
- Antes de la cuantificación de los títulos virales, los tejidos debe ser homogeneizada para liberar las partículas virales. Esto se puede hacer varios meses más tarde en las muestras de tejido infectado se almacenan a -80
- Pese la muestra que debe ser homogeneizada utilizando una balanza analítica. En este caso, vamos a utilizar la muestra tomada a partir de A2 bien.
- Coloque el tejido en un tubo de 5 ml de poliestireno de fondo redondo de halcón y añadir 1 ml de PBS. Homogeneizar el tejido usando un homogeneizador de tejidos. Si es necesario, guarde el homogeneizado a -80 para la evaluación de los títulos virales en un momento posterior.
- A título de virus vaccinia, primer plato 1 millón de células U2OS en una placa de 6 pocillos y se incuba durante la noche en un grado 37, 5% de CO 2 húmedoficados de tal manera que han llegado a aproximadamente el 95% de confluencia del día siguiente a la incubadora.
- El uso medio libre de suero para hacer diluciones seriadas del virus, asegurándose de que cambie la punta de cada paso de dilución. Normalmente hacemos una en 10 diluciones y el uso de 100 l para transferir a 900 microlitros. ¿Cómo diluciones se hacen muchas depende del rendimiento esperado del virus.
- Después de hacer las diluciones, retire el papel que cubre las células U20S chapado a continuación, añadir 500 l de stock de virus diluido (para cada dilución) para infectar a las células U2OS. Se incuban las células durante 1 minuto hora a 37 grados centígrados en un 5% de CO 2 humidificado incubadora.
- Durante este tiempo, calentar el X 2 se concentró DMEM con 20% de SFB, y la solución al 3% del CMC en un baño de agua a 37 grados.
- Después de la incubación de 1 hora, retire el papel que cubre las células infectadas U2OS. Mezcla 1:1 volumen de 3% de CMC: 2X DMEM, 20% de SFB en conjunto y el uso de 2 ml de esta mezcla para cubrir cada pocillo de las células infectadas U2OS.
- Poner de nuevo en las células a 37 grados 5% de CO 2 humidificado incubadora durante 48 horas.
- Después de 48 horas, añadir 2 ml de metanol-acético fijador de ácido en la parte superior de la plantilla del CMC en cada pocillo e incubar a temperatura ambiente durante 10 minutos en una campana de cultivos celulares.
- Descartar la superposición fija y lavar el resto de de los pozos con agua del grifo.
- Tinción de las células U2OS fija con 2 ml de una solución de azul de Coomassie por pocillo y se incuba durante 30 minutos a temperatura ambiente a baja velocidad en un agitador de placas.
- Retire la tinción de Coomassie de los pocillos y lavar los platos con agua del grifo. Deje que se seque con el de la tapa durante aproximadamente una hora.
- Las placas resultantes viral se puede visualizar fácilmente en la figura 2C. Las placas pueden guardarse indefinidamente en esta etapa.
- Contar con placas en la etapa de dilución, donde entre 10 y 100 placas son visibles.
- Multiplicar el número de placas contadas por la dilución empleada y multiplicar el número resultante por 2 para dar un título en PFU / ml. Por ejemplo, si se cuentan 25 placas en el pozo donde se utilizó una dilución de un millón de veces, el título de la muestra sin diluir inicial es de 25 multiplicado por 1 millón de multiplicar por 2 o 50 millones de PFU / ml. Además dividimos este número por el peso inicialmente medida de la muestra para informar de los títulos de UFP / g
6. Los resultados representativos:
Con el fin de determinar con exactitud si una muestra de tejido obtenida quirúrgicamente normal / tumor es o no es infectables con el virus, primero debe asegurarse de que la muestra de tejido es menos viable. Fig. 1A muestra que la viabilidad se evaluó mediante un tinte metabólico (Alamar azul) y que el tejido normal y tumoral pueden permanecer metabólicamente activo durante un periodo de al menos 72 horas. Esto sugiere que los tejidos ex vivo cultivadas pueden apoyar la replicación viral. Una ventaja significativa de virus oncolíticos es que pueden ser modificados para expresar transgenes terapéuticos o de imagen. Fig. 2D-E demuestra que las buenas prácticas agrarias o de luciferasa se puede detectar a partir de tejidos infectados ex vivo, más el apoyo que estos tejidos son viables y infectables también. A pesar de una mayor expresión del transgen se asocia generalmente con la replicación viral, no es necesariamente equivalente a un ciclo de vida productiva viral que conduce a la auto-amplificación y la propagación, que se cree que es importante para la actividad terapéutica. Por esta razón, es necesario determinar si el virus se produce más de lo que se utilizó para infectar inicialmente el tejido. Fig. 2B muestra que en la cuantificación viral por la placa de ensayo, más virus se obtiene después de 72 horas y después la infección de tejido recogidas inmediatamente después de la infección. En general, estos datos muestran que el tejido extirpado quirúrgicamente tumor pueden permanecer viables en cultivo celular por un período de al menos 72 horas, durante el cual la replicación viral tiempo puede ser apoyada.

Figura 1. Descripción general de los tejidos de muestreo / seccionamiento protocolo. Muestras de tejido se procesa mediante la eliminación de varios núcleos de 2 mm que posteriormente se divide en cuatro cuartos que se distribuyen al azar en los pozos A1-A4. Los códigos de color indican los reactivos utilizados en cada pocillo. Las casillas sombreadas en los pozos representan cada trimestre desde el 6 núcleos individuo representado. El tejido en el pozo A1 se transfiere a un nuevo pozo (C1), con los medios de comunicación después de la lectura inicial alamar azul. Una segunda lectura se realiza al final de la incubación de 72 horas con el virus. Wells A4 y B4 se complementan con luciferina después de la incubación de 72 horas después de la infección
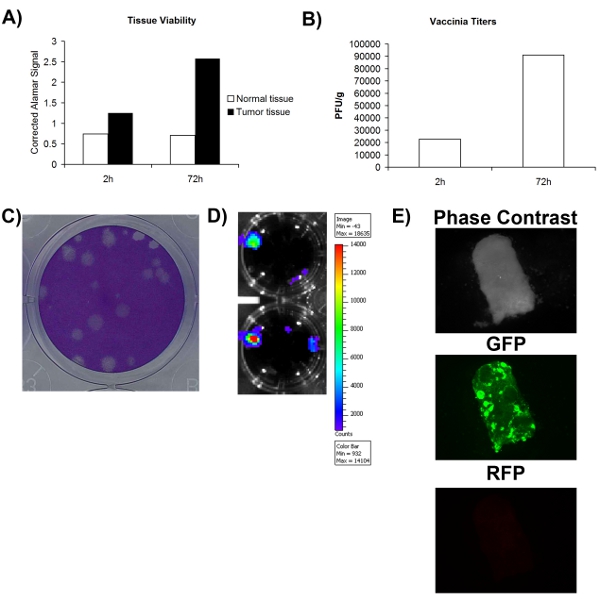
Figura 2. Viabilidad y infectability de muestras de tejido del paciente. A) la viabilidad del tejido, medido por alamar señal azul en 2 horas y 72 horas después de la recolección. Eje Y representa el espacio en blanco de la señal corregida alamar azul. B) título del virus vacciniarecogidos por gramo de muestras de tejidos 2 y 72 horas post-infección. C) Ejemplo de placas de virus vaccinia en células U2OS siguientes tinción con Coomassie. D) de la señal de luminiscencia obtenido de pacientes VV-luciferasa tejido infectado utilizando imágenes IVIS. E) imágenes de microscopía de fluorescencia de muestra de tejido de pacientes infectados con VV-GFP.
Discusión
Uno de los pasos críticos de este protocolo es la obtención de muestras de tejido fresco. Si la muestra se pone en cultivo de células después de una larga espera en la sala de operaciones en un medio inadecuado (por ejemplo, PBS), esto puede comprometer la viabilidad del tejido y evitar infectability. Es de destacar que el tejido normal es inherentemente más propensos a estos efectos que los tejidos tumorales. Otro punto crítico es cómo muchos núcleos se utilizan para tomar muestras del tejido y la consistencia de su tamaño. Inconsistencias en el tamaño se producirá una mayor variabilidad entre las muestras del paciente ya que factores como la hipoxia tisular y la superficie infectectable fluctuará en función del tamaño de los núcleos y barrios centrales. Si bien esto puede ser parcialmente resuelto mediante el uso de máquinas de cortar el tejido, una de las ventajas del método que aquí se presenta es que es relativamente fácil y menos propenso a la contaminación, y de aplicación general para una variedad de tipos de tejidos, incluyendo tejidos blandos o viscosos que no son fácilmente susceptibles en el tejido cortado. Cabe destacar que el número de núcleos se puede aumentar con el fin de obtener una mejor representación del tejido. Además, los núcleos se puede cortar en piezas más (por ejemplo, 5-8) para dar cabida a otros ensayos de potencial de hacerse en paralelo, como el ADN, el ARN, o la extracción de proteínas. Sin embargo, el número de piezas en las que los núcleos se puede cortar al tamaño reproducible dependerá del tamaño real de los núcleos, que pueden ser modificados mediante el uso de diferentes sacatestigos tamaño. Opcionalmente, una manera de ayudar a la obtención de piezas de tejido de forma reproducible de tamaño es para igualar la longitud de los núcleos con una regla antes de subdividir aún más en trozos más pequeños. El protocolo, naturalmente, puede ser modificado para dar cabida a otros virus y hemos descubierto que los tejidos pueden ser viables y apoyar la reproducción de hasta 6 días. El protocolo adicional se puede extender a otras mediciones de manera viral-expresado transgenes incluyendo cytrokines. Tras la infección, los tejidos también pueden ser embebidos en parafina para seguir el corte y coloración mediante métodos inmunohistoquímicos, lo que permite un mayor refinamiento de la histología de los tejidos y cómo se relaciona con la infección viral 10-12.
Divulgaciones
Agradecimientos
Nos gustaría agradecer al Dr. Hesham Abdelbary humanos para proporcionar los especímenes quirúrgicos de los datos presentados en la figura 2.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios (opcional) |
|---|---|---|---|
| Elevados de glucosa en DMEM | Hyclone | SH30243.01 | |
| De suero fetal bovino | NorthBio Inc. | NBSF-701 | |
| Anfotericina B solución | Sigma Aldrich | A2942 | Uso en el 0,1% |
| Pennicilin-estreptomicina | Sigma Aldrich | P4333 | Uso en el 1% |
| Alamar Blue | Invitrogen | DAL1025 | |
| D-luciferina de sal de potasio | Productos de Imagen Molecular | D-luciferina de sal de potasio 1g | Volver a suspender en PBS a 10 mg / ml y el filtro de 0,22 micras filtro |
| MEM en polvo | Gibco | # 41500018 | Hacer en la mitad del volumen sugiere hacer 2X MEM y el filtro de 0,22 micras filtro antes de su uso |
| Carboximetil celulosa (CMC) | Sigma Aldrich | C9481 | Prepare una solución al 3% en agua destilada y autoclave. Tenga en cuenta que el polvo puede tomar algún tiempo para volver a suspender |
| Coomassie Brilliant Blue R | Sigma Aldrich | B7920 | |
| 2 mm biopsia punch | Miltex | MX-33-31 | |
| Doble Filospada de preparación | Personna Medical Care | 74-0002 | |
| Microscopio de disección de fluorescencia | Leica | modelo M205 FA | |
| Imágenes in vivo del sistema (IVIS) | Caliper Life Sciences | IVIS ® serie 200 | |
| Tejido Tearor | Biospec productos | modelo 985370-395 |
Referencias
- Parato, K. A., Senger, D., Forsyth, P. A., Bell, J. C. Recent progress in the battle between oncolytic viruses and cancer. Nat Rev Cancer. 5, 965-976 (2005).
- Renouf, L. C., Thway, K., Sibtain, A., McNeish, I. A., Newbold, K. L., Goldsweig, H., Coffin, R., Nutting, C. M. Phase I/II study of oncolytic HSV GM-CSF in combination with radiotherapy and cisplatin in untreated stage III/IV squamous cell cancer of the head and neck. Clin Cancer Res. 16, 4005-4015 (2010).
- Lal, R., Harris, D., Postel-Vinay, S., de Bono, J. Reovirus: Rationale and clinical trial update. Curr Opin Mol Ther. 11, 532-539 (2009).
- Park, B. H., Hwang, T., Liu, T. C., Sze, D. Y., Kim, J. S., Kwon, H. C., Oh, S. Y., Han, S. Y., Yoon, J. H., Hong, S. H., Moon, A., Speth, K., Park, C., Ahn, Y. J., Daneshmand, M., Rhee, B. G., Pinedo, H. M., Bell, J. C., Kirn, D. H. Use of a targeted oncolytic poxvirus, JX-594, in patients with refractory primary or metastatic liver cancer: a phase I trial. Lancet Oncol. 9, 533-542 (2008).
- Breitbach, C. J., Reid, T., Burke, J., Bell, J. C., Kirn, D. H. Navigating the clinical development landscape for oncolytic viruses and other cancer therapeutics: no shortcuts on the road to approval. Cytokine Growth Factor Rev. 21, 85-89 (2010).
- Boeuf, F. L. e. Synergistic interaction between oncolytic viruses augments tumor killing. Mol Ther. 18, 888-895 (2010).
- Silva, N. D. e., Atkins, H., Kirn, D. H., Bell, J. C., Breitbach, C. J. Double trouble for tumours: exploiting the tumour microenvironment to enhance anticancer effect of oncolytic viruses. Cytokine Growth Factor Rev. 21, 135-141 (2010).
- Diallo, J. S. A high-throughput pharmacoviral approach identifies novel oncolytic virus sensitizers. Mol Ther. 18, 1123-1129 (2010).
- Cooke, S. L. Intra-tumour genetic heterogeneity and poor chemoradiotherapy response in cervical cancer. Br J Cancer. , (2010).
- Pennington, K., Chu, Q. D., Curiel, D. T., Li, B. D. L., Mathis, J. M. The Utility of a Tissue Slice Model System to Determine Breast Cancer Infectivity by Oncolytic Adenoviruses. J Surg Res. , 1-6 (2010).
- Hochberg, M. Tropism of herpes simplex virus type 1 to non-melanoma skin cancers. Br J Dermatol. , (2010).
- Kuip, H. v. a. n. d. e. r. Short term culture of breast cancer tissues to study the activity of the anticancer drug taxol in an intact tumor environment. BMC Cancer. 6, 86-86 (2006).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados