Se requiere una suscripción a JoVE para ver este contenido. Inicie sesión o comience su prueba gratuita.
Method Article
ReAsH / Flash etiquetado y análisis de imágenes de las proteínas en las células del sensor Tetracysteine
En este artículo
Resumen
El biarsenical FlAsH tintes y ReAsH se unen específicamente a los motivos tetracysteine en proteínas y selectiva puede etiquetar las proteínas en células vivas. Recientemente, esta estrategia de etiquetado se ha utilizado para desarrollar sensores para diferentes conformaciones de las proteínas o los estados oligoméricos. Se describe el mecanismo de etiquetado y métodos para analizar cuantitativamente vinculante.
Resumen
Las proteínas fluorescentes y tintes son herramientas esenciales para el estudio de proteínas tráfico, localización y función en las células. Mientras que las proteínas fluorescentes como la proteína verde fluorescente (GFP) han sido ampliamente utilizados como socios de la fusión de las proteínas para hacer un seguimiento de las propiedades de una proteína de interés 1, los acontecimientos recientes más pequeñas etiquetas permiten nuevas funcionalidades de las proteínas que se examinarán en las células, como el cambio conformacional y proteínas de asociación 2, 3. Un sistema de etiqueta pequeña implica un motivo tetracysteine (CCXXCC) genéticamente insertado en una proteína diana, que se une a colorantes biarsenical, ReAsH (fluorescente de color rojo) y Flash (de color verde fluorescente), con una alta especificidad, incluso en las células vivas 2. El sistema de TC / biarsenical tinte ofrece mucho menos restricciones estéricas de la proteína de acogida de proteínas fluorescentes que ha permitido a varios nuevos métodos para medir el cambio en la conformación y las interacciones proteína-7.4. Recientemente hemos desarrollado una nueva aplicación de etiquetas de TC como sensores de oligomerización en células que expresan huntingtina mutante, que cuando mutan agregados en las neuronas en la enfermedad de Huntington 7. Huntingtina fue etiquetado con dos tintes fluorescentes, una una proteína fluorescente para seguir la localización de proteínas, y la segunda, una etiqueta de TC, que sólo vincula a los tintes biarsenical en monómeros. Por lo tanto, los cambios en la colocalización entre la proteína y la reactividad tinte biarsenical contenido habilitado oligómero submicroscópicas que se asigna espacio dentro de las células. Aquí se describe cómo etiquetar TC-etiquetados proteínas fusionadas a una proteína fluorescente (Cherry, las buenas prácticas agrarias o PPC) con flash o ReAsH en vivo las células de mamíferos y la forma de cuantificar la fluorescencia de dos colores (cereza / Flash, PPC / Flash o GFP / ReAsH combinaciones).
Protocolo
1. Preparación de las células para el etiquetado con ReAsH / Flash
- Utilizando los métodos estándar de cultivo celular para la línea celular de interés, preparar un cultivo de células adheridas directamente en una diapositiva de células imágenes en vivo listo para la transfección.
- Transfectar el plásmido que contenía TC-etiquetado de genes de interés en función de su método de transfección de la elección.
Tenga en cuenta que es importante la utilización de controles positivos y negativos para evaluar el grado de unión específica a las etiquetas de TC y evaluar de forma bleedthrough de fluorescencia entre los canales en la recogida de micrografías confocal. Por lo tanto, de dos colores (por ejemplo, Flash / cereza o ReAsH / PPC o combinaciones ReAsH / GFP), asegúrese de muestras se preparan para un solo color (por ejemplo, proteínas fluorescentes solo o si es posible una proteína TC-etiquetado vinculados a Flash / ReAsH pero sin fluorescentes proteína)
- Uno o dos días después de la transfección, aclare suavemente las células con 300 L precalentado (a 37 ° C) HBSS.
- Sumergir suavemente las células con Flash M 1 (o ReAsH) en 300 l de HBSS precalentado y 10 M de 1,2-etanoditiol (EDT).
Es importante agregar EDT primero antes de añadir Flash / ReAsH y hacer que el buffer justo antes de añadir a las células. Incubar durante exactamente 30 minutos a 37 ° C en la incubadora de cultivo de tejidos. En nuestra experiencia los tiempos de incubación más largo aumenta significativamente la fluorescencia de fondo. Nuevas construcciones también deben ser optimizados para el etiquetado de tiempo y Flash / ReAsH concentración (0.5-2 M).
- Aspire con cuidado el etiquetado solución de las células y luego vuelva a colocar con 300 l HBSS precalentado + 250 M 2,3-dimercaptopropanol (BAL) por 15 min a 37 ° C.
- Retire la solución de lavado por aspiración suave y reemplazar con 300 l HBSS precalentado.
Después de este lavado, las células se pueden fijar con paraformaldehído (15 min con 3,2% de solución), aunque hemos encontrado que este aumento no específico de fluorescencia tinte biarsenical. De ahí que por lo general la imagen de la células vivas a temperatura ambiente. (Tenga en cuenta que la fijación de las células antes de su etiquetado impide la unión colorante biarsenical.)
2. Imágenes de las células en un microscopio confocal
- En el microscopio confocal, configurar los parámetros para obtener imágenes de los fluoróforos individual (ver Tabla 1) y asegurarse de que no es bleedthrough insignificante entre los canales. Esto se puede lograr mediante la comprobación fluoróforos individuales (en las muestras de control) en contra de cada opción de adquisición de diferentes fluorescente para la fluorescencia. Ajuste de la longitud de onda de emisión puede ayudar a minimizar bleedthrough (aunque esto también puede reducir la relación señal / ruido).
- También puede ajustar la configuración del fotomultiplicador para que el máximo de fluorescencia en la muestra no saturar el detector. (Esto puede ser detectado mediante el ajuste de Q-LUT en el confocal Leica SP2). Una vez que la mejor configuración de imagen se determinan, no cambie ninguna de ellas entre las muestras.
- Otros ajustes se suelen utilizar (aunque estos pueden ser optimizados) son una velocidad de barrido de 200 Hz y recoger 4 promedios de línea y un diámetro de orificio de 1 unidad Airy. El diámetro del agujero de alfiler puede ser ampliado si la señal / ruido es un problema, sin embargo, esto puede resultar en una pérdida de imagen.
- Recoger las imágenes de confocal de 12-bit (o superior) formato, si es posible. 12-bit formato capta un mayor rango dinámico de los valores (0-4095) para cada intensidad de los píxeles de 8 bits (0-255). Esto es importante para asegurar el más rico conjunto de datos se registra, lo que maximiza la calidad de los análisis de datos cuantitativos.
- Recoge imágenes del canal de la proteína fluorescente (Cherry, las buenas prácticas agrarias o PPC) y también para el canal biarsenical tinte (flash o ReAsH) para todas las muestras.
3. Análisis de los datos
- Instale el software ImageJ en su ordenador 8. http://rsbweb.nih.gov/ij/
- Asegúrese de que su versión de ImageJ tiene los siguientes plugins:
- Abrir ImageJ, y si se utiliza una versión anterior a la v1.32c, haga clic en las opciones siguientes para permitir que múltiples imágenes que se abrirá a la vez (que se puede hacer manteniendo pulsado el botón de control mientras hace clic en diferentes archivos):
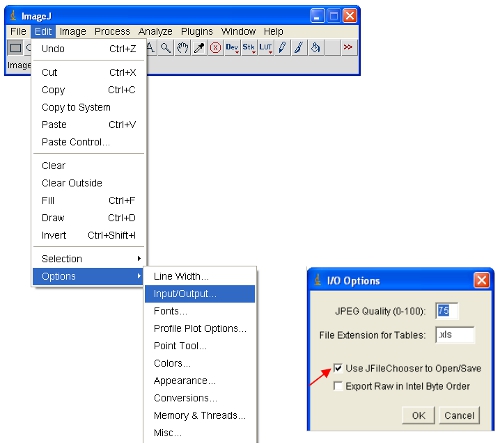
- Abra las imágenes de interés en ImageJ.
ImageJ definirá automáticamente las intensidades de los píxeles máximos y mínimos que se muestran en la pantalla para cada imagen por separado. Teniendo en cuenta que las diferentes imágenes se han dintensidades ifferent píxeles, esto significa que las imágenes mostradas no son comparables como se ven. - Para asegurarse de que las imágenes se abren todas en la misma escala, que físicamente puede definir los límites superior e inferior intensidades de los píxeles para ser visto (esto no va a cambiar el contenido de los datos reales de las imágenes, como sería el caso en algunos otros programas). Estos valores se puede establecer en el siguiente menú:
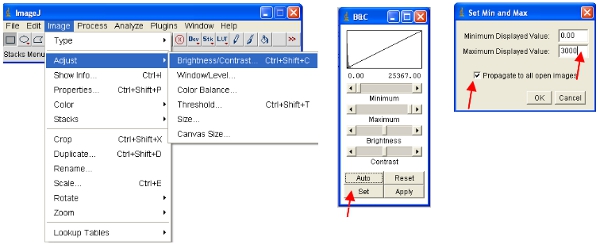
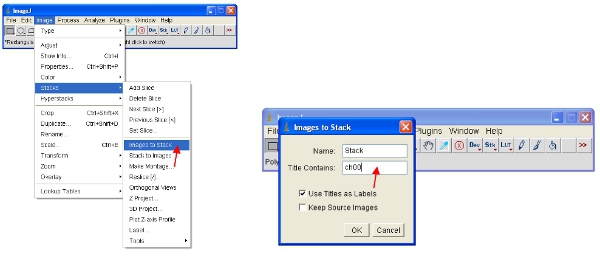
- Un enfoque alternativo es trabajar con las pilas, lo que pone todas las imágenes juntas en un solo archivo y se escalará de forma automática (para ver) todas las imágenes de la pila a la misma escala. La forma más fácil de trabajar con los datos es convertir cada canal a una pila. Por lo tanto, para el canal de la proteína fluorescente convertir a todos a la pila como se muestra. Usted puede seleccionar un canal por el apilamiento de todas las imágenes que contiene un nombre común (por ejemplo, "ch00") en el título.
- Ahora convertir todas las imágenes abiertas a 8 bits para su análisis. Esto va a cambiar la escala del rango considerado en un rango de 0 a 255 (que define de 8 bits).
IMPORTANTE: No guarde el original de 12-bit (o superior) de formato o se pierde el contenido de la información. Tenga en cuenta que algunos paquetes de software sólo puede mostrar imágenes de 8 bits por lo que este formato es útil para la toma de datos, etc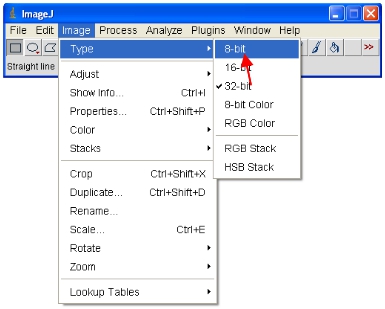
- Guardar una copia en una carpeta llamada "8-bit convertido" utilizando la opción "Guardar como ..." opción.
- Un método para examinar el grado de fijación del colorante biarsenical en una imagen de conjunto es para llevar a cabo un complot intensidad de la correlación de píxeles. Esto dibuja cada píxel de valor en un canal de relación con el correspondiente valor de píxel en un segundo canal. Por lo tanto, una posición de píxeles de alta en el PPC fluorescencia también será alto en la fluorescencia ReAsH si disponen de un enlace.
- Para analizar el píxel co-correlación, asegúrese de que el ReAsH de 8-bits y las imágenes de Cerulean / GFP están abiertas en ImageJ.
- Abra el "Correlador imagen" plug-in, como se indica a continuación. Seleccione "Image1", como la pila de ReAsH o Flash y "Image2", como la pila de la proteína fluorescente.
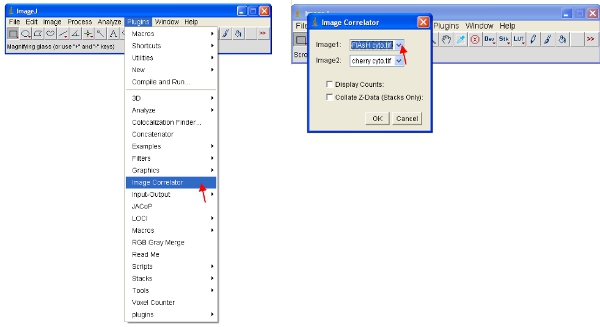
- La pila resultante no puede mostrar información detallada - esto es normal. Guarde la pila en una nueva carpeta llamada "Diagramas de dispersión" y darle el mismo nombre que la muestra se refiere a (por ejemplo, "flash-cereza gráfica de correlación")
- Para ver la información significativa que puede hacer una de dos opciones. En primer lugar transformar los datos para que sea en el formato de registro. Luego visualmente reescalar los datos de la siguiente manera:
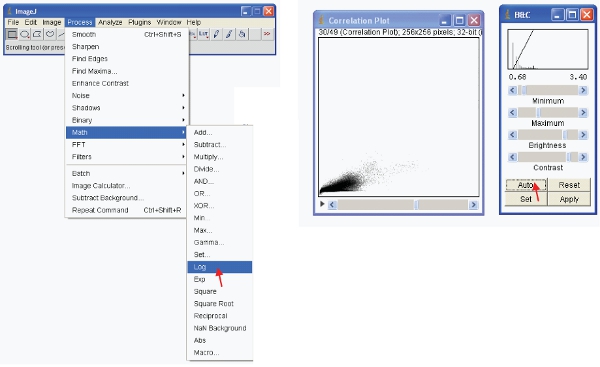
- Como alternativa, puede cambiar la escala de los datos visuales para mostrar sólo los valores bajos (por ejemplo, 1-255) y mostrar los datos utilizando una LUT especial. Una LUT (Look Up Table) representa una tabla de colores que se asignan a cada valor de píxel en una imagen . Esto puede ser usado para definir un plan de pseudocolor de una imagen y es útil para la definición de ciertas características de una imagen. Para crear una, haga clic LUT personalizada en "editor LUT" y hacer uno nuevo, como el que se muestra (esto puede ser guardado y utilizado más adelante).
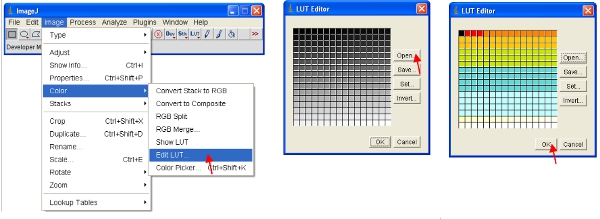
- Establecer el rango de brillo / contraste 0-255 (como se describe en el paso 13). Para "congelar" la imagen que la mostrada en la pantalla, la imagen se puede convertir a formato RGB, que guarda un valor de 8 bits para cada uno de los colores rojo, verde y azul de cada píxel.
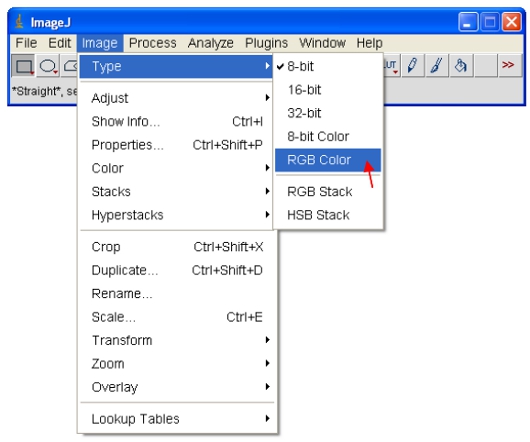
Para copiar y pegar imágenes a otros programas de abrir por primera vez las imágenes de 8-bit o 16-bit. Como se describe en el paso 14, asignar una combinación de colores LUT de la imagen. De la PPC, asigne el "Cyan" LUT como se describe a continuación ...
- Seleccione la imagen y copiarla en el portapapeles de selección, ...
4. Los resultados representativos:
El éxito de las células de etiquetado con los tintes biarsenical depende de los parámetros clave. En primer lugar, el momento en el etiquetado con los tintes es crucial. Hemos encontrado que durante largos períodos de etiquetado (más de 30 minutos) se traduce en un alto grado de tinción de fondo inespecífica. La figura 1 muestra un resultado típico de una forma de tipo salvaje de un fragmento de la huntingtina (25Q) fusionado con el Cerulean PPC derivado que contenga una etiqueta de TC como se describió anteriormente 7. Esta muestra se tiñó durante 30 minutos con ReAsH y no hay experiencia mínima en la muestra que carecen de la etiqueta de TC. Hemos encontrado que la fijación de las células con paraformaldehído plano aumenta mientras que la fijación con metanol abroga la fluorescencia de la etiqueta de la proteína fluorescente. De ahí que sea posible que la imagen de la células vivas. Es importante señalar también que la fijación previaal etiquetado con los tintes biarsenical impide su unión, presumiblemente debido a las modificaciones del motivo de TC.
Otro factor fundamental para obtener resultados consistentes es la densidad de las células. Hemos encontrado que es esencial para las células de la imagen que están más o menos distribuidos y también que agrupar extensa puede dar lugar a manchas irregulares de los tintes biarsenical en diferentes células.
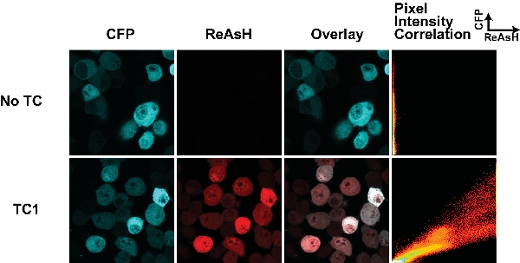
Figura 1. Tetracysteine etiquetas y tinción ReAsH en células vivas transfectadas con la huntingtina (exon1-25Q)-Cerulean fusiones. La etiqueta de TC se encuentra en el cruce de la fusión de la huntingtina, Celeste (como se describe en 7). La trama de intensidad de correlación de píxeles permite una evaluación a las diferencias en ReAsH vinculante en toda la célula y puede ser utilizado para trazar los cambios en ReAsH vinculante debido al cambio conformacional o ligando.
Access restricted. Please log in or start a trial to view this content.
Discusión
El enfoque de la localización de la etiqueta de proteínas con una proteína fluorescente y propiedades conformacionales con un tinte segunda ofrece un gran potencial para el mapeo en diferentes conformaciones de las proteínas se acumulan en las células y los eventos que cambian la dinámica de la conformación de la proteína. ReAsH / Flash se utilizó por primera vez como un sensor en el celular de plegamiento de las proteínas celulares de los mamíferos del ácido retinoico-proteína de unión I 4. En ...
Access restricted. Please log in or start a trial to view this content.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue financiado por becas de DMH y TDM (NHMRC subvenciones para proyectos). DMH es un compañero Grimwade, financiado por la Fundación Miegunyah.
Access restricted. Please log in or start a trial to view this content.
Materiales
| Name | Company | Catalog Number | Comments |
| Nombre del reactivo | Empresa | Número de catálogo | Comentarios |
|---|---|---|---|
| 8 y μ-diapositivas | Ibidi | 80826 | Consideramos que estos cámara de diapositivas para ser especialmente útil para el cultivo de células para la imagen. |
| TC-Flash II en las células de detección de etiqueta Tetracysteine Kit * * * fluorescencia verde de células vivas imágenes | Invitrogen | T34561 (flash) o T34562 (ReAsH) | |
| Solución salina equilibrada de Hanks | Invitrogen | 14175-103 | |
| 2,3-dimercapto-1-propanol | Sigma-Aldrich | D1129-5ML | |
| 1,2-etanoditiol | Sigma-Aldrich | 02390-25ML |
Referencias
- Tsien, R. Y. The green fluorescent protein. Ann. Rev. Biochem. 67, 509-544 (1998).
- Griffin, B. A., Adams, S. R., Tsien, R. Y. Specific covalent labeling of recombinant protein molecules inside live cells. Science. 281, 269-2672 (1998).
- Uttamapinant, C. A fluorophore ligase for site-specific protein labeling inside living cells. Proc. Natl. Acad. Sci. USA. 107, 10914-10919 (2010).
- Ignatova, Z., Gierasch, L. M. Monitoring protein stability and aggregation in vivo by real-time fluorescent labeling. Proc. Natl. Acad. Sci. USA. 101, 523-528 (2004).
- Coleman, B. M. Conformational detection of prion protein with biarsenical labeling and FlAsH fluorescence. Biochem. Biophys. Res. Commun. 380, 564-568 (2009).
- Luedtke, N. W., Dexter, R. J., Fried, D. B., Schepartz, A. Surveying polypeptide and protein domain conformation and association with FlASH and ReAsH. Nat. Chem. Biol. 3, 779-784 (2007).
- Ramdzan, Y. M. Conformation sensors that distinguish monomeric proteins from oligomers in live cells. Chem. Biol. 17, 371-379 (2010).
- Abramoff, M. agelhaes, PJ, S. J. R. am Image processing with ImageJ. Biophotonics International. 11, 36-42 (2004).
- Hearps, A. The biarsenical dye Lumio exhibits a reduced ability to specifically detect tetracysteine-containing proteins within live cells. J. Fluor. 17, 593-597 (2007).
- Adams, S. R. New biarsenical ligands and tetracysteine motifs for protein labeling in vitro and in vivo: Synthesis and biological applications. J. Am. Chem. Soc. 124, 6063-6076 (2002).
- Shaner, N. C., Steinbach, P. A., Tsien, R. Y. A guide to choosing fluorescent proteins. Nat. Meth. 2, 905-909 (2005).
Access restricted. Please log in or start a trial to view this content.
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados