Method Article
Asistida por microondas diagnóstico rápido de enfermedades de virus de plantas por microscopía electrónica de transmisión
En este artículo
Resumen
Este estudio describe un método que permite el diagnóstico rápido y libre de enfermedades virales en las plantas cerca de la mitad de un día mediante el uso de una combinación de preparación de muestras asistida por microondas para la planta de microscopía electrónica de transmisión y los métodos de tinción negativa.
Resumen
Las investigaciones de los cambios ultraestructurales inducidas por virus son a menudo necesarios para identificar claramente las enfermedades virales en las plantas. Con la preparación de muestras convencionales de microscopía electrónica de transmisión (TEM) estas investigaciones pueden durar varios días 1,2 y por tanto no adecuada para un diagnóstico rápido de enfermedades virales de las plantas. La fijación de microondas se pueden utilizar para reducir drásticamente el tiempo de preparación de muestras para las investigaciones de TEM con similares resultados ultraestructurales observados después de la preparación de muestras convencional 3-5. Diferentes dispositivos de microondas por encargo están disponibles que pueden ser utilizados para la fijación de éxito y la inclusión de muestras biológicas para investigación TEM 5-8. En este estudio hemos demostrado sobre el virus del mosaico del tabaco (TMV) las plantas infectadas con Nicotiana tabacum que es posible diagnosticar alteraciones ultraestructurales en las hojas en la mitad de una semana a través de la preparación de muestras asistida por microondas TEM. Hemos elegido para llevar a cabo este estudio con un dispositivo de microondas disponibles en el mercado, ya que lleva a cabo la preparación de muestras casi en su totalidad de forma automática 5 a diferencia de los otros dispositivos disponibles en muchos pasos todavía tiene que realizarse de forma manual 6.8 y por lo tanto más tiempo y mucho trabajo. Como preparación de la muestra se realiza de forma totalmente automática tinción negativa de las partículas virales en la savia de los restantes TMV hojas infectadas y el siguiente examen de la ultraestructura y el tamaño se puede realizar durante la fijación e inclusión.
Protocolo
Microondas preparación de muestras asistida
- Antes del inicio de la preparación de muestras es necesario programar el procesador automático de tejidos de microondas para la microscopia electrónica (Leica EM AMW, Leica Microsystems, Viena, Austria) con los siguientes protocolos (Tabla 1) para la preparación de muestras asistida por microondas para TEM:
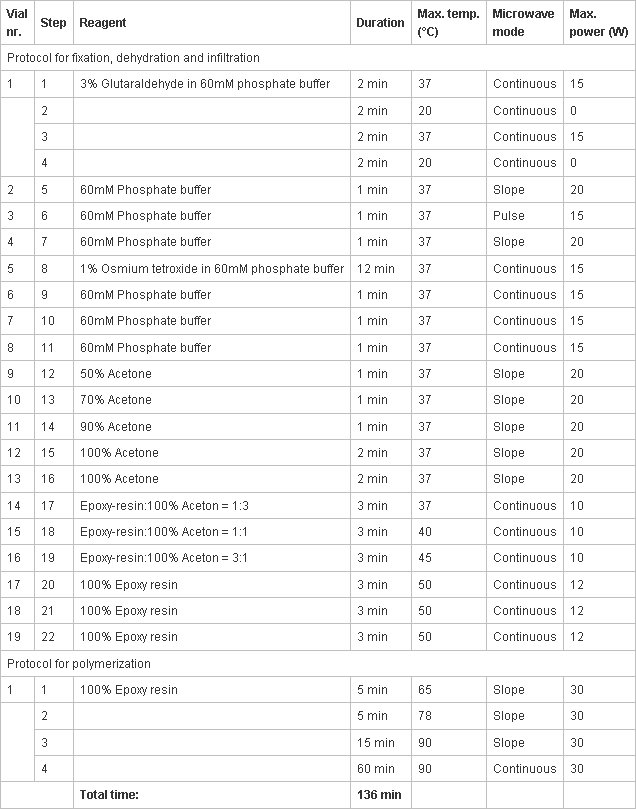
Tabla 1. Protocolo para la preparación de la muestra mediante la irradiación de microondas. Las distintas columnas muestran (de izquierda a derecha):- Número Vial (nr Vial.) Representa el orden en que se carga el vial en el carrusel del procesador.
- Paso del proceso actual.
- Reactivos en los viales.
- Duración de la etapa actual.
- La temperatura máxima que se alcanza en el vial antes de la irradiación de microondas se apaga.
- Establecimiento de la irradiación de microondas: aumento continuo = bruscos de temperatura, manteniendo la temperatura; Pendiente = aumento de la temperatura suave, la temperatura final alcanzada al final; pulsada = aumento rápido de la temperatura, la energía apagado hasta que la temperatura bajó 5 ° C, el poder reanudó alcance la temperatura .
- La potencia máxima de la irradiación de microondas.
- Recién preparar las soluciones para las diversas fases descritas en el protocolo de preparación de la muestra (por resina epoxi Agar 100 ver 1.7), llenarlos en los viales designados de acuerdo con el protocolo programado (Tabla 1), la carga de los viales en el carrusel, a continuación, insertar el carrusel en el procesador de tejidos de microondas, y, finalmente, la carga de la primera copa en la cámara de mono-modo.
- Cortar secciones pequeñas de las hojas (1mm 2) de Nicotiana tabacum infectadas con el Virus del mosaico del tabaco (TMV), con una hoja de afeitar en una placa de cera de modelar en una caída de 3% de glutaraldehído (Agar Scientific Ltd., Stansted, Inglaterra) en 60 mM Sørensen tampón fosfato (pH 7,2) a temperatura ambiente.
- La transferencia de las secciones con pinzas finas de inmediato en las cestas designadas con una abertura de malla de aproximadamente 200μm. Pila de las canastas en la parte superior de cada uno y los inserta en la cámara de mono-modo. Se debe tener cuidado de que las muestras se cubren constantemente con solución fijadora durante la carga y el apilamiento de las canastas para que no se sequen.
- Inicie el microondas previamente programada la asistencia de protocolo de preparación de muestras para la fijación, deshidratación e infiltración.
- Mientras que la preparación de muestras se realiza automáticamente por el procesador de tejido microondas continuar con tinción negativa con el material vegetal restante como se describe en la sección 3 (tinción negativa).
- Recién preparar Agar 100 resina epoxi mediante la mezcla de los componentes que se exponen: Agar llenar 24g 100, 16 g de anhídrido succínico dodecenil, y 10 g de anhídrido metil nadic (para todos los componentes ver Agar Scientific Ltd., Stansted, Inglaterra) en un vaso de plástico de calor a 40 ° C y mezclar bien. Añadir 1,2 g de bencil dimetilamina y mezclar bien. Rellene Agar 100 resina epoxi en la polimerización designado se forma justo antes de que el protocolo de preparación de la muestra llega a su fin (por ejemplo, durante el paso 22 en la tabla 1).
- Después de que el protocolo está terminado (después del paso 22 en la tabla 1) la liberación de las cestas apiladas que contienen las muestras se infiltraron desde la cámara de mono-modo en el último frasco de carrusel. Retire el carrusel desde el dispositivo de microondas, desapilar las cestas y cargarlos usando pinzas finas en las formas de polimerización designado. Se debe tener cuidado de que las muestras están siempre cubiertos de resina epoxi Agar 100 durante desapilado y la carga para que no se sequen.
- Pila de las formas de polimerización en la parte superior de cada uno. Se debe tener cuidado de que las muestras están siempre cubiertos de resina epoxi Agar 100 durante el apilado y carga de manera que no se sequen.
- Eliminar los viales utilizados anteriormente en el carrusel del procesador de tejidos de microondas, que carga con las cestas apiladas e insertar en el carrusel en el procesador de tejidos de microondas.
- Iniciar el protocolo de polimerización previamente programada (tabla 1).
- Mientras que la polimerización se lleva a cabo automáticamente por el procesador de tejidos microondas, examinar las redes de tinción negativa con un microscopio electrónico de transmisión [por ejemplo, Philips CM10 TEM, FEI (anteriormente Philips), Eindhoven, Países Bajos] y llevar a cabo el análisis de imágenes como se describe en la sección 3 y 4 ( tinción negativa y análisis de imágenes).
- Después de que el protocolo está terminado eliminar las formas de polimerización de la cámara de mono-modo, desapilar las formas de polimerización y eliminar los bloques polimerizados que contienen las muestras. Ahora están listos para ser seccionados con un microtomo.
2. Corte y seccionamiento
- Introduzca uno o más bloques en los titulares de la muestra por separado para el corte ultra fino con la muestra en quedarse encima de 1 cm del soporte.
- Recorte el bloque con un condensador de ajuste muestra para TEM (por ejemplo, Leica Reichert Ultratrim, Leica Microsystems), de modo que una cara del bloque de máx. 1 mm de longitud y 200μm de espesor que contiene material de la hoja tanto como sea posible se logra (tamaño de bloque cara podría ser necesario ajustar el tamaño de la cuchilla de diamante).
- Sección del bloque con un ultramicrótomo (por ejemplo, Reichert Leica Ultracut S, Leica Microsystems) mediante el uso de un cuchillo de diamante en un ángulo de cuchilla de 45 º (por ejemplo, Diatome Ultra 45, Gröpl, Tulln, Austria). Espesor de la sección debe ser ajustado a alrededor de 70 a 90 nm y la velocidad de corte debe estar alrededor de 1 mm / s. Recoger varias secciones con una formvar (Agar Scientific Ltd.) recubierto de cobre o níquel 200 rejilla de malla cuadrada.
- Después de la tinción de las secciones de la parrilla con citrato de plomo (Agar Scientific Ltd., citrato de plomo 1,1 g disueltos en 42 ml de agua doblemente destilada y 8 ml de NaOH 1N) durante 5 minutos en una placa de petri parcialmente lleno con NaOH para crear un CO 2 sin medio ambiente y durante 15 minutos con acetato de uranilo al 1% (Agar Scientific Ltd.) disuelto en agua destilada a temperatura ambiente. Lave las rejillas con agua destilada durante 1 minuto entre cada paso después de la tinción. Deje secar al aire de las rejillas en una celda de la malla.
- Examinar las secciones con un microscopio electrónico de transmisión (por ejemplo, Philips CM10 TEM, FEI, Eindhoven, Holanda).
3. Tinción negativa
- Cosecha de aproximadamente 100 mg de material de las hojas infectadas con TMV y preparar la savia bruta por homogeneizar el material por 2 minutos con una hoja de afeitar en un portaobjetos en 100μl de 60 mm Søfrensen (pH 7,2).
- Transferencia de 20μl del homogeneizado resultante en el primer pozo de un portaobjetos de microscopio recubierto de teflón, con 4 o más pozos (como alternativa también es posible transferir el homogeneizado en un trozo de parafina).
- Coloque una rejilla Formvar recubierto en la parte superior de la homogeneizado con el formvar (Agar Scientific Ltd.) cara revestida mirando hacia la baja y se incuba durante 5 minutos.
- Lave la red 2 veces durante 2 minutos cada uno mediante la colocación de la rejilla en la parte superior de dos gotas de 200μl Sørensen 60 mM (pH 7,2).
- Incubar la red durante 1 minuto con una solución recién preparada de ácido fosfotúngstico al 2% (Agar Scientific Ltd.) en una solución 60 mM Sørensen (pH 6,5).
- Retire la rejilla y deje que se seque al aire en una celda de la malla.
- Examinar la red con un microscopio electrónico de transmisión (por ejemplo, Philips CM10 TEM, FEI, Eindhoven, Holanda). Tomar por lo menos 10 imágenes elegidas al azar de viriones con tinción negativa (por lo menos 10 o más viriones debe ser visible en cada imagen) con el microscopio electrónico de transmisión con un aumento de 21000X primaria o superior. Se debe tener cuidado de que todas las imágenes tienen el mismo aumento.
4. De análisis de imagen
- Medir la longitud y la anchura de al menos 100 elegidas al azar partículas del virus solo en las micrografías tomadas de las muestras con tinción negativa mediante el uso de cualquier análisis de imágenes de software [por ejemplo, células D (Olympus, la Vida y la Ciencia de los Materiales Europe GmbH, Hamburgo, Alemania) con el herramienta de análisis de partículas o Optimas 6.5.1 (Media Cybernetics Inc., de Bethesda, Maryland, EE.UU.)].
- Calcular medias y desviaciones estándar para lograr una longitud y anchura media de las partículas del virus visualizado por los métodos de tinción negativa y TEM.
- Compare las características de longitud y ultraestructurales (obtenido en 2.5) con un tamaño de los virus y las alteraciones ultraestructurales inducidas por virus de las enfermedades conocidas en la literatura con el fin de identificar claramente las enfermedades causadas por virus.
5. Los resultados representativos:
Después de la preparación de muestras asistida por microondas típico TMV inducida por alteraciones ultraestructurales, tales como grandes áreas que contienen viriones alineados en forma paralela se puede observar con el microscopio electrónico de transmisión en el citosol de las células infectadas por Nicotiana tabacum (Fig. 1A). Además, en la savia bruta de TMV hojas infectadas partículas de TMV se pudo observar como flexuoso, en forma de barra estructuras después de la tinción negativa (Fig. 1B). Análisis de imágenes de 100 partículas de virus reveló un tamaño promedio de TMV de 280 nm de longitud y 17nm de ancho (Fig. 2). La ultraestructura de las células infectadas con TMV y el tamaño de los viriones observada en este estudio se encontró que de acuerdo con TMV inducida por las propiedades ultraestructurales en el tabaco y el rango de tamaño de partículas de TMV previamente reportados en la literatura 9-15.
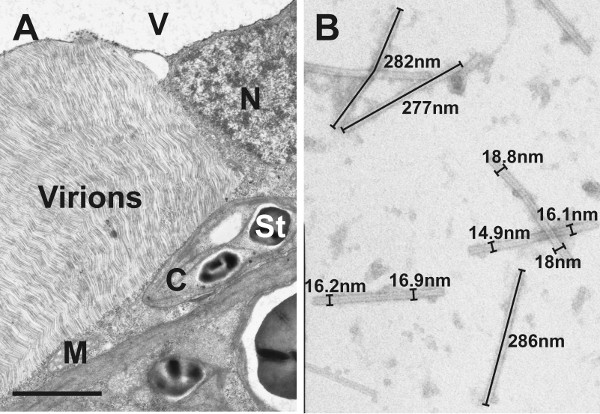
Figura 1. Micrografías electrónicas de transmisión de las células de la hoja de TMV-infectados y los viriones. A) La imagen muestra la ultraestructura de las células infectadas con TMV mesófilo de la hoja de Nicotiana tabacum después de la preparación de muestras asistida por microondas de la planta. Tenga en cuenta la gran superficie de los viriones paralelos alineados que se acumuló en el citosol.C = cloroplastos con almidón (St), M = mitocondria, N = núcleo, V = vacuola, Bar = 2μm. B) La imagen muestra los viriones que fueron detectados por tinción negativa en la savia de las hojas infectadas.
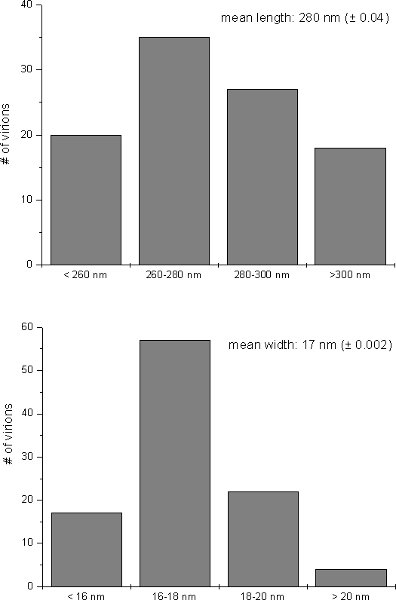
Figura 2. Tamaño relativo de los viriones. Distribución relativa de la longitud y la anchura de TMV-partículas después de la tinción negativa de la savia de las hojas infectadas, ya que apareció en el microscopio electrónico. Los valores medios (media longitud / anchura media ± desviación estándar) se calcula a partir de 100 viriones.
Discusión
Asistida por microondas de preparación de muestras de plantas para TEM se ha demostrado que la oferta de datos ultraestructurales rápido y fiable a las pocas horas 3,4,16. La preservación fina estructural de las membranas de los organelos y logra con el método utilizado en este estudio fue similar a las muestras convencionales y cryofixed 5,15 con la ventaja de una reducción masiva en la fijación de la muestra y la incrustación de tiempo de 3 días o más a cerca de 2 horas. Esto representa el protocolo de muestreo más rápido de preparación para TEM actualmente disponibles en la literatura. El método descrito en este estudio combinado asistida por microondas de preparación de muestras de plantas para TEM con los métodos de tinción negativa, que permite una identificación clara y rápida de la TMV inducida por alteraciones ultraestructurales y el agente viral en sí. TMV alteraciones inducidas ultraestructurales podría ser investigado después de la poda, corte y post-tinción en aproximadamente 4 horas después del inicio de la fijación en el microscopio electrónico de transmisión. Usando el modo totalmente automático la preparación de muestras liberó a los investigadores para llevar a cabo la tinción negativa en el ínterin con el fin de determinar el tamaño y el ancho del agente viral. Por lo tanto, podemos concluir que este método permite un diagnóstico claro y rápido de las enfermedades de virus de la planta en alrededor de medio día, que es de gran importancia para su futuro uso en experimentos científicos en la agricultura y la planta de fitopatología. Como este método también podría utilizarse para el diagnóstico rápido de enfermedades de los animales y humanos que tiene un gran potencial para su futura aplicación en medicina y patología veterinaria.
Divulgaciones
No hay conflictos de interés declarado.
Agradecimientos
Este trabajo fue apoyado por el Fondo Científico de Austria (FMF, P20619 y P22988 para BZ).
Materiales
| Name | Company | Catalog Number | Comments |
| Glutaraldehyde | Agar Scientific | R1312 | |
| Osmium tetroxide | Agar Scientific | R1022 | |
| Agar 100 resin | Agar Scientific | R1043 | |
| Dodecenyl succinic anhydride | Agar Scientific | R1051 | |
| Methyl nadic anhydride | Agar Scientific | R1081 | |
| Benzyl dimethylamine | Agar Scientific | R1060 | |
| Lead citrate | Agar Scientific | R1210 | |
| Uranyl acetate | Agar Scientific | R1260A | |
| Phosphotungstic acid | Agar Scientific | R1213 | |
| Formvar | Agar Scientific | R1202 | |
| Leica EM AMW | Leica Microsystems | ||
| Leica (Reichert) Ultratrim | Leica Microsystems | Newer model is available | |
| Leica (Reichert) Ultracut S | Leica Microsystems | Newer model is available | |
| Diatome Ultra 45 | Gröpl | ||
| Philips CM10 TEM | FEI | Newer model is available | |
| Cell D | Olympus Corporation | ||
| Optimas 6.5.1 | Media Cybernetics Inc. | Newer version is available |
Referencias
- Bozzola, J. J., Russell, D. . Electron Microscopy. , (1999).
- Kuo, J., Kuo, J. Processing plant tissues for ultrastructural study. Methods in Molecular Biology, Electron Microscopy, Methods and Protocols. 369, 47-65 (2007).
- Schroeder, J. A., Gelderblom, H. R., Hauroeder, B., Schmetz, C., Milios, J., Hofstaedter, F. Microwave-assisted tissue processing for sameday EM-diagnosis of potential bioterrorism and clinical samples. Micron. 37, 577-590 (2006).
- Webster, P., Kuo, J. Microwave-assisted processing and embedding for transmission electron microscopy. Methods in Molecular Biology, Electron Microscopy, Methods and Protocols. 369, 47-65 (2007).
- Zechmann, B., Zellnig, G. Microwave assisted rapid plant sample preparation for transmission electron microscopy. J. Microsc. 233, 258-268 (2009).
- Lería, F., Marco, R., Medina, F. J. Structural and antigenic preservation of plant samples by microwave-enhanced fixation, using dedicated hardware, minimizing heat-related effects. Micr. Res. Techniq. 65, 86-100 (2004).
- Giberson, R. T., Austin, R. L., Charlesworth, J., Adamson, G., Herrera, G. A. Microwave and digital imaging technology reduce turnaround times for diagnostic electron microscopy. Ultrastruct. Pathol. 27, 187-196 (2003).
- Cavusoglu, I., Minbay, F. Z., Temel, S. G., Noyan, S. Rapid polymerisation with microwave irradiation for transmission electron microscopy. Eur. J. Morph. 39, 313-317 (2001).
- Ermolina, I., Morgana, H., Greena, N. G., Milnerb, J. J., Feldmanc, Y. Dielectric spectroscopy of tobacco mosaic virus. Biochim. Biophys. Acta. 1622, 57-63 (2003).
- Maeda, H. An atomic force microscopy study for the assembly structures of tobacco mosaic virus and their size evaluation. Langmuir. 13, 4150-4161 (1997).
- Milne, R. G. Multiplication of tobacco mosaic virus in tobacco leaf palisade cells. Virology. 28, 527-532 (1966).
- Reunov, A. V., Gnutova, I. V., Lapshina, L. A. Effect of tobacco mosaic virus strains on the ultrastructure of tobacco leaf parenchymal cells. Biol. Bull. 33, 409-415 (2006).
- Sachse, C., Chen, J. Z., Coureux, P. D., Stroupe, M. E., Fändrich, M., Grigorieff, N. High-resolution electron microscopy of helical specimens: a fresh look at tobacco mosaic virus. J. Mol. Biol. 371, 812-835 (2007).
- Smith, M. L., Lindbo, J. A., Dillard-Telm, S., Brosio, P. M., Lasnik, A. B., McCormick, A. A., Nguyen, L. V., Palmer, K. E. Modified tobacco mosaic virus particles as scaffolds for display of protein antigens for vaccine applications. Virology. 348, 475-488 (2006).
- Zechmann, B., Zellnig, G. Rapid TEM diagnosis of plant virus diseases. J. Virol. Meth. 162, 163-169 (2009).
- Giberson, R. T., Demaree, R. S. Microwave processing techniques for electron microscopy: a four-hour protocol. Meth. Molec. Biol. 117, 145-158 (1999).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados